REVISÃO DA LITERATURA
Impact of Antineoplastic Treatment on Oral Cavity and Oropharyngeal Microbiota of Head and Neck Cancer Patients: Systematic Review
Impacto del Tratamiento Antineoplástico en la Microbiota Oral y Orofaríngea de Pacientes Afectados por el Cáncer de Cabeza y Cuello: Revisión Sistemática
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n1.1581
Iran Alves da Silva1; Larissa Karine Barbosa2; Diego Belmiro do Nascimento Santos3; Sibele Ribeiro de Oliveira4; Cláudia Cristina Brainer de Oliveira Mota5; Adrya Lúcia Peres6
1-6Centro Universitário Tabosa de Almeida. Associação Caruaruense de Ensino Superior e Técnico (Asces-Unita). Caruaru (PE), Brasil.
1E-mail: iranalvesdasilva0@gmail.com. Orcid iD: https://orcid.org/0000-0002-7295-3869
2E-mail: 2017220029@app.asces.edu.br. Orcid iD: https://orcid.org/0000-0002-8312-8549
3E-mail: diegobelmiro@outlook.com. Orcid iD: https://orcid.org/0000-0002-0109-6863
4E-mail: sibeleribeiro@asces.edu.br. Orcid iD: https://orcid.org/0000-0001-8211-7357
5E-mail: claudiabmota@gmail.com. Orcid iD: https://orcid.org/0000-0002-7909-5908
6E-mail: adryaperes@asces.edu.br. Orcid iD: https://orcid.org/0000-0003-4892-5486
Endereço para correspondência: Iran Alves da Silva. Rua José Joaquim de Araújo, 162 – Manoel Lucas. Santa Cruz do Capibaribe (PE), Brasil. CEP 55195-039. E-mail: iranalvesdasilva0@gmail.com
RESUMO
Introdução: As cavidades oral e orofaríngea apresentam uma grande diversidade de micro-organismos que se encontram normalmente em homeostase com outros micro-organismos e o próprio hospedeiro, contudo, pacientes com câncer de cabeça e pescoço submetidos ao tratamento oncológico podem desencadear modificações fisiológicas nos seus organismos, assim como impactos na sua microbiota residente. Objetivo: Revisar sistematicamente os estudos sobre o impacto provocado pelo tratamento antineoplásico sobre a microbiota oral e orofaríngea em pacientes com câncer de cabeça e pescoço. Método: Revisão sistemática, realizada entre abril e junho de 2020. Busca nas bases de dados Biblioteca Virtual em Saúde, Google Acadêmico, PubMed e ScienceDirect. Utilizaram-se os descritores “head and neck neoplasms”, “mouth neoplasms” e “microbiota” em inglês; e “neoplasias de cabeça e pescoço”, “neoplasias bucais” e “microbiota” em português. Foram selecionados artigos originais e disponíveis na íntegra, publicados na última década (2010 a 2020), nos idiomas português e inglês. Resultados: Foram incluídos oito artigos nesta revisão. Assim, a maioria dos estudos apresentou alterações na quantidade de micro-organismos residentes ou invasão de bactérias exógenas nos pacientes submetidos ao tratamento antineoplásico; o descontrole da homeostase da microbiota desencadeou processos cariogênicos e inflamatórios na mucosa. Conclusão: As alterações no microbioma da cavidade oral e orofaríngea advindas do tratamento antineoplásico podem ser fatores de predisposição a efeitos adversos no indivíduo, como desenvolvimento de cárie e mucosite oral.
Palavras-chave: neoplasias bucais; neoplasias de cabeça e pescoço; microbiota; antineoplásicos.
ABSTRACT
Introduction: A great diversity of microorganisms are found in the oral and oropharyngeal cavities, which are normally in homeostasis with other microorganisms and the host itself. Patients with head and neck cancer undergoing cancer treatment may trigger physiological changes in their bodies and impact in the resident microbiota. Objective: Systematically review studies on the impact of antineoplastic treatment on oral and oropharyngeal microbiota in patients with head and neck cancer. Method: Systematic review carried out between April and June 2020. Articles were searched in the Virtual Health Library, Google Scholar, PubMed and ScienceDirect databases in English, utilizing the descriptors "head and neck neoplasms", "mouth neoplasms" and "microbiota" and “neoplasias de cabeça e pescoço”, “neoplasias bucais” and “microbiota” in Portuguese. Original articles available in full, published in the last decade (2010 to 2020), in Portuguese and English were selected. Results: 8 articles were included in this review. Most of studies have shown quantitative changes in resident microorganisms or invasion of exogenous bacteria in patients in antineoplastic treatment; uncontrolled microbiota homeostasis triggered cariogenic and inflammatory processes in the mucosa. Conclusion: Changes in the microbiome of the oral cavity and oropharyngeal resulting from antineoplastic treatment may be predisposing factors for adverse effects as the development of caries and oral mucositis.
Key words: mouth neoplasms; head and neck neoplasms; microbiota; antineoplastic agents.
RESUMEN
Introducción: Las cavidades bucal y orofaríngea presentan una gran diversidad de microorganismos que normalmente se encuentran en homeostasis con otros microorganismos y su propio hospedador, sin embargo, los pacientes con cáncer de cabeza y cuello sometidos a tratamiento contra el cáncer pueden desencadenar cambios fisiológicos en tu cuerpo, así como también impactos en su microbiota residente. Objetivo: Revisar sistemáticamente los estudios sobre el impacto del tratamiento antineoplásico en la microbiota oral y orofaríngea en pacientes con cáncer de cabeza y cuello. Método: Revisión sistemática realizada entre abril y junio de 2020. Se buscaron artículos en las bases de datos de la Biblioteca Virtual en Salud, Google Scholar, PubMed y ScienceDirect. Se utilizaron los descriptores "head and neck neoplasms", "mouth neoplasms" and "microbiota" en inglés y “neoplasias de cabeça e pescoço”, “neoplasias bucais” e “microbiota” en portugués. Incluyeron artículos originales y disponibles en su totalidad, publicados en la última década (2010 a 2020), en portugués e inglés. Resultados: En esta revisión se incluyeron ocho artículos. Así, la mayoría de los estudios han mostrado cambios en el número de microorganismos residentes o invasión de bacterias exógenas en pacientes sometidos a tratamiento antineoplásico, la homeostasis de la microbiota sin controle desencadena procesos cariogénicos e inflamatorios en la mucoso. Conclusión: Los cambios en el microbioma de la cavidad oral y orofaríngea por el tratamiento antineoplásico pueden ser factores predisponentes a los efectos adversos en el individuo, como el desarrollo de caries y mucositis oral.
Palabras clave: neoplasias de la boca; neoplasias de cabeza y cuello; microbiota; antineoplásicos.
INTRODUÇÃO
Os tumores malignos de lábios, cavidade oral, faringe, laringe, cavidade nasal e tireoide são agrupados como cânceres de cabeça e pescoço. Os principais sítios anatômicos acometidos nesse grupo de neoplasias constituem a cavidade oral (mucosa bucal, gengiva, palato duro, lingual e assoalho de língua); a faringe (orofaringe, nasofaringe e hipofaringe); a cavidade nasal e os seios paranasais; a laringe glótica, supraglótica e glândulas. Cerca de 40% das lesões ocorrem na cavidade oral, 15% na faringe, 25% na laringe e os 20% restantes estão distribuídos nos demais sítios1. O número de casos novos de câncer da cavidade oral esperados para o Brasil, para cada ano do triênio 2020-2022, será de 11.200 casos em homens e de 4.010 em mulheres2.
O câncer de cabeça e pescoço frequentemente é diagnosticado em estágios já avançados3. Desse modo, a demora para a confirmação diagnóstica e a definição do tratamento acabam levando a uma terapêutica mais agressiva e, consequentemente, a um maior número de reações adversas como consequência do tratamento4. A radioterapia é geralmente a terapia de primeira escolha, sendo direcionada à região de cabeça e pescoço, podendo desencadear efeitos adversos como mucosite, xerostomia, disgeusia, odinofagia e infecções5.
Nas regiões da cavidade oral e orofaríngea, a presença de micro-organismos ultrapassa mais de 700 espécies; ainda se estima que várias espécies não foram catalogadas taxonomicamente, tendo em vista que a semelhança do seu material genético com espécies já registradas é um fator que impossibilita a total descrição do bioma microbiano6. Os filos de bactérias já identificados e com maior prevalência são Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria e Fusobacteria. Enquanto os gêneros de bactérias de maior predominância correspondem a Streptococcus, Actinomyces, Veillonella, Fusobacterium, Porphyromonas, Prevotella, Treponema, Neisseria, Haemophilis, Lactobacillus, Capnocytophaga, Eikenella, Leptotrichia, Peptostreptococcus, Staphylococcus e Propionibacterium7,8.
Dentro dos gêneros citados, o Streptococcus é mais frequente, sendo uma bactéria com forma de cocos Gram-positivas. Mesmo fazendo parte da microbiota residente, algumas espécies como Streptococcus mutans em condições favoráveis à sua proliferação podem causar cárie dentária, já que são capazes de fermentar uma grande variedade de açúcares9. Além disso, bactérias como Enterococcus faecalis, Enterococcus faecium e Escherichia coli, comuns no trato gastrointestinal inferior, podem acabar colonizando a cavidade oral de forma acidental, seja por transmissão de água e alimentos contaminados, objetos infectados ou até mesmo contato com as fezes contaminadas; podendo desencadear processos infecciosos10,11.
Fungos se encontram em um quantitativo menor, porém estabelecem um papel primordial na manutenção do equilíbrio da microbiota oral, podendo ser encontrados os dos gêneros Candida, Cladosporium, Aureobasidium, Saccharomyces, Aspergillus, Fusarium e Cryptococcus. O gênero Candida, principalmente a espécie Candida albicans, pode ser um fator de risco para infecções denominadas de candidíase, principalmente em pacientes imunocomprometidos12.
Sabe-se que, em condições saudáveis, a microbiota se relaciona a um estado de homeostase com o hospedeiro, semelhante ao que ocorre com as outras interações entre os micro-organismos em diferentes partes do corpo humano13. Esses micro-organismos desempenharam um papel vital na construção de um ambiente ideal para a sua sobrevivência, melhor absorção de nutrientes, interação com outras espécies por meio da comunicação microbiana, regulando as taxas de crescimento microbiano e até mesmo protegendo o hospedeiro de micro-organismos exógenos com potencial patogênico14. Entre os fatores que auxiliam na relação entre as interações envolvidas por micro-organismos e seu habitat, destacam-se a temperatura, pH, presença de oxigênio (potencial oxidação-redução), nutrientes (endógenos e exógenos) e o próprio sistema de defesa do hospedeiro15. Todos esses fatores são imprescindíveis na microbiota no processo saúde-doença, pois modulam a colonização por determinados micro-organismos, os quais serão capazes de sobreviver e se proliferar no ambiente e, assim, estabelecer a microbiota residente16.
Ainda há paradigmas a respeito dos efeitos do tratamento antineoplásico em relação aos micro-organismos que habitam a cavidade oral e orofaríngea. Pacientes em terapia antineoplásica acabam apresentando muitas vezes o sistema imunológico comprometido, além de serem acometidos pela redução do fluxo salivar e pela possibilidade de mucosite, que acaba tornando mais suscetível a quebra da homeostase da microbiota, criando um habitat mais propício a infecções, seja de micro-organismos residentes que proliferam de maneira incontrolável ou pela invasão e fixação de micro-organismos exógenos patogênicos. Tal problemática pode provocar uma piora no quadro clínico do paciente e até contribuir em suspensão do tratamento antineoplásico17. Nesse contexto, micro-organismos, principalmente bactérias, podem trazer consigo multirresistência a antibióticos e alto percentual de virulência, agravando o processo infeccioso até gerar um quadro de sepse. O Instituto Latino-Americano de Sepse (ILAS)18 estima que 400 mil casos de sepse são diagnosticados por ano no Brasil, provocando aproximadamente a morte de 240 mil indivíduos. A taxa de mortalidade no país é de 65% dos casos, 25% maior do que a média mundial (30%-40%). Ainda de acordo com o ILAS, 25% da ocupação de leitos nas Unidades de Terapia Intensiva (UTI) ocorrem pela sepse, sendo a principal causa de morte nesses locais18.
O entendimento das alterações sobre a microbiota provocada pelo tratamento contra o câncer de cabeça e pescoço pode identificar aspectos de impacto na sobrevida do paciente, tornando sua compreensão fundamental para auxiliar no melhor planejamento e na redução de reações adversas ao paciente. Com base nos dados supracitados, a presente revisão sistemática concentrou-se em um aprofundamento no conteúdo acerca da mudança, colonização e prevalência de bactérias e fungos relacionados com a terapia antineoplásica em indivíduos acometidos por câncer de cabeça e pescoço, analisando produções científicas nacionais e internacionais.
MÉTODO
A prática baseada em evidências tem proporcionado um crescente aumento na produção das revisões de literatura sistemática, que são consideradas estudos secundários, tendo pesquisas primárias como sua fonte de dados. Compreendem-se, por estudos primários, os artigos científicos que relatam os resultados de pesquisas observacionais ou experimentais19. Sendo assim, trata-se de uma revisão sistemática, realizada entre abril e novembro de 2020, conduzida conforme a metodologia Preferred Reporting Items for Sistematic Reviews and Meta-Analyses (PRISMA)20 e cadastrada no International Prospective Register of Systematic Reviews (PROSPERO) com número de registro CRD42021219974.
Durante esse período, foram avaliados diferentes tipos de estudos disponíveis nas bases de dados: Biblioteca Virtual em Saúde (BVS); Google Acadêmico; PubMed; e ScienceDirect, que contivessem os descritores indexados ao MeSH (Medical Subject Headings) ou os seus correspondentes no DeCS (Descritores em Ciências da Saúde): “head and neck neoplasms”,”mouth neoplasms” e “microbiota” na língua inglesa e “neoplasias de cabeça e pescoço”, “neoplasias bucais” e “microbiota” em português.
Por seguinte, a realização da estratégia de busca consistiu nas seguintes combinações: “head and neck neoplasms” OR “mouth neoplasms” AND “microbiota”, “neoplasias de cabeça e pescoço” OR “neoplasias bucais” AND “microbiota”. Como critérios de inclusão, foram selecionados artigos publicados entre abril de 2010 a abril de 2020 (disponíveis na íntegra em inglês ou português), que apresentassem pesquisas em seres humanos, avaliando a interação da microbiota oral e orofaríngea no tratamento oncológico.
Foram excluídos do estudo artigos de revisão, pesquisas que não envolviam pacientes em uso de alguma terapia antineoplásica e artigos em outras línguas que não fossem o português e o inglês. Ainda neste estudo, foi utilizado o software Rayyan, desenvolvido pelo Qatar Computing Research Institute (QCRI), para o arquivamento, organização e seleção dos artigos de forma dinâmica e segura21.
Desse modo, após consulta às bases de dados e aplicação das estratégias de busca, ocorreu a exportação dos artigos para o Rayyan e foram identificados os que estavam em duplicidade nas bases. Os títulos e resumos dos artigos foram lidos para determinar a elegibilidade conforme os critérios de inclusão preestabelecidos, por meio de dois pesquisadores, e qualquer desacordo foi resolvido mediante discussão. Ainda, se a discordância persistisse, um terceiro pesquisador era consultado para obter consenso. Assim, objetivando a minimização de possíveis vieses de aferição dos estudos, como erros de interpretação e delineamento.
RESULTADOS
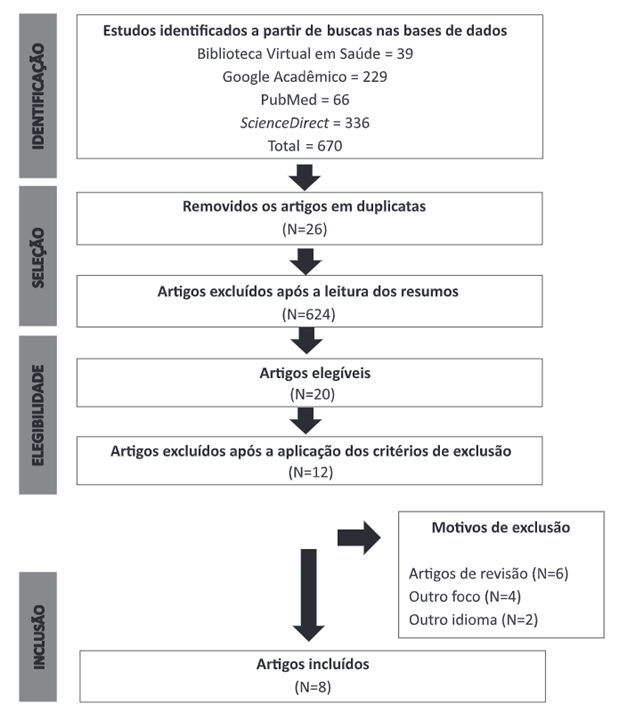
Ao realizar a busca nas bases de dados, foi encontrado um total de 670 artigos na soma dos artigos gerados das quatro bases de dados. Após a eliminação de 26 artigos duplicados, foram localizados 644 artigos. A base de dados ScienceDirect apresentou um maior número de trabalhos, totalizando 331 pesquisas. Desse total, 327 foram excluídos após a leitura dos resumos, por não se enquadrarem nos critérios de inclusão previamente estabelecidos. Na sequência, a base de dados Google Acadêmico localizou 218 artigos, sendo que 211 foram retirados após a leitura dos resumos. O PubMed exibiu 63 artigos; destes, após filtragem pela leitura dos títulos e dos resumos, foram excluídos 58 artigos. Já a BVS apresentou 32 publicações; em seguida, com a leitura dos resumos, excluíram-se 28. Logo após a elegibilidade e a aplicação dos critérios de exclusão e inclusão, foram selecionados oito artigos. A Figura 1 apresenta a síntese do processo de seleção dos artigos.
|
|
|
Figura 1. Fluxograma PRISMA para revisão sistemática, com descrição das fases de identificação dos estudos |
A Tabela 1 mostra as características dos artigos incluídos quanto aos autores do respectivo estudo, ano de publicação, local, tipo de estudo, quantitativo de amostras, gênero, faixa etária e classificação do câncer.
As referências selecionadas nos resultados do presente trabalho foram publicadas no período de 2011 a 2019. Os artigos selecionados nesta revisão foram publicados nos seguintes periódicos científicos, Archives of Health Investigation, EBioMedicine, Journal of Oral Microbiology, Nutrición Hospitalaria, PloS One e Revista Brasileira de Cancerologia; ainda quanto ao tipo de estudo, foram obtidos estudo de coorte (n=7; 87,5%) e caso-controle coorte (n=1; 12,5%). A América do Sul e a Ásia foram os continentes de origem da maioria dos artigos incluídos na pesquisa, ambas apresentando n=3 (37,5%) totalizando n=6 (75%) com contribuições oriundas do Brasil e China (n=3; 37,5%; n=3; 37,5%), seguidos da América do Norte (n=1; 12,5%) e Europa (n=1; 12,5%), cujas contribuições foram respectivamente de Estados Unidos e Espanha. Não houve artigo selecionado de países da África e da Oceania.
Nos oito estudos incluídos, havia 257 participantes, sendo 153 (59,53%) do gênero masculino, 54 (21,01%) do gênero feminino e 50 (19,45%) não foram identificados pelo autor da pesquisa. Dos 257 indivíduos totais, 12 eram pacientes do grupo controle que não foram acometidos pelo câncer e 245 apresentavam algum câncer na região cabeça e pescoço, sendo a distribuição anatômica: nasofaringe (n=50; 20,4%), laringe (n=19; 7,75%), cavidade oral (n=9; 3,7%), língua (n=6; 2,44%), faringe (n=4; 1,63%) e (n=157; 64,08%) sem relato da região acometida pelo câncer.
O perfil histológico dos tumores relatados nas pesquisas foi de carcinoma (n=196; 80%) e neoplasias malignas indiferenciadas (n=6; 2,44%); em 43 indivíduos (17,55%), não houve a classificação histológica. Ainda foi possível agrupar os tipos de carcinomas, sendo espinocelular ou de células escamosas (n=137; 69,89%), basoescamoso (n=4; 2,04%), células acinares (n=4; 2,04%) e metastático do tipo linfoepitelial (n=1; 0,51%). Em 25,51% (n=50), houve apenas o relato de que se designava como carcinoma.
Em relação ao tipo de tratamento, todos os artigos (n=8; 100%) relataram a predominância da radioterapia para o tratamento do câncer de cabeça e pescoço com ou sem uso de outro meio terapêutico; por conseguinte, o tratamento com radioterapia concomitante com a quimioterapia ou com a quimioterapia de indução foi representado em cinco estudos (62,5%). Em dois estudos (25%), houve uso associado de radioterapia e cirurgia. Os achados acerca dos objetivos, tempo de coleta das amostras e conclusão dos estudos selecionados estão expostos na Tabela 2. Já as características das condições odontológicas e os aspectos microbiológicos dos estudos que avaliaram a interação da microbiota frente ao tratamento antineoplásico de pacientes com câncer de cabeça e pescoço são demonstrados na Tabela 3.
|
Tabela 1. Características dos estudos que avaliaram a interação da microbiota frente ao tratamento antineoplásico de pacientes com câncer de cabeça e pescoço |
||||||
|
Autor/Ano |
Local |
Tipo de estudo |
Amostras (N) |
Sexo dos pacientes |
Faixa etária |
Classificação do câncer |
|
Gaetti-Jardim Jr et al., 2011 |
Brasil |
Estudo de coorte |
50 pacientes |
38 M e 12 F |
16 a 80 anos (média 59,5) |
44 pacientes apresentaram carcinoma espinocelular, 4 carcinoma de células acinares, 1 paciente apresentou carcinoma espinocelular basaloide e outro apresentou neoplasia maligna indiferenciada |
|
Simões et al., 2011 |
Brasil |
Estudo de coorte |
21 pacientes |
- |
32 a 94 anos |
A mais acometida foi a base da língua (6 casos) seguida da laringe (5 casos). Em 95% dos casos, o tipo histológico encontrado foi o carcinoma de células escamosas, sendo o outro caso diagnosticado como carcinoma metastático tipo linfoepitelial |
|
Hu et al., 2013 |
China |
Estudo de coorte |
8 pacientes |
- |
26 a 70 anos |
– |
|
Souza et al., 2015 |
Brasil |
Estudo de coorte |
50 pacientes |
36 M e14 F |
18 a 78 anos (média 51,3) |
42 eram portadores de carcinoma espinocelular, 5 apresentavam neoplasias malignas indiferenciadas, além de 3 casos de carcinoma basoescamoso |
|
Vidal-Casariego et al., 2015 |
Espanha |
Estudo de coorte |
35 pacientes |
26 M e 9 F |
Média 63,8 |
14 apresentaram câncer na região da laringe, 9 na cavidade oral, 4 na faringe e 8 em outras regiões |
|
Zhang et al., 2015 |
China |
Caso-controle/coorte |
21 pacientes (12 grupo controle; 9 do grupo caso) |
- |
- |
Carcinoma localizado na nasofaringe |
|
Zhu et al., 2017 |
China |
Estudo de coorte |
41 pacientes |
27 M e 14 F |
22-75 anos (média 47,2) |
Carcinoma localizado na nasofaringe |
|
Mougeot et al; 2019 |
Estados Unidos |
Estudo de coorte |
31 pacientes |
26 M e 5 F |
24 a 84 anos (média 56,8) |
Carcinoma de células escamosas |
|
Legendas: M = Masculino; F = Feminino. |
||||||
|
Tabela 2. Características dos estudos que avaliaram a interação da microbiota frente ao tratamento antineoplásico de pacientes com câncer de cabeça e pescoço |
||||
|
Autor/Ano |
Objetivos |
Tempo de coleta das amostras |
Intervenções odontológicas |
Conclusão |
|
Gaetti-Jardim Jr et al., 2011 |
Avaliar a ocorrência de leveduras, pseudomonas e bactérias entéricas na cavidade oral de pacientes submetidos à RT para tratamento de câncer de cabeça e pescoço |
Antes do tratamento odontológico e da RT (estágio 1), imediatamente após o término da RT (estágio 2) e 30 dias após o término da RT (estágio 3) |
Apenas 38% dos pacientes procuraram tratamento odontológico que consistiu em extrações dentárias, tratamento periodontal e procedimentos restauradores. Além disso, todos os pacientes foram orientados a usar 5 ml de uma suspensão oral contendo 100.000 U/ml de nistatina aquosa 3 vezes ao dia, para prevenir a candidíase oral durante a RT |
Modificações no ambiente oral por causa do tratamento com RT parecem facilitar a colonização da cavidade oral por membros da família Enterobacteriaceae, gêneros Enterococcus e Candida |
|
Simões et al., 2011 |
Identificar a presença de espécies de Candida e analisar a possibilidade desse fungo atuar como fator agravante da mucosite em pacientes portadores de câncer de cabeça e pescoço, os quais estejam sendo submetidos ao tratamento antineoplásico |
Período mínimo de 2 semanas em tratamento com RT apenas ou de RT associada à QT |
- |
Os pacientes estudados apresentaram correlação positiva entre lesões de mucosite oral e colonização fúngica por Candida
|
|
Hu et al., 2013 |
Explorar o microbioma dinâmico central da microbiota oral na placa supragengival durante o curso da RT de cabeça e pescoço |
Todas as amostras foram coletadas em 7 momentos no prazo de 7 semanas. As amostras coletadas antes do tratamento, com nenhuma dose recebida, foram usadas como grupo controle |
Avaliação da saúde bucal antes da RT. Quando necessário, as lesões de cárie eram restauradas, o tratamento endodôntico realizado e os dentes duvidosos extraídos. Os pacientes receberam instruções de higiene oral, mas nenhuma terapêutica especial com flúor foi adicionada |
Foram encontrados 140 gêneros pertencentes a 13 filos. 4 filos (Actinobacteria, Bacteroidetes, Firmicutes e Proteobacteria) e 11 gêneros (Streptococcus, Actinomyces, Veillonella, Capnocytophaga, Derxia, Neisseria, Rothia, Prevotella, Granulicatella, Luteococcus e Gemella) foram encontrados em todos os indivíduos, apoiando o conceito de um microbioma central |
|
Souza et al., 2015 |
Avaliar a ocorrência de micro-organismos oportunistas da família Enterobacteriaceae e dos gêneros Enterococcus e Staphylococcus na microbiota bucal de pacientes oncológicos submetidos à RT de cabeça e pescoço |
Antes do tratamento radioterápico, 15-22 dias após o início do tratamento, imediatamente após o final da RT, 30 dias após o tratamento, 6 e 12 meses após a conclusão da terapia |
Apenas 36% dos pacientes seguiram a orientação dos centros de RT e procuraram tratamento odontológico previamente à realização da RT, de forma que apenas 16% dos pacientes mostravam-se livres de cáries no início do tratamento radioterápico. Ao realizar as coletas das amostras, todos os pacientes receberam orientações sobre técnicas de escovação, uso de fio dental e higiene de dispositivos protéticos |
Os resultados sugeriram que a colonização bucal por micro-organismos oportunistas foi frequente e estável ao longo do tempo, mas sem uma nítida correlação com a saúde bucal e intensidade do tratamento radioterápico |
|
Vidal-Casariego et al., 2015 |
Demonstrar se a modalidade de tratamento, o estado nutricional e a flora orofaríngea contribuem para o desenvolvimento de mucosite no câncer de cabeça e pescoço tratado com RT |
Antes da RT (recrutamento), no meio do período de RT e após o término da RT |
– |
O isolamento orofaríngeo de patógenos bacterianos pode favorecer o desenvolvimento e o agravamento da mucosite oral |
|
Zhang et al., 2015 |
Investigar a relação entre função salivar, microbiota oral e ausência de cárie por radiação |
12 a 36 meses após a RT |
– |
Não foi encontrada correlação clara entre as características da microbiota salivar do paciente e a cárie por radiação 1 ano após a RT. Esses resultados sugerem que a função salivar em pacientes irradiados não se recupera completamente após 12 a 36 meses, mas o valor do pH e a capacidade de tamponamento da saliva retornam ao normal após 1 ano ou mais após a RT |
|
Zhu et al., 2017 |
Investigar alterações dinâmicas no perfil bacteriano oral e correlações entre a gravidade da mucosite e as alterações bacterianas durante a RT |
Antes da irradiação, após a 5ª, 10ª, 15ª, 20ª, 25ª, 30ª e 35ª irradiação |
Antes do início do tratamento com radiação, todos os pacientes receberam 1 exame clínico completo e instruções de higiene oral. Os procedimentos cirúrgicos foram realizados em pacientes com cárie, doenças pulpares e gengivite, incluindo limpeza dentária profissional, obturação, tratamento endodôntico e exodontia de dentes não restauráveis |
As alterações da microbiota oral estão correlacionadas com a progressão e com o agravamento da mucosite induzida por RT em pacientes com carcinoma nasofaríngeo |
|
Mougeot et al., 2019 |
Caracterizar o microbioma oral de pacientes com CCP submetidos à RT na linha de base (T0) e 6 (T6) e 18 (T18) meses após a RT, e determinar se havia relação com aumento de cárie |
Em 3 momentos denominados antes da RT, 6 meses após o tratamento com RT e 18 meses após a RT |
As recomendações de higiene oral incluíam a escovação de pelo menos 2 vezes ao dia, o uso do fio dental diariamente e a aplicação diária de creme dental com flúor |
Esses dados sugerem que a diferença de base no microbioma é um fator importante que pode explicar o resultado da cárie dentária em pacientes com câncer de cabeça e pescoço tratados com radiação. Tais dados sugerem um papel cariogênico de P. melaninogenica e um potencial papel protetor de certas espécies bacterianas como A. defectiva, porém estudos mais detalhados são necessários para confirmação |
|
Legendas: RT = Radioterapia; QT = Quimioterapia; CCP = Câncer de cabeça e pescoço. |
||||
|
Tabela 3. Características das condições odontológicas e aspectos microbiológicos dos estudos que avaliaram a interação da microbiota frente ao tratamento antineoplásico de pacientes com câncer de cabeça e pescoço |
|||
|
Autor/Ano |
Condições odontológicas |
Alterações bacteriológicas da microbiota |
Alterações micológicas da microbiota |
|
Gaetti-Jardim Jr et al., 2011 |
A presença de próteses totais ou condições dentárias (ou seja, presença ou ausência de cárie cavitada) não influenciou a ocorrência de mucosite (teste do qui-quadrado, p=0,139). O estado periodontal não influenciou a ocorrência de mucosite (teste qui-quadrado, p=0,779). A ocorrência de mucosite foi associada ao desenvolvimento de xerostomia (teste qui-quadrado, p=0,021) |
Inicialmente, antes da RT, micro-organismos entéricos foram cultivados de amostras de mucosa oral, sendo identificados como E. faecalis e Citrobacter freundii. Além disso, 30 dias após a RT, bactérias entéricas e Pseudomonas foram cultivadas em 77,8% dos pacientes edêntulos e em 46,9% dos pacientes dentados. Ademais, pacientes desdentados apresentaram maior frequência de colonização oral por micro-organismos entéricos (p=0,038) e a RT foi associada a um aumento significativo na ocorrência desses micro-organismos (p<0,001) |
15 pacientes (30%) foram inicialmente colonizados por Candida spp. Aumentando para 78% logo após a RT e 84% 30 dias após a RT; esse aumento não estava diretamente relacionado ao estado dentário ou periodontal. 30 dias após a RT, as leveduras foram recuperadas de todos os indivíduos edêntulos e de 75% dos pacientes dentados. Os isolados de fungos foram identificados como Candida albicans, C. tropicalis, C. krusei, C. glabrata ou C. parapsilosis. A presença de C. albicans concomitantemente com espécies não albicans de Candida foi particularmente comum após RT |
|
Simões et al., 2011 |
– |
– |
A maioria dos pacientes estudados recebeu irradiação entre 2.880cGy e 6.160cGy e, em apenas 3 pacientes, não foi detectada proliferação de fungos do gênero Candida. A colonização fúngica foi observada em 19 casos. Os pacientes estudados apresentaram correlação positiva entre lesões de mucosite oral e colonização fúngica |
|
Hu et al., 2013 |
Foram excluídos do estudo pacientes que apresentassem lesões de cárie cavitadas não tratadas ou abscessos orais e aqueles incapazes de manter a higiene oral durante o estudo |
Apenas 2 gêneros (Streptococcus e Actinomyces) estiveram presentes em todos os pontos durante a RT no tempo de 10 Gy a 60 Gy. A abundância relativa de Streptococcus oscilou entre 21,33% (20 Gy) e 3,2% (50 Gy), e a de Actinomyces permaneceu estável (cerca de 4,48% a 4,85%) no estágio inicial dos pontos de tempo (10 Gy, 20 Gy, 30 Gy), mas subiu para 23,32% no ponto de tempo de 50 Gy. Vários outros gêneros, incluindo Veillonella, Capnocytophaga, Derxia, Neisseria, Rothia, Prevotella, Granulicatella, Luteococcus e Gemella foram identificados em algum momento nos sujeitos durante a RT (10 Gy-60 Gy) |
|
|
Souza et al., 2015 |
Os pacientes apresentavam condições bastante variáveis de higiene bucal, sendo que 18% apresentaram uma higiene satisfatória, enquanto 36%, higiene regular, 46% condições precárias de higiene. As condições de higiene bucal mostraram uma significativa deterioração durante e imediatamente após a RT, evidenciada pelo maior acúmulo de biofilme visível (teste de qui-quadrado, p=0,042). Observou-se que todos os pacientes que desenvolveram mucosite graus III e IV apresentavam condições precárias de higiene dental (teste de qui-quadrado, p<0,001) |
Identificou-se a presença de espécies da família Enterobacteriaceae, Enterococos e Estafilococos. Inicialmente, acreditou-se na hipótese de que as condições precárias de higiene bucal, comuns nos pacientes estudados, pudessem constituir o principal elemento que condicionava a transmissão dos micro-organismos encontrados, o que poderia ser potencializado pelo uso de próteses, além da ocorrência de mucosite e xerostomia, que deteriorariam as já precárias condições bucais. O papel desses fatores isoladamente sugeria que a presença dos micro-organismos nos pacientes seria transitória. Entretanto, os micro-organismos-alvo estiveram presentes, em parcela significativa dos pacientes, ao longo do tempo de avaliação, tendo aumentado com a RT e se mantido em patamares elevados mesmo 12 meses após a conclusão |
|
|
Vidal-Casariego et al., 2015 |
– |
Colonização bacteriana foi encontrada em 28,6% (10/27) de pacientes, e as espécies isoladas incluíram Staphylococcus aureus (3/10), Escherichia coli (3/10), Pseudomonas aeruginosa (2/10), Serratia spp. (2/10), Enterobacter cloacae (2/10), Citrobacter freundii (2/10), Klebsiella oxytoca (1/10) e Agrobacterium radiobacter (1/10). Em 4 casos, mais de 1 espécie bacteriana foi isolada |
Os fungos foram cultivados em 35,3% (12/35) de pacientes: 11 amostras corresponderam à Candida albicans e 1 amostra à Candida tropicalis |
|
Zhang et al., 2015 |
Foram incluídos no estudo indivíduos que apresentassem cárie dentária recente após RT, e excluídos aqueles que demonstrassem periodontite |
Foram observados 11 gêneros de (Streptococcus, Neisseria, Scardovia, Porphyromonas, Fusobacteria, Lautropia, Veillonella, Capnocytophaga, Rithia, Leptotrichia e Prevotella), sendo Streptococcus spp. e Neisseria spp. presentes em mais de 80% das amostras |
– |
|
Zhu et al., 2017 |
Foram excluídos do estudo os pacientes, assim que apresentavam má higiene bucal e/ou desenvolveram formas graves de doenças periodontais |
Houve abundância relativa significativamente maior de Streptococcus nos casos de mucosite de graus III e IV. Além disso, em comparação com indivíduos saudáveis, os pacientes oncológicos incluídos neste estudo abrigavam abundâncias significativamente maiores de Pseudomonas, Pediococcus e Oscillibacter na orofaringe, todos os quais foram mostrados por estarem associados a infecções humanas |
– |
|
Mougeot et al., 2019 |
Foram estudados 2 grupos, 1 de pacientes com aumento da cárie dentária e outro de pacientes sem aumento da cárie dentária |
A espécie Streptococcus mutans aumentou no período de 6 meses após o tratamento, nos pacientes com e sem aumento da cárie dentária. Já a espécie Prevotella melaninogenica diminuiu no período de 6 meses após a terapia antineoplásica nos pacientes sem aumento da cárie dentária. Ainda, a da espécie associada à saúde, Abiotrophia defeituosa, diminuiu no grupo de pacientes com aumento da cárie dentária |
– |
|
Legenda: RT = Radioterapia. |
|||
DISCUSSÃO
No presente estudo, observa-se que os pacientes do sexo masculino são mais acometidos pelo câncer de cabeça e pescoço, em concordância com as estatísticas mundiais22. Entre os perfis histopatológicos, a maioria dos estudos apontou o carcinoma de células escamosas como o mais prevalente, dado em conformidade com a literatura científica23,24. A radioterapia foi a terapia mais utilizada para o tratamento de cânceres que atingem a região da cabeça e pescoço, esse dado corrobora a maioria dos protocolos mundiais de tratamento antineoplásico22.
Diante dos diversos estudos analisados, verificou-se que a microbiota da cavidade oral e da orofaringe sofre alterações perante a terapia antineoplásica25-31. Sequelas advindas desses tratamentos como mucosite, xerostomia e depressão do sistema imune afetam diretamente na relação de homeostase entre os micro-organismos e a saúde do hospedeiro, tornando até mesmo micro-organismos já residentes em potenciais patógenos31-33.
Cinco dos estudos informaram os cuidados orais adotados para os pacientes: três deles realizaram um protocolo de adequação do meio bucal com procedimentos periodontais, restauradores e cirúrgicos, além de instruções de higiene oral26,29,30 e dois deles realizaram apenas instruções de higiene oral25,27. Mesmo assim, em nenhum dos estudos selecionados, a instituição de cuidados orais consistiu em variável metodológica do estudo, visto que os cuidados foram instituídos para todos os pacientes. Os demais estudos não fizeram menção a qualquer tipo de intervenção odontológica28,31,33. Adicionalmente, um dos estudos que realizou adequação de meio bucal dos pacientes destacou que apenas 38% dos pacientes procuraram tratamento odontológico30, enquanto outro estudo descreveu que apenas 36% dos pacientes seguiram a orientação dos centros de radioterapia e procuraram tratamento odontológico previamente à realização da radioterapia27.
O gênero Candida é o mais predominante entre os fungos residentes da cavidade oral32, contudo, as várias alterações a que seu hospedeiro é submetido durante a terapia antineoplásica podem alterar sua posição harmônica no equilíbrio microbiano. Em seu estudo, Vidal-Casariego et al.28 cultivaram leveduras em 35,3% dos pacientes totais com câncer em tratamento, tendo 11 (97,7%) amostras que corresponderam à espécie Candida albicans e uma (8,3%) amostra à Candida tropicalis28, com número inferior ao da variedade de espécies isoladas no estudo de Gaetti-Jardim Jr et al.30, que identificaram, em 84% dos pacientes após 30 dias da sessão radioterápica, as seguintes espécies de fungos: Candida albicans, C. tropicalis, C. krusei, C. glabrata e C. parapsilosis. Mesmo com as orientações repassadas do uso de suspensão de nistatina durante a radioterapia, ocorreu a proliferação de fungos Candida spp., sendo esse fator ligado principalmente à baixa adesão do paciente, sendo importante o acompanhamento odontológico na aderência de uma terapêutica eficiente30.
Além disso, o estudo de Gaetti-Jardim Jr et al.30 ainda permitiu identificar um aumento de 78% dos fungos Candida spp. imediatamente após o término do tratamento radioterápico e de 84% 30 dias após a última sessão de radioterapia, estando ainda associados à manifestação da mucosite de graus III e IV30. Esse dado é compatível com o estudo de Simões et al.31, que mostraram um desenvolvimento de candidíase em associação com mucosite oral graus III e IV, comprovando a correlação positiva entre as lesões e a colonização fúngica por Candida31.
Ainda nos isolados de Gaetti-Jardim Jr et al.30, antes da radioterapia, os micro-organismos entéricos foram cultivados a partir de amostras de mucosa oral de quatro pacientes desdentados (22,5%) e de biofilmes subgengivais de três pacientes dentados (9,4%), sendo identificadas bactérias exógenas com potencial patogênico como E. faecalis em seis amostras de pacientes desdentados ou dentados e Citrobacter freundii em uma amostra de um paciente desdentado. Além disso, 30 dias após o término do tratamento radioterápico, bactérias entéricas e pseudomonas foram cultivadas em 77,8% dos pacientes desdentados e em 46,9% dos pacientes dentados. Estabelecendo como os gêneros mais frequentemente detectados Citrobacter, Enterobacter, Enterococcus, Klebsiella, Morganella, Proteus e Pseudomonas. Nesse sentido, pacientes desdentados apresentaram maior frequência de colonização oral por micro-organismos entéricos, e a radioterapia foi associada a um aumento significativo na ocorrência desses micro-organismos. A ocorrência de micro-organismos entéricos não foi associada à gengivite ou à periodontite, mas foram observadas com maior frequência entre os consumidores de tabaco e os pacientes com mucosite nível III ou IV30.
Na pesquisa de Souza et al.27, foi possível encontrar, após o início da radioterapia, que o primeiro grupo microbiano, cuja prevalência se elevou, foi o dos membros da família Enterobacteriaceae, nas primeiras duas a três semanas de tratamento e na conclusão da radioterapia, mantendo-se frequentes no biofilme sub e supragengival, saliva e mucosa dos irradiados nos 12 meses após a radioterapia. A ocorrência dos cocos Gram-positivos não se elevou no início da radioterapia, mas E. faecalis se mostrou mais prevalente ao final, mantendo-se em patamares elevados de ocorrência um ano após a conclusão do tratamento radioterápico. Resultados semelhantes foram obtidos para os gêneros Enterococcus e Staphylococcus, enquanto E. faecium não teve sua ocorrência significativamente modificada pela radioterapia. A presença de membros da família Enterobacteriaceae e E. faecalis mostrou-se relacionada com as condições de higiene bucal, predominando entre os pacientes com higiene precária. Após 12 meses de avaliação, observou-se que, apenas nos pacientes que desenvolveram mucosite oral graus II e III, houve colonização por Enterococcus spp. e/ou bastonetes Gram-negativos da família Enterobacteriaceae27.
Nos resultados de Vidal-Casariego et al.28, verificou-se o isolamento na orofaringe de patógenos em 28,6% dos pacientes que desenvolveram mucosite oral; as cepas isoladas incluíram Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Serratia spp, Enterobacter cloacae, Citrobacter freundii, Klebsiella oxytoca, e Agrobacterium radiobacter. Não houve diferença significativa na colonização microbiana quanto ao sexo do paciente, local e estágio do câncer28.
No estudo de Hu et al.29, amostras da placa supragengival reunida das superfícies bucogengivais do primeiro molar superior em pacientes em radioterapia durante seis semanas de tratamento identificou 11 gêneros microbianos (Streptococcus, Actinomyces, Veillonella, Capnocytophaga, Derxia, Neisseria, Rothia, Prevotella, Granulicatella, Luteococcus e Gemella), que foram designados como um microbioma nuclear neste estudo, variando sua abundância relativa durante o curso da radioterapia. O gênero Streptococcus se apresentou com maior prevalência em todos os sujeitos durante as seis sessões e consistiu em grande número de espécies cariogênicas e não cariogênicas, incluindo S. sobrinus, S. mutans, S. oralis, S. mitis e S. pneumonia. O gênero Actinomyce obteve segunda maior prevalência29. Em concordância, as pesquisas de Zhu et al.26 também identificaram abundância relativa significativamente maior de Streptococcus em pacientes que apresentaram mucosite de graus III e IV, relacionada também com a progressão e o agravamento da mucosite induzida por radioterapia em pacientes com carcinoma nasofaríngeo. No mesmo estudo, em alguns pacientes, foram detectadas abundâncias significativamente de Pseudomonas, Pediococcus e Oscillibacter em orofaringe, todas as quais demonstraram estar associadas a infecções humanas. Esses resultados mostraram que as mudanças na comunidade microbiana oral correlacionadas com a progressão e agravamento da mucosite induzida por radioterapia em pacientes oncológicos e a busca de estratégias odontológicas para o tratamento precoce e prevenção da incidência de mucosite grave durante a radioterapia são essenciais26.
Pacientes submetidos à radioterapia apresentam risco elevado de cárie de radiação, sendo uma das complicações tardias do tratamento. Mougeot et al.25 realizaram um estudo com dois grupos de pacientes, um com aumento da cárie dentária e outro sem aumento. Foi observada diminuição da espécie Prevotella melaninogenica, frequentemente associada à cárie em crianças pequenas, em seis meses após a radioterapia no grupo de indivíduos sem aumento da cárie. Enquanto as espécies associadas à saúde do hospedeiro, Abiotrophia defectiva, diminuíram no grupo de pacientes com aumento da cárie dentária. Ainda, foi observado que a predominância da espécie Streptococcus mutans aumentou em seis meses após a radioterapia nos pacientes dos dois grupos, micro-organismo intimamente associado à cárie. Consequentemente, se torna fundamental observar como a radioterapia pode provocar alterações nos perfis da microbiota nos pacientes oncológicos, e assim resultar em fraquezas de defesa do hospedeiro que podem ser aumentadas pela não conformidade com as boas práticas de higiene oral25.
Contudo, Zhang et al.33 realizaram um estudo do tipo coorte-controle no qual analisaram a saliva de pacientes após 12 a 36 meses do fim do tratamento radioterápico, encontrando 80% do total das bactérias pertencentes às espécies Streptococcus spp. e Neisseria spp., sendo que distribuições semelhantes foram detectadas no grupo controle. Dessa forma, não ocorreu correlação clara entre as características da microbiota salivar do paciente e a cárie por radiação um ano após o tratamento. Ainda sugeriram que a função salivar em pacientes irradiados não se recupera completamente após 12 a 36 meses, mas o valor do pH e a capacidade de tamponamento da saliva retornam às condições normais, após um ano, o que permite melhor controle na homeostase da microbiota33.
Fundamentalmente, Zhang et al.33 encontraram níveis mais baixos de índice de placa nos participantes do grupo pacientes sem cárie de radiação do que nos participantes do grupo pacientes exibindo cárie de radiação (p=0,038). Visto que o índice de placa é uma avaliação direta do nível de higiene oral, uma diferença significativa no índice de placa indica que o grupo pacientes sem cárie de radiação tem melhor higiene oral do que o outro grupo. No entanto, mais estudos de caráter longitudinais e com maior população amostral devem ser realizados para relacionar a má higiene oral como um fator causal no desenvolvimento de cárie por radiação33.
Esta revisão buscou mostrar um panorama presente na literatura dos últimos dez anos, acerca da temática do impacto do tratamento antineoplásico sobre a microbiota da cavidade oral e orofaríngea em pacientes acometidos pelo câncer na região cabeça e pescoço, seguindo a metodologia PRISMA, no entanto, pela qualidade heterogênea dos estudos selecionados neste artigo, é inviável a realização de uma metanálise.
CONCLUSÃO
Após análise dos artigos selecionados, os autores relataram presença de processos patológicos, como mucosites e cáries dentárias, em grande parte dos pacientes envolvidos em suas pesquisas, sendo estas causadas por micro-organismos presentes na microbiota oral e orofaríngea, sendo os mais frequentemente relatados: bactérias da espécie Streptococcus spp. e fungos da espécie Candida spp. Além disso, o tratamento com radiação influencia no comportamento desse microbioma por meio do comprometimento funcional do organismo, alterando seu sistema imunológico, função salivar, entre outros. Esses fatores contribuem para o aumento da proliferação microbiológica, elevando as chances de os pacientes em tratamento ou pós-tratamento desenvolverem processos patológicos na cavidade oral e orofaríngea pelos micro-organismos. Tendo em vista essa condição, o entendimento das alterações do microbioma oral provocadas pelo tratamento contra o câncer de cabeça e pescoço e uma participação ativa da equipe de odontologia hospitalar permitem um melhor planejamento para atender às necessidades dos pacientes, proporcionando uma melhor saúde bucal e reduzindo o impacto provocado pelo tratamento antineoplásico.
CONTRIBUIÇÕES
Todos os autores contribuíram substancialmente na concepção e/ou no planejamento do estudo; na obtenção, análise e/ou interpretação dos dados; na redação e/ou revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Colombo J, Rahal P. Alterações genéticas em câncer de cabeça e pescoço. Rev Bras Cancerol. 2009;55(2):165-74. doi: https://doi.org/10.32635/2176-9745.RBC.2009v55n2.1648
2. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2020: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2019 [acesso 2020 maio 25]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/estimativa-2020-incidencia-de-cancer-no-brasil.pdf
3. Instituto Nacional de Câncer José Alencar Gomes da Silva. Dia Nacional de Combate ao Câncer: estimativa 2016: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2015 [acesso 2020 maio 25]. Disponível em: http://www.oncoguia.org.br/pub//10_advocacy/Estimativas_INCA.pdf [Apresentação em Powerpoint].
4. Lee SC, Tang IP, Avatar SP, et al. Head and neck cancer: possible causes for delay in diagnosis and treatment. Med J Malaysia. 2011;66(2):101-4.
5. Lambert R, Sauvaget C, Camargo Cencela M, et al. Epidemiology of cancer from the oral cavity and oropharynx. Eur J Gastroenterol Hepatol. 2011;23(8):633-41. doi: https://doi.org/10.1097/MEG.0b013e3283484795
6. Chen T, Yu WH, Izard J. et al. The human oral microbiome database: a web accessible resource for investigating oral microbe taxonomic and genomic information. Database (Oxford). 2010;2010:baq013. doi: https://doi.org/10.1093/database/baq013
7. Sampaio-Maia B, Caldas IM, Pereira ML, et al. The oral microbiome in health and its implication in oral and systemic diseases. Adv Appl Microbiol. 2016;97:171‐210. doi: https://doi.org/10.1016/bs.aambs.2016.08.002
8. Jenkinson HF, Lamont RJ. Oral microbial communities in sickness and in health. Trends Microbiol. 2005;13(12):589-95. doi: https://doi.org/10.1016/j.tim.2005.09.006
9. Lemos JA, Palmer SR, Zeng L, et al. The Biology of Streptococcus mutans. Microbiol Spectr. 2019;7(1):GPP3-0051-2018. doi: https://doi.org/10.1128/microbiolspec.GPP3-0051-2018
10. Komiyama EY, Lepesqueur LSS, Yassuda CG, et al. Enterococcus species in the oral cavity: prevalence, virulence factors and antimicrobial susceptibility. PloS One. 2016;11(9):e0163001. doi: https://doi.org/10.1371/journal.pone.0163001
11. Leão-Vasconcelos LSNO, Lima ABM, Costa DM, et al. Enterobacteriaceae isolates from the oral cavity of workers in a Brazilian oncology hospital. Rev Inst Med Trop São Paulo. 2015;57(2):121‐7. doi: https://doi.org/10.1590/S0036-46652015000200004
12. Ghannoum MA, Jurevic RJ, Mukherjee PK, et al. Characterization of the oral fungal microbiome (Mycobiome) in healthy individuals. PLoS Pathog. 2010;6(1):e1000713. doi: https://doi.org/10.1371/journal.ppat.1000713
13. Moon JH, Lee J. Probing the diversity of healthy oral microbiome with bioinformatics approaches. BMB Rep. 2016;49(12):662-570. doi: https://doi.org/10.5483/bmbrep.2016.49.12.164
14. Costalonga M, Herzberg MC. The oral microbiome and the immunobiology of periodontal disease and caries. Immunol Lett. 2014;162(2 Pt A):22-38. doi: https://doi.org/10.1016/j.imlet.2014.08.017
15. Nasry B, Choong C, Flamiatos E, et al. Diversity of the oral microbiome and dental health and disease. Int J Clin Med Microbiol. 2016;1(1):1-8. doi: https://doi.org/10.15344/2456-4028/2016/108
16. Terai T, Okumura T, Imai S, et al. Screening of probiotic candidates in human oral bacteria for the prevention of dental disease. PLoS One. 2015;10(6):e0128657. doi: https://doi.org/10.1371/journal.pone.0128657
17. Kim BS, Han DH, Lee H, et al. Association of salivary microbiota with dental caries incidence with dentine involvement after 4 years. J Microbiol Biotechnol. 2018;28(3):454-64. doi: https://doi.org/10.4014/jmb.1710.10028
18. Instituto Latino-Americano de Sepse [Internet]. São Paulo: Sepse; c2016. Santa Casa faz alerta à sociedade no Dia Mundial de Combate à Sepse; 2016 dez 6 [acesso 2020 jun 3]. Disponível em: https://ilas.org.br/interacao/?p=230
19. Galvão TF, Pereira MG. Revisões sistemáticas da literatura: passos para sua elaboração. Epidemiol Serv Saúde. 2014.;23(1):183-4. doi: http://doi.org/10.5123/S1679-49742014000100018
20. Moher D, Liberati A, Tetzlaff J, et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med. 2009;6(7):e1000097. doi: http://doi.org/10.1371/journal.pmed.1000097
21. Ouzzani M, Hammady H, Fedorowicz Z, et al. Rayyan--a web and mobile app for systematic reviews. Syst Rev. 2016;5:210. doi: https://doi.org/10.1186/s13643-016-0384-4
22. Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-49. doi: http://doi.org/10.3322/caac.21660
23. Muzic JG, Schmitt AR, Wright AC, et al. Incidence and trends of basal cell carcinoma and cutaneous squamous cell carcinoma: a population-based study in olmsted county, Minnesota, 2000 to 2010. Mayo Clin Proc. 2017;92(6):890‐8. doi: https://doi.org/10.1016/j.mayocp.2017.02.015
24. Curado MP, Hashibe M. Recent changes in the epidemiology of head and neck cancer. Curr Opin Oncol. 2009;21(3):194-200. doi: https://doi.org/10.1097/CCO.0b013e32832a68ca
25. Mougeot JC, Stevens CB, Almon KG, et al. Caries-associated oral microbiome in head and neck cancer radiation patients: a longitudinal study. J Oral Microbiol. 2019;11(1):1586421. doi: https://doi.org/10.1080/20002297.2019.1586421
26. Zhu XX, Yang XJ, Chao YL, et al. The potential effect of oral microbiota in the prediction of mucositis during radiotherapy for nasopharyngeal carcinoma. EBioMedicine. 2017;18:23‐31. doi: https://doi.org/10.1016/j.ebiom.2017.02.002
27. Souza FRN, Meca LB, Correia ASC, et al. Microrganismos oportunistas na boca de pacientes irradiados: avaliação de 12meses pós-tratamento. Arch Health Invest. 2015;4(5):55-61.
28. Vidal-Casariego A, Fernández-Natal I, Calleja-Fernández A, et al. Nutritional, microbiological, and therapeutic factors related to mucositis in head and neck cancer patients: a cohort study. Nutr Hosp. 2015;32(3):1208‐13. doi: https://doi.org/10.3305/nh.2015.32.3.9299
29. Hu YJ, Shao ZY, Wang Q, et al. Exploring the dynamic core microbiome of plaque microbiota during head-and-neck radiotherapy using pyrosequencing. PLoS One. 2013;8(2):e56343. doi: https://doi.org/10.1371/journal.pone.0056343
30. Gaetti-Jardim Jr E, Ciesielski FIN, Nunes de Sousa FR, et al. Occurrence of yeasts, pseudomonads and enteric bacteria in the oral cavity of patients undergoing head and neck radiotherapy. Braz J Microbiol. 2011;42(3):1047-55. doi: https://doi.org/10.1590/S1517-83822011000300024
31. Simões CA, Castro JFL, Cazal C. Candida oral como fator agravante da mucosite radioinduzida. Rev Bras Cancerol. 2011;57(1):23-9. doi: https://doi.org/10.32635/2176-9745.RBC.2011v57n1.681
32. Dabas PS. An approach to etiology, diagnosis and management of different types of candidiasis. J Yeast Fungal Res. 2013;4(6):63-74. doi: https://doi.org/10.5897/JYFR2013.0113
33. Zhang J, Liu H, Liang X. et al. Investigation of salivary function and oral microbiota of radiation caries-free people with nasopharyngeal carcinoma. PLoS One. 2015;10(4):e0123137. doi: https://doi.org/10.1371/journal.pone.0123137
Recebido em 9/3/2021
Aprovado em 5/7/2021
Editor-associado: Daniel Cohen. Orcid iD: https://orcid.org/0000-0002-0089-1910
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde