ARTIGO ORIGINAL
Evolução do Estado Nutricional de Crianças e Adolescentes com Leucemia Linfoide Aguda submetidos a Terapia Oncológica
Evolution of the Nutritional status of Children and Adolescents with Acute Lymphoid Leukemia undergoing Cancer Therapy
Evolución del Estado Nutricional de Niños y Adolescentes con Leucemia Linfoide Aguda en Tratamiento Oncológico
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n2.1865
Adauto Cezar Melo Paiva1; Jullyana Flávia da Rocha Alves2; Derberson José do Nascimento Macêdo3; Marcele Araújo Gonçalves4
1-4Instituto de Medicina Integral Prof. Fernando Figueira (IMIP). Recife (PE), Brasil.
1E-mail: adauto.cezar@hotmail.com. Orcid iD: https://orcid.org/0000-0003-3183-4422
2E-mail: jullyana-alves@hotmail.com. Orcid iD: https://orcid.org/0000-0002-9739-8427
3E-mail: derbersonjose@gmail.com. Orcid iD: https://orcid.org/0000-0002-5653-4461
4E-mail: marcelearaujog96@gmail.com. Orcid-iD: https://orcid.org/0000-0003-3257-6226
Endereço para correspondência: Adauto Cezar Melo Paiva. Rua General Cândido Borges Castelo Branco, 252 – Iputinga. Recife (PE), Brasil. CEP 50670-170. E-mail: adauto.cezar@hotmail.com
RESUMO
Introdução: Quando se fala em câncer infantojuvenil, a leucemia linfoide aguda (LLA) ganha destaque por causa da sua elevada prevalência nessa população. De todos os tipos de câncer que atingem esse público, crianças e adolescentes parecem ser mais suscetíveis aos efeitos adversos como a má nutrição e/ou excesso de peso ao longo do tratamento. Objetivo: Avaliar a evolução do estado nutricional de crianças e adolescentes com LLA submetidos à terapia oncológica. Método: Estudo retrospectivo, longitudinal, com pacientes portadores de LLA submetidos à terapia antineoplásica, realizado com 69 crianças e adolescentes (até 19 anos), de ambos os sexos. As medidas de peso e altura foram coletadas em oito ocasiões distintas ao longo de todo o tratamento, tendo o primeiro registro acontecido no início e o último ao término de todas as sessões do tratamento antineoplásico. Resultados: Ao diagnóstico, houve uma prevalência de pacientes classificados como eutróficos. Quando correlacionados a faixa etária e o indicador Altura/Idade para idade, foi observado que crianças menores de 10 anos apresentaram valores mais baixos se comparados com os maiores de 10 anos no decorrer do tratamento, além de uma tendência de incremento no escore Peso/Idade de forma lenta até o seu final. Conclusão: Os pacientes submetidos ao tratamento antineoplásico de LLA apresentaram uma redução na velocidade de crescimento, além de leve ganho de peso ao final da terapia, o que sugere uma interferência negativa da terapêutica empregada sobre o estado nutricional nessa população.
Palavras-chave: leucemia-linfoma linfoblástico de células precursoras/tratamento farmacológico; avaliação nutricional; estado nutricional; criança; adolescente.
ABSTRACT
Introduction: When it comes to childhood cancer, acute lymphoid leukemia (ALL) stands out due to its high prevalence in this population. Of all types of cancer affecting this population, children and adolescents seem to be more susceptible to adverse effects such as malnutrition and/or overweight during treatment. Objective: To evaluate the evolution of the nutritional status of children and adolescents with acute ALL undergoing cancer therapy. Method: Retrospective, longitudinal study with patients with ALL undergoing antineoplastic therapy carried out with 69 children and adolescents (up to 19 years old) of both sexes. Weight and height measurements were collected on eight different occasions throughout the treatment, the first at the beginning of the treatment and the last at the end of all the sessions of antineoplastic treatment. Results: At diagnosis, there was prevalence of patients classified as eutrophic. When the age group and the indicator of Height/Age for age were correlated, it was observed that children under 10 years old had lower values when compared to those older than 10 years during the treatment, in addition to a rising trend of the Weight/Age score slowly until its end. Conclusion: Patients undergoing antineoplastic treatment for ALL presented a reduction in the velocity of growth, in addition to a slight weight gain at the end of the therapy, which suggests a negative interference on the nutritional status of this population.
Key words: precursor cell lymphoblastic leukemia-lymphoma/drug therapy; nutrition assessment; nutritional status; child; adolescent.
RESUMEN
Introducción: En lo que respecta al cáncer infantil, se destaca la leucemia linfoide aguda (LLA) por su alta prevalencia en esta población. De todos los tipos de cáncer que afectan a este público, los niños y adolescentes parecen ser más susceptibles a efectos adversos como desnutrición y/o sobrepeso durante el tratamiento. Objetivo: Evaluar la evolución del estado nutricional de niños y adolescentes con LLA en tratamiento oncológico. Método: Estudio longitudinal retrospectivo con pacientes con LLA sometidos a tratamiento antineoplásico. Realizado con 69 niños y adolescentes (hasta 19 años), de ambos sexos. Las medidas de peso y talla se recogieron en ocho ocasiones diferentes a lo largo del tratamiento, donde el primer registro tuvo lugar al inicio del tratamiento y el último al final de todas las sesiones de tratamiento antineoplásico. Resultados: Al diagnóstico, hubo una prevalencia de pacientes clasificados como eutróficos. Cuando el grupo de edad y el indicador Altura/Edad se correlacionaron, se observó que los niños menores de 10 años presentaron valores menores en comparación con los mayores de 10 años durante el tratamiento, además de una tendencia a aumentar el Peso/Edad puntúe lentamente hasta el final. Conclusión: Los pacientes sometidos a tratamiento antineoplásico de LLA mostraron una reducción en la velocidad de crecimiento, además de un ligero aumento de peso al final de la terapia, lo que sugiere una interferencia negativa de la terapia utilizada sobre el estado nutricional de esta población.
Palabras clave: leucemia-linfoma linfoblástico de células precursoras/tratamiento farmacológico; evaluación nutricional; estado nutricional; niño; adolescente.
INTRODUÇÃO
Quando se fala em câncer infantojuvenil (0-19 anos), a leucemia linfoide aguda (LLA) ganha destaque em virtude da sua elevada prevalência nessa população. De todos os tipos de câncer que atingem esse público, as leucemias representam 32% e correspondem a uma variação de 1% a 4% de todas as neoplasias no mundo1. No Brasil, a incidência de novos casos de leucemias em 2020 diminuiu, embora atualmente esse tipo de câncer represente o décimo câncer mais comum no país e o sétimo na Região Nordeste2.
Ao avaliar crianças e adolescentes com LLA, foi verificada uma elevada frequência de excesso de peso já ao diagnóstico. Esse excesso de peso representou um fator de risco para um desfecho desfavorável, visto que a presença de sobrepeso e/ou obesidade pode estar relacionada a sérias complicações caso sejam mantidas no decorrer do tratamento3. De forma semelhante, foi constatado o excesso de peso em metanálise, que incluiu um total de 8.680 crianças e adolescentes com LLA e 2.922 com leucemia mieloide aguda (LMA) que receberam tratamento durante os anos 1985-2008. Sendo assim, analisou-se que o elevado Índice de Massa Corporal (IMC) esteve associado a um aumento de 56% no risco de mortalidade e na sobrevida reduzida de crianças e adolescentes portadoras de neoplasias linfoides e mieloides4.
O mais agravante é que esse ganho de peso muitas vezes persiste além do período de tratamento, tornando esses pacientes mais suscetíveis ao aparecimento de outras comorbidades associadas, tais como dislipidemias, diabetes, hipertensão5,6. Entre as medicações presentes nos protocolos quimioterápicos relacionadas ao excesso de peso, encontram-se também os corticosteroides (GCs), que geralmente são administrados em altas doses (dexametasona com dosagem mínima de 6 mg/m2 e prednisona com dosagem mínima de 60 mg/m2) e utilizados por todos os pacientes em tratamento de LLA, afetando o apetite e favorecendo o ganho ponderal7.
Por outro lado, vários efeitos adversos relacionados ao tratamento antineoplásico potencializam a má nutrição, podendo ser citados: náuseas, vômitos, diarreia, anorexia, perda de peso e mucosite. Essas repercussões são frequentemente observadas durante o tratamento de LLA, especialmente durante o primeiro ano de tratamento, podendo persistir ao longo do tempo, o que pode estar relacionado a um déficit no crescimento, comprometendo a altura final dos pacientes8. Após o término do tratamento, espera-se que aproximadamente 70% dos pacientes recuperem o atraso ao longo de um período de 2-3 anos, dependendo da intensidade, do tipo e da duração da terapia9.
Dessa forma, a nutrição é essencial para o crescimento e o desenvolvimento adequados, além de ser um componente crítico na otimização dos resultados clínicos de pacientes em tratamento oncológico. O impacto que a terapia antineoplásica causa na má nutrição, seja ela caracterizada pelo déficit, seja pelo excesso de peso, parece ser determinante sobre a saúde e qualidade de vida desses pacientes. Portanto, este trabalho teve por objetivo avaliar a evolução do estado nutricional de crianças e adolescentes com LLA submetidos à terapia oncológica, e assim contribuir com a adoção de medidas de prevenção e controle, auxiliando a melhora da qualidade de vida dessa população.
MÉTODO
Tratou-se de um estudo retrospectivo, longitudinal, conduzido na Unidade de Oncologia Pediátrica do Instituto de Medicina Integral Professor Fernando Figueira (IMIP), centro de referência da Região Nordeste do Brasil, com pacientes portadores de LLA, que tiveram seu tratamento compreendido no período de 2015 até 2020. A coleta de dados se deu entre os meses de outubro a dezembro de 2020, mediante informações obtidas em prontuários (eletrônico e físico).
Foram incluídos na pesquisa crianças e adolescentes de ambos os sexos, com idades até 19 anos e que foram tratados para LLA, sendo excluídos aqueles impossibilitados de realizar avaliação antropométrica convencional (amputados, anasarca ou portador de alguma síndrome genética), em recaída da doença oncológica e prontuários com informações incompletas em relação a peso e à altura.
Todas as informações necessárias ao estudo foram obtidas por meio de prontuário e aplicadas em formulário previamente estruturado, contendo: peso, estatura, sexo, indicadores antropométricos, idade, data de nascimento, procedência, classificação de risco da doença, início do tratamento, término do tratamento, classificação da leucemia. As medidas de peso e altura foram coletadas no momento das consultas ambulatoriais de rotina ou previamente às sessões de quimioterapia, totalizando, para cada paciente, oito aferições ao longo do tratamento. Nesse processo, o primeiro registro antropométrico aconteceu no início do tratamento quimioterápico e o último realizado ao término de todas as sessões do tratamento antineoplásico, intercalados por outros seis registros, que foram separados por uma média de 110 dias. Esse tempo foi utilizado com base nas atualizações de peso e estatura registradas em prontuário do paciente que fazem parte da rotina do hospital.
Para a avaliação do estado nutricional, a amostra foi pesada em balança digital Balmak® (modelo: BKH-200F, São Paulo, Brasil), com precisão de 0,100kg e capacidade de até 200 kg, disposta em um local plano; e a altura, por meio do antropômetro acoplado à balança, sendo utilizado, para os menores de 24 meses, um infantômetro (Welmy®, São Paulo, Brasil), com campo de uso de 100 cm. O diagnóstico nutricional foi realizado a partir dos índices antropométricos Peso/Idade (P/I), Altura/Idade (A/I) e Índice de Massa Corporal/Idade (IMC/I), segundo o sexo, considerando-se que as crianças abaixo de dois desvios-padrão (DP) apresentavam déficits nutricionais e acima de um DP para o indicador IMC/I, excesso de peso, e acima de dois DP para P/I, peso elevado para idade10. Os resultados foram expressos em escores-Z, empregando-se o programa WHO AnthroPlus® versão 3.2.2.
Os dados foram tabulados no programa Excel para Windows®. As análises foram realizadas no programa Statistical Package for the Social Sciences (SPSS) versão 13.0. As variáveis contínuas foram testadas quanto à normalidade pelo teste de Kolmogorov Smirnov. Para as variáveis com distribuição normal, utilizou-se o teste t de Student para comparar dois grupos independentes e o teste t pareado para comparar dois grupos dependentes. Para comparação entre as proporções, utilizou-se o teste qui-quadrado. Foi adotado um nível de significância de 5%.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa (CEP) do IMIP, em 14 de outubro de 2020, com CAAE: 39039520.2.0000.5201, de acordo com a Resolução n.º 466/1211 do Conselho Nacional de Saúde. Todos os dados coletados ficarão sob a guarda da coordenação da pesquisa, sendo garantidos o sigilo e a confidencialidade.
RESULTADOS
Os resultados da Tabela 1 demonstraram que, dos 69 pacientes avaliados, a maior parte era do sexo masculino (55,1%; n=38), com faixa etária predominante de crianças menores de 10 anos (63,8%; n=44) e provenientes, em sua maioria, do interior do Estado de Pernambuco (42%; n=29). Em relação à gravidade da doença, 46,4% foram classificados como tendo alto risco (n=32), enquanto 40,6% (n=28) apresentaram risco intermediário da doença.
|
Tabela 1. Variáveis sociodemográficas e clínicas de pacientes com LLA em um hospital de referência no Recife, Brasil, 2020 |
||
|
Variáveis |
n |
% |
|
Sexo |
||
|
Masculino |
38 |
55,1 |
|
Feminino |
31 |
44,9 |
|
Faixa etária |
||
|
0-10 anos |
44 |
63,8 |
|
5-10 anos |
18 |
23,2 |
|
> 10 anos |
9 |
13 |
|
Procedência |
||
|
Recife |
17 |
24,6 |
|
RMR |
20 |
29 |
|
Interior do Estado |
29 |
42 |
|
Outros Estados |
3 |
4,3 |
|
Risco da doença |
||
|
Intermediário |
28 |
40,6 |
|
Alto |
32 |
46,4 |
|
Especial |
9 |
13 |
|
TOTAL |
69 |
100 |
|
Legenda: RMR = Região Metropolitana do Recife. |
||
Quanto ao estado nutricional no momento do diagnóstico, houve uma predominância de pacientes classificados como eutróficos, mediante os indicadores antropométricos de P/I, E/I e IMC/I com 90%, 98,6% e 87%, respectivamente, com tempo médio de tratamento de 30 meses (±1,866 DP).
No Gráfico 1, está exposta a evolução dos escores dos três parâmetros antropométricos avaliados, iniciando do diagnóstico até o término do tratamento, dividida em oito cortes avaliativos. Todos os pacientes foram avaliados até o quinto corte (n=69/100%) e 47 pacientes foram avaliados até o oitavo corte (68,1%). A média entre os cortes foi de 110 dias (±27 DP).
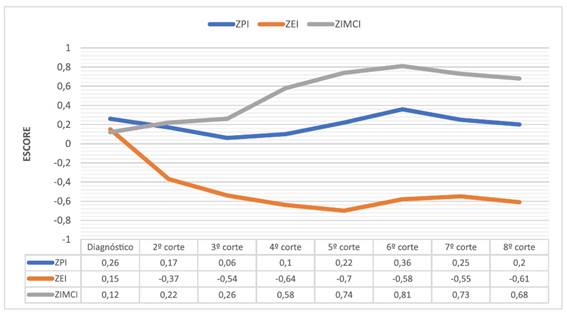
Gráfico 1. Evolução dos escores de P/I, E/I e IMC/I durante todo o tratamento oncológico
de pacientes com LLA em um hospital de referência no Recife, Brasil, 2020
Legendas: ZPI = Escore-Z do peso-para-idade; ZEI = Escore-Z da estatura-para-idade;
ZIMCI = Escore-Z do Índice de Massa Corporal-para-idade.
Como pode ser visto no Gráfico 1, ao analisar a evolução dos escores dos três parâmetros antropométricos do diagnóstico até o término do tratamento, é possível constatar que o escore de P/I apresentou uma queda até o terceiro corte e, nos cortes subsequentes, voltou a crescer de forma lenta até o final do tratamento. Já o indicador E/I, como já descrito anteriormente, foi o mais afetado, pois seu escore ao início do tratamento foi de 0,15 e despencou para -0,61 ao seu final. Por sua vez, quando se observa o escore de IMC/I ao longo dos cortes, percebe-se um incremento desse indicador durante o tratamento antineoplásico.
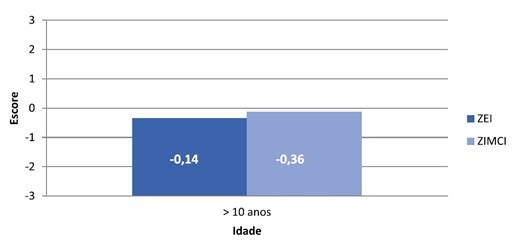
Gráfico 2. Correlação entre a média dos escores de E/I e IMC/I e a faixa etária de
jovens com idade superior a 10 anos de pacientes com LLA em um hospital de
referência no Recife, Brasil, 2020
Legendas: ZEI = Escore-Z da estatura-para-idade;
ZIMCI = Escore-Z do Índice de Massa Corporal-para-idade.
Ao correlacionar a faixa etária e a classificação dos parâmetros antropométricos de acordo com os cortes avaliativos, observou-se uma influência estatisticamente significante no indicador de E/I, como descrito na Tabela 2, de forma que os menores de 10 anos (87%) tiveram uma redução na velocidade de crescimento no decorrer do tratamento, diferentemente do verificado entre os maiores de 10 anos, os quais possivelmente já tinham estabilizado o crescimento linear. De forma divergente, a variação na faixa etária não interferiu nos parâmetros de P/I e IMC/I (p>0,05).
Foi observado ainda que, durante o tratamento, os escores mais elevados de E/I estavam com os indivíduos acima de 10 anos (p=0,04), como pode ser visto no Gráfico 2, o que não aconteceu quando analisado o indicador IMC/I, em que verificou-se uma correlação inversamente proporcional, ou seja, quanto maior a idade, menores foram os valores de IMC, sendo esse achado estatisticamente significativo (p=0,002).
|
Tabela 2. Correlação entre faixa etária e a adequação da estatura nos oito cortes avaliativos, de crianças e adolescentes durante todo o período de tratamento antineoplásico, em um hospital de referência no Recife, Brasil, 2020 |
|||||||
|
|
Estatura adequada |
Baixa estatura |
Total |
P** |
|||
|
Faixa etária |
n |
% |
n |
% |
n |
% |
|
|
1º corte |
|
|
|
|
|
|
|
|
0 a <10 anos |
45 |
51,1 |
1 |
1,5 |
46 |
30 |
0,692* |
|
> 10 anos |
23 |
26,1 |
0 |
0,0 |
23 |
15,0 |
|
|
2º corte |
|
|
|
|
|
|
|
|
0 a <10 anos |
42 |
47,7 |
4 |
6,2 |
46 |
30 |
0,007* |
|
> 10 anos |
23 |
26,1 |
0 |
0,0 |
23 |
15,0 |
|
|
3º corte |
|
|
|
|
|
|
|
|
0 a <10 anos |
40 |
45,4 |
6 |
9,3 |
46 |
30 |
0,032* |
|
> 10 anos |
23 |
26,1 |
0 |
0,0 |
23 |
15,0 |
|
|
4º corte |
|
|
|
|
|
|
|
|
0 a <10 anos |
38 |
43,2 |
8 |
12,3 |
46 |
30 |
0,012* |
|
> 10 anos |
22 |
25,0 |
1 |
1,5 |
23 |
15,0 |
|
|
5º corte |
|
|
|
|
|
|
|
|
0 a <10 anos |
38 |
43,2 |
8 |
12,3 |
46 |
30 |
0,012* |
|
> 10 anos |
22 |
25,0 |
1 |
1,5 |
23 |
15,0 |
|
|
6º corte |
|
|
|
|
|
|
|
|
0 a <10 anos |
34 |
38,6 |
9 |
13,9 |
43 |
28,1 |
0,278* |
|
> 10 anos |
18 |
20,5 |
2 |
3,1 |
20 |
13,1 |
|
|
7º corte |
|
|
|
|
|
|
|
|
0 a <10 anos |
30 |
34,1 |
6 |
9,3 |
36 |
32,5 |
0,063* |
|
> 10 anos |
16 |
18,2 |
1 |
1,5 |
17 |
11,1 |
|
|
8º corte |
|
|
|
|
|
|
|
|
0 a <10 anos |
27 |
30,7 |
4 |
6,2 |
31 |
20,3 |
0,585* |
|
> 10 anos |
15 |
17,0 |
1 |
1,5 |
16 |
10,5 |
|
|
(*) Teste qui-quadrado de Pearson. (**) P valor < 0,05. |
|||||||
DISCUSSÃO
O presente estudo foi composto exclusivamente por pacientes portadores de LLA. Diferentemente do estudo de Laks et al.12, que encontrou uma menor parcela de pacientes de alto risco de 28,6%, a presente pesquisa constatou uma maior frequência de pacientes de alto risco. Assim como visto por Revuelta Iniesta et al.13, que analisaram crianças e adolescentes escoceses tratados com câncer, a maioria dos pacientes era do sexo masculino.
Dudeja et al.14 acompanharam pacientes recém-diagnosticados com câncer por um período de dois anos em um hospital infantil na Índia, e, a partir desses dados, foi observada uma idade média ao diagnóstico de 5,1 anos, o que se diverge do encontrado no presente estudo, em que verificou-se uma idade média ao diagnóstico de 9,2 anos.
Com relação à duração do tratamento, a amostra apresentou uma média de 30 meses (±1,866 DP), já que a maior parte da população do estudo terminou o tratamento próximo do tempo esperado de 30 meses para portadores de LLA. Esse dado corrobora o estudo de Oliveira et al.15, que, ao analisarem o estado nutricional de crianças e adolescentes em tratamento de LLA, em Unidade de Oncologia Pediátrica, também na Região Nordeste, verificaram que o tempo de tratamento obtido (28,5 meses) foi semelhante ao encontrado no presente estudo.
Considerar o estado nutricional no momento do diagnóstico é uma fase crucial para o êxito do tratamento oncológico, pois esse estado pode influir negativamente em toda a terapêutica e no prognóstico dos pacientes. Neste estudo, houve uma predominância de pacientes classificados como eutróficos ao diagnóstico, o que corrobora o encontrado por Gomes et al.16, que, ao analisarem crianças e adolescentes (com menos de 19 anos) diagnosticados com LLA e acompanhados pelo Serviço de Oncologia Pediátrica de dois hospitais da cidade de Natal, no Rio Grande do Norte, Brasil, também obtiveram uma alta prevalência de eutrofia (85,7%) nesse mesmo período.
Quanto ao crescimento, os achados sugerem que houve um comprometimento do crescimento linear durante o tratamento antineoplásico, de forma que, quando correlacionados a idade dos indivíduos e o escore de E/I, constatou-se que quanto maior a idade, maior foi o escore de E/I. Isso possivelmente pode ser explicado pelo fato de que o ponto de corte é igual para todas as faixas etárias, e os adolescentes que já passaram pelo estirão de crescimento parecem ser os menos afetados. Resultado semelhante foi observado por Vilela e Viana8, em que o comprometimento estatural foi mais significativo em pacientes abaixo de 4 anos do que naqueles com idade superior a esta, sendo mais significativamente observado tal prejuízo ao final do tratamento.
De forma contrária, quando a faixa etária foi comparada com o indicador IMC/I, foi verificada uma correlação inversamente proporcional, ou seja, indivíduos maiores de 10 anos apresentaram um menor escore de IMC/I. Isso pode reforçar a hipótese de que indivíduos com idade superior, já com o crescimento estabilizado, apresentam valores menores de IMC por terem uma estatura já consolidada. Browne et al.17 também observaram em sua amostra uma menor frequência de pacientes portadores de LLA com incremento de IMC, sendo essa prevalência mais expressiva na faixa etária de crianças maiores de 10 anos.
A partir do momento que o indicador de IMC/I é empregado para classificar o estado nutricional e o indivíduo já possui um déficit estatural, esse indicador pode ser frágil, e o indivíduo tende a ser classificado erroneamente como sobrepeso/obesidade. Além disso, o retardo no crescimento somado a outros fatores que também contribuem para o excesso de peso durante e após o tratamento quimioterápico, como o uso de GCs, erro alimentar, excesso no tempo de telas, comportamento sedentário e deficiente acompanhamento multidisciplinar durante todo tratamento, são discutidos por muitos trabalhos como possíveis causas do excesso de peso em sobreviventes de câncer18-20. Os resultados encontrados no presente estudo sinalizam a importância quanto à análise da possível influência do comprometimento estatural sobre o incremento do IMC observado.
Com relação à evolução do escore P/I, percebeu-se uma queda até o terceiro corte avaliativo. Essa pequena queda no peso inicialmente pode ser justificada pela indução do tratamento à qual pacientes com LLA são submetidos, fase em que esses pacientes experimentam os primeiros efeitos colaterais da quimioterapia, podendo cursar com redução do apetite, náuseas e vômitos. Conforme ponderado por Schmiegelow et al.21, indivíduos portadores de LLA, quando submetidos a agentes antineoplásicos sob doses intensas, são mais susceptíveis aos efeitos adversos que potencializam a má nutrição. Isso acontece porque os principais efeitos colaterais descritos para algumas medicações utilizadas na terapêutica da LLA (vincristina, asparaginase e/ou metrotexato) na população pediátrica incluem disgeusia, anorexia, perda de peso, anemia, diarreia, náuseas, vômitos, infecções, fadiga, queda de cabelo e dor, os quais podem levar ao déficit nutricional, que não afetará apenas negativamente a resposta do paciente ao tratamento, como também prolongará o tempo de permanência hospitalar22.
Ainda sobre o escore P/I, percebeu-se um leve aumento subsequente ao terceiro corte que foi mantido até o final do tratamento. Isso corrobora o obtido por den Hoed et al.23, pois, em sua amostra, houve um aumento no IMC, associado a um atraso do crescimento. Adicionalmente, Withycombe et al.24 também constataram, em sua amostra, um incremento no peso maior ou igual a 20%, já que, dos pacientes que apresentaram esse ganho de peso, a maioria (93%) não era obeso no início da terapia.
É importante salientar que, embora os achados obtidos na presente pesquisa sejam relevantes para essa população e temática, algumas informações pertinentes não puderam ser coletadas com o advento da pandemia pelo novo coronavírus (2019-nCoV), o que resultou em algumas limitações referentes à impossibilidade da coleta de medidas como circunferência do braço e prega cutânea tricipital, a fim de evitar o contato físico com os pacientes, as quais dariam maior fidedignidade ao diagnóstico nutricional.
CONCLUSÃO
Diante do exposto, é possível concluir que pacientes em tratamento antineoplásico de LLA apresentaram uma redução na sua velocidade de crescimento, além de um declínio no peso corporal até o terceiro corte, com posterior ganho ponderal até o final do tratamento.
Nessa perspectiva, novos estudos são necessários para melhor descrever a evolução do estado nutricional em crianças e adolescentes portadores de LLA ao diagnóstico, durante e após o tratamento oncológico, mediante as alterações encontradas em cada etapa da terapia antineoplásica, a fim de direcionar orientações nutricionais mais assertivas.
CONTRIBUIÇÕES
Todos os autores contribuíram na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
AGRADECIMENTOS
A toda a equipe de nutrição do IMIP que contribuiu diretamente para a excelência na minha formação profissional.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Secretaria Estadual de Saúde de Pernambuco (SES-PE).
REFERÊNCIAS
1. American Cancer Society. Global cancer facts & figures [Internet]. 4th ed. Atlanta (GA): American Cancer Society; 2018 [cited 2020 Nov 15]. Available from: https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/global-cancer-facts-and-figures/global-cancer-facts-and-figures-4th-edition.pdf
2. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2020: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2019 [acesso 2020 setembro 19]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/estimativa-2020-incidencia-de-cancer-no-brasil.pdf
3. Seki Y, Okamoto Y, Kodama Y, et al. Risk factors and the prevention of weight gain during induction chemotherapy in children with acute lymphoblastic Leukemia. J Pediatr Hematol Oncol. 2018;40(6):e334-e337. doi: https://doi.org/10.1097/MPH.0000000000001098
4. Orgel E, Genkinger JM, Aggarwal D, et al. Association of body mass index and survival in pediatric leukemia: a meta-analysis. Am J Clin Nutr. 2016;103(3):808-17. doi: https://doi.org/10.3945/ajcn.115.124586
5. Guler E, Col N, Buyukcelik M, et al. Prevalence of hypertension determined by ambulatory blood pressure monitoring (ABPM) and body composition in long-term survivors of childhood cancer. Pediatr Hematol Oncol. 2018;35(1):1-10. doi: https://doi.org/10.1080/08880018.2018.1425784
6. Joffe L, Dwyer S, Glade Bender JL, et al. Nutritional status and clinical outcomes in pediatric patients with solid tumors: a systematic review of the literature. Semin Oncol. 2019;46(1):48-56. doi: https://doi.org/10.1053/j.seminoncol.2018.11.005
7. Wędrychowicz A, Hull B, Tyrawa K, et al. Cushing disease in children and adolescents - assessment of the clinical course, diagnostic process, and effects of the treatment - experience from a single paediatric centre. Pediatr Endocrinol Diabetes Metab. 2019;25(3):127-43. doi: https://doi.org/10.5114/pedm.2019.87179
8. Vilela MIOP, Viana MB. Longitudinal growth and risk factors for growth deficiency in children treated for acute lymphoblastic leukemia. Pediatr Blood Cancer. 2007;48(1):86-92. doi: https://doi.org/10.1002/pbc.20901
9. Bruzzi P, Bigi E, Predieri B, et al. Long-term effects on growth, development, and metabolism of ALL treatment in childhood. Expert Rev Endocrinol Metab. 2019;14(1):49-61. doi: https://doi.org/10.1080/17446651.2019.1561271
10. World Health Organization. WHO child growth standards: length/height-for-age, weight-for-age, weight-for-length, weight-for-height and body mass index-for-age: methods and development. Geneva: WHO, 2006.
11. Conselho Nacional de Saúde (BR). Resolução nº 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos [Internet]. Diário Oficial da União, Brasília, DF. 2013 jun 13 [acesso 2021 out 2]; Seção 1:59. Disponível em: https://conselho.saude.gov.br/resolucoes/2012/Reso466.pdf
12. Laks D, Longhi F, Wagner MB, et al. Avaliação da sobrevida de crianças com leucemia linfocítica aguda tratadas com o protocolo Berlim-Frankfurt-Munique. J Pediatr (Rio J). 2003;79(2):149-58. doi: https://doi.org/10.1590/S0021-75572003000200010
13. Revuelta Iniesta R, Paciarotti I, Davidson I, et al. Nutritional status of children and adolescents with cancer in Scotland: a prospective cohort study. Clin Nutr ESPEN. 2019;32:96-106. doi: https://doi.org/10.1016/j.clnesp.2019.04.006
14. Dudeja S, Gupta S, Sharma S, et al. Incidence of vincristine induced neurotoxicity in children with acute lymphoblastic leukemia and its correlation with nutritional deficiencies. Pediatr Hematol Oncol. 2019;36(6):344-51. doi: https://doi.org/10.1080/08880018.2019.1637981
15. Oliveira BA, Lins MM, Pedrosa F, et al. Estado nutricional de crianças e adolescentes sobreviventes de leucemia linfoide aguda tratados em um Centro de Referência da Região Nordeste do Brasil. Rev Nutr. 2013;26(3):271-81. doi: https://doi.org/10.1590/S1415-52732013000300002
16. Gomes CC, Silva CCG, Nascimento PRP, et al. Nutritional status and appetite-regulating hormones in early treatment of acute lymphoblastic leukemia among children and adolescents: a cohort study. Sao Paulo Med J. 2020;138(2):118-25. doi: https://doi.org/10.1590/1516-3180.2019.0307.r1.19112019
17. Browne EK, Zhou Y, Chemaitilly W, et al. Changes in body mass index, height, and weight in children during and after therapy for acute lymphoblastic leukemia. Cancer. 2018;124(21):4248-59. doi: https://doi.org/10.1002/cncr.31736
18. Collins L, Zarzabal LA, Nayiager T, et al. Growth in children with acute lymphoblastic leukemia during treatment. J Pediatr Hematol Oncol. 2010;32(8):e304-7. doi: https://doi.org/10.1097/MPH.0b013e3181ece2bb
19. Arpe MLH, Rørvig S, Kok K, et al. The association between glucocorticoid therapy and BMI z-score changes in children with acute lymphoblastic leukemia. Support Care Cancer. 2015;23(12):3573-80. doi: https://doi.org/10.1007/s00520-015-2718-5
20. Borim LNB, Ruiz MA, Conte ACF, et al. Estado nutricional como fator prognóstico em crianças portadoras de Leucemia Linfocítica Aguda. Rev Bras Hematol Hemoter. 2000;22(1):47-53. doi: https://doi.org/10.1590/S1516-84842000000100007
21. Schmiegelow K, Attarbaschi A, Barzilai S, et al. Consensus definitions of 14 severe acute toxic effects for childhood lymphoblastic leukaemia treatment: a Delphi consensus. Lancet Oncol. 2016;17(6):e231-e239. doi: https://doi.org/10.1016/S1470-2045(16)30035-3
22. Koshimoto S, Arimoto M, Saitou K, et al. Need and demand for nutritional counselling and their association with quality of life, nutritional status and eating-related distress among patients with cancer receiving outpatient chemotherapy: a cross-sectional study. Support Care Cancer. 2019;27(9):3385-94. doi: https://doi.org/10.1007/s00520-018-4628-9
23. den Hoed MAH, Pluijm SMF, de Groot-Kruseman HA, et al. The negative impact of being underweight and weight loss on survival of children with acute lymphoblastic leukemia. Haematologica. 2015;100(1):62-9. doi: https://doi.org/10.3324/haematol.2014.110668
24. Withycombe JS, Smith LM, Meza JL, et al. Weight change during childhood acute lymphoblastic leukemia induction therapy predicts obesity: a report from the Children's Oncology Group. Pediatr Blood Cancer. 2015;62(3):434-9. doi: https://doi.org/10.1002/pbc.25316
Recebido em 12/4/2021
Aprovado em 30/8/2021
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde