ARTIGO ORIGINAL
Fatores Prognósticos e Funcionalidade na Síndrome de Compressão Medular Metastática: um Estudo de Coorte
Prognostic Factors and Functionality in Metastatic Spinal Cord Compression: Cohort Study
Factores Pronósticos y Funcionalidad a Síndrome de Compresión Espinal Metástasico: un Estudio de Cohorte
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n2.2160
Eduarda Martins de Faria1; Bianca Paraiso de Araujo2; Patricia Almeida Chelles3; Alessandra Grasso Giglio4; Erica Alves Nogueira Fabro5; Luciana Velasco Bizzo6; Anke Bergmann7; Luiz Claudio Santos Thuler8; Gustavo Telles da Silva9
1,2Centro Universitário IBMR. Rio de Janeiro (RJ), Brasil. E-mails: eduardamarf@hotmail.com; bianca.paraiso@hotmail.com. Orcid iD: https://orcid.org/0000-0002-5255-625X; Orcid iD: https://orcid.org/0000-0003-0928-8381
3-7,9Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Rio de Janeiro (RJ), Brasil. E-mail: patalchelles@gmail.com; chandydasc@hotmail.com; ericanfabro@gmail.com; lbizzo@inca.gov.br; abergmann@inca.gov.br; ggustfisio@gmail.com. Orcid iD: https://orcid.org/0000-0001-5687-0302; Orcid iD: https://orcid.org/0000-0003-4431-2535; Orcid iD: https://orcid.org/0000-0003-0959-7678; Orcid iD: https://orcid.org/0000-0003-4175-8021; Orcid iD: https://orcid.org/0000-0002-1972-8777; Orcid iD: https://orcid.org/0000-0001-7606-2564
8INCA. Universidade Federal do Estado do Rio de Janeiro (Unirio). Rio de Janeiro (RJ), Brasil. E-mail: lthuler@gmail.com. Orcid iD: https://orcid.org/0000-0003-2550-6537
Endereço para correspondência: Gustavo Telles da Silva. Coordenação Técnico-assistencial do INCA. Rua do Resende, 128 ‒ Centro. Rio de Janeiro (RJ), Brasil. CEP 20231-092. E-mail: ggustfisio@gmail.com
Introdução: A síndrome de compressão medular metastática (SCMM) tem grande potencial de perda irreversível da função motora e sensitiva, sendo considerada uma emergência oncológica. Objetivo: Avaliar o prognóstico da SCMM e a funcionalidade dos pacientes com tumores sólidos. Método: Estudo de coorte que incluiu pacientes com câncer que desenvolveram SCMM entre janeiro de 2017 e dezembro de 2018. Os dados clínicos e sociodemográficos foram extraídos dos prontuários físicos e eletrônicos. Análise de sobrevida foi realizada pelo método Kaplan-Meier. Resultados: O estudo abrangeu 90 pacientes que apresentaram SCMM. Ao diagnóstico da SCMM, 55,5% dos pacientes não conseguiam realizar marcha. Os pacientes com SCMM após câncer de pulmão tiveram 4,1 vezes maior risco de morrer (IC 95%, 1,79-9,41; p=0,001), os pacientes com tumores geniturinários tiveram 1,9 vezes maior risco de morrer (IC 95%, 1,06-3,45; p=0,02) e os pacientes com outros tipos de tumor tiveram 3,1 vezes maior risco de morrer (IC 95%, 1,58-6,24; p=0,001) quando comparados aos pacientes com SCMM após câncer de mama. Conclusão: Destaca-se a relevância clínica deste estudo ao descobrir que o tipo de tumor primário é um fator preditor independente para sobrevida da SCMM. Ao diagnóstico da SCMM, mais da metade dos pacientes não realizam marcha.
Palavras-chave: compressão da medula espinal; neoplasias da coluna vertebral; metástase neoplásica; prognóstico.
ABSTRACT
Introduction: Metastatic Spinal Cord Compression (MSCC) has great potential of irreversible loss of motor and sensory function, and it is considered an oncological emergency. Objective: Evaluate the prognosis of MSCC and the functionality of patients with solid tumors. Method: Cohort study was conducted in patients with cancer who developed MSCC between January 2017 and December 2018. Clinical and socio-demographic data were extracted from physical and electronic charts. Survival analysis was performed by the Kaplan-Meier method. Results: The study included 90 patients who were diagnosed with MSCC. At the time of MSCC diagnosis, 55.5% of patients were unable to walk. Patients with MSCC after lung cancer had 4.1-fold more odds of death (95% CI: 1.79-9.41; p=0.001), those with genitourinary tumors, 1.9-fold higher risk of death (95% CI: 1.06-3.45; p=0,02), and with other types of tumors, 3.1-fold higher risk of death (95% CI: 1.58-6.24; p=0.001) when compared with patients with MSCC after breast cancer. Conclusion: The clinical relevance of this study relies on the findings that the primary type of tumor is a predictive factor for overall survival of MSCC. More than half of the patients were unable to walk at the MSCC diagnosis.
Key words: spinal cord compression; spinal neoplasms; neoplasm metastasis; prognosis.
RESUMEN
Introducción: El síndrome de compresión espinal (SCE) tiene un gran potencial de pérdida irreversible de la función motora y sensorial, siendo considerado una emergencia oncológica. Objetivo: Evaluar el pronóstico de SCE y la funcionalidad de los pacientes. Método: Estudio de cohorte que incluyó pacientes con cáncer que desarrollaron SCE entre enero de 2017 y diciembre de 2018. Se extrajeron datos clínicos y sociodemográficos de historias clínicas físicas y electrónicas. El análisis de supervivencia se realizó mediante el método de Kaplan-Meier. Resultados: El estudio cubrió a 90 pacientes que tenían SCE. En el diagnóstico de SCE, 55,5% de los pacientes no pueden caminar. En comparación con los pacientes con cáncer de mama, los pacientes con cáncer de pulmón tenían 4,1 veces más riesgo de morir (IC 95%, 1,79-9,41; p=0,001), los pacientes con tumores genitourinarios 1,9 veces mayor de morir (IC 95%, 1,06-3,45; p=0,02) y aquellos pacientes con otro tipo de tumor, 3,1 veces mayor riesgo de morir (IC 95%, 1,58-6,24; p=0,001). Conclusión: Este estudio encontró que el tipo de tumor primario es un factor predictivo para la supervivencia de le SCE. Más de la mitad de los pacientes no caminan en el momento del diagnóstico de SCE.
Palabras clave: compresión de la médula espinal; neoplasias de la columna vertebral; metástasis de la neoplasia; pronósticos.
INTRODUÇÃO
Nos últimos anos, tem sido observado um aumento da incidência de lesões medulares não traumáticas. A etiologia dessas lesões pode ser categorizada como degenerativa, infecciosa, vasculares e neoplásica1,2.
Com o envelhecimento populacional, o câncer se tornou um dos principais problemas de saúde pública global3. Estimam-se, no Brasil, para cada ano do triênio 2020-2022, 625 mil novos casos de câncer4.
A inclusão de novas modalidades terapêuticas e o aumento da sobrevida dos pacientes oncológicos podem favorecer ao surgimento de metástases, entre elas, a no sistema esquelético. O avanço da metástase óssea nos pacientes oncológicos pode ocasionar lesões líticas ou osteoblásticas5-7. Essas lesões tendem a comprometer a eficácia desse sistema esquelético em neutralizar cargas mecânicas, podendo ocasionar dor e, consequentemente, fraturas patológicas, por exemplo, nas vértebras5-7.
O colapso vertebral e o aumento da formação de tecido ósseo neoplásico aumentam o risco de invasão do canal medular, o que pode comprimir as estruturas neurais, causando a síndrome de compressão medular metastática (SCMM)8,9. A SCMM tem grande potencial de perda irreversível da função motora e sensitiva, sendo considerada uma emergência oncológica que demanda diagnóstico e manejos imediatos10,11.
A incidência dessa desordem pode variar significativamente de acordo com o tipo de tumor primário12,13. Nos pacientes com câncer de pâncreas, a incidência de SCMM é de 0,6% e, nos pacientes com câncer de pulmão, é de 4%11,13.
A principal manifestação neurológica no momento do diagnóstico é a dor na região da coluna vertebral, correspondendo de 80% a 95% dos indivíduos, porém outras manifestações encontradas são: alterações sensitivas, disfunção esfincteriana e fraqueza motora. O déficit de força muscular pode ser encontrado entre 35% e 75% dos pacientes, gerando um impacto direto em sua independência funcional, ocasionando desde dificuldade na marcha até a paralisia das estruturas corporais abaixo do nível da lesão e, com isso, influenciando negativamente NA sua qualidade de vida9-11,14.
O prognóstico desses pacientes, muitas vezes, é reservado, e o desfecho pode ocorrer em poucos meses. Atualmente, existe uma lacuna sobre o curso clínico da SCMM na população brasileira. Novos dados sobre a funcionalidade dos pacientes e a identificação de fatores prognósticos para sobrevida são de suma importância para o entendimento dessa complicação, ajudando a direcionar para uma melhor estratégia terapêutica e proporcionando um tratamento personalizado. Assim, o objetivo deste estudo foi avaliar o prognóstico e a funcionalidade dos pacientes com SCMM.
MÉTODO
Foi realizado um estudo de coorte que incluiu pacientes com câncer que desenvolveram SCMM entre janeiro de 2017 e dezembro de 2018. A população do estudo foi identificada por meio do Sistema de Controle de Atendimento do Serviço de Fisioterapia (SISCASF), sendo elegíveis os casos em que o planejamento e a realização do tratamento foram realizados de forma exclusiva no Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA). Os pacientes com neoplasias hematológicas e os menores de 18 anos foram excluídos do estudo.
A SCMM teve como definição critérios radiológicos e clínicos, como a compressão, endentação, deslocamento ou revestimento do saco dural que envolve a medula espinhal e a cauda equina11. O diagnóstico da SCMM foi confirmado por meio de ressonância magnética, tomografia computadorizada ou tomografia computadorizada por emissão de pósitrons.
Os dados clínicos e sociodemográficos foram extraídos dos prontuários físicos e eletrônicos a partir do diagnóstico de câncer até o óbito, perda de seguimento do paciente ou término do estudo. As variáveis avaliadas foram: sexo, idade, raça, estado conjugal, escolaridade, tipo de tratamento para o câncer, tipo de tumor primário, tipo de tratamento para SCMM, número de metástase antes da SCMM, sítios de metástase, número de vértebras afetadas, performance status (PS), deambulação e função motora.
Os resultados foram apresentados em tabelas e figuras, sendo destacados no texto os principais aspectos observados. Para análise descritiva da população do estudo, foram utilizadas medidas de tendência central e dispersão para as variáveis contínuas e distribuição de frequência para as categóricas. A análise de sobrevida foi realizada pelo método de Kaplan-Meier para a avaliação exploratória entre as variáveis independentes e o tempo até os desfechos. Objetivando-se identificar se as diferenças entre as curvas que eram estatisticamente significantes, foi calculado o teste do log-rank.
Foram considerados como desfecho a sobrevida global e o tempo entre o diagnóstico da SCMM até o evento (óbito), ou até a data do término do seguimento (31/12/2019), ou até a última consulta realizada no hospital (censura).
Todas as variáveis que demonstraram um valor de p<0,20 foram selecionadas para o modelo de regressão múltipla de Cox por intermédio do método Stepwise Forward, objetivando estimar os fatores independentes que estivessem associados ao óbito. Foram considerados estatisticamente significantes os valores de p≤0,05 para todas as análises. Os dados foram processados e analisados por meio do software Statistical Package for Social Science (SPSS) para Windows, São Paulo, Brasil, versão 21.0.
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa do INCA sob o número de protocolo CAAE 89670418.0.00000.5274, parecer 2.714.857, em 15/7/2018.
RESULTADOS
No total, o estudo abrangeu 90 pacientes que apresentaram SCMM (Figura 1) e a média de idade no momento do diagnóstico da SCMM foi de 54 anos (±12,5).
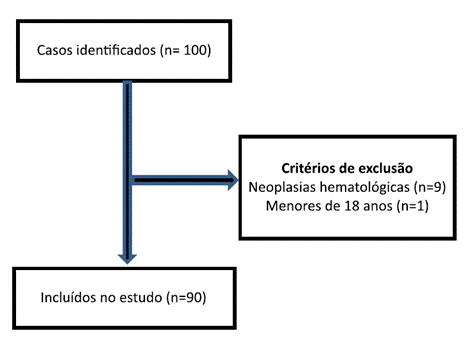
Figura 1. Critério de elegibilidade dos casos
Em relação às características sociodemográficas e clínicas representadas na Tabela 1, a maioria dos pacientes era de mulheres (70,0%), brancos (34,4%), casados (46,7%) e tinha baixa escolaridade (50,0%). O tipo de tratamento para o câncer mais utilizado foi a quimioterapia (82,2%), seguido pela cirurgia (41,1%), radioterapia (32,2%) e seis pacientes (6,6%) não realizaram tratamentos específicos. A maioria dos pacientes tinha câncer de mama (46,7%), seguido por tumores do tipo geniturinário (27,8%), câncer de pulmão (11,1%) e outros (14,4%).
O tempo mediano entre o diagnóstico do câncer e o desenvolvimento da SCMM foi de 20 meses (IC 95%, 5,59-35,54).
O sintoma inicial mais comum entre os pacientes foi a dor na região da coluna vertebral (81,1%). Os segmentos da coluna vertebral mais acometidos foram a coluna torácica (58,8%), coluna lombossacra (15,6%) e coluna cervical (10,0%). No total, 14 pacientes (15,6%) apresentaram SCMM em múltiplos níveis da coluna vertebral.
|
Tabela 1. Características sociodemográficas dos pacientes com SCMM (n=90) |
|
|
Características |
n (%) |
|
Sexo |
|
|
Masculino |
27 (30,0) |
|
Feminino |
63 (70,0) |
|
Idade ao diagnóstico da SCMM |
|
|
≤60 anos |
65 (72,2) |
|
>60 anos |
25 (27,8) |
|
Etnicidade |
|
|
Branco |
31 (34,5) |
|
Negro |
18 (20,0) |
|
Pardo |
39 (43,3) |
|
Indígena |
1 (1,1) |
|
Missing |
1 (1,1) |
|
Situação conjugal |
|
|
Casado |
42 (46,7) |
|
Separado |
5 (5,6) |
|
Viúvo |
13 (14,4) |
|
Solteiro |
28 (31,1) |
|
Missing |
2 (2,2) |
|
Escolaridade |
|
|
≤8 anos de estudo |
45 (50,0) |
|
>8 anos de estudo |
41 (45,6) |
|
Missing |
4 (4,4) |
|
Tipos de tratamento para câncer* |
|
|
Quimioterapia |
74 (82,2) |
|
Cirurgia |
37 (41,1) |
|
Radioterapia |
29 (32,2) |
|
Nenhum |
6 (6,6) |
|
Tipos de tumor primário |
|
|
Mama |
42 (46,7) |
|
Pulmão |
10 (11,1) |
|
Geniturinário |
25 (27,8) |
|
Outros |
13 (14,4) |
|
Tipos de tratamento para a SCMM |
|
|
Radioterapia |
72 (80,0) |
|
Cirurgia |
8 (8,9) |
|
Outros |
10 (11,1) |
|
Número de metástase antes da SCMM |
|
|
≤1 metástase |
46 (51,1) |
|
>1 metástase |
44 (48,9) |
|
Metástase hepática |
|
|
Sim |
13 (14,4) |
|
Não |
77 (85,6) |
|
Número de vertebras afetadas |
|
|
≤2 vértebras |
62 (68,9) |
|
>que 2 vértebras |
28 (31,1) |
|
Performance status |
|
|
≤2 |
27 (30,0) |
|
>2 |
59 (65,6) |
|
Missing |
4 (4,4) |
|
Deambulação |
|
|
Sim |
36 (40,0) |
|
Não |
50 (55,6) |
|
Missing |
4 (4,4) |
|
Legenda: SCMM = Síndrome de compressão medular metastática. (*) Mais de um tratamento pode ter sido realizado simultaneamente. |
|
No momento do diagnóstico da SCMM, 11 pacientes (12,2%) apresentavam disfunção esfincteriana, e 17 pacientes (18,9%) utilizavam cateter vesical para a incontinência. Em relação à função motora, 10 pacientes (11,2%) não apresentavam déficit motor, 26 pacientes (28,9%) apresentavam déficit motor, mas efetuavam marcha, 31 pacientes (34,4%) apresentavam déficit motor severo e não efetuavam marcha, e 19 pacientes (21,1%) apresentavam perda total da função motora abaixo do nível da lesão (Tabela 2).
Ao todo, 85 pacientes (94,4%) foram internados. Durante a internação, 15 pacientes (17,6%) evoluíram a óbito, 70 pacientes (82,4%) receberam alta, e 42 pacientes (46,7%) realizaram fisioterapia ambulatorial. No momento da alta da internação, sete pacientes (7,8%) não apresentavam déficit motor, 24 pacientes (26,7%) apresentavam déficit motor moderado, mas 24 que realizavam marcha (26,7%) estavam com déficit motor severo e não a realizavam, e 12 pacientes (13,3%) apresentaram perda total da função motora abaixo do nível da lesão (Tabela 2).
|
Tabela 2. Características clínicas dos pacientes com SCMM (n=90) |
|
|
Características |
n (%) |
|
Segmentos afetados da coluna* |
|
|
Cervical |
10 (10,0) |
|
Torácica |
53 (58,8) |
|
Lombossacral |
14 (15,6) |
|
Múltiplos |
14 (15,6) |
|
Função vesical ao diagnóstico da SCMM |
|
|
Normal |
55 (61,1) |
|
Disfunção vesical |
11 (12,2) |
|
Incontinência com uso de cateter vesical |
17 (18,9) |
|
Sem informação |
7 (7,8) |
|
Função motora ao diagnóstico da SCMM |
|
|
Sem déficit motor |
10 (11,2) |
|
Déficit motor, marcha preservada |
26 (28,9) |
|
Déficit motor severo, sem marcha preservada |
31 (34,4) |
|
Perda total da função motora |
19 (21,1) |
|
Sem informação |
4 (4,4) |
|
Função motora na alta hospitalar (n=70) |
|
|
Sem déficit motor |
7 (7,8) |
|
Déficit motor, marcha preservada |
24 (26,7) |
|
Déficit motor severo, sem marcha preservada |
24 (26,7) |
|
Perda total da função motora |
12 (13,3) |
|
Sem informação |
3 (3,3) |
|
Legenda: SCMM = Síndrome de compressão medular metastática. (*) Mais de um seguimento pode ter sido afetado simultaneamente. |
|
O tempo mediano de internação dos pacientes com câncer de mama foi de 18 dias, o dos pacientes com câncer de pulmão foi de nove dias, o dos com câncer geniturinário foi de 22 dias, e o dos pacientes com outros tipos de tumores sólidos foi de 16 dias, sendo essa diferença estatisticamente significante (p=0,01).
Para o tratamento da SCMM, 72 pacientes (80,0%) realizaram radioterapia, oito pacientes (8,9%) fizeram cirurgia, e dez pacientes (11,1%) realizaram outro tipo de tratamento. Além disso, 46 (51,1%) utilizaram bifosfonato após o diagnóstico de SCMM. Ao final, 52 pacientes (57,8%) foram encaminhados para rede hospitalar especializada em cuidados paliativos (dados não apresentados em tabelas).
As estimativas de tempo de sobrevida dos pacientes com SCMM foram sumarizadas na Tabela 3. Em três meses, 65,5% dos pacientes estavam vivos; em seis meses, 47,5% dos pacientes estavam vivos; e, em 12 meses, 33,6% estavam vivos. O tempo de sobrevida mediano desses pacientes foi de 5,2 meses (IC 95%, 3,42-7,02).
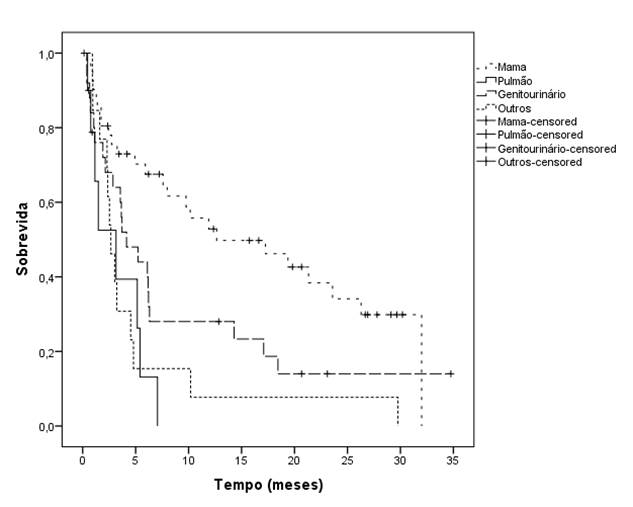
O tempo de sobrevida mediano, para os pacientes com câncer de mama, foi de 12,6 meses; para os pacientes com tumores do tipo geniturinário, de 4,1 meses; para os pacientes com câncer de pulmão, foi de 3,1 meses; e, para os outros tumores sólidos, de 2,6 meses (p<0,001) conforme a Tabela 3 e o Gráfico 1. Já o tempo de sobrevida mediano, para aqueles pacientes que tiveram até duas vértebras afetadas, foi de 6,3 meses; e, para aqueles com mais de duas vértebras afetadas, foi de 4,1 meses (p=0,04). O tempo de sobrevida mediano, para aqueles pacientes que deambulavam, foi de 7,9 meses; e, para aqueles que não deambulavam, foi de 3,6 meses (p=0,01).
Após ajustes pelas variáveis que apresentaram significância de p<0,20, a análise multivariada revelou que, comparados àqueles pacientes com câncer de mama, os pacientes com câncer de pulmão tiveram 4,1 vezes maior risco de morrer (IC 95%, 1,79-9,41; p=0,001); já aqueles pacientes com tumores geniturinários apresentaram um risco de 1,9 vezes maior de morrer (IC 95%, 1,06-3,45; p=0,02); e aqueles pacientes com outros tipos de tumor apresentaram 3,1 vezes maior risco de morrer (IC 95%, 1,58-6,24; p=0,001).
|
Tabela 3. Estimativa do tempo de sobrevida após SCMM |
|||||
|
Variável |
Sobrevida (%) |
Mediana |
Log-rank |
||
|
3 meses |
6 meses |
12 meses |
|||
|
Sexo |
|
|
|
|
|
|
Masculino |
55,6 |
37,0 |
22,2 |
3,6 |
0,15 |
|
Feminino |
70,1 |
52,4 |
39,0 |
6,3 |
|
|
Idade ao diagnóstico da SCMM |
|
|
|
|
|
|
≤60 anos |
68,1 |
45,4 |
35,4 |
5,2 |
0,65 |
|
>60 anos |
58,5 |
54,4 |
28,2 |
6,1 |
|
|
Etnicidade |
|
|
|
|
|
|
Branco |
59,1 |
38,4 |
24,4 |
4,9 |
0,23 |
|
Outros |
67,9 |
52,3 |
38,0 |
6,2 |
|
|
Situação conjugal |
|
|
|
|
|
|
Com companheiro |
66,7 |
49,2 |
32,9 |
5,9 |
0,68 |
|
Sem companheiro |
63,5 |
47,0 |
35,0 |
4,7 |
|
|
Escolaridade |
|
|
|
|
|
|
≤8 anos de estudo |
60,6 |
46,2 |
28,5 |
5,2 |
0,74 |
|
>8 anos de estudo |
68,2 |
50,1 |
41,7 |
6,3 |
|
|
Tipos de tumor primário |
|
|
|
|
|
|
Mama |
75,5 |
67,5 |
52,9 |
12,6 |
<0,001 |
|
Geniturinário |
64,0 |
44,0 |
28,0 |
4,1 |
|
|
Pulmão |
52,5 |
13,1 |
00,0 |
3,1 |
|
|
Outros |
46,2 |
15,4 |
7,7 |
2,6 |
|
|
Segmentos acometidos |
|
|
|
|
|
|
Cervical |
66,7 |
55,6 |
55,6 |
18,4 |
0,80 |
|
Torácica |
62,0 |
42,4 |
26,8 |
5,1 |
|
|
Lombossacral |
78,6 |
35,7 |
35,7 |
5,2 |
|
|
Múltiplos |
64,3 |
50,0 |
42,9 |
3,7 |
|
|
Tipos de tratamento para a SCMM |
|
|
|
|
|
|
Radioterapia |
64,3 |
47,7 |
34,8 |
5,4 |
0,54 |
|
Cirurgia |
75,0 |
50,0 |
37,5 |
3,7 |
|
|
Outros |
66,7 |
44,4 |
22,2 |
5,2 |
|
|
Número de metástase antes da SCMM |
|
|
|
|
|
|
≤1 metástase |
68,3 |
52,4 |
36,0 |
6,2 |
0,23 |
|
>1 metástase |
62,6 |
42,3 |
31,2 |
4,5 |
|
|
Metástase hepática |
|
|
|
|
|
|
Sim |
66,7 |
47,6 |
35,7 |
5,1 |
0,81 |
|
Não |
65,4 |
47,6 |
33,3 |
5,4 |
|
|
Número de vértebras afetadas |
|
|
|
|
|
|
≤2 vértebras |
66,7 |
54,9 |
39,0 |
6,3 |
0,04 |
|
>2 vértebras |
63,0 |
29,5 |
20,3 |
4,1 |
|
|
Performance status |
|
|
|
|
|
|
≤2 |
70,0 |
50,6 |
38,2 |
7,0 |
0,46 |
|
>2 |
60,8 |
44,1 |
30,2 |
4,7 |
|
|
Deambulação |
|
|
|
|
|
|
Sim |
72,2 |
58,3 |
43,1 |
7,9 |
0,01 |
|
Não |
57,5 |
36,6 |
24,4 |
3,6 |
|
|
Total |
65,5 |
47,5 |
33,6 |
5,2 |
|
|
Legenda: SCMM = Síndrome de compressão medular metastática. |
|||||
|
|
|
Gráfico 1. Tempo de sobrevida dos pacientes com SCMM de acordo com o tipo de tumor primário |
DISCUSSÃO
A SCMM é uma manifestação angustiante que está relacionada com dor, declínio neurológico progressivo e com prognóstico curto e reservado10. No presente estudo, foi demonstrado que pacientes com SCMM após câncer de pulmão apresentam maior risco de morte quando comparados a pacientes com câncer de mama, além de ter sido comprovado o grande impacto dessa desordem na funcionalidade humana. Ao diagnóstico, 55% dos pacientes não efetuavam marcha, e, no momento da alta da internação, 40% permaneceram sem efetuar marcha.
Outros estudos que abordaram a funcionalidade de pacientes demonstraram o grau de incapacidade que SCMM pode ocasionar15-17. De acordo com Pessina et al.16, 42,3% dos pacientes com SCMM secundário a tumores sólidos não realizavam marcha. Recentemente, Younsi et al.17 verificaram a função motora pré e pós-cirurgia de laminectomia descompressiva em pacientes com SCMM; eles relataram que, na admissão, 80% dos pacientes não deambulavam, e, na alta hospitalar, 51% dos pacientes recuperaram a capacidade de deambular.
A SCMM difere em alguns aspectos de lesões medulares de etiologia diferentes. Pacientes com lesões medulares traumáticas são mais jovens, apresentam internações mais prolongadas, maior proporção de lesões medulares completas, maior acometimento do segmento cervical, porém com melhoria da funcionalidade similar quando comparados aos pacientes com SCMM após programa de reabilitação18,19.
Na comparação dos pacientes com SCMM e pacientes com lesões medulares não traumáticas, existe uma maior proporção de pacientes tetraplégicos no grupo de lesões medulares não traumáticas, além de uma alta proporção de não especificidade do nível anatômico da lesão e uma melhoria similar da funcionalidade em ambos os grupos após um programa de reabilitação20. Essas descobertas corroboram os dados apresentados neste estudo, em que apenas 20% dos pacientes apresentavam acometimento cervical e uma minoria de pacientes tinham lesões medulares completas (21%) ao diagnóstico da SCMM. Tais dados podem ser explicados pelo caráter progressivo das manifestações neurológicas de acordo com o crescimento tumoral e a compressão medular, facilitando o diagnóstico antes que a lesão se torne completa.
Os resultados dos estudos que abordaram lesões medulares de diferentes etiologias demonstraram que, quando bem selecionados, os pacientes com SCMM com uma maior expectativa de vida e participação em um programa de reabilitação apresentam melhora da funcionalidade independente da malignidade etiológica18-20. No Brasil, a falta de informações sobre os fatores prognósticos para sobrevida dos pacientes com SCMM impactam na tomada de decisão e no manejo dos pacientes. No presente estudo, o tipo de tumor primário, o número de vértebras afetadas e a deambulação foram fatores estatisticamente significantes para sobrevida, porém, após análise múltipla, somente o tipo de tumor primário demonstrou ser um fator prognóstico independente.
Previamente, o impacto prognóstico do tipo de tumor primário na sobrevida dos pacientes com SCMM foi citado15,16,21-24. Pacientes com câncer de mama e câncer de próstata apresentam uma maior expectativa de vida comparados a outros tipos de câncer como câncer de pulmão16,25,26. Essa afirmação corrobora os achados deste estudo, em que pacientes com SCMM após câncer de pulmão tiveram um risco quatro vezes maior de morrerem em comparação aos pacientes com câncer de mama.
Outras variáveis, como metástases viscerais, capacidade de deambulação e sexo, são amplamente discutidas em estudos que abordam SCMM24,27-30. Em uma recente metanálise, foi sugerido que a metástase visceral é um importante fator prognóstico e apresenta um maior impacto para sobrevida para pacientes com câncer de pulmão e câncer de próstata27. Outro estudo demonstrou que as mulheres obtiveram uma sobrevida substancialmente mais elevada do que nos homens28. Neste estudo, a análise de sobrevida por sexo não teve achados estatisticamente significantes, porém as descobertas desta pesquisa indicam que os pacientes do sexo feminino apresentaram uma sobrevida maior em comparação aos pacientes do sexo masculino.
A capacidade de deambular é uma variável que demonstra resultados conflitantes em relação ao prognóstico dos pacientes. Em um estudo multicêntrico que abordou pacientes submetidos à radioterapia, foi demonstrado que pacientes que não deambulavam antes da primeira sessão de radioterapia apresentavam maior chance de morte precoce24. Por outro lado, Feng et al. observaram que a deambulação era um preditor significativo para sobrevida somente na análise univariada, demonstrando resultado similar ao presente estudo30.
Em suas potencialidades, este estudo preencheu uma importante lacuna de conhecimento no contexto nacional. Essas novas descobertas podem ajudar na identificação de pacientes com prognósticos variados, permitindo desde tratamentos mais agressivos a pacientes com melhor prognóstico até aconselhamentos e medidas de suporte para pacientes com prognóstico reservado, com foco na tomada de decisões de forma individualizada. De outra forma, como limitações, deve ser ressaltado que foram incluídos pacientes atendidos pelo serviço de fisioterapia, o que pode ter introduzido viés de seleção. Entretanto, a rotina institucional preconiza atendimentos a todos os pacientes com SCMM. Por isso, embora o viés seja possível, acredita-se que não tenha influenciado nesses resultados.
CONCLUSÃO
Verificou-se que o tipo de tumor primário é um fator preditor independente para sobrevida de pacientes com SCMM, além de pacientes com câncer de pulmão apresentarem maior risco de morte quando comparados a pacientes com câncer de mama. Ademais, no momento do diagnóstico, os pacientes com SCMM já apresentam grande perda funcional, e mais da metade dos pacientes não realizavam marcha.
CONTRIBUIÇÕES
Gustavo Telles da Silva, Bianca Paraiso de Araujo e Eduarda Martins de Faria participaram da concepção e/ou do planejamento do estudo; da obtenção, análise e interpretação dos dados; da redação e revisão crítica. Patricia Almeida Chelles, Erica Alves Nogueira Fabro e Luciana Velasco Bizzo participaram da concepção e/ou do planejamento do estudo; da redação e revisão crítica. Luiz Claudio Santos Thuler, Alessandra Grasso Giglio e Anke Bergmann participaram da análise e/ou interpretação dos dados; da redação e/ou revisão crítica. Todos os autores aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
A autora Anke Bergmann declara potencial conflito de interesses pela condição de ser a editora científica da Revista Brasileira de Cancerologia do INCA. Os demais autores não possuem conflito de interesses.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. New PW, Cripps RA, Bonne Lee B. Global maps of non-traumatic spinal cord injury epidemiology: towards a living data repository. Spinal Cord. 2014;52(2):97-109. doi: https://doi.org/10.1038/sc.2012.165
2. New PW, Marshall R. International spinal cord injury data sets for non-traumatic spinal cord injury. Spinal Cord. 2014;52(2):123-32. doi: https://doi.org/10.1038/sc.2012.160
3. Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. doi: https://doi.org/10.3322/caac.21492
4. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2020: incidência de câncer no Brasil. Rio de Janeiro: INCA; 2019.
5. Silva GT, Bergmann A, Thuler LCS. Skeletal related events in patients with bone metastasis arising from non-small cell lung cancer. Support Care Cancer. 2016;24(2):731-6. doi: https://doi.org/10.1007/s00520-015-2835-1
6. Coleman RE. Clinical features of metastatic bone disease and risk of skeletal morbidity. Clin Cancer Res. 2006;12(20 Pt 2):6243s-9s. doi: https://doi.org/10.1158/1078-0432.CCR-06-0931
7. von Moos R, Body JJ, Egerdie B, et al. Pain and analgesic use associated with skeletal-related events in patients with advanced cancer and bone metastases. Support Care Cancer. 2016;24(3):1327-37. doi: https://doi.org/10.1007/s00520-015-2908-1
8. Di Martino A, Caldaria A, De vivo V, et al. Metastatic epidural spinal cord compression. Expert Rev Anticancer Ther. 2016;16(11):1189-98. doi: https://doi.org/10.1080/14737140.2016.1240038
9. Patnaik S, Turner J, Inaparthy P, et al. Metastatic spinal cord compression. Br J Hosp Med (Lond). 2020;81(4):1-10. doi: https://doi.org/10.12968/hmed.2019.0399
10. Lawton AJ, Lee KA, Cheville AL, et al. Assessment and management of patients with metastatic spinal cord compression: a multidisciplinary review. J Clin Oncol. 2019;37(1):61-71. doi: https://doi.org/10.1200/JCO.2018.78.1211
11. Loblaw DA, Perry J, Chambers A, et al. Systematic review of the diagnosis and management of malignant extradural spinal cord compression: the cancer care ontario practice Guidelines Initiative’s Neuro-Oncology Disease Site Group. J Clin Oncol. 2005;23(9):2028-37. doi: https://doi.org/10.1200/JCO.2005.00.067
12. Mak KS, Lee LK, Mak RH, et al. Incidence and treatment patterns in hospitalizations for malignant spinal cord compression in the United States, 1998-2006. Int J Radiat Oncol Biol Phys. 2011;80(3):824-31. doi: https://doi.org/10.1016/j.ijrobp.2010.03.022
13. Silva GT, Bergmann A, Thuler LCS. Impact of symptomatic metastatic spinal cord compression on survival of patients with non-small-cell lung cancer. World Neurosurg. 2017;108:698-704. doi: https://doi.org/10.1016/j.wneu.2017.09.079
14. Lak AM, Rahimi A, Abunimer AM, et al. Quantifying the impact of surgical decompression on quality of life and identification of factors associated with outcomes in patients with symptomatic metastatic spinal cord compression. J Neurosurg Spine. 2020;33(2):237-44. doi: https://doi.org/10.3171/2020.1.SPINE191326
15. Tancioni F, Navarria P, Lorenzetti MA, et al. Multimodal approach to the management of metastatic epidural spinal cord compression (MESCC) due to solid tumors. Int J Radiat Oncol Biol Phys. 2010;78(5):1467-73. doi: https://doi.org/10.1016/j.ijrobp.2009.09.038
16. Pessina F, Navarria P, Carta GA, et al. Long-term follow-up of patients with metastatic epidural spinal cord compression from solid tumors submitted for surgery followed by radiation therapy. World Neurosurg. 2018;115:e681-e7. doi: https://doi.org/10.1016/j.wneu.2018.04.136
17. Younsi A, Riemann L, Scherer M, et al. Impact of decompressive laminectomy on the functional outcome of patients with metastatic spinal cord compression and neurological impairment. Clin Exp Metastasis. 2020;37(2):377-90. doi: https://doi.org/10.1007/s10585-019-10016-z
18. Scivoletto G, Lapenna LM, Di Donna V, et al. Neoplastic myelopathies and traumatic spinal cord lesions: an Italian comparison of functional and neurological outcomes. Spinal Cord. 2011;49(7):799-805. doi: https://doi.org/10.1038/sc.2011.6
19. Gedde MH, Lilleberg HS, Aßmus J, et al. Traumatic vs non-traumatic spinal cord injury: a comparison of primary rehabilitation outcomes and complications during hospitalization. J Spinal Cord Med. 2019;42(6):695-701. doi: https://doi.org/10.1080/10790268.2019.1598698
20. Fortin CD, Voth J, Jaglal SB, et al. Inpatient rehabilitation outcomes in patients with malignant spinal cord compression compared to other non-traumatic spinal cord injury: a population based study. J Spinal Cord Med. 2015;38(6):754-64. doi: https://doi.org/10.1179/2045772314Y.0000000278
21. Lei M, Yu J, Yan S, et al. Clinical outcomes and risk factors in patients with cervical metastatic spinal cord compression after posterior decompressive and spinal stabilization surgery. Ther Clin Risk Manag. 2019;15:119-27. doi: https://doi.org/10.2147/TCRM.S184497
22. He S, Wei H, Ma Y, et al. Outcomes of metastatic spinal cord compression secondary to primary hepatocellular carcinoma with multidisciplinary treatments. Oncotarget. 2017;8(26):43439-49. doi: https://doi.org/10.18632/oncotarget.15708
23. Silva GT, Costa TGP, Bessa CM, et al. Predictors of overall survival in non-small-cell lung cancer patients with metastatic spinal cord compression treated with short-course radiotherapy. Eur J Cancer Care (Engl). 2021;30(4):e13427. doi: https://doi.org/10.1111/ecc.13427
24. Rades D, Panzner A, Janssen S, et al. Outcomes after radiotherapy alone for metastatic spinal cord compression in patients with oligo-metastatic breast cancer. Anticancer Res. 2018;38(12):6897-903. doi: https://doi.org/10.21873/anticanres.13066
25. Rades D, Weber A, Karstens JH, et al. Prognostic role of the number of involved extraspinal organs in patients with metastatic spinal cord compression. Clin Neurol Neurosurg. 2014;118:12-5. doi: https://doi.org/10.1016/j.clineuro.2013.12.007
26. Tabouret E, Gravis G, Cauvin C, et al. Long-term survivors after surgical management of metastatic spinal cord compression. Eur Spine J. 2015;24(1):209-15. doi: https://doi.org/10.1007/s00586-014-3676-1.
27. Lun DX, Chen NW, Feng JT, et al. Visceral metastasis: a prognostic factor of survival in patients with spinal metastases. Orthopc Surg. 2020;12(2):552-60. doi: https://doi.org/10.1111/os.12657
28. Pitz MW, Musto G, Navaratnam S. Sex as an independent prognostic factor in a population-based non-small cell lung cancer cohort. Can Respir J. 2013;20(1):30-4. doi: https://doi.org/10.1155/2013/618691
29. Karimi D, Morgen SS, Fruergaard S, et al. Long-term survival after surgical treatment of spinal metastasis - the predictive role of sex. Anticancer Res. 2020;40(3):1475-9. doi: https://doi.org/10.21873/anticanres.14091
30. Feng JT, Yang XG, Wang F, et al. Prognostic discrepancy on overall survival between ambulatory and nonambulatory patients with metastatic spinal cord compression. World Neurosurg. 2019;121:e322-e32. doi: https://doi.org/10.1016/j.wneu.2018.09.102
Recebido em 24/6/2021
Aprovado em 7/10/2021
Editora-executiva: Letícia Casado. Orcid iD: https://orcid.org/0000-0001-5962-8765
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde