REVISÃO DA LITERATURA
Boas Práticas na Administração do Rituximab: Revisão Integrativa da Literatura
Good practices in Rituximab Administration: Integrative Literature Review
Buenas Prácticas en la Administración de Rituximab: Revisión Integradora de la Literatura
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n3.2194
Carmelita Almeida Rodrigues1; Maria Theresa Camilo de Lima2; Edvane Birelo Lopes De Domenico3
1-3Universidade Federal de São Paulo, Escola Paulista de Enfermagem. São Paulo (SP), Brasil.
1E-mail: carmelitaalmeidal@gmail.com. Orcid iD: https://orcid.org/0000-0001-6804-0322
2E-mail: theresacami1o2@hotmai1.com. Orcid iD: https://orcid.org/0000-0002-0640-9793
3E-mail: domenico.edvane@unifesp.br. Orcid iD: https://orcid.org/0000-0001-7455-1727
Endereço para correspondência: Carmelita Almeida Rodrigues. Rua Dr. Olavo Egídio, 726, apto. 73 – Santana. São Paulo (SP), Brasil. CEP 02037-000. E-mail: carmelitaalmeidal@gmail.com
RESUMO
Introdução: O rituximab é um anticorpo monoclonal quimérico camundongo/humano, amplamente utilizado no cenário terapêutico de vários diagnósticos. Por apresentar diferentes protocolos de administração, manejo e efeitos adversos, seu uso requer atenção da equipe de saúde. Objetivo: Descrever os protocolos infusionais do rituximab na primeira infusão, nas subsequentes e na dessensibilização, e caracterizar a sua segurança. Método: Revisão integrativa da literatura. A busca pelos periódicos foi realizada nas bases de dados e bibliotecas eletrônicas: LILACS, PubMed, MEDLINE, SciELO e BDEnf. Resultados: O cruzamento dos descritores proporcionou a identificação de 413 artigos. Destes, 113 foram lidos na íntegra e, ao final, 16 artigos foram aplicáveis ao desenho do estudo. Os artigos foram publicados entre os anos de 2016 e 2020, com predomínio da língua inglesa (87,5%). Quanto às principais formas de administração do medicamento, nove estudos abordaram a infusão por via intravenosa (em variadas modalidades de tempo) e sete por via subcutânea. Conclusão: De acordo com a literatura científica, todas as modalidades de infusão intravenosa e subcutânea demostram ser seguras e eficazes se os protocolos forem adequadamente indicados e corretamente aplicados.
Palavras-chave: rituximab/administração & dosagem; protocolos de quimioterapia combinada antineoplásica; protocolos antineoplásicos.
ABSTRACT
Introduction: Rituximab is a mouse/human chimeric monoclonal antibody, widely used in the therapeutic setting of various diagnoses, due to its different administration, management and adverse effects protocols; its use requires attention by the healthcare team. Objective: Describe the infusion protocols for rituximab in the first, subsequent and desensitization infusions, and characterize their safety. Method: Integrative literature review. The search was performed in databases and electronic libraries: LILACS, PubMed, MEDLINE, SciELO and BDEnf. Results: In all, 413 articles were eligible after crossing the descriptors. Of these, 113 were read in full and eventually, 16 articles matched the study design. The articles were published from 2016 to 2020, predominantly in English (87.5%). Concerning the main routes of administration in the studies included, nine addressed the intravenous infusion (in different modalities of time) and seven, subcutaneously. Conclusion: According to the scientific literature, all intravenous and subcutaneous infusion modalities are shown to be safe and effective if the protocols are correctly selected and applied.
Key words: rituximab/administration & dosage; antineoplastic combined chemotherapy protocols; antineoplastic protocols.
RESUMEN
Introducción: Rituximab es un anticuerpo monoclonal quimérico de ratón/humano, ampliamente utilizado em el ámbito terapéutico de diversos diagnósticos. Debido a sus diferentes protocolos de administración, manejo y efectos adversos, su uso requiere la atención del equipo de salud. Objetivo: Describirlos protocolos de infusión de rituximab em la primera, subsiguiente y desensibilización, y caracterizar su seguridad. Método: Es una revisión integradora de la literatura. La búsqueda de revistas se realizó en bases de datos y bibliotecas electrónicas: LILACS, PubMed, MEDLINE, SciELO y BDEnf. Resultados: Cruzar los descriptores proporciono la elegibilidad de 413 artículos. De estos, 113 fueron leí dos íntegramente y al final, 16 artículos fueron aplicables al diseño del estudio. Los artículos fueron publicados entre 2016 y 2020, con predominio del inglés (87,5%). En cuanto a las principales formas de administración del fármaco, entre los estudios incluidos, nueve abordaron la infusión intravenosa (en diferentes modalidades de tiempo) y siete la vía subcutánea. Conclusión: Según la literatura científica, todas las modalidades de infusión intravenosa y subcutánea se muestran seguras y efectivas si los protocolos están debidamente indicados y correctamente aplicados.
Palabras clave: rituximab/administración & dosificación; protocolos de quimioterapia combinada antineoplásica; protocolos antineoplásicos.
INTRODUÇÃO
O rituximab é um anticorpo monoclonal quimérico camundongo/humano que se liga especificamente ao CD20, localizado nos linfócitos pré-B e linfócitos B maduros. CD20 é uma proteína transmembrana que está presente em mais de 95% de todas as células B dos linfomas não Hodgkin e de leucemias. O fármaco foi aprovado para uso em 1997 pela Food and Drug Administration (FDA), nos Estados Unidos da América (EUA), e está indicado em bula para o tratamento de linfoma não Hodgkin (LNH); leucemia linfoide crônica (LLC); artrite reumatoide; granulomatose de Wegener e poliangite microscópica. Seu uso também vem sendo estudado e aplicado em lúpus eritematoso sistêmico, esclerose múltipla, pênfigo e em glomerulopatias no adulto. Faz parte do tratamento padrão para os LNH, podendo ser usado em associação à quimioterapia ou em modalidade de monoterapia1,2.
Por se tratar de um anticorpo monoclonal, o perfil de eventos adversos e a segurança em seu uso requerem atenção da equipe de saúde. Os estudos clínicos mostraram que 77% dos pacientes apresentaram reações infusionais na primeira exposição à infusão intravenosa, podendo ser principalmente febre, calafrios, erupção cutânea, dor de cabeça, hipotensão, falta de ar, broncoespasmo, náusea, vômito e dor abdominal. Reações graves, como anafilaxia, também podem ocorrer1,3.
Algumas medidas são recomendadas para evitar e minimizar a ocorrência de eventos adversos relacionados à infusão do rituximab. É importante que as equipes de saúde tenham conhecimentos específicos sobre a administração e saibam classificar as reações infusionais de acordo com o National Cancer Institute Common Terminology Criteria for Adverse Events (NCI CTCAE)4.
Diante da ampliação da utilização do rituximab no cenário terapêutico de vários diagnósticos e do conjunto de eventos adversos apresentados, fez-se necessário analisar e compilar a literatura científica relacionada à administração do fármaco para que boas práticas sejam instituídas pelos profissionais, visando à segurança dos pacientes. Nesse contexto, o presente estudo objetivou descrever os protocolos infusionais do rituximab na primeira infusão, nas subsequentes e na dessensibilização, bem como caracterizar a sua segurança.
MÉTODO
Foi realizada uma revisão integrativa da literatura, baseada nas etapas de identificação do tema e na elaboração da pergunta norteadora; seleção da amostragem; categorização dos estudos; análise dos dados extraídos; discussão e interpretação dos resultados; apresentação da revisão integrativa e síntese do conhecimento5.
Na primeira etapa, formularam-se as perguntas norteadoras do estudo: Quais as orientações protocolares para a primeira infusão, para as infusões posteriores de rituximab e para as dessensibilizações? Os protocolos evidenciam segurança para o paciente?
As perguntas de estudo foram convertidas no acrônimo SPIDER, sendo a amostra (sample) constituída pelos pacientes adultos recebendo rituximab. O fenômeno de interesse (phenomenon of interest) está relacionado com as evidências sobre a infusão da medicação em contexto. O desenho (design) relaciona-se com estudos experimentais, observacionais e revisões sistemática e integrativa da literatura, classificados em níveis de evidências estabelecidos pelo Joanna Briggs Institute (JBI). Como resultado (evaluation), objetivou-se selecionar protocolos para promover a administração segura do rituximab para pacientes e profissionais de saúde. Por fim, os tipos de pesquisa (research type) que compuseram os critérios de inclusão dos artigos foram os estudos quantitativos, qualitativos e mistos6.
A segunda etapa consistiu na escolha das palavras-chave: reação infusional, controle infusional, infusão rápida, infusão lenta; e dos Descritores em Ciências da Saúde (DeCS): pacientes, rituximab, anticorpo monoclonal, oncologia, administração intravenosa, administração subcutânea, enfermagem, protocolos antineoplásicos, síndrome da liberação de citocina e hipersensibilidade. A busca pelos periódicos foi realizada nas bases de dados e/ou em bibliotecas eletrônicas: LILACS, PubMed, MEDLINE, SciELO e BDEnf, sendo cada termo aplicado também nos idiomas espanhol e inglês. O período de publicação dos artigos compreendeu os anos de 2016 a 2020.
Os critérios de inclusão foram: estudos sobre o rituximab em pacientes adultos, publicados no período de tempo supracitado, disponíveis na íntegra, nos idiomas português, espanhol e inglês, que abordassem as formas de administração e reações infusionais do medicamento. Foram excluídos: teses, dissertações, artigos de opinião e editoriais (Figura 1).
O instrumento elaborado para a coleta e análise dos dados contemplou os seguintes itens: título da publicação, autores, periódico, idioma, ano de publicação, tipo de artigo, objetivo do estudo, resultados, conclusão, limitações do estudo e forma citada da administração do rituximab. A ferramenta utilizada na classificação das evidências científicas dos artigos selecionados foi a do JBI7 que preconiza a classificação de estudos de forma piramidal, sendo a base o nível 5 (opinião de especialistas); o nível 4, estudos observacionais descritivos; nível 3, estudos observacionais analíticos; nível 2, quase experimentais; e nível 1, experimentais. Cada nível conta ainda com subdivisões em letras que vão de a-e.
Na fase de seleção, os resumos dos artigos foram lidos pelas autoras e, após a etapa de identificação, os periódicos selecionados lidos na íntegra. Um instrumento de coleta de dados foi utilizado, selecionando-se os dados de forma a atender aos objetivos da pesquisa. Todos os pesquisadores participaram da etapa de descrição da síntese dos dados.
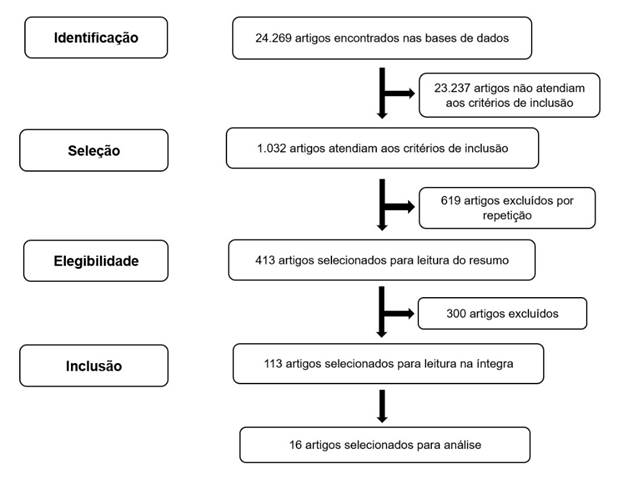
Figura 1. Fluxograma de seleção de artigos incluídos no estudo
RESULTADOS
O cruzamento dos descritores proporcionou a identificação de 413 artigos. Destes, 16 artigos correspondiam às perguntas de pesquisa. Quanto ao tempo, os artigos foram publicados entre os anos de 2016 e 2020, com predomínio da língua inglesa (87,5%) e da língua portuguesa (12,5%). Os países de publicação dos estudos foram: EUA (43,75%), Brasil (12,5%), Canadá (12,5%), Espanha (12,5%), Reino Unido (6,5%), República Tcheca (6,25%) e Coreia do Sul (6,25%).
No Quadro 18-23, encontram-se resumidos os resultados da busca com os estudos organizados por título, autores, ano e país; método e nível de evidência de acordo com o JBI; objetivos dos estudos; resultados e recomendações. Por fim, foi elaborada uma coluna para análise do tipo de administração do rituximab que cada estudo citava.
|
Quadro 1. Análise dos estudos incluídos na revisão |
||||
|
Título/autores/ano/país |
Método e nível de evidência (JBI) |
Objetivos do estudo |
Resultados e recomendações de segurança |
Protocolos de infusão |
|
Reactions to rituximab in an outpatient infusion center: a 5-year Review
Levin et al.8, 2016/EUA |
Estudo transversal
NE 4.b |
Compreender melhor a tomada de decisão clínica em torno das reações de rituximab e reexposição subsequente |
Pacientes que apresentam reações de grau 1 ao rituximab podem retomar à infusão com segurança no mesmo dia
Reações de graus 3 e 4 podem precisar de uma avaliação especializada de risco antes da administração adicional de rituximab
Mais pesquisas são necessárias para entender o manejo ideal de pacientes com reações de grau 2 |
PRIMEIRA INFUSÃO INTRAVENOSA - A primeira infusão deve ser iniciada com velocidade de 50 mg/h
- Se não ocorrer reação infusional, aumentar 50 mg/h a cada 30 min até o máximo de 400 mg/h
INFUSÕES SUBSEQUENTES - As infusões subsequentes de pacientes que não tiveram reação infusional podem ser iniciadas a uma taxa de 100 mg/h a cada 30 min até o máximo de 400 mg/h
|
|
Tolerance and safety of rapid 2-hour infusion of rituximab in patients with kidney-affecting autoimmune diseases and glomerulonephritides: a single-centre experience
Hartinger et al.9, 2019/República Tcheca |
Estudo de coorte com grupo de controle
NE 3.c |
Avaliar a tolerância e segurança da infusão rápida de 2 h de rituximab em pacientes com doenças autoimunes e glomerulonefrites |
A infusão rápida de rituximab em 2 h parece ser segura em pacientes com várias doenças autoimunes que afetam os rins. A metilprednisolona, na pré-medicação, pode ser substituída com segurança por hidrocortisona
Como as longas infusões de rituximab são demoradas e apresentam um fardo para os pacientes e a equipe médica, a infusão rápida pode economizar tempo e proporcionar reduções de custos |
INFUSÕES SUBSEQUENTES
Recomendações para infusão IV de 2 h
- Para pacientes que não tiveram reação infusional na primeira vez, a infusão de 2 h pode ser escolhida
- A infusão de rituximab deve ser iniciada a 250 mg/h durante os primeiros 30 min e após deve ser aumentada para 600 mg/h |
|
Implementation and evaluation of a 90-minute rituximab infusion protocol at the Richard L. Roudebush VA Medical Center
Fenton et al.10, 2020/EUA |
Estudo transversal retrospectivo
NE 4.b |
Apoiar a implementação segura de um protocolo de infusão rápida de 90 min para rituximab no Centro Médico Richard L. Roudebush VA |
As medidas proativas utilizadas para implementar o protocolo de infusão rápida de rituximab melhoraram as taxas de prescrição do profissional de saúde, a satisfação da enfermagem e a gestão das reações relacionadas à infusão. A economia potencial de tempo a cada infusão foi significativa |
INFUSÕES SUBSEQUENTES
Recomendações para infusão IV de 90 min
- Pacientes que não tiveram reação infusional (graus 3 e 4) na primeira vez, a infusão de 90 min pode ser escolhida
- A infusão de rituximab deve ser iniciada com 20% da dose programada para ser infundida durante os primeiros 30 min e os 80% restantes programados para serem infundidos por 60 min
|
|
Sixty-minute infusion rituximab protocol allows for safe and efficient workflow
Dotson et al.11, 2016/EUA |
Estudo de coorte com grupo de controle
NE 3.c |
Avaliar a segurança e a viabilidade de um protocolo de infusão rápida de rituximab de 60 min, no centro de infusão ambulatorial de um centro de câncer abrangente |
Os resultados demonstraram que pacientes cuidadosamente selecionados podem receber a segunda infusão de rituximab e as subsequentes de acordo com um protocolo de infusão de 60 min sem pré-medicação de esteroide. Esse protocolo de economia de tempo não compromete a segurança do paciente e foi avaliado positivamente pela equipe de enfermagem |
INFUSÕES SUBSEQUENTES
Recomendações para infusão IV de 60 min
- Para pacientes que não tiveram reação infusional graus 3 e 4 na primeira administração, a infusão de 60 min pode ser escolhida
- A infusão de rituximab deve ser iniciada a 100 mg/h por 15 min e a dose restante deve ser administrada durante 45 min |
|
Clinical significance of rituximab infusion-related reaction in diffuse large B-cell lymphoma patients receiving R-CHOP
Cho et al.12, 2019/Coreia do Sul |
Estudo transversal retrospectivo
NE 4.b |
Avaliar o significado clínico da IRR de rituximab em pacientes com linfoma difuso de grandes células B que receberam R-CHOP |
A reação relacionada à infusão não foi associada à sobrevida global ou sobrevivência livre de progressão de pacientes com LNH difuso de grandes células B em comparação com aqueles que não tinham reação relacionada à infusão. O estudo sugere a necessidade de observação mais cuidadosa para reação relacionada à infusão em pacientes com sintomas B ou envolvimento da medula óssea |
PRIMEIRA INFUSÃO INTRAVENOSA
- A primeira infusão deve ser iniciada com velocidade de 50 mg/h. Se não ocorrer reação infusional, aumentar 50 mg/h a cada 30 min até o máximo de 400 mg/h
INFUSÕES SUBSEQUENTES
- As infusões subsequentes de pacientes que não tiveram reação infusional podem ser iniciadas a uma taxa de 100 mg/h a cada 30 min até o máximo de 400 mg/h
|
|
Anticorpos monoclonais no tratamento oncológico: revisão de literatura para o atendimento ao paciente e manejo das reações infusionais
Bruneto et al.13, 2019/Brasil |
Revisão sistemática de literatura
NE 3.b |
Identificar como manejar reações infusionais relacionadas aos anticorpos monoclonais; descrever protocolo de conduta para atendimento a reação infusional; identificar os anticorpos monoclonais de maior ocorrência de reações infusionais |
O protocolo de manejo da reação infusional inclui: explicar o procedimento para o paciente; educar o paciente para o automonitoramento sobre o regime de tratamento e garantir que todos os funcionários saibam dos pacientes que estão recebendo a primeira infusão e os riscos relacionados; realizar a infusão em uma sala com equipamentos de reanimação cardiovascular e avaliar de forma padronizada os pacientes, priorizando os sinais e sintomas característicos das reações infusionais e outros que podem agravá-los |
PRIMEIRA INFUSÃO INTRAVENOSA
- A primeira infusão deve ser iniciada com velocidade de 50 mg/h. Se não ocorrer reação infusional, aumentar 50 mg/h a cada 30 min até o máximo de 400 mg/h
INFUSÕES SUBSEQUENTES
- Para pacientes que não tiveram reação infusional graus 3 e 4 na primeira administração: § infusão IV de 90 min § infusão IV de 60 min
|
|
Rituximab hypersensitivity and desensitization: a personalized approach to treat cancer and connective tissue diseases
Yang e Castells14, 2019/EUA |
Série de caso
NE 4.c |
Oferecer 3 cenários clínicos com uma abordagem para avaliação da reação inicial, estratificação de risco e recomendações propostas para dessensibilização |
Rápida dessensibilização: capaz de superar a hipersensibilidade e retorno ao tratamento. Conduta: assim que uma reação é identificada, o paciente é estratificado como de risco para determinar a viabilidade da dessensibilização. Um dos protocolos é selecionado e adaptado para superar os sintomas específicos experimentados por aquele paciente durante sua reação inicial com pré-medicação apropriada |
INFUSÃO INTRAVENOSA EM MODALIDADE DE PROTOCOLO DE DESSENSIBILIZAÇÃO
- Protocolo de 16 etapas para uma dose de 765 mg dividida em 4 bolsas com diluições graduais uma após a outra: § Bolsa 1 com 0,383 mg/250 ml ‒ inicia-se a infusão a uma taxa de 2,5 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 4 § Bolsa 2 com 7,650 mg/250 ml ‒ inicia-se a infusão a uma taxa de 2,5 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 8 § Bolsa 3 com 76,500 mg/250 ml ‒ inicia-se a infusão a uma taxa de 5 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 12 § Bolsa 4 com 758, 961 mg/250 ml ‒ inicia-se a infusão a uma taxa de 10 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 16 chegando a um fluxo de 80 ml/h que permanece até o término da bolsa. Tempo total de infusão de aproximadamente 7 h
- Protocolo de 12 etapas para uma dose de 858,75 mg dividida em 3 bolsas com diluições graduais uma após a outra: § Bolsa 1 com 8,588 mg/250 ml ‒ inicia-se a infusão a uma taxa de 2 ml/h por 15 min, após evolui para 5 ml/h e dobra-se a taxa a cada 15 min até a etapa 4 § Bolsa 2 com 85,875 mg/250 ml ‒ inicia-se a infusão a uma taxa de 5ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 8 § Bolsa 3 com 851,992 mg/250 ml ‒ inicia-se a infusão a uma taxa de 10 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 12, chegando-se ao fluxo de 80 ml/h, que permanece até o término da bolsa. Tempo total de infusão de aproximadamente 6 h
|
|
Rituximab hypersensitivity: evaluation, desensitization, and potential mechanisms
Wong e Long15, 2017/EUA |
Estudo transversal retrospectivo
NE 4.b |
Analisar as características do paciente e o padrão de hipersensibilidade ao rituximab, além dos resultados de dessensibilização para otimizar o gerenciamento |
25 pacientes foram submetidos a 170 dessensibilizações IV contínuas com base em 3 protocolos: 168 dessensibilizações ocorreram com sucesso
O mecanismo mediado por IgE e a degranulação dos mastócitos, além da síndrome de liberação de citocinas e síndrome de lise tumoral, podem contribuir para uma porção significativa das reações de hipersensibilidade entre pacientes |
INFUSÃO INTRAVENOSA EM MODALIDADE DE PROTOCOLO DE DESSENSIBILIZAÇÃO
Protocolo 1: rápido Infusão em 8 etapas para uma dose de 500 ml, dividida em 2 bolsas de 250 ml, com diluições graduais uma após a outra: § Bolsa 1 com 0,2 mg/ml ‒ inicia-se a infusão a uma taxa de 5 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 4 § Bolsa 2 com 2 mg/ml ‒ inicia-se a infusão a uma taxa de 10 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 8, chegando-se ao fluxo de 80 ml/h, que permanece até o término da bolsa
Protocolo 2: intermediário Infusão em 13 etapas para uma dose de 500 mg, dividida em 3 bolsas de 250 ml, com diluições graduais uma após a outra: § Bolsa 1 com 0,02 mg/ml ‒ inicia-se a infusão a uma taxa de 2,5 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 4 § Bolsa 2 com 0,2 mg/ml ‒ inicia-se a infusão a uma taxa de 5 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 8 § Bolsa 3 com 2 mg/ml ‒ inicia-se a infusão a uma taxa de 10 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 13, chegando-se ao fluxo de 80 ml/h, que permanece até o término da bolsa
Protocolo 3: alto risco Infusão em 13 etapas para uma dose de 500 mg, dividida em 4 bolsas de 1.000 ml, com diluições graduais uma após a outra: § Bolsa 1 com 0,0005 mg/ml ‒ inicia-se a infusão a uma taxa de 20 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 3 § Bolsa 2 com 0,005 mg/ml ‒ inicia-se a infusão a uma taxa de 20 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 6 § Bolsa 3 com 0,05 mg/ml ‒ inicia-se a infusão a uma taxa de 20 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 9 § Bolsa 4 com 0,5 mg/ml ‒ inicia-se a infusão a uma taxa de 20 ml/h, por 15 min e dobra-se 20 ml a cada 15 min até a etapa 13, chegando-se ao fluxo de 80 ml/h, que permanece até o término da bolsa
|
|
Assessment of confirmed clinical hypersensitivity to rituximab in patients affected with B-Cell neoplasia
Novelli et al.16, 2020/Espanha |
Estudo de coorte com grupo de controle
NE 3.c |
Descrever os resultados do teste de hipersensibilidade intradérmica para avaliar uma possível reação mediada por IgE em pacientes que receberam rituximab IV no contexto de linfoma de células B após um protocolo de dessensibilização de 12 etapas |
Protocolo de dessensibilização auxiliou 70% dos pacientes a completarem a imunoquimioterapia programada
O protocolo de dessensibilização de 12 etapas é muito eficaz e viável na prática clínica. É necessário determinar o mecanismo subjacente à reação à infusão em razão do risco de recorrência na exposição futura ao medicamento |
INFUSÃO INTRAVENOSA EM MODALIDADE DE PROTOCOLO DE DESSENSIBILIZAÇÃO
- Protocolo de 12 etapas para uma dose de 675 mg, dividida em 3 bolsas, com diluições graduais uma após a outra: § Bolsa 1 com 1,5 mg/50 ml ‒ inicia-se a infusão a uma taxa de 2 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 4 § Bolsa 2 com 15 mg/50 ml ‒ inicia-se a infusão a uma taxa de 5 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 8 § Bolsa 3 com 669 mg/250 ml ‒ inicia-se a infusão a uma taxa de 10 ml/h por 15 min e dobra-se a taxa a cada 15 min até a etapa 12, chegando-se ao fluxo de 80 ml/h, que permanece até o término da bolsa. Tempo total de infusão de aproximadamente 6 h
|
|
Update on the subcutaneous administration of rituximab in Canadian Cancer Centres
Stewart et al.17, 2020/Canadá |
Estudo observacional retrospectivo
NE 3.e |
Relatar dados do estudo SCuBA e fornecer perspectivas sobre a experiência prática com a formulação SC de rituximab entre oncologistas, enfermeiras, farmacêuticos e grupos de defesa de pacientes canadenses |
Houve redução média do custo de preparação do medicamento de 33,5% com a formulação SC, em comparação com a formulação IV
O tempo médio de administração e tempo médio de ocupação de “cadeira” foi maior com a formulação IV
Participantes também relataram uma redução média no desperdício de medicamentos de 62,0% com a formulação SC |
INFUSÃO SUBCUTÂNEA
- A via SC só poderá ser utilizada a partir do segundo ciclo de rituximab
LINFOMA NÃO HODGKIN
- Seringa pronta para injeção de 1.400 mg de rituximab, em 11,7 ml de solução contendo hialuronidase. A injeção deve ser realizada exclusivamente na hipoderme da região abdominal com um tempo de injeção de 5 min. O paciente deve ser observado por, no mínimo, 15 min
LEUCEMIA LINFOIDE CRÔNICA
- Seringa pronta para injeção de 1.600 mg/13,4 ml de solução contendo hialuronidase - A injeção deve ser realizada exclusivamente na hipoderme da região abdominal, com um tempo de injeção de 7 min. O paciente deve ser observado por, no mínimo, 15 min
|
|
Modelo de impacto orçamentário do rituximabe subcutâneo comparado ao intravenoso no tratamento do linfoma não Hodgkin difuso de grandes células B, CD-20 positivo, no sistema de saúde suplementar brasileiro
Kashiura et. al.18, 2018/Brasil |
Estudo de coorte com grupo de controle
NE 3.c |
Estimar o impacto orçamentário da incorporação do rituximab SC em comparação com sua apresentação IV já utilizada, sob a perspectiva do sistema de saúde privado brasileiro
|
Estimou-se um total de 3.846 pacientes com LNH difuso em todo o sistema de saúde suplementar, ao longo de cinco anos
A incorporação progressiva de rituximab SC no sistema de saúde suplementar pode gerar uma economia de recursos estimada em R$ 15.835.969,11
No tratamento do LNH difuso de grandes células B, o sistema de saúde suplementar brasileiro pode economizar até R$ 15,8 milhões |
INFUSÃO SUBCUTÂNEA
- A via SC só poderá ser utilizada a partir do segundo ciclo de rituximab
LINFOMA NÃO HODGKIN
- Seringa pronta para injeção de 1.400 mg rituximab em 11,7 ml de solução contendo hialuronidase
- A injeção deve ser realizada exclusivamente na hipoderme da região abdominal, com um tempo de injeção de 5 min. O paciente deve ser observado por, no mínimo, 15 min
|
|
Efficacy and safety of subcutaneous and intravenous rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone in first-line diffuse large B-cell lymphoma: the randomized MabEase study
Lugtenburg et al.19, 2017/EUA |
Ensaio clínico
NE 1 |
Examinar a eficácia e a segurança do rituximab SC vs. a formulação IV como parte de um regime de R-CHOP |
De 576 pacientes randomizados, 572 (378 SC; 194 IV) receberam tratamento. As taxas de resposta completa ao final da indução/resposta completa não confirmada foram de 50,6% (SC) e 42,4% (IV) Após uma mediana de 35 meses, a sobrevida global mediana, livre de eventos e livre de progressão, não foi alcançada. Eventos adversos de grau ≥3 (SC 58,3%; IV 54,3%) e eventos adversos relacionados à administração (ambos os grupos 21%) foram semelhantes entre os braços. Combinados com evidências anteriores, os resultados deste estudo fornecem suporte para o uso de rituximab SC nesse cenário
|
INFUSÃO SUBCUTÂNEA - A via SC só poderá ser utilizada a partir do segundo ciclo de rituximab
LINFOMA NÃO HODGKIN
- Seringa pronta para injeção de 1.400 mg rituximab em 11,7 ml de solução contendo hialuronidase
- A injeção deve ser realizada exclusivamente na hipoderme da região abdominal, com um tempo de injeção de 5 min. O paciente deve ser observado por, no mínimo, 15 min
|
|
Subcutaneous rituximab for the treatment of b-cell hematologic malignancies: a review of the scientific rationale and clinical development
Davies et al.20, 2017/Inglaterra |
Revisão de literatura
NE 3.b |
Resumir a justificativa e os principais estudos clínicos do rituximab SC
|
A formulação SC foi submetida a um programa de desenvolvimento clínico sequencial demonstrando que, em doses fixas, o rituximab SC atinge concentrações séricas mínimas não inferiores em pacientes com LNH e leucemia linfocítica crônica, com eficácia e segurança comparáveis em relação à formulação IV. O benefício adicional do rituximab SC é permitir uma preparação e tempos de administração simplificados e encurtados, resultando em uma melhor utilização de recursos, economia de tempo e potencialmente de custo
|
INFUSÃO SUBCUTÂNEA
- A via SC só poderá ser utilizada a partir do segundo ciclo de rituximab
LINFOMA NÃO HODGKIN
- Seringa pronta para injeção de 1.400 mg rituximab em 11,7 ml de solução contendo hialuronidase
- A injeção deve ser realizada exclusivamente na hipoderme da região abdominal, com um tempo de injeção de 5 a 6 min. O paciente deve ser observado por, no mínimo, 15 min
|
|
A Canadian perspective on the subcutaneous administration of rituximab in non-Hodgkin lymphoma
MacDonald et al.21, 2017/Canadá |
Revisão de literatura
NE 3.b |
Discutir o uso de rituximab SC como uma alternativa potencial à formulação IV no Canadá
|
Os resultados indicam que a farmacocinética não é inferior e as taxas de resposta são comparáveis às obtidas com a formulação IV. Além disso, a formulação SC é preferida por pacientes e profissionais de saúde, pois reduz a administração e o tempo de cadeira. As vantagens adicionais incluem menor potencial para erros de dosagem, menor tempo de preparação, menor desperdício de medicamento e menos reações relacionadas à infusão |
INFUSÃO SUBCUTÂNEA - A via SC só poderá ser utilizada a partir do segundo ciclo de rituximab
LINFOMA NÃO HODGKIN
- Seringa pronta para injeção de 1.400 mg rituximab em 11,7 ml de solução contendo hialuronidase
- A injeção deve ser realizada exclusivamente na hipoderme da região abdominal, com um tempo de injeção de 5 min. O paciente deve ser observado por, no mínimo, 15 min
|
|
Preference for subcutaneous or Intravenous Administration of rituximab among patients with untreated CD20+ diffuse large B-cell lymphoma or follicular lymphoma: results from a prospective, randomized, open-label, crossover study (PrefMab)
Rummel et al.22, 2017/EUA |
Ensaio clínico
NE 1 |
Avaliar a preferência e satisfação do paciente pela formulação SC vs. IV de rituximab, administrada com quimioterapia, em pacientes não tratados previamente com diagnóstico de linfoma difuso de grandes células B CD20 + ou linfoma folicular |
No ciclo 8, 81% dos pacientes que completaram o questionário de preferência do paciente, preferiram rituximab SC. A satisfação do paciente, medida pelo questionário de satisfação com a infusão de rituximab, foi maior para SC do que para o IV. Os eventos adversos foram geralmente equilibrados entre as vias de administração e nenhum novo sinal de segurança foi detectado |
INFUSÃO SUBCUTÂNEA - A via SC só poderá ser utilizada a partir do segundo ciclo de rituximab
LINFOMA NÃO HODGKIN - Seringa pronta para injeção de 1.400 mg rituximab em 11,7 ml de solução contendo hialuronidase. A injeção deve ser realizada exclusivamente na hipoderme da região abdominal, com um tempo de injeção de 5 min. O paciente deve ser observado por, no mínimo, 15 min
LEUCEMIA LINFOIDE CRÔNICA
- Seringa pronta para injeção de 1.600 mg/13,4 ml de solução contendo hialuronidase
- A injeção deve ser realizada exclusivamente na hipoderme da região abdominal, com um tempo de injeção de 7 min. O paciente deve ser observado por, no mínimo, 15 min
|
|
Time savings with rituximab subcutaneous injection versus rituximab intravenous infusion: a time and motion study in eight countries
De Cock et al.23, 2016/Espanha |
Estudo de coorte com grupo de controle
NE 3.c |
Quantificar o tempo do profissional de saúde ativo e o tempo de cadeira do paciente para rituximab SC e IV, incluindo economia de tempo potencial |
O tempo médio de profissional de saúde ativo foi de 35,0 e 23,7 min para o processo IV e SC, respectivamente (-32%, p<0,0001). Por país, a redução relativa no tempo foi de 27%-58%. O tempo médio de cadeira foi de 262,1 min para IV, incluindo 180,9 min de duração da infusão, vs. 67,3 min para SC, incluindo 8,3 min de administração de injeção SC. Em comparação com o rituximab IV, o rituximab SC foi associado à redução do tempo de cadeira e tempo de profissional de saúde ativo
|
INFUSÃO SUBCUTÂNEA
A via SC só poderá ser utilizada a partir do segundo ciclo de rituximab |
|
Legendas: IRR = reação relacionada à infusão; R-CHOP = rituximab mais ciclofosfamida, doxorrubicina, vincristina e prednisona; IV = intravenoso; SC = subcutâneo; NE = nível de evidência; IgE = imunoglubulina E; JBI = Joanna Briggs Institute; CD20 = antígeno de linfócito B CD20; LNH = linfoma não Hodgkin. |
||||
Os níveis de evidência dos artigos avaliados, de acordo com a JBI, foram: 56,25% (n=9) estudos de fase 3; 31,25% (n=5) estudos de fase 4, sendo esses últimos considerados recomendações baseadas na vida real por meio do método observacional; e 12,5% (n=2) estudos de fase 17.
Quanto às principais formas de administração do medicamento, entre os estudos incluídos, nove abordaram a infusão por via endovenosa (em variadas modalidades de tempo), e sete por via subcutânea.
Em relação às boas práticas, os artigos destacaram pontos importantes quanto à classificação de risco para reação infusional e seu manejo, gerenciamento da hipersensibilidade, cuidados de armazenamento da droga e raciocínio clínico para escolha da via de infusão (Quadro 2)12-16,20,24.
|
Quadro 2. Boas práticas na administração do rituximab |
|
|
Fatores de risco para reação infusional12,13 |
· Alta carga tumoral, infiltrações pulmonares, idade avançada, pacientes com leucemia linfocítica crônica ou linfoma de células do manto e pacientes com doenças cardíacas e ou pulmonares preexistentes · Ser a primeira infusão do paciente |
|
Prevenção da reação12,13 |
· Pré-medicar o paciente com analgésico/antipirético, anti-histamínico e glicocorticoide entre 30-60 min antes do rituximab · Infundir o medicamento apenas por bomba de infusão e seguir a graduação do fluxo conforme protocolo preestabelecido · Orientar o paciente sobre os sinais de alarme para reação infusional |
|
Manejo da reação infusional12,13 |
· Pausar a infusão imediatamente, comunicar a equipe médica, aferir sinais vitais, oximetria de pulso e realizar exame físico · As condutas específicas dependerão do grau da reação · Carro de emergência quando reação grave |
|
Manejo da hipersensibilidade14-16 |
· Realizar teste intradérmico · Avaliar se o paciente é elegível para receber o rituximab por meio dos protocolos de dessensibilização |
|
Escolha da via de infusão20 |
De acordo com: · o número do ciclo (1ª sempre deve ser IV) · a indicação diagnóstica (SC é apenas para LNH e LLC) · os recursos da instituição de saúde |
|
Armazenamento da medicação24 |
· A bolsa de rituximab deve ficar em refrigeração (2 ºC a 8 ºC até antes da infusão), deve ser retirada 30 min antes de ser instalada no paciente para ficar em temperatura ambiente · O enfermeiro deve atentar-se à validade da bolsa, que geralmente é de 24 h refrigerada e 12 h em temperatura ambiente |
|
Legendas: IV = intravenoso; SC = subcutâneo; LNH = linfoma não Hodgkin; LLC = leucemia linfoide crônica. |
|
O reconhecimento e manejo das reações infusionais de todos os graus também são requeridos aos profissionais, que devem classificar as reações de acordo com o NCI CTCAE e registrar adequadamente todo o procedimento executado no prontuário do paciente, sendo esse registro de suma importância para definição da modalidade de tempo que será escolhida nas infusões subsequentes12,13.
DISCUSSÃO
Os estudos analisados destacam a existência de mais de um mecanismo envolvido nas reações infusionais, sendo estes, a síndrome de liberação de citocinas, as reações mediadas por mastócitos (nos casos agudos) e os mecanismos envolvidos na lise tumoral e na doença do soro (nas reações tardias)1,2.
O NCI CTCAE é uma ferramenta importante para auxiliar os profissionais de saúde na classificação do grau das reações infusionais. A sessão que avalia a reação relacionada à infusão consiste nas sentenças mostradas no Quadro 325.
|
Quadro 3. Critérios do NCI para eventos adversos |
|
|
Classificação (CTCAE)25 |
Características e ações indicadas |
|
Grau 1 |
Reação transitória leve; interrupção da infusão não indicada; intervenção não indicada |
|
Grau 2 |
A interrupção da terapia ou infusão é indicada. Responde prontamente ao tratamento sintomático com, por exemplo, anti-histamínicos, anti-inflamatórios não esteroides, narcóticos, fluidos IV); medicamentos profiláticos indicados por <=24 h |
|
Grau 3 |
Quando prolongado, por exemplo, não responde rapidamente à medicação sintomática e/ou breve interrupção da infusão; recorrência dos sintomas após a melhora inicial; internação indicada por sequelas clínicas |
|
Grau 4 |
Consequências com risco de vida; indicado intervenção imediata |
|
Grau 5 |
Morte |
|
Legendas: CTCAE = Common Terminology Criteria for Adverse Events; IV = intravenoso. |
|
Foram identificadas seis modalidades de infusão intravenosa descritas na literatura consultada, sendo elas classificadas em lentas (n=2) e rápidas (n=4). A primeira infusão do paciente sempre deverá ocorrer na modalidade lenta e essa recomendação prevalece sendo indicada até os dias atuais. Seu objetivo é expor o paciente aos poucos à droga e à liberação gradual de citocinas no sangue, diminuindo o risco de reação aguda grave. Ela ocorre da seguinte maneira: deve ser iniciada com velocidade de 50 mg/h e, se não ocorrer reação infusional, deve-se aumentar 50 mg/h a cada 30 minutos até o máximo de 400 mg/h. O tempo total de infusão pode variar de 3,5 a 6 horas, considerando um cenário sem reação, dependente do volume de solução em que está diluída a droga8,10,23.
A segunda opção de infusão lenta é utilizada nos casos em que o paciente tem hipersensibilidade à droga. Para essa modalidade, existem protocolos de dessensibilização. Tais protocolos variam em número de etapas, que vão de oito a 16, com um tempo de infusão de 4,7 a 16 horas, contendo duas a quatro bolsas com concentrações diferentes para cada protocolo. O objetivo da dessensibilização é possibilitar o uso da droga de forma segura, quando os pacientes apresentarem reações graves em exposição anterior, mesmo com todas as medidas de precaução sendo adotadas14-16.
Quando o paciente tem histórico de reação grave (grau 3 ou 4), são indicadas uma avaliação com alergista e a realização de teste intradérmico com rituximab 0,1%. Após avaliação, se a conduta médica for utilizar o protocolo de dessensibilização, a infusão deve ocorrer em local onde haja área de cuidados intensivos disponíveis, caso o paciente necessite. Um estudo realizado nos EUA, em 2019, demonstrou três casos de pacientes com reação moderada e severa que se beneficiaram do protocolo de 12 e 16 etapas e conseguiram receber a dose completa do rituximab14-16.
As infusões rápidas são elegíveis a partir do segundo ciclo, quando o paciente não apresenta reação grau 3 ou 4. A opção mais antiga é a presente na bula do primeiro fabricante da droga, que consiste no seguinte: a administração deve ser iniciada a uma taxa de 100 mg/h e, se não ocorrer reação infusional, deve-se aumentar 100 mg/h a cada 30 minutos até o máximo de 400 mg/h. O tempo total de infusão pode variar de 2,5 a 3,5 horas, considerando um cenário sem reação, dependente do volume de solução da droga8,10.
Outras modalidades de infusões rápidas surgiram em um cenário que visava a diminuir o tempo do paciente nos centros de infusão, aumentando, assim, a rotatividade de cadeiras e leitos, otimizando o tempo ativo do profissional de saúde e aumentando o conforto para os pacientes. Uma delas é a infusão em 2 horas, que deve ser iniciada a 250 mg/h durante os primeiros 30 minutos, aumentando para 600 mg/h, até o término da bolsa9.
A opção de administrar o anti-CD20 em 90 minutos está indicada na bula de um dos fabricantes do rituximab e foi validada após estudo de segurança fase 3 multicêntrico. Deve ser iniciada com 20% da dose programada para ser infundida durante os primeiros 30 minutos, e os 80% restantes programados para serem infundidos por 60 minutos10.
A modalidade de infusão mais rápida descrita na literatura é a de 60 minutos, na qual a infusão deve ser iniciada a 100 mg/h por 15 minutos, e a dose restante deve ser administrada durante 45 minutos. No estudo de Dotson et al.11, os pacientes elegíveis foram aqueles que, além de não terem apresentado reação 3 ou 4 em sua primeira infusão, não possuíam comorbidades cardíacas, não tinham alta contagem de linfócitos inicial (superior a 10 × 103 células/μL), sem diagnóstico de linfoma agressivo (Burkitt’s ou linfoblásticos) e que não tivessem histórico de alergia a medicações à base de murinos. Nesse estudo, 50 pacientes receberam o rituximab no protocolo de 60 minutos, e nenhum apresentou reação grau 3 ou 411.
Em todas as modalidades de infusão intravenosa, um ponto importante para o escalonamento é a diluição da droga, que deve estar na proporção de 1 a 4 mg para cada ml de diluente (soro fisiológico 0,9% ou soro glicosado 5%), uma vez que a recomendação do fluxo é em mg/h, e não em ml/h. Cada modalidade de infusão traz a miligramagem inicial e máxima, ficando para o profissional responsável pela infusão a responsabilidade de verificar o volume que comporta essa miligramagem, definindo, assim, o fluxo correto da infusão24.
Quando a proporção da diluição das bolsas de rituximab é de 1 mg/ml, a definição do fluxo na bomba de infusão sempre será 1/1 proporcionalmente (por exemplo: 50 ml/h será o mesmo que 50 mg/h, ou 100 ml/h o mesmo que 100 mg/h). No entanto, se a proporção for maior que 1 mg/ml, sempre será necessária a realização de cálculos utilizando a regra de três para determinar em qual volume se concentra os miligramas solicitados em cada modalidade. A bula da medicação e os estudos consultados não trazem esse detalhe do uso da regra de três, cabendo ao leitor interpretar essa necessidade. Na infusão de 90 minutos, primeiramente, deve-se usar a regra de 3 para definir os 20% e 80% da dose, definindo, desse modo, o fluxo infusional; posteriormente, caso a proporção da diluição não seja 1/1, deve-se aplicar a regra mais uma vez para definir o fluxo em ml24,26.
Um estudo3 realizado no Memorial Sloan Kettering Cancer Center em 2018 chamou atenção para uma prática até então não analisada: o preenchimento do equipo da bomba de infusão com o diluente ao invés da solução contendo a droga. A incidência de reação de hipersensibilidade foi de 35% no braço iniciado com diluente versus 19% no braço iniciado com droga, evidenciando que, quando o equipo é preparado com a medicação, a exposição do paciente ao rituximab é imediata, após o início da infusão. No entanto, quando o equipo é preparado com diluente, o paciente recebe apenas diluente por aproximadamente 40 minutos antes de ser exposto ao rituximab, resultando em morte celular retardada e liberação de citocinas. A nova prática de utilizar o equipo preparado com o fármaco foi adotada e recomendada pela instituição3.
Outra modalidade de administração do rituximab é a via subcutânea. Essa formulação está aprovada para uso desde 2014, sendo indicada em bula apenas para LNH e LLC. Sua eficácia e equivalência, em comparação com a apresentação intravenosa, foram amplamente comprovadas por meio de estudos clínicos. Assim como as infusões rápidas, a via subcutânea só poderá ser elegível a partir do segundo ciclo, quando não houve reação de grau 3 ou 4 na primeira infusão1,19,22.
Existem duas apresentações para uso subcutâneo: para LNH (seringa de 1.400 mg/11,7 ml administrada em 5 minutos) e para LLC (seringa de 1.600 mg/13,4 ml administrada em 7 minutos), ambas contendo hialuronidase humana recombinante, uma enzima que facilita a perfusão de substâncias no tecido subcutâneo. O produto deve ser mantido sob refrigeração (2 ºC a 8 ºC) e tem estabilidade de 48 horas nessa temperatura. Em temperatura ambiente, sua estabilidade cai para 8 horas. A região abdominal é a área de escolha para a aplicação. Em relação aos efeitos colaterais, existe um perfil de semelhança com a formulação IV, acrescido dos eventos cutâneos locais relacionados à injeção, como dor e eritema. Cabe destacar a importância da lentidão na administração, de 5 a 6 minutos, devendo ser objeto de treinamento para os enfermeiros e de educação ao paciente para que este compreenda o procedimento17,20,21.
Um estudo clínico (PrefMab)22 avaliou a preferência e a satisfação do paciente pela formulação subcutânea versus intravenosa de rituximab e mostrou, como resultado, que 81% deles preferiram a modalidade subcutânea22. Entre os benefícios para os pacientes, estão: menos tempo necessário no centro de infusão, ganho de tempo para outras atividades, menor custo com estacionamento, possibilidade de receber o tratamento sem precisar de um acesso venoso de longa permanência e receber a pré-medicação por via oral17,20.
Para os profissionais e serviços de saúde, os ganhos são: economia financeira; menor tempo necessário para assistir o paciente; melhor readequação dos recursos provenientes do ganho de tempo obtido com a administração subcutânea, permitindo maior rotatividade de atendimentos nas unidades ambulatoriais; mais disponibilidade dos profissionais para consultas; redução de filas de espera para tratamento; economia de materiais necessários à administração endovenosa; menor potencial de erro de dose; e desperdício, pelo fato de as doses serem fixas na modalidade subcutânea, além de menor tempo de manipulação pelo farmacêutico17,23.
No Canadá, a taxa geral de conversão da via intravenosa para subcutânea é de 55%, com exceção das províncias de Quebec e Saskatchewan. Estima-se que, após três anos de implementação do rituximab subcutâneo, 5.762 canadenses tenham recebido a injeção, e um total de 128.715 horas e 40 milhões de dólares tenham sido economizados17. Já um estudo brasileiro demonstrou que a implementação de rituximab subcutânea no sistema de saúde suplementar economizaria potencialmente cerca de 15 milhões de reais ao longo de cinco anos18.
No que diz respeito às limitações do estudo, a principal delas relaciona-se ao fato de a maior parte dos estudos abordar experiências e realidades internacionais, demandando maior atenção para a transposição dos mesmos protocolos para os pacientes e para as estruturas e processos infusionais nacionais. Outra limitação relaciona-se à intencionalidade da revisão integrativa, que tem o alcance de apresentar o estado de conhecimento sobre o fenômeno, mas não de indicar o mais eficaz.
CONCLUSÃO
Há diferentes opções de administração do rituximab baseadas em evidências e que devem ser consideradas de acordo com as condições clínicas do paciente, diagnóstico, posologia, bem como recursos institucionais e experiência clínica dos profissionais da saúde diretamente envolvidos. De acordo com a literatura científica, todas as modalidades de infusão, intravenosas e subcutâneas demonstraram ser seguras e eficazes se os protocolos forem adequadamente indicados e seguidos.
Em resumo, pode-se dizer que a primeira infusão do paciente sempre deve ser lenta e por via intravenosa. Para a segunda infusão, o rituximab subcutâneo se mostrou a melhor opção para os pacientes elegíveis, mesmo em comparação com as modalidades de infusão rápida, pois exige menos tempo e menos recursos que a formulação IV, além de ser preferido pelos pacientes. Já nos casos de reação moderada e grave, quando o benefício do fármaco pode superar o risco da reação, os protocolos de dessensibilização podem ser uma opção segura e plausível.
Em conclusão, o uso do rituximab atrai cada vez mais atenção como opção de tratamento para diversas doenças que não estão restritas à onco-hematologia. Alguns estudos reforçam a importância da avaliação clínica abrangente do paciente e de uma equipe de profissionais da saúde (médicos, enfermeiros e farmacêuticos) preparada para o processo ser seguro para o paciente. Por conseguinte, protocolos institucionais devem sustentar a prática segura, baseada em evidências científicas para cada intencionalidade de uso e via de administração.
CONTRIBUIÇÕES
Todas as autoras contribuíram substancialmente na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados, assim como na redação e revisão crítica com contribuição intelectual e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Du FH, Mills EA, Mao-Draayer Y. Next-generation anti-CD20 monoclonal antibodies in autoimmune disease treatment. Auto Immun Highlights. 2017;8(1):12. doi: https://doi.org/10.1007/s13317-017-0100-y
2. Santos JE, Fiel D, Santos R, et al. Uso do rituximabe em glomerulopatias em adultos e justificativas. J Bras Nefrol. 2020;42(1):77-93. doi: https://doi.org/10.1590/2175-8239-JBN-2018-0254
3. Laudati C, Clark C, Knezevic A, et al. Hypersensitivity reactions: priming practice change to reduce incidence in first-dose rituximab treatment. Clin J Oncol Nurs. 2018;22(4):407-14. doi: https://doi.org/10.1188/18.CJON.407-414
4. Bupathi M, Hajjar J, Bean S, et al. Incidence of infusion reactions to anti-neoplastic agents in early phase clinical trials: The MD Anderson Cancer Center experience. Invest New Drugs. 2017;35(1):59-67. doi: https://doi.org/10.1007/s10637-016-0395-y
5. Ganong LH. Integrative reviews of nursing research. Res Nurs Health. 1987;10(1):1-11. doi: https://doi.org/10.1002/nur.4770100103
6. Araújo WCO. Recuperação da informação em saúde: construção, modelos e estratégias. ConCI. 2020;3(2):100-34. doi: https://doi.org/10.33467/conci.v3i2.13447
7. Joanna Briggs Institute. JBI levels of evidence [Internet]. Australia: Joanna Briggs Institute; 2013 Oct [cited 2018 Nov 1]. Available from: https://jbi.global/sites/default/files/2019-05/JBI-Levels-of-evidence_2014_0.pdf
8. Levin AS, Otani IM, Lax T, et al. Reactions to rituximab in an outpatient infusion center: a 5-year review. J Allergy Clin Immunol Pract. 2017;5(1):107-13. doi: https://doi.org/10.1016/j.jaip.2016.06.022
9. Hartinger JM, Satrapová V, Hrušková Z, et al. Tolerance and safety of rapid 2-hour infusion of rituximab in patients with kidney-affecting autoimmune diseases and glomerulonephritides: a single-centre experience. Eur J Hosp Pharm. 2019;26(4):210-13. Disponível em: http://doi.org/10.1136/ejhpharm-2017-001454
10. Fenton TT, Crawford BS, Bullington SM. Implementation and evaluation of a 90-minute rituximab infusion protocol at the Richard L. Roudebush VA Medical Center. Fed Pract. 2020;37(7):331-5. Cited in: PubMed; PMID 32908338.
11. Dotson E, Crawford B, Phillips G, et al. Sixty-minute infusion rituximab protocol allows for safe and efficient workflow. Support Care Cancer. 2016;24(3):1125-9. doi: https://doi.org/10.1007/s00520-015-2869-4
12. Cho KM, Keam B, Ha H, et al. Clinical significance of rituximab infusion-related reaction in diffuse large B-cell lymphoma patients receiving R-CHOP. Korean J Intern Med. 2019;34(4):885-93. doi: https://doi.org/10.3904/kjim.2017.036
13. Bruneto RV, Arruda GN, Fernandes KT, et al. Anticorpos monoclonais no tratamento oncológico: revisão de literatura para o atendimento ao paciente e manejo das reações infusionais. Arch Health Sci [Internet]. 2019 [acesso 2020 mar 23];26(3):173-8. Disponível em: https://cienciasdasaude.famerp.br/index.php/racs/article/view/1369/810
14. Yang BC, Castells MC. Rituximab hypersensitivity and desensitization: a personalized approach to treat cancer and connective tissue diseases. Ann Allergy Asthma Immunol. 2019;123(1):11-5. doi: https://doi.org/10.1016/j.anai.2019.03.008
15. Wong JT, Long A. Rituximab hypersensitivity: evaluation, desensitization, and potential mechanisms. J Allergy Clin Immunol Pract. 2017;5(6):1564-71. doi: https://doi.org/10.1016/j.jaip.2017.08.004
16. Novelli S, Soto L, Caballero A, et al. Assessment of confirmed clinical hypersensitivity to rituximab in patients affected with B-Cell neoplasia. Adv Hematol. 2020;2020:4231561. doi: https://doi.org/10.1155/2020/4231561
17. Stewart D, Aucoin JS, Crosbie T, et al. Update on the subcutaneous administration of rituximab in Canadian Cancer Centres. Curr Oncol. 2020;27(2):113-6. doi: https://doi.org/10.3747/co.27.6041
18. Kashiura D, Souza PVS, Santos HT, et. al. Modelo de impacto orçamentário do rituximabe subcutâneo comparado ao intravenoso no tratamento do linfoma não Hodgkin difuso de grandes células B, CD-20 positivo, no sistema de saúde suplementar brasileiro. J Bras Econ Saúde. 2018;10(3):255-61. doi: https://doi.org/10.21115/JBES.v10.n3.p255-61
19. Lugtenburg P, Avivi I, Berenschot H, et al. Efficacy and safety of subcutaneous and intravenous rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone in first-line diffuse large B-cell lymphoma: the randomized MabEase study. Haematologica. 2017;102(11):1913-22. doi: https://doi.org/10.3324/haematol.2017.173583
20. Davies A, Berge C, Boehnke A, et al. Subcutaneous rituximab for the treatment of B-Cell hematologic malignancies: a review of the scientific rationale and clinical development. Adv Ther. 2017;34(10):2210-31. doi: https://doi.org/10.1007/s12325-017-0610-z
21. MacDonald D, Crosbie T, Christofides A, et al. A Canadian perspective on the subcutaneous administration of rituximab in non-Hodgkin lymphoma. Curr Oncol. 2017;24(1):33-9. doi: https://doi.org/10.3747/co.24.3470
22. Rummel M, Kim TM, Aversa F, et al. Preference for subcutaneous or intravenous administration of rituximab among patients with untreated CD20+ diffuse large B-cell lymphoma or follicular lymphoma: results from a prospective, randomized, open-label, crossover study (PrefMab). Ann Oncol. 2017;28(4):836-42. doi: https://doi.org/10.1093/annonc/mdw685
23. De Cock E, Kritikou P, Sandoval M, et al. Time savings with rituximab subcutaneous injection versus rituximab intravenous infusion: a time and motion study in eight countries. PLoS One. 2016;11(6):e0157957. doi: https://doi.org/10.1371/journal.pone.0157957
24. MabThera® (rituximabe) [bula na Internet]. Rio de Janeiro: Roche; 2018. [acesso 2021 mar 6]. Disponível em: https://dialogoroche.com.br/content/dam/roche-dialogo/dialogo-brazil-assets/downloadable-assets/produtos/bulas/mabthera/Mabthera_Bula_Profissionais_da_Saude.pdf
25. Department of Health and Human Services (US), National Institutes of Health, National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE). Version 4.0 [Internet]. Bethesda, (MD): Cancer Therapy Evaluation Program; 2009 May 28 [revised 2010 June 14; cited 2021 Mar 6]. Available from: https://www.eortc.be/services/doc/ctc/ctcae_4.03_2010-06-14_quickreference_5x7.pdf
26. Silva DP, Guimarães Filho JS, Brandemberg JC. A praxeologia da regra de três algebrizada e a proposição cinco do Liber Quadratorum. RECM. 2020;16(35):61-73. doi: http://doi.org/10.18542/amazrecm.v16i35.8270
Recebido em 3/8/2021
Aprovado em 30/11/2021
Editor-associado: Fernando Lopes Tavares de Lima. Orcid iD: https://orcid.org/0000-0002-8618-7608
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde