ARTIGO ORIGINAL
Pharmaceutical Assistance to Oncological Patients Using Monoclonal Antibodies in a Reference Hospital in the west of Santa Catarina
Asistencia Farmacéutica a Pacientes Oncológicos que Utilizan Anticuerpos Monoclonales en un Hospital de Referencia en el Oeste de Santa Catarina
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n3.2316
Renan Martinelli Leonel¹; Flávia Medeiros Dutra Reis2; Daniel Andolfatto3; Gabriela Gonçalves de Oliveira4
1,2,4Universidade Federal da Fronteira Sul. Chapecó (SC), Brasil. E-mails: renanmartinellileonel@gmail.com; flaviamdreissg@gmail.com; gabriela.oliveira@uffs.edu.br. Orcid iD: https://orcid.org/0000-0002-2122-8157; Orcid iD: https://orcid.org/0000-0003-1232-5534; Orcid iD: https://orcid.org/0000-0002-2831-7267
3Associação Hospitalar Lenoir Vargas Ferreira, Hospital Regional do Oeste, Setor de Farmácia. Chapecó (SC), Brasil. E-mail: daniel.andolfatto@unochapeco.edu.br. Orcid iD: https://orcid.org/0000-0003-4872-5361
Endereço para correspondência: Gabriela Gonçalves de Oliveira. Linha Fazenda Zandavalli, chácara 03, SC283 – Interior. Guatambú (SC), Brasil. CEP 89817-000. E-mail: gabriela.oliveira@uffs.edu.br
RESUMO
Introdução: A utilização dos anticorpos monoclonais vem sendo incorporada aos protocolos de tratamento para câncer, uma vez comprovada sua eficácia. Essa modalidade de terapia é onerosa, e sua aquisição ainda constitui um obstáculo para o paciente. Objetivo: Descrever a utilização de anticorpos monoclonais no que tange à forma de aquisição, regulação e judicialização, efeitos adversos e causas de interrupção da terapia. Método: Estudo descritivo com avaliação de pacientes (n=169) em tratamento para câncer, em um hospital público, no período de 1 de agosto de 2017 a 31 de julho de 2019. Resultados: A população estudada foi majoritariamente feminina (n=115). As principais neoplasias encontradas foram de mama (n=64, 36,16%), linfomas (n=53, 29,94%) e mieloma múltiplo de plasmócito/plasmocitoma (n=25, 14,12%). Os anticorpos monoclonais mais utilizados foram o trastuzumabe (n=65, 35,71%) e rituximabe (n=54, 29,67%). Foram observadas quatro formas de aquisição dos fármacos. As aquisições por meio do Sistema Único de Saúde (SUS) (n=103, 56,59%) e judicial (n=72, 39,56%) prevaleceram. A maioria dos pacientes não apresentou efeitos adversos à terapia (60,3%); mas, entre os que apresentaram, os principais efeitos foram vômitos e náuseas, astenia, diarreia, dor, neutropenia e mucosite. Efeitos adversos/toxicidade (n=15), falta de medicamento (n=11) e atraso na liberação (n=10) foram as causas mais comuns de interrupção do tratamento. Conclusão: Os anticorpos monoclonais são mais específicos e apresentam menores efeitos. Aos fármacos indisponíveis pelo SUS, a judicialização mostra-se como uma ferramenta importante.
Palavras-chave: assistência farmacêutica; anticorpos monoclonais/uso terapêutico; anticorpos monoclonais/efeitos adversos; neoplasias/tratamento farmacológico; judicialização da saúde.
ABSTRACT
Introduction: The use of monoclonal antibodies has been incorporated into cancer treatment protocols, once their effectiveness has been proven. This type of therapy is costly and its acquisition is still an obstacle for the patient. Objective: To describe the use of monoclonal antibodies in the perspective of purchasing, regulation and judicialization, adverse effects and causes of therapy discontinuation. Method: Descriptive study evaluating patients (n=169) undergoing treatment for cancer in a public hospital, from August 1, 2017 to July 31, 2019. Results: The population investigated consisted mostly of females (n=115). The main neoplasms found were breast (n=64, 36.16%), lymphomas (n=53, 29.94%) and plasma cell/plasmacytoma multiple myeloma (n=25, 14.12%). The most used monoclonal antibodies were trastuzumab (n=65, 35.71%) and rituximab (n=54, 29.67%). Four forms of drug purchase were observed. The purchases through the National Health System (SUS) (n=103, 56.59%) and law-mandated (n=72, 39.56%) prevailed. Most patients had no therapy-related adverse effects (60.3%), but among those who did, the main effects were vomiting and nausea, asthenia, diarrhea, pain, neutropenia and mucositis. Adverse effects/toxicity (n=15), lack of medication (n=11) and delayed approval (n=10) were the most common causes of treatment discontinuation. Conclusion: Monoclonal antibodies are more specific and have lesser effects. For drugs unavailable at SUS, judicialization is an important tool.
Key words: pharmaceutical services; antibodies, monoclonal/therapeutic use; antibodies, monoclonal/adverse effects; neoplasms/drug therapy; health's judicialization.
RESUMEN
Introducción: El uso de anticuerpos monoclonales se ha incorporado a los protocolos de tratamiento del cáncer, una vez comprobada su eficacia. Este tipo de terapia es costosa y su adquisición sigue siendo un obstáculo para el paciente. Objetivo: Describir el uso de anticuerpos monoclonales en términos de adquisición, regulación y judicialización, efectos adversos y causas de interrupción de la terapia. Método: Estudio descriptivo que evaluó a pacientes (n=169) en tratamiento por cáncer, en un hospital público, desde el 1 de agosto de 2017 al 31 de julio de 2019. Resultados: La población estudiada fue mayoritariamente femenina (n=115). Las principales neoplasias encontradas fueron mama (n=64, 36,16%), linfomas (n=53, 29,94%) y mieloma múltiple de células plasmáticas/plasmocitomas (n=25, 14,16%). Los anticuerpos monoclonales más utilizados fueron trastuzumab (n=65, 35,71%) y rituximab (n=54, 29,67%). Se observaron cuatro formas de adquisición de fármacos. Predominaron las adquisiciones a través del Sistema Único de Salud (SUS) (n=103, 56,59%) y judiciales (n=72, 39,56%). La mayoría de los pacientes no presentaron efectos adversos a la terapia (60,3%), pero entre los que sí los tuvieron, los principales efectos fueron vómitos y náuseas, astenia, diarrea, dolor, neutropenia y mucositis. Los efectos adversos/toxicidad (n=15), la falta de medicación (n=11) y la liberación retardada (n=10) fueron las causas más frecuentes de interrupción del tratamiento. Conclusión: Los anticuerpos monoclonales son más específicos y tienen menos efectos. Para los medicamentos no disponibles en el SUS, la judicialización es una herramienta importante.
Palabras clave: servicios farmacéuticos; anticuerpos monoclonales/uso terapéutico; anticuerpos monoclonales/efectos adversos; neoplasias/tratamiento farmacológico; judicialización de la salud.
INTRODUÇÃO
Os compostos biofarmacêuticos, como os anticorpos monoclonais, têm alcançado maior status dentro do rol das terapias disponíveis para o câncer e têm gerado impacto na indústria farmacêutica apesar de sua descoberta não ser recente. Os anticorpos monoclonais são caracterizados de acordo com sua estrutura biológica: murinos (ou camundongo total), quimérico, humanizado e humano total1-3.
As terapias que utilizam anticorpos monoclonais são a terapia-alvo e a imunoterapia. A primeira diz respeito a anticorpos que se ligam a antígenos específicos do tumor para atacá-lo. Os mecanismos de ataque ao tumor são os mesmos utilizados para atacar micro-organismos, como opsonização, fagocitose, ativação do sistema complemento e citotoxicidade celular dependente de anticorpos. A segunda serve para fortalecer o sistema imune do paciente para que este seja capaz de combater as células patogênicas com maior eficácia1,2.
Os anticorpos monoclonais utilizados no Brasil que atuam como antineoplásicos são: nivolumabe, ipilimumabe, brentuximabe vedotina, bevacizumabe, ramucirumabe, cetuximabe, nimotuzumabe, panituzumabe, rituximabe, obinutuzumabe, ofatumumabe, pertuzumabe, trastuzumabe e trastuzumabe entasina. Os principais tumores tratados por esses medicamentos são o colorretal, pulmão, mama, células renais, ovário, tuba uterina, peritoneal, colo do útero, gástrico, cabeça e pescoço, e melanoma4. Os efeitos colaterais mais documentados são febre, calafrio, astenia, cefaleia, náusea, vômito, diarreia, hipotensão arterial, rash cutâneo e reação de hipersensibilidade1,5-8. Mesmo com a presença desses efeitos, a sobrevida dos pacientes portadores de cânceres é, de modo geral, maior com a utilização desses medicamentos em relação aos que não os utilizam, inclusive, em monoterapia9.
Em virtude da relevância do tema, da pouca caracterização em outros estudos e do grande impacto na morbimortalidade dos pacientes, este trabalho teve como objetivo descrever a utilização de anticorpos monoclonais no que tange à forma de aquisição, regulação e judicialização, efeitos adversos e motivos da interrupção da terapia, além da caracterização sociodemográfica, e as principais neoplasias dos pacientes atendidos pelo Hospital Regional do Oeste, em Santa Catarina, no período de agosto de 2017 a julho de 2019.
MÉTODO
Foi realizado um estudo do tipo descritivo. A coleta de dados foi efetuada nos setores de Oncologia e Farmácia Hospitalar do período de 1 de agosto de 2017 a 31 de julho de 2019 na Associação Lenoir Vargas Ferreira do Hospital Regional do Oeste, em Chapecó, Santa Catarina. Os prontuários eram digitais de modo que os dados foram colhidos nas dependências do hospital em horários combinados previamente com a equipe, sendo necessárias criação de login e capacitação para os pesquisadores, ambas realizadas pela própria instituição. Foram coletados os seguintes parâmetros nos prontuários: nome, idade, sexo e atividade laboral para perfil da amostra, a Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde – décima edição (CID-10)10 da neoplasia, ano de diagnóstico, protocolos quimioterápicos utilizados, terapia adjuvante e neoadjuvante e anticorpos monoclonais utilizados. Para análise dos anticorpos de forma individual, observou-se a forma de aquisição: Sistema Único de Saúde (SUS), Suplementar, Judicial e outro, que inclui o compartilhamento de anticorpos entre pacientes; além de intercorrências da terapia, intercorrências da administração parenteral e motivo da interrupção do fornecimento.
Os critérios de inclusão foram: pacientes com neoplasias sólidas e/ou hematológicas, entre pacientes internados, ambulatoriais e falecidos, em tratamento oncológico com uso de anticorpos monoclonais.
O tamanho amostral foi calculado pela fórmula:
n = [EDFF*Np(1-p)]/[(d2/Z21-α/2*(N-1)+p*(1-p)]
Onde: n é o valor da amostra, EDFF é o efeito de desenho (1), N é o tamanho da população (302), p é a frequência hipotética do fator do resultado na população (27%), d é o limite de confiança (5%), e Z é o desvio do valor médio que é aceito para alcançar o nível de confiança que se deseja. O cálculo foi realizado pelo programa Epi Info™ versão 7.2.3.1.
Pelo fato de o trastuzumabe ser o anticorpo mais prevalente, pela dificuldade de encontrar estudos semelhantes e pelos efeitos adversos da terapia serem um dos principais temas abordados neste estudo, foi utilizado, para a frequência hipotética do cálculo amostral, o percentual de efeitos adversos encontrados na terapia com trastuzumabe no seguinte estudo: Trastuzumab induces gastrointestinal side effects in HER2-overexpressing breast cancer patients11. Nesse caso, foi observada uma incidência de 27% de efeitos colaterais, valor utilizado para o cálculo.
Visando à representatividade dos dez anticorpos monoclonais na amostra, primeiramente foi calculada a porcentagem de cada anticorpo na população de usuários de anticorpos monoclonais e, em seguida, foi usada essa porcentagem para determinar o número de pacientes de cada anticorpo para a amostra. Os pacientes foram, então, agrupados por medicamento, em ordem alfabética, sendo numerados em ordem crescente, e cada grupo iniciando do número 1. Posteriormente, foi realizado o sorteio de números aleatórios para a inclusão dos participantes da pesquisa, com o uso da ferramenta disponível na página eletrônica da Epi Info™ versão 7.2.3.1. Na página eletrônica, foram inseridos, nos campos correspondentes, o primeiro e o último número para cada um dos grupos de anticorpos e o total de números aleatórios a serem gerados, de acordo com o n final calculado para cada grupo de anticorpos.
A aprovação pelo Comitê de Ética em Pesquisa da Universidade Federal da Fronteira Sul foi registrada sob o número de protocolo 3.997.777, em 29 de abril de 2020 (CAAE: 30082220.0.0000.5564).
RESULTADOS
Foram atendidos 302 pacientes no período analisado. A amostra mínima estipulada significativa foi de 152 pacientes. Por fim, avaliaram-se 169 prontuários.
A Tabela 1 demonstra a prevalência de 68,05% de pacientes femininos (n=115), sobre a população masculina (n=54, 31,95%). A média de idade prevalente nas duas populações situa-se entre 40 e 69 anos. Em 63,91% dos prontuários (n=108), não havia informação sobre a atividade laboral da população estudada. Entre as informadas, a profissão de agricultor foi a principal (8,9%) seguida pelos aposentados (7,7%).
|
Tabela 1. Dados sociodemográficos de pacientes admitidos no Hospital Regional do Oeste |
||||
|
Variáveis |
Média |
Desvio-padrão |
||
|
Faixas etárias |
Feminino n (%) |
Masculino n (%) |
||
|
20-29 |
0 |
1 (1,9) |
0,5 |
0,7 |
|
30-39 |
15 (13,0) |
3 (5,6) |
9 |
8,5 |
|
40-49 |
26 (22,6) |
8 (14,8) |
17 |
12,7 |
|
50-59 |
34 (29,6) |
10 (18,5) |
22 |
17,0 |
|
60-69 |
30 (26,1) |
18 (33,3) |
24 |
8,5 |
|
70-79 |
9 (7,8) |
10 (18,5) |
9,5 |
0,7 |
|
80 ou mais |
1 (0,9) |
4 (7,4) |
2,5 |
2,1 |
|
Total |
115 (100) |
54 |
||
|
Profissão |
n |
% |
||
|
Não informada |
108 |
63,91 |
||
|
Agricultor |
15 |
8,88 |
||
|
Aposentado |
13 |
7,69 |
||
|
Auxiliar de cozinha |
1 |
0,59 |
||
|
Auxiliar de produção |
2 |
1,18 |
||
|
Carpinteiro |
1 |
0,59 |
||
|
Comerciante |
3 |
1,78 |
||
|
Confeiteira |
2 |
1,18 |
||
|
Costureira |
2 |
1,18 |
||
|
Cozinheira |
2 |
1,18 |
||
|
Dona de casa |
7 |
4,14 |
||
|
Empregada doméstica |
1 |
0,59 |
||
|
Esteticista/cabeleireira/manicure |
2 |
1,18 |
||
|
Instrutor |
1 |
0,59 |
||
|
Operador de máquina |
1 |
0,59 |
||
|
Pedreiro |
1 |
0,59 |
||
|
Professor |
4 |
2,37 |
||
|
Servente de limpeza |
1 |
0,59 |
||
|
Trabalhador de confecção |
1 |
0,59 |
||
|
Trabalhador de granja |
1 |
0,59 |
||
|
Total |
169 |
100 |
||
As neoplasias encontradas foram agrupadas em 22 tipos (n=177), com a respectiva CID. Alguns pacientes apresentavam mais de um tipo ou subtipo de câncer no período analisado. Observa-se, na Tabela 2, que o mais encontrado no estudo foi o de câncer de mama, ocorrendo em 64 pacientes (36,16%), seguido pelos linfomas, em 53 pacientes (29,94%), e o mieloma múltiplo/neoplasia maligna de plasmócito/plasmocitoma em 25 pacientes (14,12%).
|
Tabela 2. Tipos de neoplasias observadas nos pacientes do setor de Oncologia em um hospital do Oeste catarinense |
|||
|
Tipo de câncer |
n |
% |
CID |
|
Células escamosas queratinizantes |
1 |
0,56 |
C34 |
|
Cólon |
5 |
2,82 |
C18, C189 |
|
Coração, mediastino e pleura com lesão invasiva |
1 |
0,56 |
C388 |
|
Estômago |
1 |
0,56 |
C16 |
|
Glioblastoma |
1 |
0,56 |
C71 |
|
Hepático |
2 |
1,13 |
C220 |
|
Leucemia linfocítica/linfoide crônica |
5 |
2,82 |
C911 |
|
Linfoma Hodgkin, esclerose nodular |
4 |
2,26 |
C82, C811 |
|
Linfoma não Hodgkin |
49 |
27,68 |
C82, C822, C833, C857, C911, C838 |
|
Mama |
64 |
36,16 |
C50, C504, C508, C509 |
|
Mamilo e aréola |
1 |
0,56 |
C500 |
|
Melanoma |
2 |
1,13 |
C43 |
|
Mieloma múltiplo e neoplasia maligna de plasmócito |
23 |
12,99 |
C90, C900 |
|
Neoplasia de apêndice |
1 |
0,56 |
C18 |
|
Pele do lábio |
1 |
0,56 |
C440 |
|
Plasmocitoma/plasmocitoma de coluna |
2 |
1,13 |
C900 |
|
Pleura |
1 |
0,56 |
C384 |
|
Pulmão |
1 |
0,56 |
C340 |
|
Reto alto/inferior/sigmoide/retossigmoide |
8 |
4,52 |
C20, C189, C19, C188, C187 |
|
Rim, exceto pelve renal |
1 |
0,56 |
C64 |
|
Tecido conjuntivo e tecidos moles do abdome e tórax |
2 |
1,13 |
C494 |
|
Útero |
1 |
0,56 |
C54 |
|
Total |
177 |
100 |
|
|
Legenda: CID = Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde – décima edição. |
|||
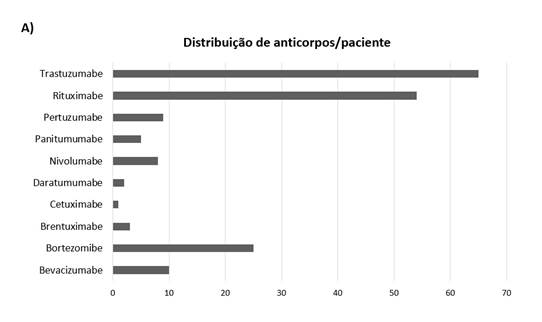
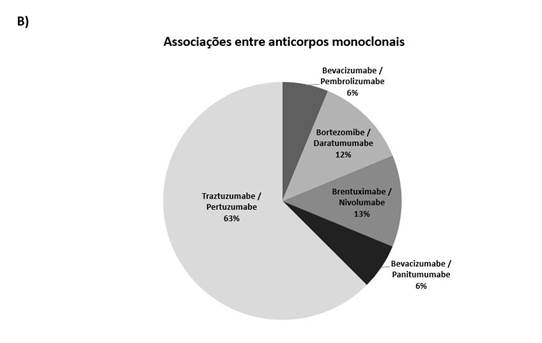
O anticorpo monoclonal mais prevalente foi o trastuzumabe (35,71%, n= 65), o qual é utilizado para o tratamento do câncer de mama. Observou-se também a utilização de rituximabe (29,67%) e o bortezomibe (13,74%). Os menos encontrados foram o cetuximabe (0,55%), daratumumabe (1,1%) e brentuximabe (1,65%) conforme o Gráfico 1A. Dos 169 pacientes avaliados, 16 (9,5%) fizeram o uso de mais de um anticorpo monoclonal. A associação do trastuzumabe com o pertuzumabe foi a mais comum (63%) de acordo com o Gráfico 1B.
|
|
|
|
|
Gráfico 1. Anticorpos monoclonais e associações administradas aos pacientes do setor de Oncologia em um hospital do Oeste catarinense. (A) Distribuição de anticorpos monoclonais aos pacientes oncológicos que fizeram uso dessa terapia (n=182); (B) Associações entre o uso dos anticorpos monoclonais |
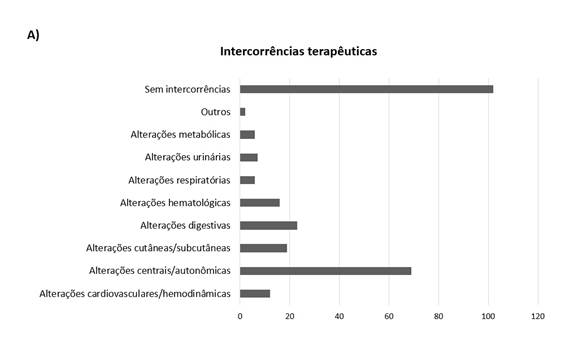
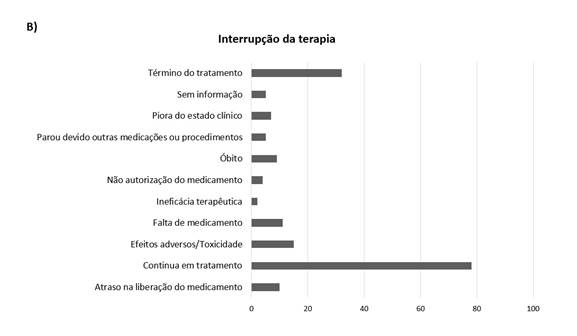
O uso de anticorpos monoclonais na terapia oncológica tem como objetivos maior eficácia e menores efeitos adversos em razão da seletividade do anticorpo ao antígeno-alvo. O Gráfico 2A demonstra que 102 pacientes (60,3%) não tiveram nenhuma intercorrência durante a terapia. Entre os que tiveram, as mais prevalentes no estudo foram as alterações centrais/autonômicas (26,3%), seguidas por alterações digestivas (8,8%), cutâneas/subcutâneas (7,3%), hematológicas (6,1%), cardiovasculares/hemodinâmicas (4,6%), urinárias (2,7%), respiratórias e metabólicas (2,3% em cada) e outros (0,8%). Os principais sintomas observados foram vômitos e náuseas (n=20), astenia (n=15), diarreia (n=12), dor (n=12), neutropenia (n=10) e mucosite (n=8). O Gráfico 2B demonstra que 32 pacientes (19%) tiveram seu tratamento interrompido. As principais causas de interrupção foram por causa de efeitos adversos e toxicidade (n=15), falta de medicamento (n=11) e atraso na liberação das medicações (n=10). Entre essas interrupções, alguns pacientes interromperam o tratamento mais de uma vez por diferentes motivos. Além disso, vale ressaltar que 72 pacientes continuavam em terapia no final do estudo.
|
|
|
|
|
Gráfico 2. Intercorrências terapêuticas e interrupção da terapia em pacientes em uso de anticorpos monoclonais em um hospital do Oeste catarinense. (A) Intercorrências observadas durante o tratamento com anticorpos monoclonais (n=262); (B) Fatores relacionados à interrupção da terapia com anticorpos monoclonais (n=100) |
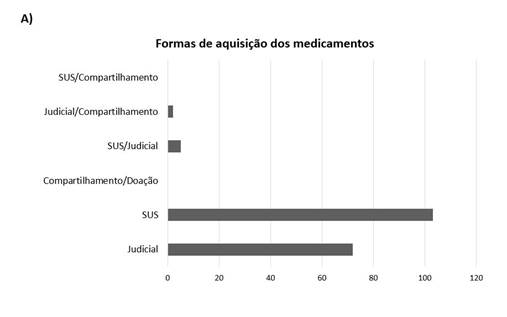
O Gráfico 3A mostra que a principal forma de aquisição dos medicamentos ocorreu por meio do SUS, totalizando 103 anticorpos, o que representou 56,59% entre os 182 anticorpos monoclonais avaliados. A via judicial foi a segunda mais prevalente, com 72 anticorpos monoclonais (39,56%), e, em terceiro e quarto, SUS/judicial e judicial/outro, respectivamente. Essas formas mistas de aquisição foram observadas em 3,85% dos anticorpos, sendo 2,75% na aquisição via SUS e judicial em relação ao trastuzumabe, e 1,1% na forma mista entre judicial e outro em relação ao bortezomibe.
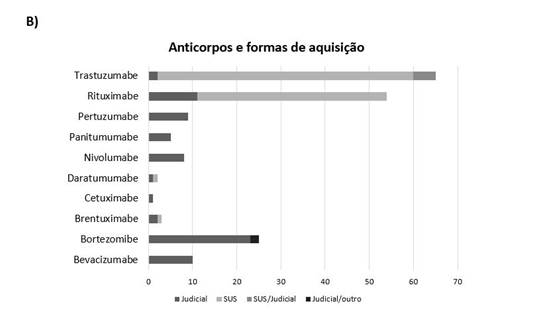
O Gráfico 3B demonstra que os principais anticorpos monoclonais encontrados foram o trastuzumabe (n= 65) e o rituximabe (n= 54), ambos distribuídos principalmente pelo SUS. Em relação à judicialização, os anticorpos monoclonais, os quais representam a maioria, são o cetuximabe, nivolumabe, panitumumabe, pertuzumabe, bevacizumabe, bortezomibe e brentuximabe, destacando-se os cinco primeiros com índice de judicialização de 100% e o bortezomibe com 92% de judicialização. Os anticorpos monoclonais com intermediário nível de judicialização foram daratumumabe (50%) e brentuximabe (66,67%). Os com menor índice foram o trastuzumabe (3,08%) e rituximabe (20,37%). O total de medicamentos judicializados foi de 39,56%.
|
|
|
|
|
Gráfico 3. Anticorpos monoclonais e aquisição. (A) Forma de aquisição dos medicamentos (n=182); (B) Anticorpos e formas de aquisição (n=182) |
DISCUSSÃO
As estimativas do Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA) demonstram que, para cada ano do triênio 2020-2022, as neoplasias mais incidentes, exceto de pele, são de próstata, cólon e reto nos homens e de mama, cólon e reto nas mulheres. Os linfomas são incidentes em ambos os sexos e compõem os dez tipos mais prevalentes12. Os cânceres mais frequentes neste trabalho foram câncer de mama (n=64, 36%), linfomas (n= 53, 30%) e mieloma múltiplo/neoplasia de plasmócito/plasmocitoma (n=25, 14%), totalizando 80%. A prevalência desses tipos de cânceres reflete os principais anticorpos administrados aos pacientes, como: trastuzumabe (35,7%), rituximabe (30%) e bortezomibe (114%). Alguns anticorpos, apesar de sua indicação para determinadas doenças oncológicas, não são liberados pelo SUS, por exemplo, o trastuzumabe para câncer gástrico avançado, e o rituximabe, para leucemia linfoide crônica13-15.
Entre as associações de anticorpos monoclonais, a mais encontrada foi entre o trastuzumabe e pertuzumabe, sendo observada em dez pacientes, embora o relatório da 53ª reunião da Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec) tenha se manifestado preliminarmente não favorável à incorporação do pertuzumabe associado ao trastuzumabe e docetaxel no tratamento do câncer de mama HER2-positivo metastático em primeira linha de tratamento. As justificativas para tal parecer foram: a maioria dos pacientes no principal estudo apresentado era virgem de tratamento com trastuzumabe; o perfil dos pacientes incluídos no estudo é diferente do perfil dos pacientes na vida real; a incorporação do pertuzumabe não se mostrou custo-efetiva e com grande impacto orçamentário ao sistema de saúde16.
Em todos os anticorpos estudados, foi relatada ao menos uma reação adversa. A maioria dos efeitos encontrados foi relacionada ao trastuzumabe, rituximabe, bevacizumabe e bortezomibe. No uso do trastuzumabe, podem ocorrer dor abdominal, cansaço, dor no peito, calafrios, febre, cefaleia, diarreia, náusea, vômito, dor nas articulações, dores musculares e manchas na pele. Alguns sinais mais graves podem ser notados em pacientes que fazem uso do trastuzumabe como a diminuição da força de ejeção do coração, levando à insuficiência cardíaca, sintoma descrito em até 22% dos pacientes13. O rituximabe pode causar aumento da susceptibilidade a infecções do trato respiratório superior, infecções do trato urinário, neutropenia, hipertensão, náusea, erupção cutânea, pirexia, prurido, urticária, irritação na garganta, rubor com calor local, hipotensão, rinite, tremores, taquicardia, fadiga, dor orofaríngea, edema periférico, eritema, hipercolesterolemia, parestesia, enxaqueca, tontura, cefaleia, alopecia, dispepsia, diarreia, refluxo gastroesofágico, úlcera oral, dor abdominal, artralgia/dor musculoesquelética, osteoartrite e bursite14,17. Já o bortezomibe pode levar a: neuropatia, hipotensão arterial, insuficiência cardíaca, alterações da função hepática, trombocitopenia, neutropenia, sangramento gastrintestinal e intracerebral, náusea, diarreia, constipação, vômitos, vertigem, tontura ou desmaios15.
Vaz et al.18 observaram, em estudo com trastuzumabe isolado, maior prevalência de cansaço como efeito adverso (45%), seguido de xerodermia (27%), dor nas pernas (18%) e vômito (9%). Quando associado à quimioterapia, os principais sintomas observados foram cansaço (26%), dor no corpo (26%), dor nas pernas (13%), enjoo (13%), falta de ar (13%) e vômito (6,7%)18.
Em relação aos principais efeitos adversos, observou-se que 102 pacientes (60,3%) não apresentaram nenhum efeito adverso durante a terapia. Entre os que apresentaram sintomas, os mais referidos foram náuseas e vômitos, astenia, diarreia, dor, neutropenia e mucosite. No entanto, há que se considerar, na avaliação de efeitos adversos, a utilização de outras medicações/terapias quimioterápicas concomitantemente pelos pacientes, ou ainda, sintomas em razão da sua condição clínica.
As políticas públicas de atenção oncológica têm proporcionado aos pacientes uma sobrevida global maior, com melhor qualidade de vida. Parte desse sucesso se deve ao avanço das terapias medicamentosas9. Uma questão que não pode ser desconsiderada para o aumento da sobrevida e a efetividade do tratamento é o fato de os pacientes recorrerem à justiça pela chance de utilizar medicamentos mais eficazes, como os anticorpos monoclonais4,19. Ademais, é notória a relação de dependência entre os processos judiciais e a implementação de tecnologias no SUS por meio da Conitec. Sem o real conhecimento da demanda da população por uma medicação, em sua grande maioria cara, é inviável a implementação de medidas públicas para incorporá-las ao repertório terapêutico disponível gratuitamente pelo SUS20.
Um dos maiores problemas na utilização desses medicamentos é o alto custo, por isso, diversos anticorpos monoclonais não se encontram disponíveis na Relação Nacional de Medicamentos Essenciais (Rename)21 e, consequentemente, no SUS. Desse modo, a judicialização representa uma possibilidade, mesmo que onerosa, para a resolução dessa questão. Em dez anos, houve um aumento de quase 5 mil por cento nos gastos com judicialização no Brasil. Em valores, esse gasto variou de R$ 26 milhões para mais de R$ 1,325 bilhão entre 2007 e 201622. O número de processos em primeira instância relacionados à saúde aumentou aceleradamente de 2009 a 2017. No período, a quantidade de casos cresceu 198%. Em 2017, 95,7 mil demandas acerca de saúde começaram a tramitar no judiciário brasileiro23. Os antineoplásicos são os mais procurados nos processos de judicialização em alguns Estados24-26, e os anticorpos monoclonais se mostraram em segundo lugar nas demandas, em um estudo no Estado do Pernambuco27. Como alguns dos anticorpos monoclonais não são contemplados pela Conitec21, a taxa de judicialização nessa classe de medicamentos é alta. Alguns anticorpos são obtidos com taxa de 100% de judicialização.
Neste estudo, 39,56% dos anticorpos monoclonais estudados foram judicializados. Os fatores associados ao ascendente número de judicializações ocorreram por medicamentos que não eram padronizados pela Conitec ou que não contemplavam valor de ressarcimento compatível com o custo da medicação.
As diferentes formas de aquisição de medicamentos encontradas neste trabalho foram, em forma decrescente: SUS; judicial; SUS/judicial e judicial/outro. Na primeira, tem-se trastuzumabe e rituximabe como principais representantes. Esses anticorpos monoclonais já foram incorporados pelo SUS, com eficácia comprovada para determinados tratamentos. Eles foram incorporados apenas nos últimos dez anos ao SUS pela Conitec, a qual avaliou, por meio de revisões sistemáticas e de metanálises, os resultados positivos de sobrevida. O medicamento trastuzumabe é indicado no SUS somente para câncer de mama HER2+, neoadjuvante, adjuvante e metastático, exceto ósseo. O rituximabe é indicado somente para linfoma não Hodgkin difuso de grandes células como primeira linha de tratamento e linfoma folicular como primeira e segunda linha. Evidenciou-se, neste estudo, que 56,59% dos anticorpos monoclonais mais prescritos possuem aquisição via administrativa, ou seja, pelo SUS. O estudo de Schulz et al.17 revelou que o tratamento de indução com rituximabe, associado à quimioterapia, obteve melhores resultados na sobrevida global (hazard ratio – HR = 0,63; intervalo de confiança de 95% – IC 95% = 0,51-0,79)17.
Observou-se que os medicamentos que necessitaram ser judicializados foram o cetuximabe, nivolumabe, panitumumabe, pertuzumabe, bortezomibe, bevacizumabe e brentuximabe, os quais, apesar de aprovados pela Conitec, para sua incorporação ao SUS, não foram obtidos por esse meio. A judicialização desses medicamentos pode ocorrer, por exemplo, por falta de medicamentos; pela sua recente incorporação, como o bortezomibe, aprovado em 2020; ou ainda por uso em cânceres diferentes dos quais foram aprovados originalmente. No Estado de Santa Catarina, existe um processo judicial coletivo, conhecido como Ação Civil Pública n.º 5019190-76.2019.4.04.7200, o qual fornece o medicamento trastuzumabe para pacientes com câncer de mama HER2+ com metástases ósseas e viscerais. Todavia, observou-se que o fornecimento não é regular e que muitas mulheres recorreram judicialmente à medicação para evitar perda de seguimento terapêutico. A via de aquisição SUS/outro, que ocorreu apenas com o trastuzumabe, se deu, por exemplo, por causa da inconsistência da requisição médica com os protocolos. O bortezomibe, único anticorpo monoclonal adquirido de forma judicial/outro, representa uma forma autorizada pelo médico (até o despacho ou deferimento judicial e o fornecimento regular), da utilização das sobras farmacologicamente estáveis dos pacientes que faziam a dose menor do que a dose do frasco.
Desse modo, nota-se a importância de políticas públicas que incentivem a comunidade médica, científica, social e jurídica a encaminharem revisões com evidências clínicas à Conitec para aprovar novas incorporações desses medicamentos no SUS; sobretudo em relação a terapias já aprovadas internacionalmente e com potencial curativo ou boa resposta terapêutica ou paliativa para doenças fatais e incapacitantes, como diversos tipos de cânceres.
A principal dificuldade encontrada neste trabalho diz respeito ao mau preenchimento de alguns prontuários, com excesso de siglas, ausência e desorganização de dados, o que limita o acesso e entendimento dessas informações.
CONCLUSÃO
Observou-se que as neoplasias predominantemente contempladas pela terapia com anticorpos monoclonais neste trabalho foram câncer de mama e neoplasias hematológicas como linfomas e mieloma. Por sua vez, a população do sexo feminino situada entre a faixa etária dos 40 aos 59 anos é a mais prevalente, reforçando a necessidade do diagnóstico precoce e do seguimento terapêutico constante, os quais podem ser prejudicados pela sobrecarga no sistema de saúde.
A seletividade das terapias com anticorpos monoclonais faz com que os efeitos adversos sejam minimizados, embora ainda sejam notórios. Os efeitos descritos em literatura também foram observados de forma análoga neste trabalho. É importante também ressaltar a combinação das terapias, que incluem quimioterápicos, entre outros.
A aquisição dos anticorpos monoclonais pelo SUS é prevalente, não obstante o impacto significativo da judicialização. Os anticorpos monoclonais não disponibilizados pelo SUS são demandados pela população, que recorrem a medidas judiciais para conseguirem seu tratamento pela União, Estado ou município. Isso justifica a importância de haver políticas públicas que incentivem a comunidade médica, científica, social e jurídica a enviarem revisões com evidências clínicas à Conitec para aprovar novas incorporações dessas tecnologias no SUS, o que garante a manutenção dos princípios que regem o sistema, como a equidade, a integralidade e a universalidade.
Infelizmente, a terapia pode ser interrompida, sobretudo por questões associadas à toxicidade, falta de medicamento e atraso na liberação dos anticorpos.
Os dados obtidos sinalizam a necessidade de atualizações constantes pela própria dinamicidade dos estudos científicos, a redução de efeitos colaterais, o aumento na expectativa de vida, a introdução no rol de medicações nos serviços de alta complexidade, a decisão da equipe gestora, o suporte às decisões judiciais e, principalmente, o benefício aos pacientes que necessitam dessas terapias.
AGRADECIMENTOS
À Associação Hospitalar Lenoir Vargas Ferreira e ao Hospital Regional do Oeste, representados por sua gestão farmacêutica e institucional, que colaboraram para realização desta pesquisa.
CONTRIBUIÇÕES
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
1. American Cancer Society [Internet]. Atlanta (GA): American Cancer Society; c2022. Monoclonal antibodies and their side effects; [revised 2019 Dec 27; cited 2020 May 6]. Available from: https://www.cancer.org/treatment/treatments-and-side-effects/treatment-types/immunotherapy/monoclonal-antibodies.html
2. Abbas AK, Lichtman AHH, Pillai S. Imunologia celular e molecular. 8. ed. Rio de Janeiro: Elsevier; 2015.
3. Murphy K. Imunobiologia de Janeway [Internet]. 8. ed. Machado DC, Renard G, Gualdi LP, tradutores. Porto Alegre: Artmed; 2014 [acesso 2020 fev 6]. Disponível em: https://edisciplinas.usp.br/pluginfile.php/4370883/mod_resource/content/1/Imunologia%20-%20Janeway%20-%208ed.pdf
4. Vidal TJ, Figueiredo TA, Pepe VLE. O mercado brasileiro de anticorpos monoclonais utilizados para o tratamento de câncer. Cad Saúde Pública. 2018;34(12):e00010918. doi: https://doi.org/10.1590/0102-311X00010918
5. Bousquet E, Zarbo A, Tournier E, et al. Development of papulopustular rosacea during nivolumab therapy for metastatic cancer. Acta Derm Venereol. 2017;97(4):539-40. doi: https://doi.org/10.2340/00015555-2566
6. Kaunitz GJ, Loss M, Rizvi H, et al. Cutaneous eruptions in patients receiving immune checkpoint blockade: clinicopathologic analysis of the nonlichenoid histologic pattern. Am J Surg Pathol. 2017;41(10):1381-9. doi: https://doi.org/10.1097/PAS.0000000000000900
7. Hong D, Sloane DE. Hypersensitivity to monoclonal antibodies used for cancer and inflammatory or connective tissue diseases. Ann Allergy Asthma Immunol. 2019;123(1):35-41. doi: https://doi.org/10.1016/j.anai.2019.04.015
8. Lewis RL, Miller KL. PD-1 inhibitors: safety of use and management of immune-mediated adverse reactions in patients with head and neck cancer. Clin J Oncol Nurs. 2019;23(6):627-38. doi: https://doi.org/10.1188/19.CJON.627-638
9. Silva CF, Silva MV, Osorio-de-Castro CGS. Os ensaios clínicos e o registro de anticorpos monoclonais e biomedicamentos oncológicos no Brasil. Rev Panam Salud Pública. 2016;39:149-56.
10. Organização Mundial da Saúde. CID-10: Classificação Estatística Internacional de Doenças e problemas relacionados à saúde. São Paulo: Edusp; 2008.
11. Al-Dasooqi N, Bowen JM, Gibson RJ, et al. Trastuzumab induces gastrointestinal side effects in HER2-overexpressing breast cancer patients. Invest New Drugs. 2009;27(2):173-8. doi: https://doi.org/10.1007/s10637-008-9152-1
12. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2020: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2019 [acesso 2020 fev 6]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/estimativa-2020-incidencia-de-cancer-no-brasil.pdf
13. Trazimera® (trastuzumabe) [bula na Internet]. São Paulo: Wyeth Indústria Farmacêutica Ltda; 2021. Bula de remédio [acesso 2020 fev 6]. Disponível em: https://www.pfizer.com.br/sites/default/files/inline-files/Trazimera_440_mg_Profissional_de_Saude_10.0.pdf
14. MabThera® (rituximabe) [bula na Internet]. Rio de Janeiro: Roche; 2018. Bula de remédio [acesso 2020 fev 6]. Disponível em: https://dialogoroche.com.br/content/dam/roche-dialogo/dialogo-brazil-assets/downloadable-assets/produtos/bulas/mabthera/Mabthera_Bula_Profissionais_da_Saude.pdf
15. Velcade® (bortezomibe) [bula na Internet]. São Paulo: Janssen-Cilag Farmacêutica Ltda.; 2022. Bula de remédio [acesso 2020 mar 18]. Disponível em: https://www.janssen.com/brasil/sites/www_janssen_com_brazil/files/prod_files/live/velcade_pub_vps.pdf
16. Ministério da Saúde (BR), Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Pertuzumabe para o tratamento do câncer de mama HER2-positivo metastático em primeira linha de tratamento associado ao trastuzumabe e docetaxel. Brasília (DF): CONITEC; 2017 dez.
17. Schulz H, Bohlius J, Skoetz N, et al. Chemotherapy plus rituximab versus chemotherapy alone for B-cell non-Hodgkin's lymphoma. Cochrane Database Syst Rev. 2007;2007(4):CD003805. doi: https://doi.org/10.1002/14651858.CD003805.pub2
18. Vaz JP, Silva AHN, Navarro PLB, et al. Avaliação dos efeitos adversos e da sobrevida em pacientes com câncer de mama HER2 positivo tratados em hospital de referência em São Paulo, Brasil. UNILUS Ensino e Pesqui [Internet]. 2020 [acesso 2020 jun 8];17(46):61-70. Disponível em: http://revista.lusiada.br/index.php/ruep/article/view/1247/u2020v17n46e1247
19. Caetano R, Rodrigues PHA, Corrêa MCV, et al. O caso do eculizumabe: judicialização e compras pelo Ministério da Saúde. Rev Saúde Pública. 2020;54:22. doi: https://doi.org/10.11606/s1518-8787.2020054001693
20. Ferraz OLM. Para equacionar a judicialização da saúde no Brasil. Rev Direito GV. 2019;15(3):e1934. doi: https://doi.org/10.1590/2317-6172201934
21. Ministério da Saúde (BR), Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde. Departamento de Assistência Farmacêutica e Insumos Estratégicos. Relação Nacional de Medicamentos Essenciais: Rename 2020 [Internet]. Brasília (DF): Ministério da Saúde; 2019 [acesso 2020 jun 25]. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/relacao_medicamentos_rename_2020.pdf
22. Ministério da Saúde (BR), Consultoria Jurídica. Judicialização da Saúde no âmbito da União em números: recursos extraordinários 566471 e 657718 [Internet]. Brasília (DF): CONJUR/MS; 2017 maio [acesso 2020 jun 25]. Disponível em: https://www.gov.br/saude/pt-br/composicao/conjur/biblioteca-eletronica/apresentacoes/judicializacao-da-saude-no-ambito-da-unio-em-numeros-recursos-extraordinrios-566471-e-657718.pdf
23. Insper [Internet]. São Paulo: Insper; [data desconhecida]. Judicialização da saúde dispara e já custa R$1,3 bi à União; 2019 maio 24 [atualizado 2019 jul 18; acesso 2020 maio 19]. Disponível em: https://www.insper.edu.br/conhecimento/direito/judicializacao-da-saude-dispara-e-ja-custa-r-13-bi-a-uniao/
24. Lima EC, Sandes VS, Caetano R, et al. Incorporação e gasto com medicamentos de relevância financeira em hospital universitário de alta complexidade. Cad Saúde Coletiva. 2010;18(4).
25. Machado MAÁ, Acurcio FA, Brandão CMR, et al. Judicialização do acesso a medicamentos no Estado de Minas Gerais, Brasil. Rev Saúde Pública. 2011;45(3):590-8. doi: https://doi.org/10.1590/S0034-89102011005000015
26. Honorato S. Judicialização da política de assistência farmacêutica: discussão sobre as causas de pedir no Distrito Federal. Cad Ibero-Amer Dir Sanit. 2015;4(3):116-27. doi: https://doi.org/10.17566/ciads.v4i3.208
27. Barreto AAM, Guedes DM, Rocha Filho JA. A judicialização da saúde no Estado de Pernambuco: os antineoplásicos novamente no topo? Rev Dir Sanit. 2019;20(1):202-22. doi: https://doi.org/10.11606/issn.2316-9044.v20i1p202-222
Aprovado em 25/1/2022
Editor-associado: Mario Jorge Sobreira da Silva. Orcid iD: https://orcid.org//0000-0002-0477-8595
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde