ARTIGO ORIGINAL
Análise do Tempo para Início do Tratamento Oncológico no Brasil: Fatores Demográficos e Relacionados à Neoplasia
Analysis of the Time to Initiate Oncological Treatment in Brazil: Demographic and Related-To-The-Tumor Factors
Análisis del Tiempo de Inicio del Tratamiento Oncológico en Brasil: Factores Demográficos y Relacionados con la Neoplasia
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n3.2354
Glebson Santos Sobral1; Yuri Barbosa Araújo2; Simone Yuriko Kameo3; Glebson Moura Silva4; Dayane Ketlyn da Cunha Santos5; Lêda Leonôr Mendonça Carvalho6
1-6Universidade Federal de Sergipe (UFS). Lagarto (SE), Brasil.
1E-mail: glebsonsobral@academico.ufs.br. Orcid iD: https://orcid.org/0000-0002-3835-7916
2E-mail: yuribarbosa@academico.ufs.br. Orcid iD: https://orcid.org/0000-0002-1724-3637
3E-mail: simonekameo@hotmail.com. Orcid iD: https://orcid.org/0000-0002-0035-2415
4E-mail: glebsonmoura@yahoo.com.br. Orcid iD: https://orcid.org/0000-0002-4977-2787
5E-mail: daayketlyn27@gmail.com. Orcid iD: https://orcid.org/0000-0002-9312-4891
6E-mail: ledacaarvalho@hotmail.com. Orcid iD: https://orcid.org/0000-0003-3174-8575
Endereço para correspondência: Glebson Santos Sobral. UFS. Av. Gov. Marcelo Déda, s/n ‒ São José. Lagarto (SE), Brasil. CEP 49400-000. E-mail: glebsonsobral@academico.ufs.br
RESUMO
Introdução: É reservado a todo brasileiro com câncer, pela Lei dos 60 Dias, o direito de começar o tratamento em até dois meses. Todavia, estudos anteriores apontam a dificuldade dos pacientes em fazer valer essa normativa ao esbarrarem em problemáticas macroestruturais dos sistemas de saúde. Objetivo: Avaliar a influência de fatores demográficos e relacionados à neoplasia sobre o tempo para início do tratamento oncológico no Brasil. Método: Estudo seccional, desenvolvido com dados oriundos do PAINEL-Oncologia, uma base pública nacional, alimentada por diversas fontes de informação do Sistema Único de Saúde. Como variáveis de interesse, elegeram-se: a) tempo de tratamento; b) sexo; c) idade; d) diagnóstico; e) estadiamento; f) modalidade terapêutica. Então, foi analisado o tempo transcorrido entre o diagnóstico e o início do tratamento oncológico. Resultados: Percebeu-se aumento exponencial, ao longo dos anos, da proporção de casos tratados oportunamente, isto é, em até 60 dias, como regulamenta a Lei. Entretanto, ainda é considerável a prevalência de atrasos no início do tratamento, sobretudo entre indivíduos idosos, do sexo masculino, com cânceres em estádios menos avançados e que precisaram de radioterapia como primeira modalidade terapêutica. Além disso, o tempo de espera foi especialmente maior para os cânceres de órgãos genitais masculinos, de cabeça e pescoço e de mama. Conclusão: Alguns fatores demográficos e relacionados à neoplasia estão envolvidos no atraso do início da terapia oncológica.
Palavras-chave: neoplasias/epidemiologia; tempo para o tratamento; medidas em epidemiologia.
ABSTRACT
Introduction: According to the 60 Days Law, all Brazilians with cancer are entitled to start treatment within two months. However, previous studies point to the difficulty of patients in enforcing this regulation, by running into macro-structural problems in health systems. Objective: To assess the influence of demographic and cancer-related factors on the time elapsed to start cancer treatment in Brazil. Method: Cross-sectional study developed with data from PAINEL-Oncologia, a national public database, fed by different sources of information from the Sistema Único de Saúde [Brazilian public health system]. The following variables of interest were chosen: a) time of treatment; b) sex; c) age; d) diagnosis; e) staging; f) therapeutic modality. Then, the time elapsed between diagnosis and the start of cancer treatment was analyzed. Results: There was an exponential increase over the years in the proportion of cases treated in a timely manner, that is, within 60 days, as mandated by the Law. However, the prevalence of delays to start treatment is still considerable, especially among elderly, males, with cancers in less advanced stages and who needed radiotherapy as their first therapeutic modality. In addition, the waiting time was especially longer for male genitalia, head and neck, and breast cancers. Conclusion: Some demographic and neoplasia-related factors are involved in late beginning of oncological therapy.
Key words: neoplasms/epidemiology; time-to-treatment; epidemiologic measurements.
RESUMEN
Introducción: Según la Ley de los 60 Días, todos los brasileños con cáncer tienen derecho a comenzar el tratamiento dentro de dos meses. Sin embargo, estudios previos señalan la dificultad de los pacientes para hacer cumplir esta regulación, por encontrarse con problemas macroestructurales en los sistemas de salud. Objetivo: Evaluar la influencia de factores demográficos y relacionados con el cáncer sobre el tiempo para iniciar el tratamiento del cáncer en Brasil. Método: Estudio seccional, desarrollado con datos de PAINEL-Oncología, base de datos pública nacional, alimentada por diferentes fuentes de información del Sistema Único de Salud [sistema público de salud brasileño]. Como variables de interés se eligieron las siguientes: a) tiempo de tratamiento; b) sexo; c) edad; d) diagnóstico; e) estadificación; f) modalidad terapéutica. Luego, se analizó el tiempo transcurrido entre el diagnóstico y el inicio del tratamiento del cáncer. Resultados: Hubo un aumento exponencial a lo largo de los años en la proporción de casos atendidos oportunamente, es decir, dentro de los 60 días, según lo que regula la Ley. Sin embargo, la prevalencia de retrasos en el inicio del tratamiento sigue siendo considerable, especialmente entre los hombres, ancianos, con cánceres en estadios menos avanzados y que necesitaron de radioterapia como primera modalidad terapéutica. Además, el tiempo de espera fue especialmente mayor para los cánceres de genitales masculinos, de cabeza y cuello y de mama. Conclusión: Algunos factores demográficos y relacionados con la neoplasia intervienen en el retraso del inicio del tratamiento del cáncer.
Palabras-clave: neoplasias/epidemiología; tiempo de tratamiento; mediciones epidemiológicas.
INTRODUÇÃO
O câncer é reconhecido como uma doença crônica prevenível1. Mundialmente, é a segunda maior causa de morte, atrás apenas das doenças cardiovasculares2. Para o Brasil, estimam-se 625 mil novos casos para cada ano do triênio 2020-2022, sendo o câncer de pele não melanoma o tipo mais incidente (177 mil), seguido pelas neoplasias de mama (66 mil), próstata (66 mil), cólon e reto (41 mil), pulmão (30 mil) e estômago (21 mil)3.
Embora os países desenvolvidos contabilizem metade dos casos de câncer globalmente, representam apenas 30% das mortes e 23% dos anos potenciais de vida perdidos2. Nesse sentido, uma investigação epidemiológica conduzida na Malásia revelou que 50% a 88% das mortes por câncer de mama seriam evitáveis mediante diagnóstico precoce e acesso ideal ao tratamento4. As disparidades socioeconômicas mais pujantes, características dos países em desenvolvimento, favorecem o pior desfecho das neoplasias malignas nesses contextos.
A Lei n.º 12.732, de 22 de novembro de 20125, confere aos brasileiros com diagnóstico confirmado de câncer o direito de iniciarem o tratamento em até 60 dias. Posteriormente, outros dispositivos complementaram essa “Lei dos 60 Dias”, como é hoje conhecida, instituindo, também, o prazo de um mês para a realização de exames diagnósticos comprobatórios e a obrigatoriedade da notificação de casos de câncer em todo território nacional6,7.
Contudo, várias pesquisas, desenvolvidas em diferentes Regiões do país, revelam que o tempo entre o diagnóstico e o início do tratamento supera, consideravelmente, aquele estipulado na Lei dos 60 Dias. Entre 2012 e 2014, no Distrito Federal, mulheres com câncer de mama precisaram esperar, em média, 211,8 dias para iniciar a terapia8. Já no Amazonas, em 2016, a mediana de tempo de espera foi de 111 dias para diversos grupos de neoplasia9. Outrossim, segundo revisão integrativa recente, a grande maioria dos pacientes não consegue iniciar o tratamento antes de três meses10.
Nesse sentido, Sacramento et al.11, ao estudarem os casos de câncer de próstata atendidos em um hospital de referência do Espírito Santo, antes e depois da promulgação dessa Lei5, não encontraram qualquer impacto do regimento sobre o tempo entre o diagnóstico e o início do tratamento naquela instituição.
Alguns fatores sociodemográficos estão associados a esse atraso no início do tratamento e parecem se repetir entre os diferentes tipos de câncer, refletindo problemáticas na macroestrutura dos sistemas de saúde. Indivíduos negros, com baixo nível socioeconômico e educacional, residentes em áreas não metropolitanas e sem plano de saúde, estão propensos a demorar mais para receber o diagnóstico e para iniciar o tratamento de diversas neoplasias12-15.
Ainda são escassos os estudos de abrangência nacional, pela anterior ausência de uma ferramenta que possibilitasse tal análise. Para suprir essa demanda, o PAINEL-Oncologia16 foi disponibilizado em maio de 2019. Substitui o antigo “módulo tratamento”, acoplado ao Sistema de Informação do Câncer (Siscan), e reúne, em uma única base, dados de casos de neoplasias do Brasil inteiro.
Essas informações são oriundas dos Sistemas de Informação em Saúde (SIS) empregados no Sistema Único de Saúde (SUS) e, portanto, não se referem à incidência de câncer no país como um todo. Ainda assim, o PAINEL-Oncologia representa uma importante ferramenta para a gestão, possibilitando o aumento expressivo dos casos captados e da qualidade das informações, à medida que reúne e refina dados conflitantes e complementares em um único sistema17.
Diante disso, este estudo busca analisar a influência de fatores demográficos e relacionados à neoplasia sobre o tempo transcorrido desde o diagnóstico até o início do tratamento oncológico no Brasil.
Projetou-se identificar alguns dos fatores implicados em atraso no início do tratamento oncológico no Brasil. Para isso, um estudo seccional foi conduzido, com a casuística extraída do PAINEL-Oncologia16, banco de dados público, que congrega informações de diferentes SIS/SUS e que permite fazer relatórios sobre o intervalo entre as datas do diagnóstico e do primeiro tratamento de cânceres no Brasil17. Dessa forma, os dados retirados desse banco representam apenas uma parcela do total de casos no país, referente, exclusivamente, àqueles disponíveis nos diferentes SIS.
A definição de caso, utilizada pelo PAINEL-Oncologia, é feita a partir da combinação do Cartão Nacional de Saúde (CNS) com a décima edição da Classificação Internacional de Doenças e Problemas Relacionados à Saúde (CID-10)18 informada. Desse modo, um mesmo CNS com mais de uma CID representa casos diferentes17. Todos os dados foram coletados durante o mês de fevereiro de 2021 e inicialmente tabulados em duplicata, por dois pesquisadores distintos, no pacote estatístico Epi Info 2000 do Centers for Disease Control and Prevention, que permite a análise da sua consistência. Foram reunidos os casos com informação sobre diagnóstico no período de 2013 a 2020, sendo o local-objeto deste estudo todas as Regiões do Brasil.
As seguintes variáveis de interesse foram selecionadas: a) tempo até o tratamento; b) sexo ‒ masculino e feminino; c) idade; d) diagnóstico; e) modalidade terapêutica ‒ cirurgia, quimioterapia, radioterapia; e ambas (quimioterapia e radioterapia); f) estadiamento ‒ 0, I, II, III, IV; e “não se aplica” para os que foram tratados por cirurgia, dada a natureza dos bancos que geram o PAINEL-Oncologia17. Posteriormente, a variável “tempo até o tratamento” teve suas categorias dicotomizadas – para melhor atender aos objetivos desta pesquisa e à análise de conformidade com a Lei n.º 12.732/125 – em ≤ 60 dias (tempo oportuno) e > 60 dias (tempo inoportuno). Além disso, a variável “diagnóstico” que se refere à neoplasia informada ao exame anatomopatológico (CID-10: C00-D48) foi categorizada em: “neoplasias malignas” (C00-C97, exceto pelas duas exceções, C44 e C73, referidas na Lei ‒ outras neoplasias malignas da pele e neoplasia maligna da glândula tireoide, respectivamente); “neoplasias in situ” (D00-D09); e “neoplasias de comportamento incerto ou desconhecido” (D37-D48)19.
Os critérios de exclusão utilizados foram: casos sem informação sobre o tempo até o início do tratamento, casos que tiveram tempo de início do tratamento anterior ao diagnóstico (tempo negativo), bem como ausência de informação sobre as variáveis de exposição.
Foram elaborados gráficos de série histórica para avaliar a mudança na distribuição de casos tratados em tempo oportuno apenas para as neoplasias malignas, já que estas representam a quase totalidade dos casos inseridos na análise, bem como pelo fato de as outras neoplasias (D00-D09 e D37-D48) terem apresentado elevadas proporções de tratamento em tempo oportuno durante todo o período analisado.
Em seguida, realizou-se uma análise descritiva dos dados por meio da distribuição das variáveis na população de estudo. Por se tratarem de variáveis categóricas, foram calculadas proporções, sendo a comparação entre os grupos realizada pelos testes do qui-quadrado de Pearson. Uma vez que a razão de chances (RC), quando o desfecho analisado é comum, pode superestimar ou subestimar a força da associação em estudos transversais, a razão de prevalências (RP) deve ser preferida nessas situações20,21. Francisco et al.22 também afirmam que a RP parece mais apropriada para analisar subgrupos do que a RC.
Dessa forma, tendo em vista o desenho do estudo, foram estimadas as RP brutas, com seus respectivos intervalos de confiança de 95% (IC95%) e consideradas estatisticamente significativas aquelas com p<0,05 pelo teste χ² de Wald. Todas as análises foram realizadas com o software Statistical Package for Social Sciences (SPSS), versão 20.0.
Por se tratar de pesquisa com dados públicos de fonte secundária, o estudo não foi submetido a um Comitê de Ética em Pesquisa. Todavia, atendeu aos princípios vigentes da Resolução nº. 46623 do Conselho Nacional de Saúde de 2012. Ademais, reitera-se que os dados não possuem identificadores pessoais dos casos, contendo apenas informações de interesse à Saúde Coletiva.
RESULTADOS
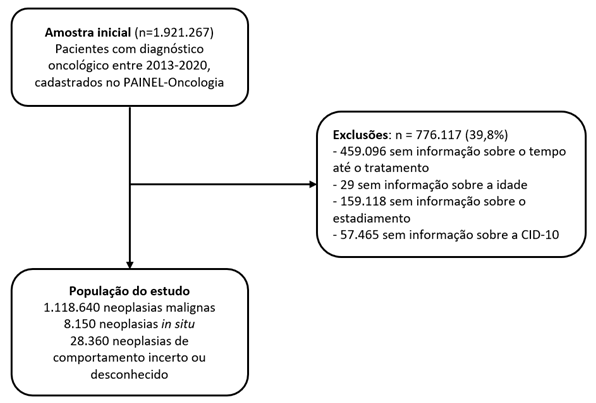
Entre o total de 1.921.267 casos de câncer oriundos do PAINEL-Oncologia16, 776.117 foram excluídos pelos motivos descritos na Figura 1. Do total de casos restantes, 1.118.640 (96,8%) correspondiam a diagnósticos regulamentados pela Lei n.º 12.732/125.
|
|
|
Figura 1. Fluxograma dos casos de neoplasia incluídos e excluídos do estudo, 2013-2020, Brasil |
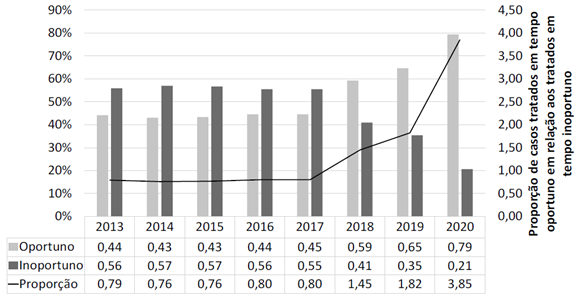
Até 2017, a distribuição proporcional de casos que foram tratados em até 60 dias permaneceu praticamente estável e inferior aos que não foram tratados até esse mesmo prazo. A partir de então, essa relação se tornou gradativamente favorável ao tratamento oportuno, até chegar a ser 3,85 vezes maior (oportuno/inoportuno) no ano de 2020 (Gráfico 1).
|
|
|
Gráfico 1. Distribuição relativa dos casos de neoplasias malignas registradas no PAINEL-Oncologia, 2013-2020, Brasil |
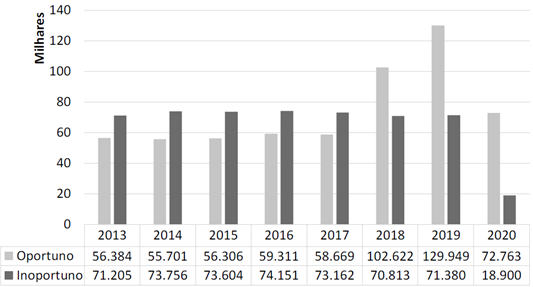
A queda absoluta de casos tabulados no PAINEL-Oncologia16 observada no biênio 2019-2020 sugere que os casos deste último ano podem ainda não estar consolidados no banco de dados (Gráfico 2).
|
|
|
Gráfico 2. Distribuição absoluta dos casos de neoplasias malignas registradas no PAINEL-Oncologia, 2013-2020, Brasil |
Como pode ser visto na Tabela 1, ao considerar todos os tipos de neoplasias inseridas (n=1.155.150), observou-se uma menor prevalência em relação às neoplasias malignas com tratamento iniciado em tempo oportuno, comparadas às demais neoplasias: neoplasias in situ e neoplasias de comportamento incerto ou desconhecido. Ao considerar a população de interesse, isto é, apenas as neoplasias malignas, foi encontrada uma associação negativa entre o sexo masculino e o tratamento oncológico oportuno.
|
Tabela 1. Variáveis relacionadas ao tratamento de pacientes com neoplasia maligna. PAINEL-Oncologia, 2013-2020, Brasil |
|||||
|
Variável |
n (%) |
Prevalência de tratamentos oportunos (%) |
RP (IC95%) |
Valor de p |
|
|
Diagnóstico (n=1.155.150) |
|
|
|
<0,001 |
|
|
Outras neoplasiasa |
36.510 (3,2%) |
99,0% |
1,0 |
|
|
|
Neoplasias malignas |
1.118.640 (96,8%) |
52,9% |
0,535 (0,533-0,536) |
|
|
|
Ano do diagnóstico (n=1.118.640)b |
|
|
|
<0,001 |
|
|
2013-2014 |
257.010 (23,0%) |
43,6% |
1,0 |
|
|
|
2015-2016 |
263.372 (23,5%) |
43,9% |
1,007 (1,002-1,012) |
|
|
|
2017-2018 |
305.266 (27,3%) |
52,8% |
1,212 (1,205-1,219) |
|
|
|
2019-2020 |
292.992 (26,2%) |
69,2% |
1,587 (1,579-1,595) |
|
|
|
Sexo (n=1.118.640)b |
|
|
|
<0,001 |
|
|
Feminino |
584.130 (52,2%) |
56,1% |
1,0 |
|
|
|
Masculino |
534.510 (47,8%) |
52,4% |
0,934 (0,931-0,937) |
|
|
|
Idade (n=1.118.640)b |
|
|
|
<0,001 |
|
|
< 20 anos |
20.025 (1,8%) |
84,0% |
1,0 |
|
|
|
20-59 anos |
503.861 (45,0%) |
57,7% |
0,687 (0,683-0,691) |
|
|
|
≥ 60 anos |
594.754 (53,2%) |
50,8% |
0,605 (0,601-0,609) |
|
|
|
Primeira modalidade terapêutica (n=1.118.640)b |
|
|
|
<0,001 |
|
|
Quimioterapia |
616.084 (55,1%) |
49,3% |
1,0 |
|
|
|
Radioterapia |
223.745 (20,0%) |
30,8% |
0,625 (0,620-0,629) |
|
|
|
Quimioterapia + radioterapia |
14.083 (1,3%) |
37,8% |
0,768 (0,752-0,785) |
|
|
|
Cirurgia |
264.728 (23,7%) |
80,8% |
1,640 (1,635-1,646) |
|
|
|
Estadiamento (n=1.118.640)b |
|
|
|
<0,001 |
|
|
0 |
53.474 (4,8%) |
49,0% |
1,0 |
|
|
|
I |
97.507 (8,7%) |
37,0% |
0,754 (0,746-0,764) |
|
|
|
II |
191.345 (17,1%) |
35,8% |
0,730 (0,722-0,738) |
|
|
|
III |
247.491 (22,1%) |
45,4% |
0,927 (0,918-0,936) |
|
|
|
IV |
264.095 (23,6%) |
50,9% |
1,040 (1,030-1,050) |
|
|
|
Não se aplica |
264.728 (23,7%) |
83,0% |
1,649 (1,635-1,664) |
|
|
|
Diagnóstico específico (n=1.118.640)b |
CID-10 |
|
|
|
<0,001 |
|
Total |
C00-C97 |
1.118.640 (100%) |
52,9% |
1,0 |
|
|
Dos órgãos genitais masculinos |
C60-C63 |
181.831 (16,3%) |
35,2% |
0,665 (0,661-0,669) |
|
|
Do lábio, cavidade oral e faringe |
C00-C14 |
93.470 (8,4%) |
43,6% |
0,825 (0,818-0,831) |
|
|
Da mama |
C50 |
236.262 (21,1%) |
46,6% |
0,881 (0,877-0,885) |
|
|
Dos órgãos genitais femininos |
C51-58 |
128.554 (11,5%) |
51,3% |
0,970 (0,964-0,975) |
|
|
Melanoma |
C43 |
12.670 (1,1%) |
57,8% |
1,092 (1,076-1,109) |
|
|
Dos órgãos digestivos |
C15-26 |
228.382 (20,4%) |
58% |
1,096 (1,092-1,100) |
|
|
Do aparelho respiratório e dos órgãos intratorácicos |
C30-39 |
90.299 (8,1%) |
66,1% |
1,249 (1,243-1,255) |
|
|
Do tecido mesotelial e tecidos moles |
C45-49 |
25.774 (2,3%) |
67,9% |
1,284 (1,273-1,295) |
|
|
Dos ossos e das cartilagens articulares |
C40-41 |
10.498 (0,9%) |
69,5% |
1,314 (1,297-1,331) |
|
|
Dos tecidos linfático, hematopoético e tecidos correlatos |
C81-C96 |
53.191 (4,8%) |
70,2% |
1,326 (1,319-1,334) |
|
|
Do trato urinário |
C64-C68 |
31.345 (2,8%) |
76,6% |
1,448 (1,439-1,458) |
|
|
Dos olhos, do encéfalo e de outras partes do sistema nervoso central |
C69-C72 |
5.023 (0,4%) |
88,6% |
1,675 (1,658-1,692) |
|
|
De outras glândulas endócrinas |
C74-C75 |
528 (<0,1%) |
97,5% |
1,844 (1,819-1,869) |
|
|
De localizações mal definidas, secundárias e de localizações não especificadas |
C76-C80 |
20.808 (1,9%) |
98,2% |
1,857 (1,853-1,862) |
|
|
De localizações múltiplas independentes |
C97 |
5 (<0,1%) |
100% |
1,891 (1,887-1,894) |
|
|
Legendas: RP = razão de prevalência; IC95% = intervalo de confiança de 95%; CID-10 = décima edição da Classificação Internacional de Doenças e Problemas Relacionados à Saúde. Nota: (a) neoplasias in situ (n=8.150) e neoplasias de comportamento incerto ou desconhecido (n=28.360); (b) avaliados apenas os casos de neoplasias malignas regulamentados pela Lei n.º 12.732/12. |
|||||
Constatou-se, ainda, que os adultos e principalmente os idosos tiveram menores RP de início oportuno comparados à população mais jovem.
Em relação à modalidade do primeiro tratamento, foram encontradas maiores prevalências de tratamento oportuno nos encaminhamentos à cirurgia, comparada à quimioterapia. Em contrapartida, as menores prevalências de tratamento oportuno foram as de quimioterapia associada à radioterapia e, sobretudo, as de radioterapia isolada.
No que tange ao estadiamento da doença, notou-se que o tratamento oportuno esteve negativamente associado aos estágios iniciais e que o grau de associação tende a positivar com estágios mais tardios.
Quanto ao início da série histórica, a partir da vigência da Lei n.º 12.732/125, os biênios apresentaram gradativamente associações mais positivas, em especial o biênio mais recente, 2019-2020.
No que se refere aos tipos de neoplasias malignas, analisados por grupos, conforme a CID-1018, verificou-se uma associação negativa entre o início oportuno do tratamento e as seguintes neoplasias malignas: C60-C63, dos órgãos genitais masculinos; C00-C14, do lábio, cavidade oral e faringe; C50, da mama; e C51-C58, dos órgãos genitais femininos. Em contrapartida, para as demais neoplasias malignas, foi encontrada uma associação positiva com o tratamento oportuno.
DISCUSSÃO
O aumento expressivo dos casos, a partir de 2018, deve-se, muito provavelmente, à Portaria n.º 64324, daquele mesmo ano, que instituiu a obrigatoriedade dos campos CNS e CID-10 no registro de procedimentos anatomopatológicos. Em função dessa pressão legal pelo monitoramento do tempo de tratamento, houve um importante avanço nas informações diagnósticas disponíveis no banco de dados em relação ao período anterior, visto que apenas os cânceres de mama e do colo do útero possuíam os campos citados como obrigatórios no Siscan. Apesar dos esforços contínuos de resgate, muitas informações anteriores a 2018 não foram recuperadas17.
A exérese de massas superficiais e pequenas de tecidos moles, especialmente aquelas com menos de 5 cm de diâmetro, é uma prática comum em centros não especializados em razão da presunção de não malignidade dessas lesões25. Posteriormente, o diagnóstico é estabelecido com exame anatomopatológico, e esses casos são registrados no PAINEL-Oncologia, dentro do intervalo de tempo de 0 a 30 dias, tendo a cirurgia de exérese como modalidade do primeiro tratamento17,19. Isso pode explicar, em parte, por que as neoplasias não malignas tiveram maior chance de receber tratamento oportuno.
Em consonância com o escopo da Lei dos 60 Dias e, por extensão, com o objetivo deste artigo, os achados discutidos a seguir referem-se apenas a neoplasias malignas5.
De acordo com os resultados deste estudo, o sexo feminino apresentou maior prevalência de tratamento oportuno. Embora isso tenha sido corroborado por estudos anteriores9,26, as diferenças de tempo entre os sexos são mais pujantes no período anterior ao diagnóstico, em que os homens tendem a negligenciar mais os sintomas e postergar a procura por atendimento médico, em virtude de um modelo de masculinidade idealizada, no qual se associa a figura masculina à resistência a doenças e ao menor cuidado de si13,27,28.
Quanto à faixa etária, os pacientes com mais de 60 anos apresentam a menor prevalência de tratamento oportuno. Isso se deve, em parte, à percepção reduzida dos idosos quanto à seriedade de suas condições de saúde, bem como pelo medo que sucede o diagnóstico de um câncer29. Além disso, comorbidades são mais frequentes nessa população, o que demanda uma avaliação clínica mais cuidadosa e demorada antes da instalação da terapia oncológica30.
Como apontado anteriormente, outras variáveis sociodemográficas estão envolvidas no atraso no início do tratamento, como a raça negra, níveis socioeconômico e educacional mais baixos, falta de plano de saúde e residência em área não metropolitana11-15. Todavia, como o PAINEL-Oncologia não disponibiliza essas variáveis, sua análise foge ao escopo deste estudo.
Os tumores de localização múltipla independente e aqueles com estadiamento 4 tiveram maiores chances de receber tratamento oportuno. Em decorrência da incapacidade do sistema de saúde em absorver todos os pacientes, os portadores de neoplasia mais avançada e sintomática recebem prioridade para iniciar o tratamento31. Idealmente, essa sobrecarga do sistema, característica dos países latino-americanos, pode ser diminuída mediante programas bem estabelecidos de diagnóstico precoce e rastreamento, que reduzem a mortalidade ao possibilitar a detecção dos tumores em estágios iniciais15,32.
Quanto à modalidade do primeiro tratamento, identificou-se que a cirurgia teve maior chance de ocorrer oportunamente. Isso pode decorrer do maior acesso a esse tipo de terapia, por causa da habilitação de alguns hospitais gerais para ofertar cirurgias oncológicas, sendo reconhecido o menor tempo de espera nesses serviços em relação aos de alta complexidade1,15,33. Também é preciso lembrar que alguns diagnósticos são firmados posteriormente à primeira intervenção, isto é, quando há coleta de material durante a cirurgia, seguida de avaliação histopatológica para confirmação de malignidade16,17. Esse fato certamente contribui para o achado.
Por outro lado, a radioterapia, tanto em associação à quimioterapia quanto isoladamente, foi a modalidade com menor prevalência de tratamentos oportunos. Essas terapêuticas dependem de encaminhamentos para centros de referência, os quais, geralmente, apresentam grande volume de atendimentos e procedimentos a serem realizados, acarretando atrasos no início da terapia15,33.
No que se refere ao tipo de câncer, verificou-se que as neoplasias dos órgãos genitais masculinos tiveram o pior desempenho quanto ao tempo decorrido entre o diagnóstico e o início do tratamento. Esse fato é influenciado pela heterogeneidade das condutas frente ao câncer de próstata. Em razão da história natural geralmente indolente, extensa literatura defende a estratégia de vigilância ativa, que consiste no monitoramento do comportamento de tumores prostáticos de baixo risco, com reavaliação periódica da necessidade de tratamento definitivo34-36. Assim, o tempo para início do tratamento pode ser prolongado, em muitos casos, sem que isso represente piora nas taxas de sobrevida dos pacientes37. Ademais, especificamente para esse grupo de neoplasias, há de se destacar a apreensão que antecede o tratamento, pelo temor de terapias dolorosas e de possíveis mudanças na imagem corporal. No âmbito individual, isso também acarreta atraso no início do tratamento28,38.
O segundo grupo de neoplasias com maior tempo de início de tratamento, nesta pesquisa, foi o dos cânceres de cabeça e pescoço. Isso está de acordo com análises epidemiológicas anteriores, que encontraram um tempo de espera médio de 12 semanas, independente da modalidade terapêutica adotada39. Por causa da localização difícil e do estágio avançado, geralmente encontrados nesses tipos de tumores, é recomendável que o tratamento seja estabelecido no menor tempo, sem comprometimento da qualidade da assistência prestada40. Todavia, são precisamente os aspectos relacionados à qualidade assistencial os principais fatores de atraso no início do tratamento do câncer de cabeça e pescoço. A solicitação e a análise de exames diagnósticos adicionais, o aumento dos encaminhamentos interdisciplinares, bem como a expansão das opções terapêuticas e o refinamento das técnicas utilizadas, exigindo maior preparação da equipe, são entraves que vêm prejudicando o início oportuno do tratamento a despeito dos avanços proporcionados39,41-43.
Finalmente, o câncer de mama merece destaque, uma vez que, em número absoluto de casos não tratados antes dos 60 dias, supera os dois primeiros grupos de neoplasia supracitados. Como acontece com os cânceres de cabeça e pescoço, procedimentos mais complexos, necessários conforme o caso, requerem avaliação pré-operatória mais detalhada e coordenação de diferentes equipes, como mastologia, cirurgia plástica e medicina nuclear43,44. No caso do câncer de mama, testes genéticos são geralmente aplicados, como ferramenta preditiva e prognóstica, para avaliar os benefícios da quimioterapia diante do risco de recorrência45. A depender do tipo histopatológico encontrado, exames de imagem mais sensíveis e biópsias de lesões secundárias são necessários para guiar o plano cirúrgico46. Tudo isso impacta no tempo global decorrido desde a definição diagnóstica até o início do tratamento.
Ainda assim, pesquisa conduzida em instituição de referência no Estado de Espírito Santo encontrou tempo de tratamento oportuno para mulheres diagnosticadas com câncer de mama, com uma mediana de 44 dias até o estabelecimento da primeira terapia, além de importante acréscimo no número total de pacientes que iniciaram o tratamento em até 60 dias47. Há, portanto, serviços brasileiros que estão conseguindo efetivar os prazos estipulados na Lei n.º 12.732/125, apesar de não serem a maioria, a julgar pela literatura consultada.
Este estudo apresenta uma série de limitações. A primeira delas é a perda de dados pelos SIS/SUS, que não são interligados, impactando bancos de dados por eles alimentados, como o PAINEL-Oncologia17. Outrossim, a carência de publicações com base nas informações do PAINEL-Oncologia dificulta a comparação dos resultados, ainda que os achados dessa investigação sejam consistentes com a epidemiologia descrita na literatura. Contudo, o elevado grau de heterogeneidade da população estudada é um aspecto positivo deste estudo, o que permite bom grau de comparabilidade com populações de perfil semelhante ao brasileiro.
Em virtude da elevada frequência de associações estatisticamente significantes, com IC95% estreitos, mesmo quando as RP entre a exposição e o desfecho eram fracas, por causa da casuística robusta, optou-se por não realizar análise ajustada por meio da regressão de Poisson com variância robusta, já que todas as variáveis seriam inseridas na análise e, de maneira enviesada, permaneceriam no modelo final.
Ao analisar o tempo entre o diagnóstico e o início do tratamento oncológico no Brasil, entre os pacientes atendidos no SUS, percebeu-se um aumento exponencial, ao longo dos anos, da proporção de casos tratados oportunamente, isto é, em até 60 dias, como regulamenta a Lei n.º 12.732/12. Entretanto, ainda é considerável a prevalência de atrasos no início do tratamento, particularmente entre indivíduos idosos, do sexo masculino e com cânceres em estádios menos avançados. Também se verificou menor prevalência de tratamentos oportunos quando os pacientes precisaram de radioterapia como primeira modalidade terapêutica. Além disso, os cânceres de órgãos genitais masculinos, de cabeça e pescoço e de mama estiveram mais associados ao atraso no início do tratamento oncológico.
Em função do constante monitoramento do tempo entre o diagnóstico e o primeiro tratamento, é provável que a utilização do PAINEL-Oncologia fomente a qualificação dos dados dos SIS/SUS que o alimentam, resultando em melhoria contínua das informações para a própria ferramenta. Consequentemente, os gestores poderão basear-se em análises como esta para guiar as políticas de saúde que melhor interfiram na realidade do tratamento oncológico no Brasil, reduzindo o tempo de espera.
CONTRIBUIÇÕES
Todos os autores contribuíram substancialmente na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados, assim como na redação e revisão crítica e aprovaram a versão final a ser publicada.
AGRADECIMENTOS
À Coordenação de Pesquisa (Copes) da UFS pela aprovação do Projeto de Iniciação Científica, do qual este artigo é fruto.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
1. Ministério da Saúde (BR), Gabinete do Ministro. Portaria nº 874, de 16 de maio de 2013. Institui a Política Nacional para a Prevenção e Controle do Câncer na Rede de Atenção à Saúde das Pessoas com Doenças Crônicas no âmbito do Sistema Único de Saúde (SUS) [Internet]. Diário Oficial da União, Brasília, DF. 2013 maio 17 [acesso 2021 ago 20]; Seção 1:129. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/gm/2013/prt0874_16_05_2013.html
2. Global Burden of Disease Cancer Collaboration. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 1990 to 2017: a systematic analysis for the Global Burden of Disease Study. JAMA Oncol 2019;5(12):1749-68. doi: https://doi.org/10.1001/jamaoncol.2019.2996
3. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2020: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2019 [acesso 2021 ago 20]. Disponível em: https://www.inca.gov.br/publicacoes/livros/estimativa-2020-incidencia-de-cancer-no-brasil
4. Ho GF, Taib NA, Pritam Singh RK, et al. What if all patients with breast cancer in Malaysia have access to the best available care: how many deaths are avoidable? Glob J Health Sci. 2017;9(8):32-9. doi: https://doi.org/10.5539/gjhs.v9n8p32
5. Ministério da Saúde (BR). Lei nº 12.732, de 22 de novembro de 2012. Dispõe sobre o primeiro tratamento de paciente com neoplasia maligna comprovada e estabelece prazo para seu início [Internet]. Diário Oficial da União, Brasília, DF. 2012 nov 23 [acesso 2021 ago 20]; Seção 1:1. Disponível em: http://www.planalto.gov.br/ccivil_03/_ato2011-2014/2012/lei/l12732.htm
6. Presidência da República (BR). Lei nº 13.685, de 25 de junho de 2018. Altera a Lei nº 12.732, de 22 de novembro de 2012, para estabelecer a notificação compulsória de agravos e eventos em saúde relacionados às neoplasias, e a Lei nº 12.662, de 5 de junho de 2012, para estabelecer a notificação compulsória de malformações congênitas [Internet]. Diário Oficial da União, Brasília, DF. 2018 jun. 26 [acesso 2021 ago 20]; Seção 1:1. Disponível em: http://www.planalto.gov.br/ccivil_03/_Ato2015-2018/2018/Lei/L13685.htm
7. Presidência da República (BR). Lei nº 13.896, de 30 de outubro de 2019. Altera a Lei nº 12.732, de 22 de novembro de 2012, para que os exames relacionados ao diagnóstico de neoplasia maligna sejam realizados no prazo de 30 (trinta) dias, no caso em que especifica [Internet]. Diário Oficial da União, Brasília, DF. 2019 out 31 [acesso 2021 ago 20]; Seção 1:1. Disponível em: http://www.planalto.gov.br/ccivil_03/_Ato2019-2022/2019/Lei/L13896.htm
8. Barros AF, Araújo JM, Murta-Nascimento CM, et al. Clinical pathways of breast cancer patients treated in the Federal District, Brazil. Rev Saúde Pública. 2019;53:14. doi: https://doi.org/10.11606/S1518-8787.2019053000406
9. Rodrigues AS, Alencar LCFS, Branco VRMC. Efetividade da Lei nº 12.732/2012 na assistência às neoplasias malignas e sua associação com a mortalidade no Estado do Amazonas. REDES. 2020;8(1):49-61. doi: http://doi.org/10.18316/REDES.v8i1.5895
10. Lombardo MS, Popim RC. Acesso do paciente à rede oncológica na vigência da “Lei dos Sessenta Dias”: revisão integrativa. Rev Bras Enferm. 2020;73(5):e20190406. doi: https://doi.org/10.1590/0034-7167-2019-0406
11. Sacramento RS, Simião LJ, Viana KCG, et al. Association of sociodemographic and clinical variables with time to start prostate cancer treatment. Ciênc Saúde Coletiva. 2019;24(9):3265-74. doi: https://doi.org/10.1590/1413-81232018249.31142017
12. Attalla K, Paulucci DJ, Blum K, et al. Demographic and socioeconomic predictors of treatment delays, pathologic stage, and survival among patients with penile cancer: a report from the National Cancer Database. Urologic Oncology. 2018;36(1):4.e17-14.e24. doi: https://doi.org/10.1016/j.urolonc.2017.09.014
13. Bhatia RK, Rayne S, Rate W, et al. Patient factors associated with delays in obtaining cancer care in Botswana. J Glob Oncol. 2018;4:1-13. doi: https://doi.org/10.1200/JGO.18.00088
14. Reeder-Hayes KE, Mayer SE, Olshan AF, et al. Race and delays in breast cancer treatment across the care continuum in the Carolina Breast Cancer Study. Cancer. 2019;125(22):3985-92. doi: https://doi.org/10.1002/cncr.32378
15. Medeiros GC, Teodózio CGC, Fabro EAN, et al. Fatores associados ao atraso entre o diagnóstico e o início do tratamento de câncer de mama: um estudo de coorte com 204.130 casos no Brasil. Rev Bras Cancerol. 2020;66(3):e-09979. doi: https://doi.org/10.32635/2176-9745.RBC.2020v66n3.979
16. PAINEL-Oncologia [Internet]. Brasília (DF): DATASUS. [data desconhecida] - [atualizado 2022 abr 15; acesso 2020 set 4]. Disponível em: http://tabnet.datasus.gov.br/cgi/dhdat.exe?PAINEL_ONCO/PAINEL_ONCOLOGIABR.def
17. Atty ATM, Jardim BC, Dias MBK, et al. PAINEL-Oncologia: uma ferramenta de gestão. Rev Bras Cancerol. 2020;66(2):e-04827. doi: https://doi.org/10.32635/2176-9745.RBC.2020v66n2.827
18. Organização Mundial da Saúde. CID-10: Classificação Estatística Internacional de Doenças e problemas relacionados à saúde. São Paulo: Edusp; 2008.
19. Nota Técnica: painel de monitoramento de tratamento oncológico: PAINEL-Oncologia. Brasília (DF): DATASUS; [2013] [acesso 2021 ago 20]. Disponível em: http://tabnet.datasus.gov.br/cgi/painel_onco/doc/painel_oncologia.pdf
20. Zocchetti C, Consonni D, Bertazzi PA. Relationship between prevalence rate ratios and odds ratios in cross-sectional studies. Int J Epidemiol. 1997;26(1):220-3. doi: https://doi.org/10.1093/ije/26.1.220
21. Thompson ML, Myers JE, Kriebel D. Prevalence odds ratio or prevalence ratio in the analysis of cross sectional data: what is to be done? Occup Environ Med. 1998;55(4):272-7. doi: https://doi.org/10.1136/oem.55.4.272
22. Francisco PMSB, Donalisio MR, Barros MBA, et al. Medidas de associação em estudo transversal com delineamento complexo: razão de chances e razão de prevalência. Rev Bras Epidemiol. 2008;11(3):347-55. doi: https://doi.org/10.1590/S1415-790X2008000300002
23. Conselho Nacional de Saúde (BR). Resolução nº 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos [Internet]. Diário Oficial da União, Brasília, DF. 2013 jun 13 [acesso 2020 set 4]; Seção 1:59. Disponível em: https://conselho.saude.gov.br/resolucoes/2012/Reso466.pdf
24. Ministério da Saúde (BR), Secretaria de Atenção à Saúde. Portaria n.º 643, de 17 de maio de 2018. Altera atributos do procedimento da Tabela de Procedimentos, Medicamentos, Órteses/Próteses e Materiais Especiais do SUS [Internet]. Diário Oficial da União, Brasília, DF; 2018 maio 21 [acesso 2021 ago 20]; Seção I:71. Disponível em: https://pesquisa.in.gov.br/imprensa/jsp/visualiza/index.jsp?data=21/05/2018&jornal=515&pagina=71
25. Khoo M, Pressney I, Hargunani R, et al. Small, superficial, indeterminate soft-tissue lesions as suspected sarcomas: is primary excision biopsy suitable? Skeletal Radiol. 2017;46(7):919-24. doi: https://doi.org/10.1007/s00256-017-2635-4
26. Lima MAN, Villela DAM. Fatores sociodemográficos e clínicos associados ao tempo para o início do tratamento de câncer de cólon e reto no Brasil, 2006-2015. Cad Saúde Pública. 2021;37(5):e00214919. doi: https://doi.org/10.1590/0102-311X00214919
27. Modesto AAD, Lima RLB, D’Angelis AC, et al. Um novembro não tão azul: debatendo rastreamento de câncer de próstata e saúde do homem. Interface 2018;22(64):251-62. doi: https://doi.org/10.1590/1807-57622016.0288
28. Neto AJM, Granado LC, Salles RJ. A compreensão das atitudes diante do diagnóstico de câncer de próstata no processo psicodiagnóstico interventivo. Rev SBPH [Internet] 2020 [acesso 2021 nov 12];23(1):66-80. Disponível em: http://pepsic.bvsalud.org/scielo.php?script=sci_arttext&pid=S1516-08582020000100007
29. Chen CP, Kung PT, Wang YH, et al. Effect of time interval from diagnosis to treatment for cervical cancer on survival: a nationwide cohort study. PloS One. 2019;14(9):e0221946. doi: https://doi.org/10.1371/journal.pone.0221946
30. Leprieur EG, Labrune S, Giraud V, et al. Delay between the initial symptoms, the diagnosis and the onset of specific treatment in elderly patients with lung cancer. Clin Lung Cancer. 2012;13(5):363-8. doi: https://doi.org/10.1016/j.cllc.2011.11.010
31. Abrao FC, Abreu IRLB, Rocha RO, et al. Impact of the delay to start treatment in patients with lung cancer treated in a densely populated area of Brazil. Clinics (São Paulo). 2017;72(11):675-80. doi: https://doi.org/10.6061/clinics/2017(11)05
32. Lemos LLP, Souza MC, Moreira DP, et al. Stage at diagnosis and stage-specific survival of breast cancer in Latin America and the Caribbean: a systematic review and meta-analysis. PloS One 2019;14(10):e0224012. doi: https://doi.org/10.1371/journal.pone.0224012
33. Ministério da Saúde (BR), Secretaria de Atenção Especializada à Saúde. Portaria nº 1.399, de 17 de dezembro de 2019. Redefine os critérios e parâmetros referenciais para a habilitação de estabelecimentos de saúde na alta complexidade em oncologia no âmbito do SUS [Internet]. Diário Oficial da União, Brasília, DF. 2018 dez 19 [acesso 2021 ago 20];Seção 1:173. Disponível em: https://www.in.gov.br/web/dou/-/portaria-n-1.399-de-17-de-dezembro-de-2019-234338206
34. Litwin MS, Tan HJ. The diagnosis and treatment of prostate cancer: a review. JAMA. 2017;317(24):2532-42. doi: https://doi.org/10.1001/jama.2017.7248
35. Loeb S, Folkvaljon Y, Curnyn C, et al. Uptake of active surveillance for very-low-risk prostate cancer in Sweden. JAMA Oncol. 2017;3(10):1393-8. doi: https://doi.org/10.1001/jamaoncol.2016.3600
36. Briganti A, Fossati N, Catto JWF, et al. Active surveillance for low-risk prostate cancer: the European Association of Urology position in 2018. Eur Urol. 2018;74(3):357-68. doi: https://doi.org/10.1016/j.eururo.2018.06.008
37. Khorana AA, Tullio K, Elson P, et al. Time to initial cancer treatment in the United States and association with survival over time: an observational study. PLoS One. 2019;14(3):e0213209. doi: https://doi.org/10.1371/journal.pone.0213209
38. Moraes V. Análise de fatores que levaram ao encaminhamento tardio em casos novos de câncer de próstata recebidos no Hospital Amaral Carvalho nos anos de 2015 e 2016 [dissertação na Internet]. Botucatu (SP): Universidade Estadual Paulista; 2018 [acesso 2021 nov 12]. Disponível em: http://hdl.handle.net/11449/154516
39. Felippu AWD, Freire EC, Silva RA, et al. Impact of delay in the diagnosis and treatment of head and neck cancer. Braz J Otorhinolaryngol. 2016;82(2):140-3. doi: https://doi.org/10.1016/j.bjorl.2015.10.009
40. Coca-Pelaz A, Takes RP, Hutcheson K, et al. Head and neck cancer: a review of the impact of treatment delay on outcome. Adv Ther. 2018;35(2):153-60. doi: https://doi.org/10.1007/s12325-018-0663-7
41. Murphy CT, Galloway TJ, Handorf EA, et al. Increasing time to treatment initiation for head and neck cancer: an analysis of the National Cancer Database. Cancer. 2015;121(8):1204-13. doi: https://doi.org/10.1002/cncr.29191
42. DeGraaff LH, Platek AJ, Iovoli AJ, et al. The effect of time between diagnosis and initiation of treatment on outcomes in patients with head and neck squamous cell carcinoma. Oral Oncol. 2019;96:148-52. doi: https://doi.org/10.1016/j.oraloncology.2019.07.021
43. Hanna TP, King WD, Thibodeau S, et al. Mortality due to cancer treatment delay: systematic review and meta-analysis. BMJ. 2020;371:m4087. doi: https://doi.org/10.1136/bmj.m4087
44. Bleicher RJ. Timing and delays in breast cancer evaluation and treatment. Ann Surg Oncol. 2018;25(10):2829-38. doi: https://doi.org/10.1245/s10434-018-6615-2
45. Vandergrift JL, Niland JC, Theriault RL, et al. Time to adjuvant chemotherapy for breast cancer in National Comprehensive Cancer Network institutions. J Natl Cancer Inst. 2013;105(2):104-12. doi: https://doi.org/10.1093/jnci/djs506
46. Padilla-Ruiz M, Zarcos-Pedrinaci I, Rivas-Ruiz F, et al. Factors that influence treatment delay for patients with breast cancer. Ann Surg Oncol. 2020;28:3714-21. doi: https://doi.org/10.1245/s10434-020-09409-2
47. Simião LJ. Estudo dos tempos entre o diagnóstico e tratamento do câncer de mama em uma instituição de referência no Espírito Santo [dissertação na Internet]. Vitória (ES): Universidade Federal do Espírito Santo; 2016 [acesso 2020 dez 30]. Disponível em: http://repositorio.ufes.br/handle/10/10100
Recebido em 21/9/2021
Aprovado em 13/12/2021
Editora-associada: Jeane Tomazelli. Orcid iD: https://orcid.org/0000-0002-2472-3444
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde