Perfil Demográfico e Clínico de Casos de Neoplasias Hematológicas em Crianças e Adolescentes
Demographic and Clinical Profile of Cases of Hematological Neoplasms in Children and Adolescents
Perfil Demográfico y Clínico de Casos de Neoplasias Hematológicas en Niños y Adolescentes
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n2.2356
Lucele Gonçalves Lima Araújo1; Vandilson Pinheiro Rodrigues2; Melaine Mont’Alverne Lawall Silva3; Gabrielle Cristinne Alves Azevedo4; Pablo de Matos Monteiro5; João Marcelo Saraiva Ferreira6; Huderson Macedo de Sousa7
1-7Universidade Federal do Maranhão (UFMA). São Luís (MA), Brasil.
1E-mail: lucele.araujo@ufma.br. Orcid iD: https://orcid.org/0000-0003-1725-9038
2E-mail: vandilson.rodrigues@ufma.br. Orcid iD: https://orcid.org/0000-0002-6785-7864
3E-mail: melaine.lawall@ufma.br. Orcid iD: https://orcid.org/0000-0003-4773-1612
4E-mail: gabrielle.azevedo@discente.ufma.br. Orcid iD: https://orcid.org/0000-0002-7737-9456
5E-mail: pm.monteir@discente.ufma.br. Orcid iD: https://orcid.org/0000-0002-3879-5326
6E-mail: joao.saraiva@discente.ufma.br. Orcid iD: https://orcid.org/0000-0002-1980-7694
7E-mail: huderson.macedo@discente.ufma.br. Orcid iD: https://orcid.org/0000-0003-2786-6253
Endereço para correspondência: Lucele Gonçalves Lima Araújo. Departamento de Morfologia da UFMA. Avenida dos Portugueses, 1966 – Vila Bacanga. São Luís (MA), Brasil. CEP 65080-805. E-mail: lucele.araujo@ufma.br
RESUMO
Introdução: As neoplasias hematológicas são importantes causas de morte na infância e adolescência. Objetivo: Caracterizar o perfil demográfico e clínico de casos notificados de neoplasias hematológicas em crianças e adolescentes em um hospital de referência do município de São Luís, Maranhão, Brasil. Método: Estudo observacional retrospectivo com dados coletados de prontuários médicos de casos de neoplasias hematológicas em pacientes com idade até 19 anos registrados em um hospital público de referência para tratamento oncológico, no período de 2005 a 2015. Foram coletados dados de caracterização geral dos pacientes e dados do seguimento do tratamento. Os testes qui-quadrado e exato de Fisher foram utilizados na análise estatística. O nível de significância adotado foi de 5% (p<0,05). Resultados: Os casos de óbito foram mais elevados nos pacientes diagnosticados com linfoma não Hodgkin. A maioria dos pacientes com leucemia linfoide era do sexo masculino com idade até 5 anos, e a frequência de óbito nos pacientes com leucemia linfoide foi mais baixa nos casos confirmados de leucemia linfoblástica de células precursoras tipo B em comparação a outras categorias. Conclusão: Os achados sugerem que a maioria dos pacientes com até 19 anos diagnosticados com leucemia linfoide era do sexo masculino e com idade até 5 anos.
Palavras-chave: neoplasias hematológicas; demografia; mortalidade; criança; adolescente.
ABSTRACT
Introduction: Hematological cancers are important causes of death in childhood and adolescence. Objective: To design the demographic and clinical profile of cases of hematological cancer reported for children and adolescents in a referral hospital in the city of São Luís, Maranhão, Brazil. Method: A retrospective observational study with secondary data collected from medical records of bone marrow tumor cases in patients aged up to 19 years registered in a public referral hospital for cancer treatment from 2005 to 2015. Patient’s profile was collected in addition to follow-up data. The chi-square and Fisher's exact test were used in the statistical analysis. The significance level was 5% (p<0.05). Results: Cases of death were higher in patients diagnosed with non-Hodgkin's lymphoma. Most patients with lymphoid leukemia were males aged up to 5 years, and the frequency of death in patients with lymphoid leukemia was lower in confirmed cases of type B lymphoblastic precursor cell leukemia when compared to the other categories. Conclusion: The findings suggest that most patients aged up to 19 years diagnosed with lymphoid leukemia were males and aged up to 5 years old.
Key words: hematologic neoplasms; demography; mortality; child; adolescent.
RESUMEN
Introducción: Las neoplasias hematológicas son causas importantes de muerte en la niñez y la adolescencia. Objetivo: Caracterizar el perfil demográfico y clínico de los casos notificados de neoplasias hematológicas en niños y adolescentes en un hospital de referencia de la ciudad de São Luís, Maranhão, Brasil. Método: estudio observacional retrospectivo con datos secundarios recolectados de registros médicos de casos de tumores de médula ósea en pacientes de hasta 19 años registrados en un hospital público de referencia para tratamiento de cáncer de 2005 a 2015. Se recolectaron datos de caracterización. Datos generales de pacientes y seguimiento -up datos. En el análisis estadístico se utilizaron las pruebas de chi-cuadrado y exacta de Fisher. El nivel de significancia adoptado fue del 5% (p<0,05). Resultados: Los casos de muerte fueron mayores en pacientes con diagnóstico de linfoma no Hodgkin. La mayoría de los pacientes con leucemia linfoide eran varones de hasta 5 años, y la frecuencia de muerte en pacientes con leucemia linfoide fue menor en los casos confirmados de leucemia de células precursoras linfoblásticas tipo B en comparación con las otras categorías. Conclusión: Los hallazgos sugieren que la mayoría de los pacientes de hasta 19 años diagnosticados con leucemia linfoide eran hombres y tenían hasta 5 años.
Palabras clave: neoplasias hematológicas; demografía; mortalidad; niño; adolescente.
INTRODUÇÃO
As leucemias, cânceres do sistema hematopoiético, são consideradas importantes causas de morte em crianças e adolescentes1,2, sendo caracterizadas pelo acúmulo de células alteradas na medula óssea3, enquanto os linfomas são cânceres iniciados nas células do sistema linfático4. Essas patologias costumam se manifestar como resultados de alterações celulares cumulativas, causando sinais e sintomas como anemia, fraqueza, febre, palidez e desânimo, adenomegalias cervical, axilar, inguinal, entre outras. Entretanto, na leucemia, a sintomatologia geralmente ocorre quando existe a disseminação das células neoplásicas para os gânglios linfáticos4, diferentemente do linfoma, cuja adenomegalia caracteriza-se como sintoma inicial5.
O linfoma linfoblástico e a leucemia linfoblástica podem ser procedentes das linhagens de linfócitos B ou T, descritos na décima edição da Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde (CID-10)6 com códigos separados, podendo causar ambiguidade de termos quanto à descrição da linhagem celular, sendo utilizado normalmente o termo sem outras especificações (SOE), para os casos sem evidência das alterações moleculares desses cânceres7,8. De acordo com a estimativa mundial, para o ano de 2017, ocorreram 249 mil casos novos de leucemia, 510 mil casos novos de linfoma não Hodgkin e 79 mil casos novos de linfoma de Hodgkin. As maiores taxas de incidência foram registradas na Austrália, Nova Zelândia, América do Norte e em Regiões da Europa9,10.
As neoplasias hematológicas mais frequentes em crianças e adolescentes são os linfomas e as leucemias11,12. Dados epidemiológicos mostraram que, no Brasil, ocorreram 4.795 óbitos por leucemia e cerca de 5.123 óbitos por linfoma Hodgkin e não Hodgkin no ano de 201713.
Nesse interim, conjectura-se, para o Brasil, no período de 2020 a 2022, um número de casos novos de leucemia, linfoma não Hodgkin e linfoma Hodgkin, respectivamente, de 5.920, 6.580 e 1.590 para homens, e de 4.890, 5.450 e 1.050 para mulheres13. A Organização Mundial da Saúde (OMS) destaca a possibilidade de 81% de incremento na incidência de câncer nos países subdesenvolvidos e em desenvolvimento, onde a mortalidade excede a sobrevida, enfatizando ser imperativo os serviços de diagnóstico prévio na atenção básica à saúde14.
Ademais, o diagnóstico e o tratamento de casos de neoplasias hematológicas infantojuvenil geram impactos em todos os membros do núcleo familiar, provocando medo, depressão e ansiedade, causados pela apreensão de sua descoberta, de seu tratamento, de seu controle e desfecho. Nessa realidade, o risco de morte é uma possibilidade iminente, indicando o quão são necessários investimentos no controle preliminar das neoplasias hematológicas infantojuvenil na cobertura universal da saúde14,15.
Diante do exposto, o objetivo do presente estudo foi caracterizar os casos de neoplasias hematológicas em crianças e adolescentes registrados em um hospital de referência no tratamento oncológico de uma capital da Região Nordeste do Brasil, com o propósito de disponibilizar dados para auxiliar profissionais e gestores de saúde no planejamento de ações de políticas de saúde pública.
MÉTODO
Trata-se de um estudo observacional retrospectivo conduzido com dados coletados nos prontuários do setor de Registro Hospitalar de Câncer (RHC) do Hospital do Câncer Aldenora Bello (HCAB), referência no tratamento oncológico, localizado no município de São Luís, capital do Estado do Maranhão, Brasil, aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal do Maranhão, sob o número CAAE: 84791617.0.0000.5087.
Foram incluídos dados de indivíduos de ambos os sexos, com idade até 19 anos que apresentavam diagnóstico confirmado de neoplasia hematológica, que foram submetidos à terapia antineoplásica e acompanhados no mesmo hospital no período de 2005 a 2015. Foram excluídos dados de pacientes que realizaram o tratamento em outras unidades de saúde, e com dados ausentes para o diagnóstico do caso. Dessa forma, a amostra total deste estudo foi de 409 pacientes, distribuídos da seguinte forma: 245 casos de leucemia linfoblástica aguda, 55 casos de leucemia mieloide aguda, 41 casos de linfoma de Hodgkin, 22 linfomas não Hodgkin, e 46 outros tipos de neoplasias hematológicas.
A coleta dos dados foi realizada com base nas informações incluída na Ficha de Registro de Tumor (FRT) do hospital. As variáveis coletadas incluíram: dados gerais (sexo, idade e local de procedência), dados do diagnóstico da neoplasia, tipo histológico, dados do tratamento (tipo de tratamento, blastos, tipo sanguíneo, desfecho do tratamento).
Para a análise estatística, foram utilizados os recursos do Statistical Package for the Social Sciences (SPSS) versão 26.0 (IBM, Chicago, IL, USA). Inicialmente, foi realizada a análise descritiva por intermédio de medidas de frequência absoluta e relativa, medidas de tendência central e medidas de dispersão. Os testes qui-quadrado (χ2) convencional ou o exato de Fisher foram utilizados na análise comparativa das frequências. O nível de significância adotado foi de 5% (p<0,05). Os resultados foram apresentados por meio de tabelas e gráficos.
RESULTADOS
Um total de 409 prontuários de pacientes com neoplasias hematológicas e idade até 18 anos foi incluído neste estudo. Observou-se, no Gráfico 1, que 245 (60%) eram casos de leucemia linfoblástica aguda. O segundo tipo mais frequente foi de leucemia mieloide aguda representando 55 casos (14%).
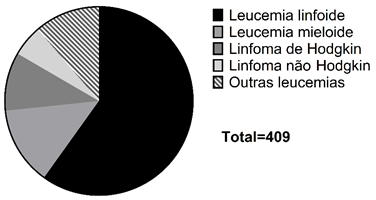
Gráfico 1. Distribuição dos casos coletados de acordo com o diagnóstico (CID-10)
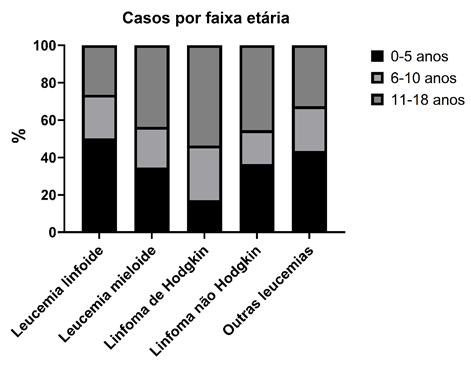
O Gráfico 2 expressa a distribuição e a análise comparativa das faixas etárias de acordo com o tipo de neoplasia hematológica. Houve diferença estatisticamente significante na distribuição das faixas etárias de acordo com o tipo de tumor (p=0,003). Os casos de leucemia linfoblástica aguda ocorreram com maior frequência em pacientes com idade até 5 anos (50,2%), enquanto os casos de leucemia mieloide aguda, doença de Hodgkin e linfoma não Hodgkin foram mais frequentes em indivíduos com idade entre 11 e 19 anos.
|
|
|
Gráfico 2. Distribuição dos casos por faixa etária de acordo com o tipo de neoplasia hematológica (p=0,003) |
Os dados da Tabela 1 revelaram que a frequência de óbito foi estatisticamente mais elevada (p<0,001) nos pacientes diagnosticados com linfoma não Hodgkin (68,2%) e leucemia mieloide aguda (65,5%) quando comparados aos pacientes com linfoma de Hodgkin (19,5%).
|
Tabela 1. Distribuição da evolução do tratamento de acordo com o tipo de neoplasia hematológica |
|||||
|
Variáveis |
Evolução do tratamento |
p |
|||
|
Sobrevida |
Óbito |
||||
|
n |
(%) |
n |
(%) |
||
|
CID no diagnóstico |
|
|
|
|
<0,001* |
|
Leucemia linfoblástica aguda |
126 |
(51,4) |
119 |
(48,6) |
|
|
Leucemia mieloide aguda |
19 |
(34,5) |
36 |
(65,5) |
|
|
Linfoma de Hodgkin |
33 |
(80,5) |
8 |
(19,5) |
|
|
Linfoma não Hodgkin |
7 |
(31,8) |
15 |
(68,2) |
|
|
Outros tipos |
21 |
(45,6) |
25 |
(54,4) |
|
|
Legenda: CID-10 = Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde. (*) Diferença estatisticamente significante pelo teste qui-quadrado (p<0,05). |
|||||
A distribuição das variáveis de caracterização geral e associação com a evolução do caso nos pacientes com leucemia linfoblástica aguda está apresentada na Tabela 2. No total da amostra de pacientes com leucemia linfoblástica aguda, observou-se que a maioria era do sexo masculino (60,8%), apresentava idade até 5 anos (50,2%), residia no interior do Estado do Maranhão (70,6%), se submeteu apenas à quimioterapia durante o tratamento (58%) e apresentava sangue tipo O (35,9%). A análise de associação revelou associação significante (p<0,001) apenas com a variável tipo de tratamento. Os casos de óbito foram mais elevados em pacientes tratados com quimioterapia combinada com radioterapia (93,8%).
|
Tabela 2. Distribuição das frequências das variáveis de caracterização geral de acordo com a evolução do tratamento entre os casos diagnosticados como leucemia linfoblástica aguda |
|||||||
|
Variáveis |
Total |
Evolução do tratamento |
p |
||||
|
Sobrevida |
Óbito |
||||||
|
n |
(%) |
n |
(%) |
n |
(%) |
||
|
Sexo |
|
|
|
|
|
|
0,452 |
|
Masculino |
149 |
(60,8) |
80 |
(53,7) |
69 |
(46,3) |
|
|
Feminino |
96 |
(39,2) |
46 |
(47,9) |
50 |
(52,1) |
|
|
Idade no diagnóstico |
|
|
|
|
|
|
0,552 |
|
0-5 anos |
123 |
(50,2) |
67 |
(54,5) |
56 |
(45,5) |
|
|
6-10 anos |
57 |
(23,3) |
29 |
(50,9) |
28 |
(49,1) |
|
|
11-19 anos |
65 |
(26,5) |
30 |
(46,1) |
35 |
(53,9) |
|
|
Procedência |
|
|
|
|
|
|
0,862 |
|
São Luís |
68 |
(27,8) |
38 |
(55,9) |
30 |
(44,1) |
|
|
Interior do MA |
173 |
(70,6) |
86 |
(49,7) |
87 |
(50,3) |
|
|
Municípios fora do MA |
2 |
(0,8) |
1 |
(50,0) |
1 |
(50,0) |
|
|
Não declarado |
2 |
(0,8) |
|
|
|
|
|
|
Tipo de tratamento |
|
|
|
|
|
|
<0,001* |
|
QT |
142 |
(58,0) |
41 |
(28,9) |
101 |
(71,1) |
|
|
QT + RT |
17 |
(6,5) |
1 |
(6,2) |
15 |
(93,8) |
|
|
QT + RT + cirúrgico |
6 |
(2,4) |
6 |
(100) |
0 |
(0) |
|
|
Não informado |
81 |
(33,1) |
|
|
|
|
|
|
Blastos |
|
|
|
|
|
|
0,417 |
|
0-20% |
152 |
(62,0) |
57 |
(37,5) |
95 |
(62,5) |
|
|
Mais que 20% |
16 |
(6,6) |
4 |
(25,0) |
12 |
(75,0) |
|
|
Não informado |
77 |
(31,4) |
|
|
|
|
|
|
Tipo sanguíneo |
|
|
|
|
|
|
0,603 |
|
A |
51 |
(20,8) |
17 |
(33,3) |
34 |
(66,7) |
|
|
B |
13 |
(5,3) |
3 |
(23,1) |
10 |
(76,9) |
|
|
AB |
3 |
(1,2) |
0 |
(0) |
3 |
(100) |
|
|
O |
88 |
(35,9) |
27 |
(30,7) |
61 |
(69,3) |
|
|
Não informado |
90 |
(36,7) |
|
|
|
|
|
|
Legendas: MA = Estado do Maranhão; QT = quimioterapia; RT = radioterapia. (*) p<0,05. |
|||||||
Além disso, observou-se que o tipo histológico também influenciou na evolução do caso (p=0,004). A frequência de óbito foi mais baixa nos casos confirmados de leucemia linfoblástica de células precursoras tipo B em comparação a outras categorias (Tabela 3).
|
Tabela 3. Associação entre a evolução do tratamento e tipo histológico do tumor nos pacientes com leucemia linfoblástica aguda |
|||||
|
Variáveis |
Evolução do tratamento |
p |
|||
|
Sobrevida |
Óbito |
||||
|
|
n |
(%) |
n |
(%) |
|
|
Tipo histológico do tumor |
|
|
|
|
0,004* |
|
Leucemia linfoblástica de células precursoras, SOE |
84 |
(45,9) |
99 |
(54,1) |
|
|
Leucemia linfoblástica de células precursoras tipo B |
11 |
(84,6) |
2 |
(15,4) |
|
|
Outros tipos |
31 |
(63,3) |
18 |
(36,7) |
|
|
Legenda: SOE = Sem outras especificações. (*) p<0,05. |
|||||
DISCUSSÃO
A análise de indicadores de neoplasias hematológicas em crianças e adolescentes pode auxiliar o monitoramento da situação de saúde nessa população, estimular descobertas epidemiológicas e o desenvolvimento de novas alternativas terapêuticas para o enfrentamento desse grupo de doenças15. Os achados do presente estudo sugerem uma maior frequência de neoplasias do tipo leucemia linfoblástica aguda, seguida de leucemia mieloide aguda, corroborando os encontrados da literatura16.
Os casos de leucemia linfoblástica aguda ocorreram com maior frequência em pacientes com idade até 5 anos, enquanto, para leucemia mieloide aguda, linfoma de Hodgkin e linfoma não Hodgkin, a maior parcela dos casos ocorreu em indivíduos com idade entre 11 e 19 anos, achado também reportado na literatua17. No entanto, ainda que não haja consenso sobre a causa real dessa prevalência na primeira infância, ela pode ser considerada uma manifestação das alterações genéticas desencadeadoras de leucemia linfoblástica aguda18-23.
Resultados promissores têm sido obtidos no tratamento para leucemia linfoblástica aguda, com taxa de sobrevida de 90%, diminuindo substancialmente os níveis agudos de morbidades tardias, fornecendo medicamentos apropriados às subclassificações mais resistentes em grupos populacionais distintos proporcionando melhor qualidade de vida aos pacientes em países desenvolvidos24,25, embora esse evento ainda pareça distante nos países em desenvolvimento26,27. Além disso, reitera-se que as investigações etiológicas familiares germinativas para o desenvolvimento da leucemia em crianças e adolescentes devem ser realizadas de forma precoce e efetiva em virtude da avaliação das novas entidades de leucemia mieloide aguda com mutações genéticas28.
Os achados deste estudo mostraram uma frequência maior de óbito nos pacientes com linfoma não Hodgkin (68,2%) e leucemia mieloide aguda (65,5%) quando comparados aos pacientes com linfoma de Hodgkin (19,5%). Diante dessa realidade, convém observar que, nos países em desenvolvimento, parece existir dificuldade de acesso aos centros hospitalares especializados, às análises de clínica médica, às terapias adequadas e, consonante com a real necessidade, tendo potencial de impactar na taxa de sobrevida16,27,29-32. Ademais, em 2017, em admissão no Sistema Único de Saúde (SUS), notou-se que o amparo oncológico para a leucemia linfoblástica aguda foi quantificado como a primeira causa de morte por doença, com taxa de 2% a 4% de casos novos em comparação a todas as leucemias e linfomas27,33-35.
No tocante à sobrevida no estudo das tendências de mortalidade por leucemias em crianças e adolescentes nas capitais dos Estados brasileiros, observou-se que houve redução no percentual de mortalidade por leucemia em crianças e adolescentes no período entre 1980 a 201533-35. A taxa de sobrevida dos pacientes com leucemia linfoblástica aguda corresponde a 64%, podendo apresentar variações regionais entre os municípios brasileiros, diferente dos países desenvolvidos com percentuais acima de 80%19,33,36,37.
A sobrevida está diretamente ligada a: diagnóstico precoce e suas revisões periódicas, equipe multidisciplinar, condições terapêuticas combinadas, exames clínicos recorrentes, planejamento dos serviços e suporte familiar31,34,37,38. Um estudo com uma amostra de crianças lituanas portadoras da leucemia linfoide aguda constatou que aquelas submetidas ao transplante de células-tronco hematopoiéticas obtiveram sobrevida compatíveis às taxas das demais Regiões da Europa39.
A sobrevida e o óbito na leucemia linfoblástica aguda estão relacionados à faixa etária, havendo melhor prognóstico em pacientes de 1 a 9 anos. Os dados do presente estudo mostraram uma frequência igual a 60,8% do sexo masculino, 50,2% com idade até 5 anos nos casos de leucemia linfoblástica aguda, e 70,6% provenientes do interior do Estado do Maranhão (70,6%), submetidos exclusivamente à quimioterapia durante o tratamento (58%) e exibia sangue tipo O (35,9%). Verificou-se também que os casos de óbito foram mais altos nos pacientes em terapia combinada, quimioterapia com radioterapia (93,8%), sugerindo-se que, nestes casos, o comportamento do tumor era mais agressivo40,41.
Neste estudo, como no cenário mundial, observou-se que a leucemia linfoide tem maior prevalência até os 5 anos de idade38 e que, por conta de tal diagnóstico, os pacientes são conduzidos, rotineiramente, a modalidades terapêuticas como os cuidados curativos e paliativos, ficando este último recomendado quando se encontram sem possibilidade de cura ou com risco de morte imediata. Os cuidados curativos são quimioterapia, radioterapia e/ou cirurgias, dependendo da conduta clínica escolhida29,30,37. Tais procedimentos têm como objetivo principal proporcionar à criança e ao adolescente a probabilidade do melhor prognóstico e a autonomia, contribuindo para o maior percentual de sobrevida37,42.
Os tipos histológicos mais frequentes foram os casos de leucemia linfoide, seguido da leucemia mieloide17,31. Observou-se, no presente estudo, que pacientes com leucemia linfoblástica (SOE) apresentaram 54,1% de casos com óbito, com diferenças estatisticamente significantes comparados às outras categorias de leucemia linfoblástica aguda. Essas taxas elevadas podem estar associadas ao diagnóstico tardio, em razão dos descompassos relacionados às políticas de saúde pública, ainda pertinentes27,29-31.
A frequência de óbito foi mais baixa nos casos confirmados de leucemia linfoblástica de células precursoras tipo B27,29. Dessa forma, parece que grande parte das leucemias linfoides detectadas não foi especificada em conformidade com os seus marcadores celulares, podendo apresentar diversos prognósticos, fato que dificulta a análise entre óbito e sobrevida12,33. Em consideração a isso, acredita-se que a ausência das especificações nos prontuários dos pacientes se caracterizou em limitação para a análise do aspecto citogenético. Nesse sentido, um cuidado maior deve ser implementado no preenchimento dos dados do paciente no prontuário, incluindo as informações necessárias para uma melhor caracterização dos casos e dos dados no acompanhamento e na evolução do tratamento12,13.
Ressalta-se ainda que o prognóstico mais favorável da leucemia linfoide parece não estar relacionado apenas ao tipo histopatológico e ao tratamento43 e que o resultado de remissão ou óbito são referências muito importantes. Nessa ótica, pesquisas justificam que a queda da mortalidade por câncer pode estar associada às novas técnicas e aos novos protocolos quimioterápicos com redução da quimiotoxicidade, permitindo potencial adaptação e aprimoramento do prognóstico das leucemias19,24.
CONCLUSÃO
Os achados sugerem que maioria dos pacientes diagnosticados com leucemia linfoblástica era do sexo masculino e com idade até 5 anos. Além disso, observou-se que a associação entre a evolução do tratamento e o tipo histológico do tumor nos pacientes com leucemia linfoblástica aguda foi mais baixa nos casos confirmados de leucemia linfoblástica de células precursoras tipo B em comparação a outras categorias. Esses dados indicam que há necessidade de planejamento de medidas que incentivem a promoção de saúde e ampliem a oferta de serviços de diagnóstico e tratamento para casos de neoplasias hematológicas.
AGRADECIMENTOS
À direção do HCAB e ao Setor de RHC, que auxiliaram na autorização e logística da coleta de dados.
CONTRIBUIÇÕES
Todos os autores contribuíram substancialmente na concepção e no planejamento do estudo; na análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Steliarova-Foucher E, Colombet M, Ries LAG, et al. International incidence of childhood cancer, 2001-10: a population-based registry study. Lancet Oncol. 2017;18(6):719-31. doi: https://doi.org/10.1016/S1470-2045(17)30186-9
2. Bertuccio P, Bosetti C, Malvezzi M, et al. Trends in mortality from leukemia in Europe: an update to 2009 and a projection to 2012. Int J Cancer. 2013;132(2):427-36. doi: https://doi.org/10.1002/ijc.27624
3. Instituto Nacional de Câncer José Alencar Gomes da Silva [Internet]. Rio de Janeiro: INCA; [data desconhecida]. Câncer: tipos de câncer; [modificado 2021 ago 8; acesso 2021 out 19]. Disponível em: https://www.inca.gov.br/tipos-de-cancer
4. Ministério da Saúde (BR), Secretaria de Atenção à Saúde. Protocolos clínicos e diretrizes terapêuticas em oncologia [Internet]. Brasília (DF): Ministério da Saúde; 2014 [acesso 2021 out 19]. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/protocolos_clinicos_diretrizes_terapeuticas_oncologia.pdf
5. Campo E, Swerdlow SH, Harris NL, et al. The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications. Blood. 2011;117(19):5019-32. doi: https://doi.org/10.1182/blood-2011-01-293050
6. Organização Mundial da Saúde. CID-10: Classificação Estatística Internacional de Doenças e problemas relacionados à saúde. São Paulo: Edusp; 2008.
7. Fritz A, Percy C, Jack A, et al., editors. International Classification of Diseases for Oncology (ICD-O). 3rd ed. Geneva: World Health Organization; 2013.
8. Nunes AL. Análise das alterações citogenéticas e sua associação com características clínicas e evolução das crianças e adolescentes com leucemia mieloide aguda [dissertação]. Belo Horizonte (MG): Faculdade de Medicina, Universidade Federal de Minas Gerais; 2016.
9. Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. doi: https://doi.org/10.3322/caac.21492
10. Ferlay J, Colombet M, Soerjomataram I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer. 2019;144(8):1941-53. doi: https://doi.org/10.1002/ijc.31937
11. Presti PF, Macedo CRD, Caran EM, et al. Estudo epidemiológico de câncer na adolescência em centro de referência. Rev Paul Pediatr. 2012;30(2):210-6. doi: https://doi.org/10.1590/S0103-05822012000200009
12. Jemal A, Torre L, Soerjomataram I, et al., editors. The cancer atlas. 3rd ed. Atlanta (GA): American Cancer Society; 2019.
13. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2020: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2019 [acesso 2021 out 19]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/estimativa-2020-incidencia-de-cancer-no-brasil.pdf
14. World Health Organization. WHO report on cancer: setting priorities, investing wisely and providing care for all [Internet]. Geneva: WHO; 2020 [cited 2020 Mar 7]. Available from: https://apps.who.int/iris/handle/10665/330745
15. Ward ZJ, Yeh JM, Bhakta N, et al. Estimating the total incidence of global childhood cancer: a simulation-based analysis. Lancet Oncol. 2019;20(4):483-93. doi: https://doi.org/10.1016/S1470-2045(18)30909-4
16. Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021. CA Cancer J Clin. 2021;71(1):7-33. doi: https://doi.org/10.3322/caac.21654
17. Churchman ML, Qian M, Te Kronnie G, et al. Germline genetic IKZF1 variation and predisposition to childhood acute lymphoblastic leukemia. Cancer Cell. 2018;33(5):937-48. doi: https://doi.org/10.1016/j.ccell.2018.03.021
18. Sousa DWL, Ferreira FVA, Félix FHC, et al. Acute lymphoblastic leukemia in children and adolescents: prognostic factors and analysis of survival. Rev Bras Hematol Hemoter. 2015;37(4):223-9. doi: https://doi.org/10.1016/j.bjhh.2015.03.009
19. Reis RS, Silva NP, Santos MO, et al. Mother and child characteristics at birth and early age leukemia: a case-cohort population-based study. J Pediatr. 2017;93(6):610-8. doi: https://doi.org/10.1016/j.jped.2016.12.009
20. Cavalcante MS, Santana Rosa IS, Torres F. Leucemia linfoide aguda e seus principais conceitos. Rev FAEMA. 2017;8(2):151-64. doi: https://doi.org/10.31072/rcf.v8i2.578
21. Sossela FR, Zoppas BCA, Weber LP. Leucemia mieloide crônica: aspectos clínicos, diagnóstico e principais alterações observadas no hemograma. Rev Bras An Clin. 2017;49(2):127-30. doi: https://doi.org/10.21877/2448-3877.201700543
22. Chaudhury S, O’Connor C, Cañete A, et al. Age-specific biological and molecular profiling distinguishes paediatric from adult acute myeloid leukaemias. Nat Commun. 2018;9:5280. doi: https://doi.org/10.1038/s41467-018-07584-1
23. Bolouri H, Farrar JE, Triche TJ Jr, et al. The molecular landscape of pediatric acute myeloid leukemia reveals recurrent structural alterations and age-specific mutational interactions. Nat Med. 2018;24(1):103-12. doi: https://doi.org/10.1038/nm.4439
24. Pieters R, Groot-Kruseman H, Van der Velden V, et al. Successful therapy reduction and intensification for childhood acute lymphoblastic leukemia based on minimal residual disease monitoring: study ALL10 from the Dutch Childhood Oncology Group. J Clin Oncol. 2016;34(22):2591-601. doi: https://doi.org/10.1200/JCO.2015.64.6364
25. Pui CH, Yang JJ, Bhakta N, et al. Global efforts toward the cure of childhood acute lymphoblastic leukaemia. Lancet Child Adolesc Health. 2018;2(6):440-54. doi: https://doi.org/10.1016/S2352-4642(18)30066-X
26. Instituto Nacional de Câncer. Registros hospitalares de câncer: planejamento e gestão [Internet]. 2. ed. rev. atual. Rio de Janeiro: INCA; 2010 [acesso 2021 out 19]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//registros-hospitalares-de-cancer-2010.pdf
27. Ferreira JMO, Klumb CE, Reis RS, et al. Lymphoma subtype incidence rates in children and adolescents: first report from Brazil. Cancer Epidemiol. 2012;36(4):e221-6. doi: https://doi.org/10.1016/j.canep.2012.03.006
28. Kansal R. Classification of acute myeloid leukemia by the revised fourth edition World Health Organization criteria: a retrospective single-institution study with appraisal of the new entities of acute myeloid leukemia with gene mutations in NPM1 and biallelic CEBPA. Hum Pathol. 2019;90:80-96. doi: https://doi.org/10.1016/j.humpath.2019.04.020
29. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2018: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2017 [acesso 2021 out 19]. Disponível em: https://portaldeboaspraticas.iff.fiocruz.br/wp-content/uploads/2019/10/estimativa-incidencia-de-cancer-no-brasil-2018.pdf
30. Instituto Nacional do Câncer José Alencar Gomes da Silva. Incidência, mortalidade e morbidade hospitalar por câncer em crianças, adolescentes e adultos jovens no Brasil: informações dos registros de câncer e do sistema de mortalidade [Internet]. Rio de Janeiro: INCA; 2016 [acesso 2021 out 19]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//incidencia-mortalidade-morbidade-hospitalar-por-cancer.pdf
31. Mutti CF, Cruz VG, Santos LF, et al. Perfil clínico-epidemiológico de crianças e adolescentes com câncer em um serviço de oncologia. Rev Bras Cancerol. 2018;64(3):293-300. doi: https://doi.org/10.32635/2176-9745.RBC.2018v64n3.26
32. Horton TM, Hoff FW, van Dijk A, et al. The effects of sample handling on proteomics assessed by reverse phase protein arrays (RPPA): functional proteomic profiling in leukemia. J Proteomics. 2021;233(1):104046. doi: https://doi.org/10.1016/j.jprot.2020.104046
33. Saraiva DCA, Santos SS, Monteiro GTR. Tendência de mortalidade por leucemias em crianças e adolescentes nas capitais dos estados brasileiros: 1980-2015. Epidemiol Serv Saúde. 2018;27(3):2017310. doi: https://doi.org/10.5123/s1679-49742018000300004
34. Santos MO. Incidência, mortalidade e morbidade hospitalar por câncer em crianças, adolescentes e adultos jovens no Brasil: informações dos registros de câncer e do sistema de mortalidade [resenha de livro]. Rev Bras Cancerol. 2018;64(3):439-40. doi: https://doi.org/10.32635/2176-9745.RBC.2018v64n3.56
35. Feliciano SVM, Santos MO, Pombo-de-Oliveira MS. Incidência e mortalidade por câncer entre crianças e adolescentes: uma revisão narrativa. Rev Bras Cancerol. 2018;64(3):389-96. doi: https://doi.org/10.32635/2176-9745.RBC.2018v64n3.45
36. Kehm RD, Spector LG, Poynter JN, et al. Does socioeconomic status account for racial and ethnic disparities in childhood cancer survival? Cancer. 2018;124(20):4090-7. doi: https://doi.org/10.1002/cncr.31560
37. Iacobucci I, Mullighan CG. Genetic basis of acute lymphoblastic leukemia. J Clin Oncol. 2017;35(9):975-83. doi: https://doi.org/10.1200/JCO.2016.70.7836
38. World Health Organization [Internet]. Geneva: WHO; c2022. Palliative care; 2020 Aug 5 [cited 2019 July 2]. Available from: https://www.who.int/news-room/fact-sheets/detail/palliative-care
39. Kairiene I, Pasauliene R, Lipunova N, et al. Improved outcome of childhood acute myeloid leukemia in an Eastern European country: Lithuanian experience. Eur J Pediatr. 2017;176(10):1329-37. doi: https://doi.org/10.1007/s00431-017-2978-9
40. Nascimento MC. Atendimentos a crianças e adolescentes com câncer em Minas Gerais: retrato de uma década. Rev Bras Cancerol. 2018;64(3):365-72. doi: https://doi.org/10.32635/2176-9745.RBC.2018v64n3.42
41. Hintz LG, Castro Júnior CG, Lukrafka JL. Perfil clínico-epidemiológico de crianças e adolescentes em tratamento oncológico. Ciênc Saúde. 2019;12(1):31421. doi: https://doi.org/10.15448/1983-652X.2019.1.31421
42. Hrusak O, Haas V, Stancikova J, et al. International cooperative study identifies treatment strategy in childhood ambiguous lineage leukemia. Blood. 2018;132(3):264-76. doi: https://doi.org/10.1182/blood-2017-12-821363
43. Pantoja LC. Estudo da resposta terapêutica e prognóstico de pacientes com diagnóstico de leucemia linfoide aguda com fusões gênicas em um hospital de referência do Pará [dissertação]. Belém (PA): Universidade Federal do Pará; 2018.
Recebido em 14/9/2021
Aprovado em 31/10/2021
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde