ARTIGO ORIGINAL
Increase of the Incidence of Biochemical Recurrence after Radical Prostatectomy in an Uro-Oncology Training Center in Brazil: Are More Advanced Diseases undergoing Surgery?
Aumento de la Incidencia de Recurrentes Bioquímicos Después de Prostatectomía Radical en un Centro de Capacitación en Urología Oncológica en Brasil: ¿Enfermedades más Avanzadas están siendo sometidas a Cirugía?
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n3.2483
Antonio Brunetto Neto1; André Matos de Oliveira2; Cecilia Rubini Rocha3; Leonardo Pereira Tavares4; Maria Fernanda Baptista Caldas5
1,2,4Hospital São Vicente, Clínica de Urologia. Curitiba (PR), Brasil. E-mails: urosaovicente@gmail.com; andrematosuro@yahoo.com; leoptavares15@hotmail.com. Orcid iD: https://orcid.org/0000-0002-1016-0783; Orcid iD: https://orcid.org/0000-0002-7131-4328; Orcid iD: https://orcid.org/0000-0001-7489-0550
3,5Pontifícia Universidade Católica do Paraná, Escola de Medicina. Curitiba (PR), Brasil. E-mails: rrcecilia@hotmail.com; mfbcaldas@hotmail.com. Orcid iD: https://orcid.org/0000-0003-2090-9126; Orcid iD: https://orcid.org/0000-0002-7082-7201
Endereço para correspondência: Maria Fernanda Baptista Caldas. Rua Jeremias Maciel Perretto, 1288, casa 46 ‒ Mossunguê. Curitiba (PR), Brasil. CEP 81210-310. E-mail: mfbcaldas@gmail.com
Introdução: O câncer de próstata é a neoplasia maligna mais incidente em homens, representando 29% dos diagnósticos da doença no Brasil, segundo o Instituto Nacional de câncer José Alencar Gomes da Silva (INCA). Esse câncer é suspeito em alterações do toque retal e/ou do nível sérico do antígeno prostático específico (PSA) total, sendo o diagnóstico definitivo feito por estudo histopatológico. Objetivo: Verificar a associação entre parâmetros clínicos e anatomopatológicos após prostatectomia radical com recidiva bioquímica ao longo do seguimento. Método: Estudo retrospectivo observacional dos parâmetros clínicos (idade, PSA inicial, toque retal, classificação histopatológica da International Society of Urological Pathology (ISUP), escala de D’Amico e estádio clínico) e anatomopatológicos (grau ISUP da peça cirúrgica, margens cirúrgicas, extensão extracapsular tumoral e presença de linfonodos acometidos), de 177 pacientes submetidos à prostatectomia radical em serviço de uro-oncologia de junho/2010-maio/2018. Resultados: A recidiva bioquímica ocorreu em 44,1% dos casos no tempo de seguimento médio de 34,9 meses. A análise univariada demonstrou PSA inicial >9 ng/mL, toque retal alterado, classificação patológica ISUP 4 e 5, risco D’Amico alto e estágio clínico TNM T3 como fatores diretamente associados à recidiva bioquímica. As margens cirúrgicas foram positivas em 46,3%; em 47,7%, identificou-se extensão extraprostática tumoral. Linfonodos positivos em 10,9% e vesículas seminais comprometidas ocorreram em 21,8%. Conclusão: Fatores clínico-patológicos podem ser preditores de recidiva bioquímica. Nesses casos, foi identificado padrão clínico pré-tratamento supostamente mais agressivo em comparação à literatura em geral. Além disso, deve-se considerar a curva de aprendizado dos cirurgiões em formação no serviço, o que pode resultar em maiores taxas de margens cirúrgicas positivas.
Palavras-chave: prostatectomia; neoplasias da próstata; recidiva local de neoplasia.
ABSTRACT
Introduction: Prostate cancer is the most common cancer in men representing 29% of diagnoses of the disease in Brazil according to the National Cancer Institute José Alencar Gomes da Silva (INCA). If digital rectal examination presents alterations and/or altered serum level of prostate-specific antigen (PSA) total is detected, there is suspicion of prostate cancer, but the definitive diagnosis occurs only with histopathological study. Objective: To correlate clinical and pathological parameters after radical prostatectomy with biochemical recurrence during follow-up. Method: Retrospective observational study of clinical parameters (age, initial PSA, digital rectal examination, histopathological classification of the International Society of Urological Pathology (ISUP), D’Amico scale and clinical stage) and pathological (ISUP degree of the surgical specimen, surgical margins, extracapsular tumor extension and presence of positive lymph nodes) of 177 patients who underwent radical prostatectomy in an uro-oncology service from June 2010 to May 2018. Results: Biochemical recurrence occurred in 44.1% of the cases within a mean follow-up time of 34.9 months. Univariate analysis showed that baseline PSA>9 ng/mL, altered rectal examination, pathological ISUP classification 4 and 5, high D’Amico risk, and clinical TNM stage T3 are risk factors for biochemical recurrence. Surgical margins were positive in 46.3%, and in 47.7% extracapsular extension was identified. Positive lymph nodes were detected in 10.9% and positive seminal vesicles occurred in 21.8%. Conclusion: Clinical and pathological factors can be predictors of biochemical recurrence. In these cases, it was identified a more aggressive clinical pattern than the literature in general. In addition, it should be considered the learning curve of surgeons in training at the service, which can result in higher rates of positive surgical margins.
Key words: prostatectomy; prostatic neoplasms; neoplasm recurrence, local.
RESUMEN
Introducción: El cáncer de próstata es lo más incidente en hombres representando 29% de los diagnósticos de enfermedades en Brasil según Instituto Nacional del Cáncer José Alencar Gomes da Silva (INCA), se sospecha en tacto rectal y/o en el nivel de análisis del antígeno prostático específico (PSA) total alterado, y el diagnóstico definitivo se realiza mediante el estudio histopatológico. Objetivo: Correlacionar los parámetros clínicos y patológicos después de la prostatectomía radical con la recurrencia bioquímica a lo largo del seguimiento. Método: Estudio observacional retrospectivo de parámetros clínicos (edad, PSA inicial, tacto rectal, clasificación histopatológica de la International Society of Urological Pathology (ISUP), escala D’Amico y estadio clínico) y patológicos (grado ISUP de la muestra quirúrgica, márgenes quirúrgicos, extensión capsular tumoral extra y ganglios linfáticos positivos) de 177 pacientes sometidos a prostatectomía radical en servicio de uro-oncología de junio/2010-mayo/2018. Resultados: La recurrencia bioquímica ocurrió en el 44,1% de los casos en un tiempo de seguimiento promedio de 34,9 meses. El análisis univariado demostró que el PSA inicial >9 ng/mL, alteración del tacto rectal, clasificación patológica ISUP 4 y 5, alto riesgo de D’Amico y estadificación TNM clínico T3 como factores de riesgo para recurrencia bioquímica. Los márgenes quirúrgicos fueron positivos en el 46,3%, y en el 47,7% se identificó una extensión extra capsular adicional. Los ganglios linfáticos positivos fueron detectados en 10,9% y las vesículas seminales positivas ocurrieron en el 21,8%. Conclusión: Los factores clínicos y patológicos pueden ser predictores de recurrencia bioquímica. En estos casos, fue identificado un patrón más agresivo que la literatura en general. Además, se debe considerar la curva de aprendizaje de los cirujanos en formación en el servicio, lo que puede resultar en mayores tasas de márgenes quirúrgicos positivos.
Palabras clave: prostatectomia; neoplasias de la próstata; recurrencia local de neoplasia.
INTRODUÇÃO
A prostatectomia radical demonstra benefícios clínicos oncológicos em pacientes com câncer de próstata clinicamente significante, como maior sobrevida livre de metástases e maior sobrevida global1. Em tumores com baixo risco de progressão, cerca de 85% dos pacientes submetidos à cirurgia não apresentam evidência de doença após cinco anos, e dois terços após dez anos2. Entretanto, a incidência de recorrência bioquímica após tratamento cirúrgico, definida como a elevação de antígeno prostático específico – do inglês, prostate-specific antigen (PSA) – acima de 0,2 ng/ml em duas medidas consecutivas, apresenta resultados divergentes na literatura3,4.
A evolução clínica desse grupo de pacientes é variável, entre os quais alguns com recidiva bioquímica manifestam rápida progressão para metástases, enquanto, em outros, o aumento de PSA pode não interferir na sobrevida oncológica. Dados de sobrevida em dez anos, comparando pacientes com e sem diagnóstico de recidiva bioquímica, não demonstraram diferença na sobrevida global2. Apesar da correlação incerta entre recidiva bioquímica e sobrevida câncer específica, a elevação de PSA indica persistência de células tumorais e evoca discussão sobre tratamento adjuvante com seus consequentes efeitos adversos, além de resultar em ansiedade ao paciente2.
Com base em tais considerações, é necessária a compreensão do perfil epidemiológico local, do perfil clínico-patológico dos pacientes tratados em serviço público de oncologia e sua possível correlação com o desfecho clínico oncológico. O objetivo do estudo foi correlacionar os parâmetros clínicos e patológicos com o desfecho oncológico (cura ou recidiva bioquímica) após prostatectomia radical, e definir fatores de risco para o evento em questão.
MÉTODO
Estudo retrospectivo observacional no qual foram incluídos os dados de 179 pacientes submetidos à prostatectomia radical em uma única Unidade de Assistência de Alta Complexidade em Oncologia (Unacon), o Hospital São Vicente, em Curitiba (PR), uma das referências da Região Sul do país para pacientes oncológicos do Sistema Único de Saúde (SUS), no período de junho de 2010 a maio de 2018. Os dados foram buscados de forma retrospectiva, por análise prontuários eletrônicos da instituição. O projeto foi aprovado pelo Comitê de Ética em Pesquisa (CEP) do Hospital São Vicente, Curitiba (PR) sob o número de Protocolo 3.589.604, CAAE 19429019.1.0000.0020, atendendo às exigências éticas e científicas fundamentais da Resolução 466/20125 do Conselho Nacional de Saúde.
Os dados clínicos avaliados foram: idade, PSA inicial, característica do exame digital da próstata (alterado ou normal), graduação histopatológica da International Society of Urological Pathology (ISUP) da biópsia diagnóstica (graus 1 a 5), escala de risco de D’Amico6 ‒ combina PSA, escore de Gleason e estadiamento clínico da Classificação de Tumores Malignos (TNM)7 ‒, e classifica-se como baixo, intermediário ou alto risco. Os dados patológicos cirúrgicos foram: graduação histopatológica ISUP da peça cirúrgica, estadiamento patológico TNM, margens cirúrgicas (sim ou não), extensão tumoral extracapsular (sim ou não), vesículas seminais (sim ou não) e presença de linfonodos positivos. Quanto à classificação TNM, é usada para classificar separadamente o tumor individual (T), linfonodo (N) e elementos metastáticos (M) e depois agrupá-los em estágios definidos do câncer. Os objetivos dessa classificação são auxiliar no planejamento do tratamento, fornecer indicação de prognóstico e auxiliar na avaliação dos resultados do tratamento7.
Os critérios de inclusão do estudo foram pacientes com diagnóstico de câncer de próstata localizado ou localmente avançado com indicação de tratamento cirúrgico curativo; submetidos à prostatectomia radical no serviço de urologia oncológica do Hospital São Vicente em Curitiba (PR); e que aceitaram assinar o Termo de Consentimento Livre e Esclarecido (TCLE). Foram excluídos do estudo pacientes com prontuário eletrônico com dados faltantes e que não concordaram em assinar o TCLE.
Os resultados obtidos no estudo foram descritos por médias, desvio-padrão, medianas, valores mínimos e máximos (variáveis quantitativas) ou por frequências e percentuais (variáveis categóricas). Para a determinação de um ponto de corte para PSA inicial que esteja associado à recidiva bioquímica, foi ajustada uma curva receiver operating charactristic (ROC), um método gráfico que avalia a sensibilidade de um teste diagnóstico versus sua especificidade ou taxa de falso-positivos8. Modelos de Regressão de Cox, semiparamétrico que explora associações entre covariáveis9, foram ajustados para analisar a associação de fatores com o tempo livre de recidiva (análises univariada e multivariada). Para avaliar a significância de cada variável, foi usado o teste de Wald, método não paramétrico que avalia as restrições de parâmetros estatísticos10. Por meio do estudo stepwise backward, modelo de seleção de variáveis (em que valor de significância p<0,20 era excludente), foram analisadas as variáveis PSA inicial, toque retal, margem comprometida e extensão extraprostática. A medida de associação estimada foi a hazard ratio (HR), risco relativo da ocorrência do evento em função do tempo11, para a qual foram apresentados intervalos de confiança de 95% (IC 95%). Valores de p<0,05 indicaram significância estatística. Os dados foram analisados com o programa computacional Stata versão 14.1, da StataCorpLP, USA.
RESULTADOS
Dos 179 pacientes, 177 apresentavam dados clínicos e patológicos completos para análise. A idade média da população foi de 63,7 anos, e o tempo de seguimento médio de 34,9 meses.
O toque retal demonstrou alteração em 60,1% dos casos (104/177). A classificação ISUP da biópsia diagnóstica foi: 48,2% para o grupo 1, 23,5% para o grupo 2, 16,5% para o grupo 3 e 11,8% para os grupos 4 e 5, agrupados. A classificação de risco D’Amico mostrou 28,9% dos pacientes em risco baixo, 43,4% em risco intermediário e 27,7% em risco alto (Tabela 1).
|
Tabela 1. Variáveis clínicas e patológicas dos 177 pacientes estudados |
||
|
Variável |
Classificação |
n (%) |
|
Toque retal |
Alterado |
104 (60,1) |
|
Normal |
69 (39,9) |
|
|
Grau ISUP da biópsia de próstata |
1 |
82 (48,2) |
|
2 |
40 (23,5) |
|
|
3 |
28 (16,5) |
|
|
4 |
11 (6,5) |
|
|
5 |
9 (5,3) |
|
|
D’Amico |
Baixo |
50 (28,9) |
|
Intermediário |
75 (43,4) |
|
|
Alto |
48 (27,7) |
|
|
TNM clínico |
T1c |
68 (38,4) |
|
T2a |
48 (27,1) |
|
|
T2b |
24 (13,6) |
|
|
T2c |
18 (10,2) |
|
|
T3 |
19 (10,7) |
|
|
Grau ISUP da peça cirúrgica |
1 |
49 (28,3) |
|
2 |
55 (31,8) |
|
|
3 |
33 (19,1) |
|
|
4 |
14 (8,1) |
|
|
5 |
22 (12,7) |
|
|
TNM patológico |
T2 |
60 (34,5) |
|
T3a |
66 (37,9) |
|
|
T3b |
29 (16,7) |
|
|
TxN1 |
19 (10,9) |
|
|
Margem comprometida |
Não |
94 (53,7) |
|
Sim |
81 (46,3) |
|
|
Vesículas comprometidas |
Não |
136 (78,2) |
|
Sim |
38 (21,8) |
|
|
Extensão extraprostática |
Não |
92 (52,3) |
|
Sim |
84 (47,7) |
|
|
Legendas: ISUP = International Society of Urological Pathology; TNM = Classificação de Tumores Malignos. |
||
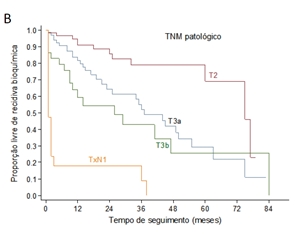
No estudo patológico cirúrgico, 71,7% apresentavam tumores clinicamente significativos, representados por ISUP de 2 a 5. O estádio TNM patológico demonstrou que 34,5% dos casos portavam doença pT2 (tumor confinado à próstata) e 37,9% classificados como pT3a, 16,7% pT3b e 10,9% pN1 (Tabela 1).
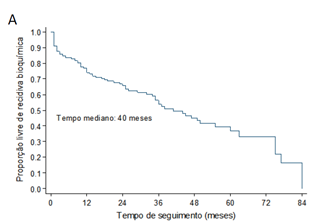
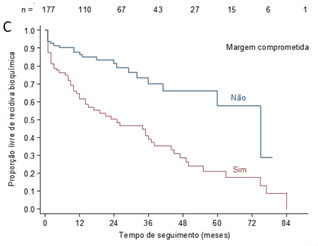
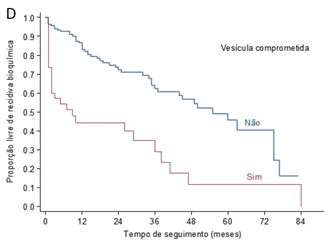
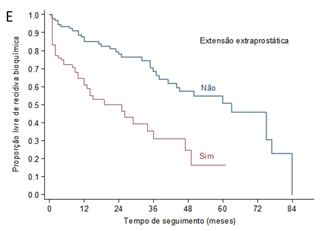
Conforme demonstra o Gráfico 1, em relação à sobrevida livre de recidiva bioquímica, em 40 meses aproximadamente, metade dos pacientes apresentou recidiva bioquímica. A presença de estadiamento patológico pT3 ou pN1, a presença de margem cirúrgica positiva, vesículas seminais comprometidas e extensão tumoral extracapsular foram variáveis correlacionadas a maior risco de recidiva bioquímica.
|
|
|
|
|
|
|
|
|
|
Gráfico 1. Curvas de sobrevida livre de recidiva bioquímica ao longo do tempo de seguimento em meses de acordo com variáveis patológicas cirúrgicas. A) Curva geral da sobrevida livre de recidiva bioquímica dos 177 pacientes estudados; B) Sobrevida livre de recorrência bioquímica associada ao estadiamento patológico TNM; C) Sobrevida livre de recidiva bioquímica associada à margem cirúrgica comprometia; D) Sobrevida livre de recidiva bioquímica associada ao comprometimento de vesículas seminais; E) Sobrevida livre de recidiva bioquímica associada à extensão extraprostática |
|
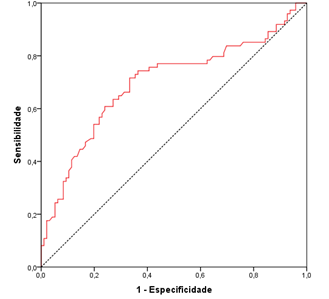
Em busca de um ponto de corte para o valor de PSA como possível marcador para recidiva bioquímica, foi demonstrado em curva ROC o ponto de corte de 9 ng/ml (Gráfico 2). A área abaixo da curva foi igual a 0,70 (p<0,001). Valores de PSA >9 ng/ml estão associados à recidiva com sensibilidade de 72% e especificidade de 67%.
|
|
|
Gráfico 2. Curva ROC associando valor inicial de PSA total (ng/ml) com o risco de recidiva bioquímica |
Na análise univariada, os fatores relevantes correlacionados com a recidiva bioquímica foram: PSA inicial acima de 9 ng/ml (p<0,001; HR 3,19), toque retal alterado (p=0,027; HR 1,74), risco D’Amico alto (p<0,001; HR 4,34), estadiamento clínico T3 (p<0,001; HR 3,65), ISUP 3 da peça cirúrgica (HR 2,11; p=0,021), ISUP 4 ou 5 (p=0,004; HR 2,54) e pN1 (p<0,001; HR 6,65), margens comprometidas (p<0,001; HR 2,92), vesículas seminais positivas (p<0,001; HR 3,26), extensão tumoral extraprostática (p<0,001; HR 3,06) de acordo com a Tabela 2.
|
Tabela 2. Análise univariada dos fatores clínicos e patológicos relacionados à recidiva bioquímica |
||||||
|
Variável |
Classificação |
n*** |
Recidiva bioquímica |
p* |
HR (IC 95%) |
|
|
Não |
Sim |
|||||
|
Idade (anos) |
64,1±6,2 (51-79) |
63,1±6,1 (51-77) |
0,865 |
1,00 (0,97-1,04) |
||
|
PSA inicial** |
9±5 (1,4-34,9) |
16,2±16,4 (3,5-105) |
<0,001 |
1,04 (1,02-1,05) |
||
|
≤9 ng/ml (ref.) |
83 |
62 (74,7) |
21 (25,3) |
|
|
|
|
>9 ng/ml |
94 |
34 (39,1) |
53 (60,9) |
<0,001 |
3,19 (1,91-5,33) |
|
|
Tempo de internamento |
2,7±1,1 (1-7) |
3,4±1,5 (2-11) |
0,081 |
1,14 (0,98-1,31) |
||
|
Toque retal |
Normal (ref.) |
69 |
46 (66,7) |
23 (33,3) |
||
|
Alterado |
104 |
52 (50) |
52 (50,0) |
0,027 |
1,74 (1,06-2,87) |
|
|
Grau ISUP da biópsia de próstata |
1 (ref.) |
82 |
51 (62,2) |
31 (37,8) |
|
|
|
2 |
40 |
26 (65,0) |
14 (35,0) |
0,694 |
1,14 (0,60-2,14) |
|
|
3 |
28 |
14 (50,0) |
14 (50,0) |
0,021 |
2,11 (1,12-3,99) |
|
|
4 ou 5 |
20 |
5 (25,0) |
15 (75,0) |
0,004 |
2,54 (1,35-4,80) |
|
|
Risco D’Amico |
Baixo (ref.) |
50 |
38 (76) |
12 (24,0) |
||
|
Intermediário |
75 |
44 (58,7) |
31 (41,3) |
0,041 |
2,00 (1,03-3,91) |
|
|
Alto |
48 |
14 (29,2) |
34 (70,8) |
<0,001 |
4,34 (2,24-8,43) |
|
|
TNM clínico |
T1c (ref.) |
68 |
42 (61,8) |
26 (38,2) |
|
|
|
T2a |
48 |
33 (68,8) |
15 (31,3) |
0,699 |
1,13 (0,60-2,15) |
|
|
T2b |
24 |
12 (50,0) |
12 (50,0) |
0,557 |
1,24 (0,61-2,53) |
|
|
T2c |
18 |
9 (50,0) |
9 (50,0) |
0,183 |
1,68 (0,78-3,61) |
|
|
T3 |
19 |
3 (15,8) |
16 (84,2) |
<0,001 |
3,65 (1,95-6,84) |
|
|
Grau ISUP da peça cirúrgica |
1 (ref.) |
49 |
33 (67,4) |
16 (32,7) |
||
|
2 |
55 |
35 (63,6) |
20 (36,4) |
0,098 |
1,76 (0,90-3,42) |
|
|
3 |
33 |
21 (63,6) |
12 (36,4) |
0,013 |
2,69 (1,23-5,89) |
|
|
4 ou 5 |
36 |
9 (25,0) |
27 (75,0) |
0,001 |
2,96 (1,57-5,56) |
|
|
TNM patológico |
T2 |
66 |
36 (54,6) |
30 (45,5) |
|
|
|
T3a |
60 |
48 (80,0) |
12 (20,0) |
0,003 |
0,36 (0,18-0,70) |
|
|
T3b |
29 |
12 (41,4) |
17 (58,6) |
0,237 |
1,44 (0,79-2,66) |
|
|
TxN1 |
19 |
2 (10,5) |
17 (89,5) |
<0,001 |
6,65 (3,51-12,6) |
|
|
Margem comprometida |
Não (ref.) |
94 |
72 (76,6) |
22 (23,4) |
||
|
Sim |
81 |
27 (33,3) |
54 (66,7) |
<0,001 |
2,92 (1,77-4,82) |
|
|
Vesículas comprometidas |
Não (ref.) |
136 |
88 (64,7) |
48 (35,3) |
||
|
Sim |
38 |
11 (29) |
27 (71,1) |
<0,001 |
3,26 (2,00-5,30) |
|
|
Extensão extraprostática |
Não (ref.) |
92 |
57 (62) |
35 (38) |
||
|
Sim |
84 |
42 (50) |
42 (50) |
<0,001 |
3,06 (1,87-4,99) |
|
|
Legendas: HR = hazard ratio; IC 95% = intervalos de confiança de 95%; PSA = antígeno prostático específico; ISUP = International Society of Urological Pathology; TNM = Classificação de Tumores Malignos; ref. = referência. (*) Modelo de Regressão de Cox e teste de Wald, p<0,05. (**) Ponto de corte indicado pelo ajuste de uma curva ROC (área abaixo da curva: 0,70 com significância estatística p<0,001). Sensibilidade do ponto de corte = 72%; especificidade do ponto de corte = 67%. (***) Número total de pacientes da amostra analisada (n=177). |
||||||
Na análise multivariada, foi vista a associação com a recidiva bioquímica das seguintes variáveis: ISUP 4 ou 5 (p=0,136; HR 1,85), margens comprometidas (p=0,073; HR 1,72), vesículas seminais comprometidas (p=0,527; HR 1,24) e extensão extraprostática (p=0,022; HR 2,05).
Na abordagem stepwise backward (p<0,20 para a variável sair do modelo), o PSA inicial >9 ng/ml (p=0,017; HR 2,06), toque retal alterado (p=0,030; HR 1,92), margem comprometida (p=0,029; HR 1,92) e extensão extraprostática (p=0,009; HR 2,2) foram correlacionados com maior risco de recidiva bioquímica (Tabela 3).
|
Tabela 3. Análise multivariada stepwise backward |
||||
|
Variável |
Classificação |
p* |
HR (IC 95%) |
|
|
PSA (ng/ml) |
≤9 |
|
|
|
|
>9 |
0,017 |
2,06 (1,14-3,74) |
||
|
Toque retal |
Normal |
|
|
|
|
Alterado |
0,030 |
1,92 (1,07-3,47) |
||
|
Margem comprometida |
Não |
|
|
|
|
Sim |
0,029 |
1,92 (1,07-3,46) |
||
|
Extensão extraprostática |
Não |
|
|
|
|
Sim |
0,009 |
2,20 (1,22-3,99) |
||
|
Legendas: HR = hazard ratio; IC 95% = intervalos de confiança de 95%; PSA = antígeno prostático específico. (*)Valores de p dos testes estatísticos e os valores estimados de HR com respectivos intervalos de confiança de 95% (IC 95%) para o modelo final. |
||||
DISCUSSÃO
Os dados do estudo demonstram a evolução clínica dos pacientes submetidos à prostatectomia radical em um serviço público oncológico brasileiro. Em 34,9 meses de seguimento, a recidiva bioquímica após tratamento cirúrgico para o câncer de próstata ocorreu em 44,1% dos casos, maior do que a ocorrência descrita em estudos semelhantes da literatura. Aguilera et al.12 reportaram 37,3% de recidiva bioquímica, enquanto outra série13 com 400 pacientes submetidos à prostatectomia radical relatou taxa de 32%.
O toque retal demonstrou alteração em 60,1% dos casos e foi fator independente para recidiva bioquímica (p=0,03; HR 1,92). Comparativamente, em uma série espanhola com 276 pacientes submetidos à prostatectomia para tratamento do câncer de próstata, 93 (33%) obtiveram o exame alterado12. O PSA acima do ponto de corte também foi determinante para prognóstico desfavorável (p<0,017), observando-se maior incidência de recidiva em pacientes com PSA inicial >9 ng/mL constituindo importante fator preditivo de recorrência bioquímica após tratamento cirúrgico.
Dos pacientes estudados, 10,9% tiveram linfonodos positivos nas peças das linfadenectomias pélvicas realizadas durante a prostatectomia. A porcentagem de comprometimento linfonodal na literatura é variável14,15. Abdollah et al.14 analisaram 5.274 pacientes com câncer de próstata tratados com prostatectomia radical e linfadenectomia pélvica estendida e encontraram 13,8% de linfonodos acometidos (N+). Os autores afirmam ter havido uma média mais elevada em relação a demais estudos americanos, possivelmente por realizarem uma linfadenectomia mais extensa do que outros estudos, o que levaria à maior amostragem de linfonodos14. Em outro estudo multicêntrico, reportou-se uma série com 130.080 pacientes submetidos à prostatectomia radical entre 1988 e 2006. Foi evidenciado que a média de acometimento linfonodal reduziu ao longo do tempo, de 10,7% no início do estudo para 3,1%, ao final. Essa queda pode ter sido relacionada à menor taxa de amostragem de linfonodos no decorrer do período15.
A porcentagem de margens cirúrgicas positivas foi de 46,3% e sua presença, relacionada na análise multivariada com a recidiva bioquímica (p=0,029). Em estudo com 1.250 pacientes submetidos à prostatectomia radical por câncer de próstata clinicamente localizado, 23,84% dos casos apresentavam margens cirúrgicas positivas16. As margens comprometidas apontaram para um maior risco de recidiva bioquímica. As taxas de falha de prostatectomia foram de 45% a 55% em pacientes com margens positivas quando comparados a 15% a 25% daqueles com margens livres16. Outro estudo com 74 pacientes submetidos à prostatectomia radical e com estadiamento patológico T3a mostrou taxa de margem cirúrgica positiva de 49,3%17. Na análise multivariada, presença de ISUP 4 ou maior na margem comprometida, margem comprometida maior do que 3 mm e presença de duas ou mais áreas de margem comprometida foram fortemente relacionadas à recorrência bioquímica18. A variabilidade das taxas de margens cirúrgicas comprometidas na literatura pode ser decorrente da heterogeneidade amostral do padrão clínico antes da cirurgia, além da heterogeneidade das técnicas cirúrgicas e experiência da equipe cirúrgica.
Uma das hipóteses para a elevada incidência das margens cirúrgicas positivas é o fato de cirurgiões em formação (residentes e especializandos) participarem ativamente das cirurgias. A curva de aprendizagem dos cirurgiões pode elevar a incidência de margens positivas. Um estudo19 que se propôs a estudar curva de aprendizado da prostatectomia radical evidenciou que, após 20 cirurgias, houve uma redução significativa no tempo operatório de 150 para 120 minutos e, após a 29ª cirurgia, a necessidade de transfusão de sangue também diminuiu de 9% para 3%. Entretanto, o percentual de margens cirúrgicas comprometidas permaneceu estável durante a curva de aprendizado, sugerindo um elevado número de casos operados para reduzir a sua incidência19.
Outra hipótese é de que pacientes do grupo analisado chegaram com doença em estágio clínico e patológico mais avançado. A totalidade dos pacientes consiste em usuários do SUS e questões como acesso e diagnóstico mais tardio sugerem ser o status socioeconômico um fator independente da recorrência bioquímica20. Um estudo Australiano evidenciou o impacto do status socioeconômico na sobrevida geral de pacientes oncológicos. Em seus resultados, a população portadora de câncer de estômago, colorretal, fígado, pulmões, mama e próstata, que morava em regiões de periferia, teve piores resultados21. Freeman et al.22 realizaram um estudo semelhante, focado em câncer de próstata, no qual verificou-se que o pior status socioeconômico foi significativamente relacionado à menor sobrevida de câncer específica, em população americana.
É importante mencionar algumas limitações do estudo: o caráter retrospectivo da coleta de dados, o que pode resultar em falta de uniformidade dos dados registrados em prontuário eletrônico. A amostra foi coletada em apenas uma instituição, o que impede a generalização dos resultados obtidos, sendo necessários futuros estudos multicêntricos nacionais.
Por se tratar de dados da rede pública de atendimento, fonte de cuidados médicos da maioria da população brasileira, sua interpretação pode ajudar no desenvolvimento de estratégias que visem a reduzir o impacto do câncer de próstata e suas repercussões após tratamento. Estratégias como aumentar o alcance de informação dos pacientes e a equipe de saúde quanto ao diagnóstico precoce e ao tratamento efetivo da população poderão contribuir para aumentar a sobrevida livre de recorrência bioquímica após tratamento cirúrgico.
CONCLUSÃO
Em uma população atendida por um serviço público de oncologia do Sul do Brasil, foi encontrado um padrão patológico mais agressivo e, por consequência, uma maior taxa de recidiva bioquímica, em comparação com a literatura.
Atraso no diagnóstico oncológico e curva de aprendizado dos cirurgiões em treinamento são possíveis fatores associados aos resultados.
AGRADECIMENTOS
À Márcia Olandoski pela contribuição nas análises estatísticas.
CONTRIBUIÇÕES
Todos os autores contribuíram substancialmente na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados, assim como na redação e revisão crítica com contribuição intelectual; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Ministério da Saúde (BR), Secretaria de Atenção à Saúde. Portaria nº 498, de 11 de maio de 2016. Aprova as Diretrizes Diagnósticas e Terapêuticas do Adenocarcinoma de Próstata. Diário Oficial da União, Brasília, DF. 2016 maio12 [acesso 2019 ago 12]; Seção 1:140. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/sas/2016/prt0498_11_05_2016.html
2. Belinelo RGS, Almeida SM, Oliveira PP, et al. Exames de rastreamento para o câncer de próstata: vivência de homens. Esc Anna Nery Rev Enferm. 2014;18(4):697-704. doi: https://doi.org/10.5935/1414-8145.20140099
3. Instituto Nacional de Câncer. Programa Nacional de Controle do Câncer da Próstata: documento de consenso [Internet]. Rio de Janeiro: INCA; 2002 [acesso 2019 ago 12]. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/cancer_da_prostata.pdf
4. Mottet N, van den Bergh RCN, Briers E, et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer—2020 Update. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent. Eur Urol. 2021;79(2):243-62. doi: https://doi.org/10.1016/j.eururo.2020.09.042
5. Conselho Nacional de Saúde (BR). Resolução nº 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos [Internet]. Diário Oficial da União, Brasília, DF. 2013 jun 13 [acesso 2019 set 20]; Seção 1:59. Disponível em: https://conselho.saude.gov.br/resolucoes/2012/Reso466.pdf
6. D’Amico AV, Whittington R, Malkowicz SB, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA. 1998;280(11):969-74. doi: https://doi.org/10.1001/jama.280.11.969
7. Sobin LH. TNM: principles, history, and relation to other prognostic factors. Cancer. 2001;91(8 Suppl):1589-92. doi: https://doi.org/10.1002/1097-0142(20010415)91:8+<1589::aid-cncr1170>3.0.co;2-k
8. Park SH, Goo JM, Jo CH. Receiver operating characteristic (ROC) curve: practical review for radiologists. Korean J Radiol. 2004;5(1):11-8. doi: https://doi.org/10.3348/kjr.2004.5.1.11
9. Kong D, Ibrahim JG, Lee E, et al. FLCRM: functional linear cox regression model. Biometrics. 2018;74(1):109-17. doi: https://doi.org/10.1111/biom.12748
10. Fahrmeir L, Kneib T, Lang S, et al. Regression: models, methods and applications. Berlim: Springer; c2013. doi: https://doi.org/10.1007/978-3-642-34333-9
11. Bradburn MJ, Clark TG, Love SB, et al. Survival analysis part II: multivariate data analysis--an introduction to concepts and methods. Br J Cancer. 2003;89(3):431-6. doi: https://doi.org/10.1038/sj.bjc.6601119
12. Aguilera A, Bañuelos B, Díez J, et al. Biochemical recurrence risk factors in surgically treated high and very high-risk prostate tumors. Cent European J Urol. 2015;68(3):302-7. doi: https://doi.org/10.5173/ceju.2015.485
13. Noronha MR, Quintal MMQ, Magna LA, et al. Controversial predictors of biochemical recurrence after radical prostatectomy: a study from a Latin American (Brazilian) Institution. Int Braz J Urol. 2013;39(6):779-92. doi: https://doi.org/10.1590/S1677-5538.IBJU.2013.06.03
14. Abdollah F, Suardi N, Gallina A, et al. Extended pelvic lymph node dissection in prostate cancer: a 20-year audit in a single center. Ann Oncol. 2013;24(6):1459-66. doi: https://doi.org/10.1093/annonc/mdt120
15. Abdollah F, Sun M, Thuret R, et al. Decreasing rate and extent of lymph node staging in patients undergoing radical prostatectomy may undermine the rate of diagnosis of lymph node metastases in prostate cancer. Eur Urol. 2010;58(6):882-92. doi: https://doi.org/10.1016/j.eururo.2010.09.029
16. de La Roca R, Cunha IW, Bezerra SM, et al. Radical prostatectomy and positive surgical margins: relationship with prostate cancer outcome. Int Braz J Urol. 2014;40(3):306-15. doi: https://doi.org/10.1590/S1677-5538.IBJU.2014.03.03
17. Leite KRM, Hartmann C, Reis ST, et al. Biochemical recurrence rates are similar for pT2-positive surgical margins and pT3a. Int Braz J Urol. 2014;40(2):146-53. doi: https://doi.org/10.1590/S1677-5538.IBJU.2014.02.03
18. Lee W, Lim B, Kyung YS, et al. Impact of positive surgical margin on biochemical recurrence in localized prostate cancer. Prostate Int. 2021;9(3):151-6. doi: https://doi.org/10.1016/j.prnil.2020.12.004
19. Saito FJA, Dall’Oglio MF, Ebaid GX, et al. Learning curve for radical retropubic prostatectomy. Int Braz J Urol. 2011;37(1):67-74. doi: https://doi.org/10.1590/S1677-55382011000100009
20. Galvão AO, Martins PCV, Loyola FAZ, et al. Câncer de próstata: protocolo institucional do hospital das clínicas da Universidade Federal de Minas Gerais [Internet]. Urominas. 2018 [acesso 2019 ago 12];6(13):15-24. Disponível em: http://urominas.com/wp-content/uploads/2018/09/Ca%CC%82ncer-de-Pro%CC%81stata-%E2%80%93-Protocolo-institucional.pdf
21. Stanbury JF, Baade PD, Yu Y, et al. Cancer survival in New South Wales, Australia: socioeconomic disparities remain despite overall improvements. BMC Cancer. 2016;16:48. doi: https://doi.org/10.1186/s12885-016-2065-z
22. Freeman VL, Ricardo AC, Campbell RT, et al. Association of census tract-level socioeconomic status with disparities in prostate cancer-specific survival. Cancer Epidemiol Biomarkers Prev. 2011;20(10):2150-9. doi: https://doi.org/10.1158/1055-9965.EPI-11-0344
Recebido em 11/1/2022
Aprovado em 21/3/2022
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde