REVISÃO DA LITERATURA
Benefits and Safety of Physical Exercises in Patients with Bone Metastases: Systematic Literature Review and Meta-Analysis
Beneficios y Seguridad de los Ejercicios Físicos en Pacientes con Metástasis Óseas: Revisión Sistemática de la Literatura y Metanálisis
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n4.2520
Letícia Antoniolli Siiss1; Amanda Guarda2; Daniela Bertol Graeff3; Sheila Cristina Cecagno-Zanini4
1-3Universidade de Passo Fundo (UPF), Hospital de Clínicas de Passo Fundo (HCPF), Programa de Residência Multiprofissional em Atenção ao Câncer. Secretaria Municipal de Saúde de Passo Fundo. Passo Fundo (RS), Brasil. E-mails: leti.siiss@hotmail.com; amandaguarda@outlook.com; danibertol@upf.br. Orcid iD: https://orcid.org/0000-0002-2338-0718; Orcid iD: https://orcid.org/0000-0002-5822-8791; Orcid iD: https://orcid.org/0000-0002-7182-8855
4Universidade Estadual do Oeste do Paraná (Unioeste), Hospital Universitário de Santa Maria (HUSM). Santa Maria (RS), Brasil. E-mail: sheilacecagno@hotmail.com. Orcid iD: https://orcid.org/0000-0003-0833-0269
Endereço para correspondência: Letícia Antoniolli Siiss. Rua Quinze de Novembro, 930 – Centro. Passo Fundo (RS), Brasil. CEP 99010-090. E-mail: leti.siiss@hotmail.com
RESUMO
Introdução: A expectativa de vida de pessoas com câncer metastático está aumentando, mas esse grupo de pacientes corre um risco considerável de apresentar problemas psicológicos e de saúde física. Nesse sentido, o exercício físico tem sido um aliado no tratamento de pacientes com metástases ósseas. Objetivo: Realizar uma revisão sistemática e metanálise sobre a segurança e os benefícios do exercício físico em pacientes com metástases ósseas. Método: Metanálise com pesquisa bibliográfica realizada nas bases eletrônicas: PubMed, LILACS, PEDro e Embase. Resultados: Dos 396 estudos, somente dez foram incluídos, com um total de 531 indivíduos. Não foi observado nenhum efeito adverso musculoesquelético durante a intervenção, sendo significativamente seguro o exercício em indivíduos com metástases ósseas. Não houve melhora considerável na capacidade aeróbica, progressão da doença, qualidade de vida, massa magra e gordura corporal. Três dos estudos incluídos avaliaram a dor durante e após a intervenção, demonstrando melhora no escore de dor, assim como a diminuição do uso do analgésico no grupo intervenção. Conclusão: A terapia com exercícios aeróbicos e isométricos é segura para pacientes com metástases ósseas, além de apresentar melhora da dor, mas sem evolução relevante na capacidade aeróbica, na progressão da doença, na massa corporal e na qualidade de vida.
Palavras-chave: modalidades de fisioterapia; exercício físico; neoplasias ósseas; metástase neoplásica; ensaio clínico controlado aleatório.
ABSTRACT
Introduction: The life expectancy of individuals with metastatic cancer is increasing, but this group of patients is at considerable risk of having psychological and physical health problems. In this sense, physical exercise has been an ally in the treatment of patients with bone metastases. Objective: Systematic review and meta-analysis on the safety and benefits of physical exercise in patients with bone metastases. Method: Meta-analysis with bibliographic investigation carried out in the electronic databases PubMed, LILACS, PEDro and Embase. Results: Of the 396 studies, only 10 were included, with a total of 531 subjects. No adverse musculoskeletal effects were observed during the intervention, with exercise being significantly safe in individuals with bone metastases. There was no significant improvement in aerobic capacity, disease progression, quality of life, lean mass and body fat. Three of the studies included assessed pain during and after the intervention, showing an improvement in the pain score, as well as a decrease in use of analgesics in the intervention group. Conclusion: Therapy with aerobic and isometric exercises is safe in patients with bone metastases, in addition, it improves pain, but without significant increase of aerobic capacity, disease progression, body mass and quality of life.
Key words: physical therapy modalities; exercise; bone neoplasms; neoplasm metastasis; randomized controlled trial.
RESUMEN
Introducción: La esperanza de vida de las personas con cáncer metastásico está aumentando, pero este grupo de pacientes tiene un riesgo considerable de tener problemas de salud física y psicológica. En este sentido, el ejercicio físico ha sido un aliado en el tratamiento de pacientes con metástasis óseas. Objetivo: Realizar una revisión sistemática y un metanálisis sobre la seguridad y los beneficios del ejercicio físico en pacientes con metástasis óseas. Método: Metanálisis con búsqueda bibliográfica realizada en bases de datos electrónicas: PubMed, LILACS, PEDro y Embase. Resultados: De los 396 estudios, solo se incluyeron 10, con un total de 531 sujetos. No se observaron efectos musculoesqueléticos adversos durante la intervención, siendo el ejercicio significativamente seguro en individuos con metástasis óseas. No hubo una mejora significativa en la capacidad aeróbica, la progresión de la enfermedad, la calidad de vida, la masa magra y la grasa corporal. Tres de los estudios incluidos evaluaron el dolor durante y después de la intervención, mostrando una mejoría en la puntuación del dolor, así como una disminución en el uso de analgésicos en el grupo de intervención. Conclusión: La terapia con ejercicios aeróbicos e isométricos es segura para los pacientes con metástasis óseas, además presenta mejoría del dolor, pero sin mejoría significativa en la capacidad aeróbica, progresión de la enfermedad, masa corporal y calidad de vida.
Palabras clave: modalidades de fisioterapia; ejercicio físico; neoplasias óseas; metástasis de la neoplasia; ensayo clínico controlado aleatorio.
INTRODUÇÃO
As metástases ósseas são uma condição frequente em pacientes com câncer avançado1. Aproximadamente dois terços dos pacientes com tumor desenvolvem metástases ósseas no curso de sua doença, sendo a coluna vertebral a localização mais frequente2. É uma grande preocupação clínica em virtude de dor intensa, fraturas patológicas, compressão da medula espinhal, com uma diminuição significativa da qualidade de vida3,4. Estima-se que 70% de todos os pacientes que morrem das sequelas da doença tumoral apresentam metástases ósseas5. A metástase é, portanto, o resultado final de várias etapas interdependentes, um processo multifacetado que inclui uma complexa interação entre o tumor e o organismo hospedeiro6.
A expectativa de vida das pessoas com câncer metastático está aumentando, mas esse grupo de pacientes corre um risco considerável de apresentar problemas psicológicos e de saúde física7,8. Apesar das evidências crescentes de benefícios relevantes para a saúde, o exercício físico diminui consideravelmente durante o tratamento do câncer e permanece baixo depois9. Há evidências de que manter ou aumentar a atividade física em pacientes com câncer pode melhorar a qualidade de vida e o bem-estar à medida que a doença progride10,11. Contudo, pacientes com câncer e metástases ósseas geralmente tendem a se abster de exercícios físicos em razão de questões de insegurança. A inatividade física está associada a uma perda na função física, mobilidade, equilíbrio, massa muscular protetora, força e densidade mineral óssea12. Isso não apenas prejudica a qualidade de vida, mas também aumenta o risco de comorbidades e de fraturas.
Globalmente, as diretrizes de exercícios para câncer recomendam que indivíduos com metástases ósseas evitem a inatividade e realizem exercícios aeróbicos e de resistência13. A terapia por exercícios é um método promissor com o potencial de diminuir os sintomas e os efeitos colaterais do tratamento em pacientes com câncer. Consequentemente, melhorar a função física e retardar ou prevenir complicações esqueléticas em pacientes com metástases ósseas pode fornecer benefícios clinicamente significativos para os pacientes14. Porém, percebe-se, na prática clínica, que existem incertezas e inseguranças dos profissionais de saúde quanto ao tipo, à frequência e à intensidade de exercícios, além de haver receio de fratura óssea ou complicações musculoesqueléticas com esse perfil de pacientes.
Portanto, esta revisão teve como objetivo apresentar sistematicamente as evidências de intervenção com exercícios em indivíduos com metástases ósseas, assim como avaliar a segurança e os benefícios potenciais nesse grupo.
MÉTODO
Trata-se de uma revisão sistemática e metanálise cuja elaboração seguiu as recomendações propostas pela Colaboração Cochrane15 e pelo Preferred Reporting Items for Systematical Review and Metaanalyses: The PRISMA Statement16. Este estudo está registrado na base de revisões sistemáticas do International Prospective Register of Systematic Reviews (PROSPERO) com ID CRD42021288305.
Foram incluídos ensaios clínicos randomizados (ECR), publicados entre 2011 e 2021, artigos completos disponíveis para acesso, escritos em português, inglês e espanhol, que se enquadraram nos seguintes critérios: (1) indivíduos diagnosticados com metástase óssea independente do seu sítio primário; (2) tumores sólidos ou hematológicos; (3) idade maior ou igual a 18 anos; (4) que envolvessem intervenções com exercício aeróbico, exercício resistido ou exercício combinado (resistido/aeróbico/mobilidade) comparados com grupo controle (que não realizaram nenhum exercício ou que realizaram alguma atividade que não interferisse no tipo de exercício testado).
Foram excluídos os estudos: 1) com informações insuficientes sobre os resultados e intervenção (não obter os resultados do grupo controle trazendo informações apenas do grupo intervenção, não ter resultado do início e fim da intervenção nos impossibilitando de realizar metanálise, não conter resultados esclarecidos nas tabelas e sem resposta dos autores após entrar em contato por e-mail para esclarecimento dos resultados); 2) em que havia algum dos grupos de participantes com indivíduos sem metástase óssea; 3) que não descreviam qual o tipo de metástase.
A seleção dos artigos ocorreu em maio de 2021 utilizando as bases de dados eletrônicas, National Library of Medicine (PubMed), Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS), Physiotherapy Evidence Database (PEDro) e Embase. A terminologia utilizada para a busca baseou-se no Medical Subject Headings (MeSH) e nos Descritores em Ciências da Saúde (DeCS). Foram utilizados os termos “Neoplasm Metastasis”, “Physical Therapy Modalities”, “Exercise”, “Randomized Controlled Trial” e seus sinônimos, conforme o Quadro 1.
|
Quadro 1. Estratégia de busca utilizada na ferramenta PubMed |
|||
|
Os títulos e resumos de todos os artigos identificados pela estratégia de busca foram avaliados, independentemente, por dois investigadores. Todos os resumos que não forneceram informações suficientes sobre os critérios de inclusão e exclusão foram avaliados na íntegra e selecionados de acordo com os critérios de elegibilidade. Os mesmos dois revisores conduziram de forma individual a extração dos dados no que diz respeito às características metodológicas dos estudos, características dos pacientes, características das intervenções e desfecho. Os desacordos foram resolvidos por consenso ou por um terceiro revisor.
Para a construção desta revisão, foram percorridas as seis etapas que consistem em: elaboração da questão de pesquisa, busca na literatura dos estudos primários com base nos critérios de inclusão e exclusão, organização dos estudos pré-selecionados (extração de dados dos estudos), análise crítica dos estudos selecionados, síntese dos resultados e apresentação da revisão integrativa.
A avaliação da qualidade metodológica dos estudos incluídos realizou-se de forma descritiva e com as seguintes características: geração de sequência aleatória, alocação sigilosa, cegamento dos avaliadores dos desfechos, uso da análise de intenção de tratar e descrição das perdas e exclusões. Para avaliar o risco de viés de ECR, utilizou-se a ferramenta Revised Cochrane risk-of-bias tool for randomized trials (RoB 2)17, que é recomendada pela colaboração Cochrane atualmente, em substituição da Cochrane Risk of Bias Tool. Foram levados em consideração os seguintes domínios: viés no processo de randomização, desvios da intervenção pretendida (cegamento), viés por causa de dados faltantes, viés na aferição dos desfechos e viés no relato dos desfechos.
A metanálise foi realizada por intermédio do modelo de efeitos randômicos, e as medidas de efeito foram obtidas pelos valores pós-intervenção. Os estudos foram analisados separadamente de acordo com o tipo de exercício realizado. Considerou-se estatisticamente significativo um valor alfa igual a 0,05 e intervalo de confiança de 95% (IC 95%). A heterogeneidade estatística dos efeitos de tratamento entre os estudos foi avaliada pelos testes de Q de Cochran e de inconsistência (I²), em que se considerou que valores acima de 25% e 50% indicavam heterogeneidade moderada e alta, respectivamente. Todas as análises foram realizadas mediante o programa Review Manager, versão 5.3 (Colaboração Cochrane) conforme a Figura 1.
|
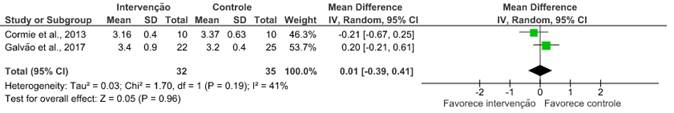
Teste de caminhada de 6 minutos
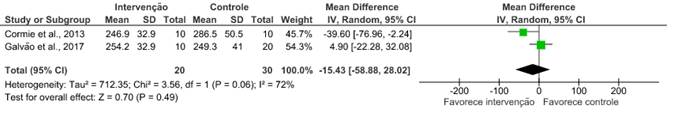
Teste caminhada de 400 metros
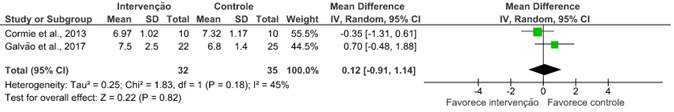
Teste Timed Up and Go
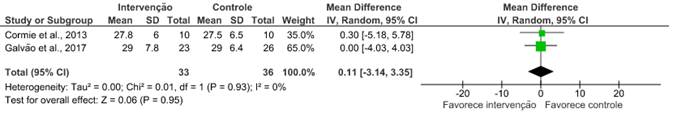
Massa de gordura corporal total
Massa magra
Questionário de qualidade de vida SF-36
Progressão da doença
|
|
Figura 1. Análise dos desfechos avaliados em pacientes com metástases ósseas comparando os grupos controle e intervenção |
RESULTADOS
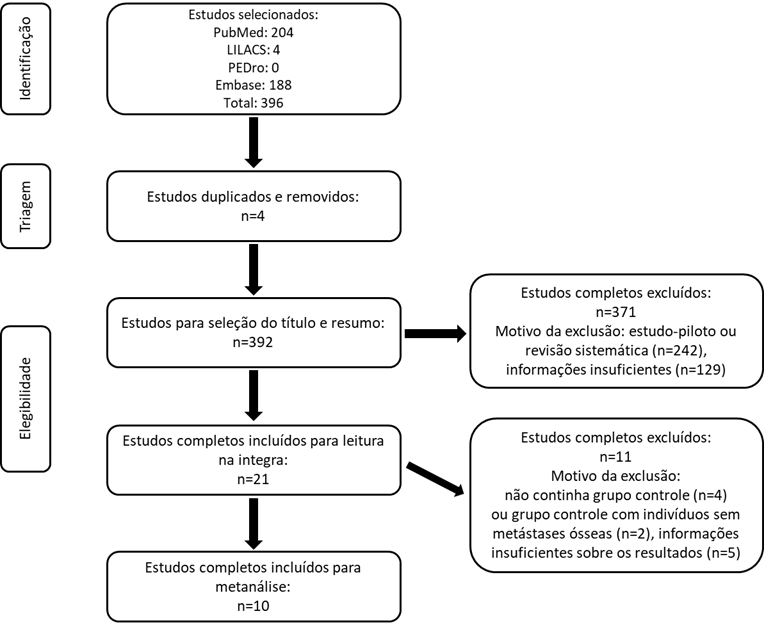
Foram encontrados 396 estudos nas bases de dados. Destes, dez artigos foram considerados de potencial relevância para análise completa dos estudos, podendo ser realizada a metanálise. Outros dez estudos preencheram os critérios de elegibilidade para a revisão sistemática, mas com resultados insuficientes para realização da metanálise. A Figura 2 representa o fluxograma da busca pelos estudos. As principais características dos estudos incluídos estão descritas no Quadro 2.
|
|
|
Figura 2. Fluxograma dos estudos identificados, segundo o PRISMA, Rio Grande do Sul, Brasil, 2021 |
|
Quadro 2. Características dos estudos selecionados sobre exercício em pacientes com metástases ósseas |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Legendas: mín. = mínimo; máx. = máximo. |
Para calcular o risco de viés, ou seja, avaliar a qualidade metodológica dos estudos, foi utilizada a ferramenta RoB 217 por ser atualmente recomendada pela Colaboração Cochrane. Os estudos incluídos na metanálise apresentaram 100% de mascaramento adequado, 100% de dados presentes (sem perdas de seguimento) e também 100% de relato dos desfechos adequado. Porém, o processo de randomização foi adequado em 40% dos estudos, e a aferição dos desfechos foi de 60% adequado. Assim, o resultado final dos dez ECR incluídos teve 20% de baixo risco de viés e 80% de algumas preocupações com viés de acordo com o Quadro 3.
|
Quadro 3. Risco de viés dos estudos selecionados |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Nove artigos14,18-25 avaliaram a segurança da fisioterapia e do exercício físico durante a intervenção em pacientes com metástase óssea. Os desfechos avaliados foram quedas, fraturas, internações hospitalares, eventos adversos e complicações esqueléticas. Na avaliação desses desfechos após a fisioterapia com exercícios combinados e exercícios isométricos, nenhum estudo apresentou algum efeito adverso como quedas ou complicações musculoesqueléticas. Na avaliação das fraturas, não houve diferença significativa entre os grupos controle e intervenção após fisioterapia com exercícios combinados, pois ambos os grupos não apresentaram o evento fratura durante e após a intervenção.
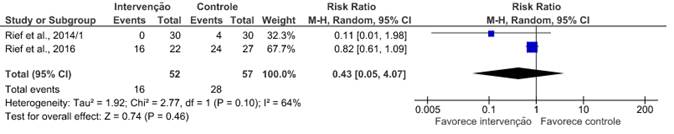
Por meio das metanálises realizadas, pode-se dizer que não houve efeito relevante na diminuição da progressão da doença por meio de exercícios isométricos21,25 (risco relativo – RR: 0,45; IC 95%: 0,05 a 4,07; I2=64%), e a alta heterogeneidade pode ser explicada em virtude dos vieses encontrados nos artigos, os quais geram uma diminuição na qualidade metodológica dos estudos. Bjerre et al.18 trouxeram como intervenção o exercício aeróbico e teve como resultado significativo mais casos de progressão da doença no grupo controle (16 pacientes de 19) em comparação com o grupo intervenção (9 de 22; p=0,009).
Dois14,19 dos nove artigos avaliaram a capacidade aeróbica desses pacientes após o uso de exercícios combinados, em que não houve melhora considerável nos desfechos apresentados. Os desfechos avaliados nesses artigos contaram com o teste de caminhada de seis minutos (RR: 0,01; IC 95%: -0,39 a 0,41; I2=41%); o de caminhada de 400 metros (RR: -15,43; IC 95%: -58,88 a 28,02; I2=72%); e o teste Timed Up and Go (RR: 0,12; IC 95%: -0,91 a 1,14; I2=45%).
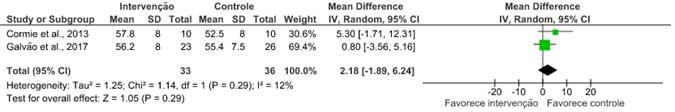
Para a avaliação desse desfecho, a massa magra e a gordura corporal foram avaliadas por absorciometria de raios-X de dupla energia de corpo inteiro (Hologic Discovery A, Waltham, MA, EUA). Dos dez artigos selecionados, apenas dois14,19 avaliaram a massa magra (RR: 2,18; IC 95%: -1,89 a 6,24; I²=12%) e a gordura corporal (RR: 0,11; IC 95%: -3,14 a 3,35; I²=0%), após a fisioterapia com o uso de exercícios combinados. Cormie et al.19 relataram uma mudança em todo o corpo e diferença significativa na massa magra apendicular dos grupos durante a intervenção de 12 semanas. Já Galvão et al.14 não constataram mudanças para medidas de massa magra ou massa gorda corporal total. Após a metanálise, conclui-se que não houve melhora significativa nos desfechos apresentados.
Três artigos19,21,23 relataram a avaliação da dor mediante a escala visual analógica (EVA) após intervenção, mas não foi possível realizar metanálise desses desfechos, pois cada artigo relatou o resultado de uma maneira diferente, obtendo resultados heterogêneos, mesmo quando se trata da própria escala.
Rief et al.21 descreveram, em seu artigo, que o grupo de intervenção melhorou no escore de dor (EVA: 0-10) ao longo do curso (p<0,001) e foi relevantemente melhor entre os grupos (p=0,003) após três meses.
Em outro estudo de Rief et al.23, selecionado para esta revisão, o curso da EVA no grupo de intervenção foi expressivamente menor durante e após a radioterapia (p<0,001). O uso de medicação analgésica mostrou o mesmo resultado, sendo significativamente menor o uso de analgésicos durante e após a radioterapia no grupo intervenção (p<0,001). Com o passar do tempo, a medicação concomitante e a dose equivalente de morfina oral diminuíram no grupo intervenção, mas aumentaram no grupo controle.
Cormie et al.19 relataram que a gravidade da dor óssea relatada em cada sessão de exercício foi baixa, com uma média de 0,6±0,7 em uma escala de 0 (sem dor) a 10 (dor muito forte) e um máximo de 1,4±1,2 em todas as sessões. O nível mais alto de dor óssea registrado durante o programa de exercícios foi 3,3.
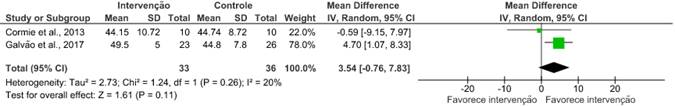
A metanálise pode ser feita com dois artigos14,19 que avaliaram esse desfecho da mesma maneira. Esses estudos trouxeram o resultado da qualidade de vida por meio da escala Short Form Health Survey 36 (SF-36). O uso de exercícios combinados não apresentou melhora relevante na qualidade de vida (RR: 3,54; IC 95%: -0,76 a 7,83; I²=20%), possivelmente por conter poucos estudos e com pequena amostra.
Bjerre et al.18 avaliaram a qualidade de vida por meio da escala Functional Assessment of Cancer Therapy – Prostate (FACT-P), específica para câncer de próstata, e seu resultado foi expressivamente maior no grupo intervenção em comparação com o grupo controle em 12 semanas, com uma diferença de 7,6 pontos (IC 95%: 0,5 a 15,0; p=0,038). Rief et al.23 avaliaram esse desfecho com a utilização do European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire Bone Metastases Module (EORTC QLQ-BM22), porém, com a exceção dos aspectos psicossociais, a diferença entre os grupos não atingiu significância estatística, o que também pode ser em razão do pequeno tamanho da amostra de estudo, que foi de 60 pacientes.
DISCUSSÃO
Este estudo incluiu dez ECR1,14,18-25 cuja frequência de todos os estudos foi de seis meses, com duração de 15 minutos a uma hora cada intervenção, contendo um total de 531 participantes randomizados, dos quais 265 fizeram parte do grupo intervenção, e 266 fizeram parte do grupo controle. Três ECR14,19,20 adotaram como intervenção o exercício combinado (exercícios resistidos + exercícios aeróbicos + exercícios de alongamento e de flexibilidade), cinco ECR21,22-25 realizaram apenas exercícios isométricos, um1 teve como conduta exercícios isométricos em conjunto com exercícios de flexibilidade, e um estudo18 realizou apenas exercícios aeróbicos.
O estudo apresenta limitações no que se refere à dificuldade para conseguir uma amostra homogênea e à deficiência metodológica dos artigos por trazer formas diferentes de descrição dos resultados e não descrever os valores do desvio-padrão e média das variáveis. Outra questão limitante foi a falta da escrita esclarecida dos resultados, impossibilitando a interpretação e a realização da metanálise.
Ao analisar os estudos, nove deles14,18-25 avaliaram a segurança do exercício físico em pacientes com metástases ósseas; os resultados são positivos em relação ao exercício, já que nenhum apresentou algum efeito adverso ou complicações musculoesqueléticas, nem apresentou nenhuma fratura. Além disso, houve quatro internações hospitalares no grupo controle e nenhuma no grupo intervenção18.
Indivíduos com metástases ósseas geralmente são imobilizados, principalmente por causa do risco de fraturas patológicas e do perigo relacionado de compressão da medula espinhal. Rosenberger et al.1 investigaram a viabilidade de exercícios isométricos de estabilização da coluna vertebral concomitantes à radioterapia paliativa analgésica em pacientes com metástases espinhais instáveis (ou seja, alto risco de fratura, pontuação de Taneichi ≥ D)26; como resultado, os exercícios mostraram-se seguros e, dadas as adaptações individuais, também viáveis e eficazes em termos de força muscular específica.
Contudo, pacientes com câncer e metástases ósseas geralmente tendem a se abster de exercícios físicos, em muitos casos, por sua própria insegurança. Por conta da relativa escassez de pesquisas sobre a segurança e a eficácia do exercício no ambiente de oncologia, a não realização de exercícios é altamente prejudicial, pois a inatividade física está associada a uma perda na função física e, consequentemente, em declínios adicionais na estrutura e na função musculoesquelética, maior risco de comorbidades, fraturas e redução da qualidade de vida1,19.
Bjerre et al.18 e Cormie et al.19 sugerem que exercícios aeróbicos e de resistência apropriadamente projetados e supervisionados podem ser seguros e bem tolerados por pacientes com metástase óssea e podem levar a melhorias na função física. Um esforço de treinamento entre 20% e 30% da potência máxima não causa aumento nem diminuição da força e pode ser visto como uma correspondência com a carga diária de tensões musculares induzidas. Quando um paciente é imobilizado, os músculos são ativados apenas em um grau inferior a 20%, resultando em sua atrofia. O limite de treinamento, portanto, fica em aproximadamente 30%-40% da força muscular máxima, acima da qual o treinamento pode ter um efeito positivo27. Esse foi o nível de potência de exercício que Cormie et al.19 utilizaram em sua intervenção. Nesse grupo de pacientes, observa-se que o treinamento isométrico dos músculos paravertebrais pode ser praticado com segurança em pacientes paliativos com metástases ósseas instáveis da coluna vertebral, melhorando seu escore de dor e mobilidade.
Para a avaliação da capacidade aeróbica, foram utilizados o teste de caminhada de seis minutos, o de caminhada de 400 metros, e o teste Timed Up and Go, por meio dos quais foi possível realizar a metanálise de dois estudos14,19 desses desfechos. Cormie et al.19, em seu estudo, trazem como resultado melhora na capacidade de exercício aeróbico submáximo, com mudanças favoráveis na função física observada para o grupo de exercício em comparação com o grupo de cuidados habituais. Contudo, no estudo de Galvão et al.14, não houve mudança para medidas da função física. A evidência disponível a partir da metanálise desses dois ECR, que compararam exercício combinado (38 indivíduos do grupo intervenção) versus controle (39 indivíduos), sustenta que o exercício combinado não apresentou melhora significativa nesse desfecho.
Em contrapartida, estudos apresentaram uma melhora clinicamente relevante da capacidade funcional, como força muscular, capacidade aeróbica submáxima e deambulação após treinamento envolvendo exercícios combinados e isométricos de resistência19,28.
A massa de gordura corporal e a massa magra, nesta análise, não diferiram significativamente entre os grupos. Resultados heterogêneos foram observados, dois estudos18,19 relataram diminuição da gordura corporal e melhora ou manutenção da massa corporal magra, assim como melhora na densidade mineral óssea do quadril. Já no estudo de Galvão et al.14, não houve mudanças para medidas de massa magra ou massa gorda corporal total. Diante desses resultados, entende-se que o exercício aeróbico diminui a gordura corporal e apresenta manutenção na massa magra apendicular, protegendo contra quedas e complicações esqueléticas que causam morbimortalidade significativa; entretanto, o exercício combinado não apresenta diferença considerável nesses desfechos.
Achados sobre densidade óssea, no estudo de Rief et al.24, relatam que o exercício combinado nos traz resultados de que a densidade óssea em todas as metástases aumentou significativamente em 28,3% e 80,3% após três e seis meses, respectivamente, no grupo intervenção, concluindo que o treinamento de resistência concomitante à radioterapia pode melhorar a densidade óssea. Juntamente a esse resultado, na intervenção com exercício aeróbico, Bjerre et al.18 constataram que a densidade mineral óssea do quadril apresentou uma pequena melhora (0,008 g/cm2).
O mecanismo responsável pelo crescimento das neoplasias ósseas é complexo e envolve a estimulação tumoral do osteoclasto e do osteoblasto, bem como a resposta do microambiente ósseo. O estudo de Rief et al.24 obteve dados interessantes que avaliaram a densidade óssea após intervenção de metástases osteolíticas e osteoblásticas. A análise de subgrupo de metástases osteolíticas após três e seis meses no grupo intervenção mostrou um aumento significativo de densidade óssea quando comparado ao grupo controle. A densidade óssea de metástases osteolíticas no grupo intervenção aumentou para 179,3% após seis meses. Já a avaliação das metástases osteoblásticas não mostrou diferença significativa após três e seis meses entre os grupos.
A EVA foi a ferramenta mais utilizada para a avaliação da dor nos artigos selecionados para a metanálise, porém cada artigo relatou o resultado de uma maneira diferente, impossibilitando de se realizar a análise desse desfecho. No entanto, como resultado da revisão, observam-se resultados positivos quanto à dor nesses indivíduos após intervenção e, também, sem aumento expressivo da dor durante o exercício.
Segundo os resultados de Rief et al.22, o escore de dor foi significativamente melhor entre os grupos após três meses utilizando exercícios isométricos como intervenção. Semelhantemente, a gravidade da dor óssea relatada em cada sessão de exercício foi baixa, com uma média de 0,6±0,7 em uma escala de 0 (sem dor) a 10 (dor muito forte) e um máximo de 1,4±1,2 em todas as sessões19. Ou seja, não houve incidência de mudança na dor óssea durante o exercício que fosse interferir nas atividades de vida diária após a intervenção.
Galvão et al.14 avaliaram a dor óssea por meio da escala Avaliação Funcional da Terapia do Câncer – Dor Óssea (Functional Assessment of Cancer Therapy – Bone Pain – FACT-BP), e, como resultados desse desfecho, não houve alteração na dor óssea, utilizando exercícios combinados como intervenção. Simultaneamente a esse resultado, Rief et al.22 relatam que o uso de medicação analgésica foi muito menor durante e após a radioterapia no grupo intervenção, e a medicação concomitante e dose equivalente de morfina oral diminuíram no grupo intervenção, mas aumentou no grupo controle. Ademais, no grupo intervenção, a necessidade de medicação analgésica diminuiu até seis meses após a radioterapia, enquanto aumentaram mais uma vez de forma relevante no grupo controle.
Dos artigos selecionados para metanálise, três18,21,25 continham informações sobre a progressão da doença; após a metanálise desse desfecho, em que foi possível incluir dois desses estudos21,25, conclui-se que a fisioterapia por meio dos exercícios isométricos não apresentou um efeito considerável. Rief et al.21 não observaram progressão de outras metástases na coluna vertebral após três meses no grupo intervenção, enquanto a progressão foi registrada em 17,4% dos pacientes do grupo controle (n=4). Já Bjerre et al.18 trouxeram como intervenção o exercício aeróbico e tiveram como resultado um número mais expressivo de casos de progressão da doença no grupo controle (16 pacientes de 19) em comparação com grupo intervenção (9 de 22; p=0,009), após sua intervenção com exercícios aeróbicos durante uma hora, duas vezes por semana. Interpretando os resultados desse estudo, o exercício aeróbico é uma ferramenta de grande importância para prevenção da progressão da doença.
Em sua revisão, Knols et al.29 demonstraram que os efeitos positivos da terapia com exercícios variam dependendo do tipo e do estágio de tumor, da terapia farmacêutica, dos procedimentos terapêuticos e do estilo de vida do paciente. Em seu estudo, Delrieu et al.30 consideraram que uma quantidade moderada ou vigorosa de exercício físico permaneceu estatisticamente associada a uma melhor sobrevida global apenas para pacientes com câncer de mama metastático HER2-positivo. Por outro lado, a sobrevida de pacientes com câncer luminal e triplo-negativo não foi afetada pelo nível de exercício físico. Mediante esses resultados, verifica-se que, além da importância de selecionar corretamente o tipo de tratamento fisioterapêutico, alguns aspectos são de extrema importância, como o estágio ou o tipo de tumor desse indivíduo, e seu estilo de vida.
O efeito antitumoral do exercício físico também pode ser explicado por diferentes mecanismos biológicos. O exercício físico melhora a sensibilidade à insulina, reduz os níveis de insulina em jejum, o que pode diminuir o risco de câncer de mama31,32, e também pode reduzir os níveis circulantes de estrogênio33,34. O exercício físico demonstra ainda obter efeitos imunomoduladores, aumentando a imunidade e promovendo a vigilância do câncer. Estudos mostraram que o exercício aeróbico pode diminuir o estresse oxidativo e melhorar os mecanismos de reparo do DNA, diminuindo a carcinogênese32,35.
Jones et al.36 demonstraram que mulheres com metástases do câncer de mama que atingiram consumo de oxigênio de pico (VO2pico) <1,09 L/min tiveram uma sobrevida mediana de 16 meses (IC 95%: 7 a 27 meses), já aquelas que relataram mais de 1,09 L/min no teste cardiopulmonar de exercício (TCPE), de 36 meses (IC 95%: 24 a 75 meses). Conclusões semelhantes foram apresentadas por Guercio et al.37, em um estudo de 1.218 pacientes com câncer colorretal metastático, cujo treinamento físico (18 ou mais horas metabolic equivalent of task – MET/semana) foi caracterizado por uma mortalidade geral mais baixa, em comparação com um grupo com menos de 3 MET horas/semana (hazard ratio – HR=0,85; IC 95% 0,71-1,02; p=0,06). Além disso, um estudo realizado com mulheres com câncer de mama avançado relata que engajar-se em uma hora adicional por dia de exercício físico de intensidade moderada reduziu o risco de mortalidade subsequente em 23%38. Por meio desses resultados, o treinamento físico aeróbico com frequência e intensidade adequadas, resultando na obtenção de um alto pico de VO2, pode resultar em um efeito positivo na sobrevida em pacientes oncológicos com metástases.
A análise da qualidade de vida pôde ser feita com dois artigos14,19 por meio da escala SF-36, e os resultados trazem que o uso de exercícios combinados não apresentou melhora significativa, possivelmente por conter poucos estudos e com pequena amostra. Entretanto, Bjerre et al.18 avaliaram a qualidade de vida por meio da escala FACT-P, específica para câncer de próstata, e seu resultado foi consideravelmente maior no grupo intervenção em comparação com grupo controle em 12 semanas após exercícios aeróbicos.
Na perspectiva de Rief et al.23, utilizando a avaliação do European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire Fatigue Assessment (EORTC QLQ-FA13), pode-se observar uma melhora nos aspectos psicossociais dos pacientes, assim como verificaram a redução no estresse emocional do grupo intervenção após seis meses. Hayes et al.39 e Guercio et al.37 descrevem que o exercício físico está associado a um benefício durante e após o tratamento oncológico, como a redução da frequência de complicações da quimioterapia (neutropenia, anemia, diarreia, desidratação, vômito, náusea, caquexia e neuropatia) e, de fato, é capaz de reduzir o impacto dos efeitos colaterais da terapia e os sintomas da doença. Intervenções de exercícios podem modular potencialmente a resposta imune e a expressão gênica, além de reduzir a inflamação sistêmica e o estresse oxidativo, ou a alteração da vascularização do tumor40. Nessa população, o exercício diminuiu a ansiedade, os sintomas depressivos e a fadiga durante ou após terapia41.
Todo paciente com doença metastática deve ser encorajado a praticar exercícios. De uma perspectiva de reabilitação, fatores como frequência, intensidade, tipo e tempo de exercício devem ser escolhidos em relação às atividades específicas da vida diária, ou os sintomas-alvo que a intervenção pretende melhorar. Nessa revisão, nota-se que alguns autores1,19 aumentaram gradativamente o tempo e as repetições máximas dos exercícios de acordo com a resposta individual; a seleção dos exercícios específicos baseou-se na localização das metástases ósseas de forma que as regiões afetadas não fossem direcionadas e a força mecânica minimizada.
Com o aumento da evidência que apoia a segurança e a eficácia do treinamento físico, tornou-se um importante campo da investigação clínica em oncologia. Os benefícios do exercício físico não podem ser vistos apenas em pacientes em estágio inicial, mas também em populações metastáticas. Planos de exercícios individuais podem melhorar o prognóstico e a qualidade de vida desses pacientes com câncer avançado e também desempenhar um papel significativo como uma ferramenta de cuidado de suporte. Portanto, o exercício físico supervisionado por profissionais capacitados deve se tornar um componente padrão de todo plano de tratamento oncológico, com uma abordagem personalizada e boa comunicação entre os profissionais, para que os riscos de complicações por conta do exercício físico possam ser reduzidos ao mínimo, ficando apenas os seus muitos benefícios.
CONCLUSÃO
A terapia por meio de exercícios aeróbicos e isométricos é segura em pacientes com metástases ósseas, não apresentando nenhum efeito adverso, sendo viável e recomendado o exercício físico para esse grupo de pacientes. Precisa-se de maior evidência científica quanto a diferentes formas de exercícios em indivíduos com metástases ósseas, pois é importante no seu processo de recuperação e na manutenção da qualidade de vida de forma eficaz e segura.
CONTRIBUIÇÕES
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Programa de Residências Multiprofissionais em Área Profissional da Saúde, Ministério da Educação (MEC), Brasil.
1. Rosenberger F, Sprave T, Clauss D, et al. Spinal stabilization exercises for cancer patients with spinal metastases of high fracture risk: feasibility of the DISPO-II training program. Cancers (Basel). 2021;13(2):201. doi: https://doi.org/10.3390/cancers13020201
2. Postigo R. Tumores da coluna vertebral: tumores ósseos [Internet]. Curitiba (PR): AOSpine Latin America; [data desconhecida] [acesso 2021 ago 11]. Programa de formação continua AOSpine. Disponível em: https://www.aolatam.org/ftp/edudatabase/open-files/aos_da_n1m4t1_postigo_prt.pdf
3. Whyne CM, Hu SS, Lotz JC. Biomechanically derived guideline equations for burst fracture risk prediction in the metastatically involved spine. J Spinal Disord Tech. 2003;16(2):180-5. doi: https://doi.org/10.1097/00024720-200304000-00010
4. Janjan N, Lutz ST, Bedwinek JM, et al. Therapeutic guidelines for the treatment of bone metastasis: a report from the American College of Radiology Appropriateness Criteria Expert Panel on Radiation Oncology. J Palliat Med. 2009;12(5):417-26. doi: https://doi.org/10.1089/jpm.2009.9633
5. Abrams HL, Spiro R, Goldstein N. Metastases in carcinoma. Analysis of 1000 autopsied cases. Cancer. 1950;3(1):74-85. doi: https://doi.org/10.1002/1097-0142(1950)3:1<74::aid-cncr2820030111>3.0.co;2-7
6. Brown HK, Healey JH. Metastatic cancer to the bone. In: DeVita VT Jr, Hellman S, Rosenberg AS. Principles and practice of oncology. 6th ed. Vol. 1. Philadelphia: Lippincott Raven; 2001. p. 1986-97.
7. Cramarossa G, Chow E, Zhang L, et al. Predictive factors for overall quality of life in patients with advanced cancer. Support Care Cancer. 2013;21(6):1709-16. doi: https://doi.org/10.1007/s00520-013-1717-7
8. Mehnert A, Brähler E, Faller H, et al. Four-week prevalence of mental disorders in patients with cancer across major tumor entities. J Clin Oncol. 2014;32(31):3540-6. doi: https://doi.org/10.1200/JCO.2014.56.0086
9. Javaheri PA, Nekolaichuk C, Haennel R, et al. Feasibility of a pedometer-based walking program for survivors of breast and head and neck cancer undergoing radiation therapy. Physiother Can. 2015;67(2):205-13. doi: https://doi.org/10.3138/ptc.2014-24
10. Lucas C, Vidal I, Costa J, et al. Caracterização de metástases ósseas em neoplasias ocultas e neoplasias previamente diagnosticadas. Galicia Clin [Internet]. 2016 [acesso 2021 ago 16];77(4):170-2. Disponível em: https://galiciaclinica.info/PDF/38/943.pdf
11. Beaton R, Pagdin-Friesen W, Robertson C, et al. Effects of exercise intervention on persons with metastatic cancer: a systematic review. Physiother Can. 2009;61(3):141-53. doi: https://doi.org/10.3138/physio.61.3.141
12. Sheill G, Guinan EM, Peat N, et al. Considerations for exercise prescription in patients with bone metastases: a comprehensive narrative Review. PM R. 2018;10(8):843-64. doi: https://doi.org/10.1016/j.pmrj.2018.02.006
13. Rock CL, Doyle C, Demark-Wahnefried W, et al. Nutrition and physical activity guidelines for cancer survivors. CA Cancer J Clin. 2012;62(4):243-74. doi: https://doi.org/10.3322/caac.21142
14. Galvão DA, Taaffe DR, Spry N, et al. Exercise preserves physical function in prostate cancer patients with bone metastases. Med Sci Sports Exerc. 2018;50(3):393-9. doi: https://doi.org/10.1249/MSS.0000000000001454
15. Centro Cochrane do Brasil [Internet]. São Paulo: Cochrane Brazil; c2022. Como fazer uma Revisão Sistemática Cochrane; [acesso 2021 ago 11]. Disponível em: https://brazil.cochrane.org/como-fazer-uma-revis%C3%A3o-sistem%C3%A1tica-cochrane
16. Moher D, Liberati A, Tetzlaff J, et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med. 2009;6(7):e1000097. doi: https://doi.org/10.1371/journal.pmed.1000097
17. RoB 2: a revised Cochrane risk-of-bias tool for randomized trials [Internet]. London (UK): Cochrane Methods Bias. 2021 – [cited 2021 May 6]. Available from: https://methods.cochrane.org/bias/resources/rob-2-revised-cochrane-risk-bias-tool-randomized-trials
18. Bjerre ED, Weller S, Poulsen MH, et al. Safety and effects of football in skeletal metastatic prostate cancer: a subgroup analysis of the FC prostate community randomised controlled trial. Sports Med Open. 2021;7(1):27. doi: https://doi.org/10.1186/s40798-021-00318-6
19. Cormie P, Newton RU, Spry N, et al. Safety and efficacy of resistance exercise in prostate cancer patients with bone metastases. Prostate Cancer Prostatic Dis. 2013;16(4):328-35. doi: https://doi.org/10.1038/pcan.2013.22
20. Galvão DA, Taaffe DR, Chambers SK, et al. Exercise intervention and sexual function in advanced prostate cancer: a randomised controlled trial. BMJ Support Palliat Care. 2020;12(1):29-32. doi: https://doi.org/10.1136/bmjspcare-2020-002706
21. Rief H, Omlor G, Akbar M, et al. Feasibility of isometric spinal muscle training in patients with bone metastases under radiation therapy - first results of a randomized pilot trial. BMC Cancer. 2014;14:67. doi: https://doi.org/10.1186/1471-2407-14-67
22. Rief H, Welzel T, Omlor G, et al. Pain response of resistance training of the paravertebral musculature under radiotherapy in patients with spinal bone metastases--a randomized trial. BMC Cancer. 2014;14:485. doi: https://doi.org/10.1186/1471-2407-14-485
23. Rief H, Akbar M, Keller M, et al. Quality of life and fatigue of patients with spinal bone metastases under combined treatment with resistance training and radiation therapy- a randomized pilot trial. Radiat Oncol. 2014;9:151. doi: https://doi.org/10.1186/1748-717X-9-151
24. Rief H, Petersen LC, Omlor G, et al The effect of resistance training during radiotherapy on spinal bone metastases in cancer patients - a randomized trial. Radiother Oncol. 2014;112(1):133-9. doi: https://doi.org/10.1016/j.radonc.2014.06.008
25. Rief H, Bruckner T, Schlampp I, et al. Resistance training concomitant to radiotherapy of spinal bone metastases - survival and prognostic factors of a randomized trial. Radiat Oncol. 2016;11:97. doi: https://doi.org/10.1186/s13014-016-0675-x
26. Taneichi H, Kaneda K, Takeda N, et al. Risk factors and probability of vertebral body collapse in metastases of the thoracic and lumbar spine. Spine (Phila Pa 1976). 1997;22(3):239-45. doi: https://doi.org/10.1097/00007632-199702010-00002
27. Hettinger T. Isometric muscle training. 6 th ed. Landsberg am Lech (DE): Ecomed; 1994.
28. Nadler MB, Desnoyers A, Langelier DM, et al. The effect of exercise on quality of life, fatigue, physical function, and safety in advanced solid tumor cancers: a meta-analysis of randomized control trials. J Pain Symptom Manage. 2019;58(5):899-908. doi: https://doi.org/10.1016/j.jpainsymman.2019.07.005
29. Knols R, Aaronson NK, Uebelhart D, et al. Physical exercise in cancer patients during and after medical treatment: a systematic review of randomized and controlled clinical trials. J Clin Oncol. 2005;23(16):3830-42. doi: https://doi.org/10.1200/JCO.2005.02.148
30. Delrieu L, Jacquet E, Segura-Ferlay C, et al. Analysis of the StoRM cohort reveals physical activity to be associated with survival in metastatic breast cancer. Sci Rep. 2020;10(1):10757. doi: https://doi.org/10.1038/s41598-020-67431-6
31. Gunter MJ, Hoover DR, Yu H, et al. Insulin, insulin-like growth factor-I, and risk of breast cancer in postmenopausal women. J Natl Cancer Inst. 2009;101(1):48-60. doi: https://doi.org/10.1093/jnci/djn415
32. McTiernan A. Mechanisms linking physical activity with cancer. Nat Rev Cancer 2008;8(3):205-11. doi: https://doi.org/10.1038/nrc2325
33. Choudhury F, Bernstein L, Hodis HN, et al. Physical activity and sex hormone levels in estradiol- and placebo-treated postmenopausal women. Menopause. 2011;18(10):1079-86. doi: https://doi.org/10.1097/gme.0b013e318215f7bd
34. Oh H, Arem H, Matthews CE, et al. Sitting, physical activity, and serum oestrogen metabolism in postmenopausal women: the Women's Health Initiative observational study. Br J Cancer. 2017;117(7):1070-8. doi: https://doi.org/10.1038/bjc.2017.268
35. Friedenreich CM, Neilson HK, Lynch BM. State of the epidemiological evidence on physical activity and cancer prevention. Eur J Cancer. 2010;46(14):2593-604. doi: https://doi.org/10.1016/j.ejca.2010.07.028
36. Jones LW, Courneya KS, Mackey JR, et al. Cardiopulmonary function and age-related decline across the breast cancer survivorship continuum. J Clin Oncol. 2012;30(20):2530-7. doi: https://doi.org/10.1200/JCO.2011.39.9014
37. Guercio BJ, Zhang S, Ou FS, et al. Associations of physical activity with survival and progression in metastatic colorectal cancer: results from cancer and leukemia group B (Alliance)/SWOG 80405. J Clin Oncol. 2019;37(29):2620-31. doi: https://doi.org/10.1200/JCO.19.01019
38. Palesh O, Kamen C, Sharp S, et al. Physical activity and survival in women with advanced breast cancer. Cancer Nurs. 2018;41(4):E31-E38. doi: https://doi.org/10.1097/NCC.0000000000000525
39. Hayes SC, Spence RR, Galvão DA, et al. Australian Association for Exercise and Sport Science position stand: optimising cancer outcomes through exercise. J Sci Med Sport. 2009;12(4):428-34. doi: https://doi.org/10.1016/j.jsams.2009.03.002
40. Vina J, Sanchis-Gomar F, Martinez-Bello V, et al. Exercise acts as a drug; the pharmacological benefits of exercise. Br J Pharmacol. 2012;167(1):1-12. doi: https://doi.org/10.1111/j.1476-5381.2012.01970.x
41. Wilk M, Kepski J, Kepska J, et al. Exercise interventions in metastatic cancer disease: a literature review and a brief discussion on current and future perspectives. BMJ Support Palliat Care. 2020;10(40):404-10. doi: https://doi.org/10.1136/bmjspcare-2020-002487
Recebido em 27/1/2022
Aprovado em 31/3/2022
Editor-associado: Fernando Lopes Tavares de Lima. Orcid iD: https://orcid.org/0000-0002-8618-7608
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde