ARTIGO ORIGINAL
Anxiety, Depression, Pain and Fatigue in Patients with Breast Cancer who Submitted to Combined Training
Ansiedad, Depresión, Dolor y Fatiga en Pacientes con Cáncer de Mama con Entrenamiento Combinado
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n3.2611
Marília de Oliveira Bringel1; Andréa Dias Reis2; Letícia Campos Aguiar3; João Batista Santos Garcia4
1-4Universidade Federal do Maranhão. São Luís (MA), Brasil.
1E-mail: marilia.bringel@hotmail.com. Orcid iD: https://orcid.org/0000-0001-8766-099X
2E-mail: adr.dea@hotmail.com. Orcid iD: https://orcid.org/0000-0002-1881-4382
3E-mail: leticiacampos1211@gmail.com. Orcid iD: https://orcid.org/0000-0002-2164-2198
4E-mail: jbgarcia@uol.com.br. Orcid iD: https://orcid.org/0000-0002-3597-6471
Endereço para correspondência: Andréa Dias Reis. Avenida dos Portugueses, 1966 – Sá Viana. São Luís (MA), Brasil. E-mail: adr.dea@hotmail.com
RESUMO
Introdução: Apesar do aumento na sobrevida de pacientes com neoplasias de mama, muitas persistem com ansiedade, depressão, fadiga e dor mesmo após o tratamento anticancerígeno, fatores associados a uma pior qualidade de vida. Objetivo: Avaliar a influência do treinamento combinado na ansiedade, depressão, dor e fadiga em pacientes com câncer de mama. Método: Ensaio controlado randomizado com 26 pacientes em quimioterapia, radioterapia ou acompanhamento clínico em um centro de referência em tratamento de câncer, com idade 30 a 59 anos, não praticantes de treinamento físico nos últimos três meses. O grupo experimental (GE) (n=13) foi submetido a três sessões por semana de treinamento aeróbico e resistido em 12 semanas, com duração de 60 minutos, e duas sessões de treinamento de flexibilidade por semana com duração de 20 segundos em três séries. O grupo controle (GC) (n=13) realizou somente o tratamento hospitalar convencional. Todas as avaliações foram realizadas no tempo basal e após 12 semanas. Resultados: As pacientes do GE apresentaram redução significativa da ansiedade (p=0,0242), intensidade da dor (p=0,0290) e dimensão comportamental da fadiga (0,0033). Não foram observadas diferenças na depressão (p=0,0803), interferência da dor nas atividades habituais (p=0,0933) e dimensões afetiva (p=0,0583) e sensorial/cognitiva/emocional (p=0,5525) da fadiga. O GC permaneceu inalterado em todas as variáveis. Conclusão: O treinamento combinado, envolvendo exercícios aeróbios, de resistência e de flexibilidade durante 12 semanas, apresenta efeitos benéficos na ansiedade, fadiga e dor em pacientes com câncer de mama.
Palavras-chave: neoplasias da mama; exercício físico; manejo da dor.
ABSTRACT
Introduction: Despite the increase of the survival of patients with breast cancer, many persist with anxiety, depression, fatigue, and pain even after anticancer treatment, factors associated with a worse quality-of-life. Objective: Evaluate the influence of combined training on anxiety, depression, pain and fatigue in breast cancer patients. Method: Randomized controlled trial with 26 patients undergoing chemotherapy, radiotherapy, or clinical follow-up at a referral centre for cancer treatment, aged 30 to 59 years, not practicing physical training in the last three months. The experimental group (EG) (n=13) was submitted to 3 sessions per week of aerobic and resistance training, for 12 weeks, lasting 60 minutes, and 2 sessions per week of flexibility training lasting 20 seconds in 3 sets. The control group (CG) (n=13) submitted only to conventional hospital treatment. All assessments were performed at baseline and after 12 weeks. Results: EG patients showed a significant reduction in anxiety (p=0.0242), pain intensity (p=0.0290) and the behavioral dimension of fatigue (0.0033). No differences were observed in depression (p=0.0803), interference of pain in usual activities (p=0.0933) and affective (p=0.0583) and sensory/cognitive/emotional (p=0.5525) dimensions of fatigue. The GC remained unchanged in all variables. Conclusion: Combined training involving aerobic, resistance and flexibility exercises for 12 weeks has beneficial effects on anxiety, fatigue and pain in breast cancer patients.
Key words: breast neoplasms; exercise; pain management.
RESUMEN
Introducción: A pesar del aumento de la supervivencia de las pacientes con cáncer de mama, muchas persisten con ansiedad, depresión, fatiga y dolor incluso después del tratamiento anticanceroso, factores asociados a una peor calidad de vida. Objetivo: evaluar la influencia del entrenamiento combinado sobre la ansiedad, la depresión, el dolor y la fatiga en pacientes con cáncer de mama. Método: Ensayo controlado aleatorio con 26 pacientes bajo quimioterapia, radioterapia o seguimiento clínico en un centro de referencia para el tratamiento del cáncer, con edades comprendidas entre los 30 y los 59 años, que no han practicado entrenamiento físico en los últimos tres meses. El grupo experimental (GE) (n=13) fue sometido a tres sesiones semanales de entrenamiento aeróbico y de resistencia en 12 semanas, de 60 minutos de duración, y a dos sesiones semanales de entrenamiento de flexibilidad de 20 segundos en tres series. El grupo de control (GC) (n=13) sólo realizó el tratamiento hospitalario convencional. Todas las evaluaciones se realizaron al inicio y después de 12 semanas. Resultados: Los pacientes del GE mostraron una reducción significativa de la ansiedad (p=0,0242), la intensidad del dolor (p=0,0290) y la dimensión conductual de la fatiga (0,0033). No se observaron diferencias en la depresión (p=0,0803), la interferencia del dolor en las actividades habituales (p=0,0933) y las dimensiones afectivas (p=0,0583) y sensoriales/cognitivas/emocionales (p=0,5525) de la fatiga. El GC se mantuvo sin cambios en todas las variables. Conclusión: El entrenamiento combinado de ejercicios aeróbicos, de resistencia y de flexibilidad durante 12 semanas presenta efectos beneficiosos sobre la ansiedad, la fatiga y el dolor en pacientes con cáncer de mama.
Palabras clave: neoplasias de la mama; ejercicio físico; manejo del dolor.
INTRODUÇÃO
O câncer de mama é um problema de saúde pública, sendo a neoplasia mamária a mais frequente em mulheres. Além da alta incidência global, de aproximadamente 2,1 milhões de casos novos, também foram estimados, para cada ano do triênio 2020-2022, no Brasil, 66.280 novos casos, com 840 para o Estado do Maranhão1.
Os tratamentos oncológicos melhoram a sobrevida de pacientes com câncer2; cerca de 3,9 milhões de mulheres são sobreviventes ao câncer de mama somente nos Estados Unidos das América (EUA)3, porém, muitas continuam a sofrer efeitos adversos como fadiga, depressão e ansiedade meses a anos após o diagnóstico, fatores estes associados a uma pior qualidade de vida2.
A prevalência de depressão e transtornos de ansiedade em pacientes com câncer é de 20,7% e de 10,3%, respectivamente, apresentando escores duas vezes maior do que a população em geral4. Além desses sintomas, a dor é frequente em cirurgias mamárias, mesmo as cirurgias conservadoras, visto que aproximadamente 50% das pacientes apresentam dores agudas ou crônicas5.
Como forma de manejar os efeitos adversos da neoplasia de mama e de seus diversos tratamentos, a realização de exercícios físicos tem sido identificada como terapia que promove alívio dos sintomas de depressão6, ansiedade7,8, fadiga8 e dor6, pois é capaz de proporcionar mudanças benéficas nas respostas inflamatórias sistêmicas, perfil hormonal, diminuição de citocinas pró-inflamatórias e melhora da composição corporal, resistência cardiorrespiratória e autonomia dessas pacientes2,9.
Contudo, o volume, a intensidade, a duração e os tipos de exercícios são os principais fatores que devem ser levados em consideração para pacientes com câncer10. Assim, esta pesquisa visa a avaliar o papel do treinamento combinado ‒ com exercícios aeróbicos, de resistência e de flexibilidade durante 12 semanas ‒, na ansiedade, depressão, dor e fadiga em pacientes no tratamento do câncer de mama, como também analisar os efeitos do treinamento físico na relação desses desfechos.
MÉTODO
Foi realizado um ensaio clínico randomizado, cujas pacientes foram convidadas por meio de telefonemas, reuniões padronizadas e por encaminhamento de médicos, fisioterapeutas e psicólogos, por ter sido disponibilizada, pelo Hospital do Câncer Aldenora Bello (HCAB), uma lista com contato de 300 pacientes que poderiam estar em tratamento oncológico. Aquelas que demonstraram interesse obtiveram esclarecimento do estudo e assinaram o Termo de Consentimento Livre e Esclarecido (TCLE).
A pesquisa, realizada em São Luís do Maranhão, Brasil, no período de março de 2014 a setembro de 2015, teve como critérios de inclusão: mulheres com diagnóstico e em tratamento do câncer de mama (quimioterapia ou radioterapia e/ou hormonioterapia), ou acompanhamento de câncer de mama, no HCAB, com faixa etária de 30 a 59 anos, que não tivessem realizado treinamento físico nos últimos três meses.
Os critérios de exclusão foram: pacientes sem condições de se comunicar verbalmente ou de se locomover e pacientes grávidas ou que estivessem amamentando. Foram consideradas como perdas as pacientes que faltassem três vezes consecutivas, não realizassem as avaliações, viessem a óbito, engravidassem, desistissem de participar ou que fossem suspensas por médicos.
A amostra por conveniência constituiu de 31 pacientes que foram randomizadas por sorteio e alocadas para os grupos (1:1), com uma paciente a mais para o grupo controle (GC). Divididas em grupo experimental (GE), submetido ao treinamento combinado (TC) de 12 semanas, concomitante ao tratamento hospitalar convencional (THC), como quimioterapia, radioterapia e hormonioterapia, orientados pela conduta médica, e o GC, submetido apenas ao THC.
A pesquisa seguiu os termos da Resolução n.º 466/1211, do Conselho Nacional de Saúde (CNS) e obteve aprovação do Comitê de Ética em Pesquisa da Universidade Federal do Maranhão (UFMA), com número CAAE 20665713.2.0000.5087 e também foi registrada no Clinical Trials com o protocolo NCT03061773.
Após a assinatura do TCLE, iniciou-se a pesquisa; posteriormente, as pacientes foram avaliadas por profissionais de Educação Física, Psicologia, Nutrição e Medicina. Todas as avaliações (desfechos primários e secundários) foram realizadas antes do treinamento físico (período basal) e depois de 12 semanas. A anamnese e as variáveis de caracterização amostral foram realizadas somente no período basal.
Os desfechos principais do estudo foram ansiedade e depressão, avaliadas a partir da Escala Hospitalar de Ansiedade e Depressão ‒ do inglês, Hospital Anxiety and Depression Scale (HADS) ‒, validada para o português do Brasil12. Trata-se de um questionário de fácil aplicabilidade utilizado para o diagnóstico inicial e para avaliar a evolução da ansiedade e da depressão13. Entre as principais características da escala, encontram-se: a não inclusão de sintomas vegetativos que podem ocorrer em doenças físicas, a separação entre os conceitos de ansiedade e depressão a partir de questões intercaladas, a detecção de transtornos afetivos em ambientes não psiquiátricos e a facilidade de preenchimento12. Na avaliação final, as questões 1, 3, 5, 7, 9, 11, 13 são correspondentes à ansiedade, e as questões 2, 4, 6, 8, 10, 12 e 14 são direcionadas para a depressão; o valor referente a cada resposta da questão é somado e os escores iguais ou menores do que 7 para cada variável indicam diagnósticos incertos, de 8 a 11 possíveis e maiores do que 12 aceitáveis14.
Os desfechos secundários do estudo foram dor e fadiga. A dor foi avaliada por meio do Inventário Breve da Dor ‒ do inglês, Brief Pain Inventory (BPI) ‒, validado para o português no Brasil. É um instrumento que avalia a intensidade e localização da dor, seu impacto na vida dos pacientes e a eficácia de terapias álgicas15. Os escores variam de 1 a 4 = dor leve, de 5 a 7 = moderada, e de 8 a 10 = grave. Na avaliação das dimensões, o cálculo é realizado por meio da média total de todas as questões integrantes15.
A fadiga foi avaliada por meio da Escala de Fadiga de Piper-Revisada (PFS-R)16,17, composta de 22 itens, distribuídos em três dimensões: comportamental (questões globais, laborais, sociais, individuais e sexuais), afetiva (aspectos de autoimagem e autopercepção) e sensorial/cognitiva/emocional ou sensorial-psicológica (estado psicológico, cognitivo e emocional), analisadas pela média dos itens respectivos. Na avaliação final, as questões de 2 a 7 correspondem à dimensão comportamental, as de 8 a 12 à dimensão afetiva, e as de 13 a 23 à dimensão sensorial/cognitiva/emocional; o valor referente a cada resposta da questão é utilizado para média; e o escore varia de 1 a 3 = fadiga leve, de 4 a 6 = fadiga moderada, e de 7 a 10 = fadiga intensa17.
As informações de anamnese e as variáveis de caracterização amostral foram peso (kg), estatura (cm) e idade (anos)18, situação conjugal, grau de instrução, vínculo empregatício, renda familiar – em que um salário-mínimo corresponde a R$ 788,00 nos anos de 2014 e 2015 –. Já as informações tipo de neoplasia, estadiamento patológico do câncer de mama19 e fase do tratamento foram avaliadas por meio de registro hospitalar e anamnese.
Foram mensuradas as variáveis hemodinâmicas como frequência cardíaca (FC) em repouso no Polar® FT2 e pressão arterial sistólica (PAS) e pressão arterial diastólica (PAD) com o aparelho de coluna de mercúrio convencional BD®, após cinco minutos de repouso em posição confortável18.
O nível de atividade física foi avaliado por meio do questionário International Physical Activity Questionnaire (IPAQ), versão curta20,21. O período sem prática de treinamento físico (de 3 a 12 meses e >1 ano e nunca praticou) foi inserido na anamnese.
As participantes, antes de iniciarem o treinamento combinado, realizaram uma familiarização de cada exercício. A adaptação para o treinamento aeróbico e resistido ocorreu em três sessões em uma semana, utilizando-se cicloergômetro com carga de 15 watts, e, nos exercícios resistidos, o próprio peso corporal e a fita leve (Theraband) na execução de oito a 12 repetições, e intervalo de um minuto para cada exercício. A familiarização do alongamento foi realizada em duas semanas, sendo três sessões por semana.
O programa de treinamento combinado foi conduzido por profissionais de Educação Física em ambiente hospitalar e consistiu em exercícios aeróbicos, resistidos e de flexibilidade, com duração de 12 semanas. O programa de treinamento combinado teve cinco sessões por semana, sendo três sessões por semana de treinamento aeróbico e resistido em uma mesma sessão (com supervisão por treinadores especializados), e duas sessões por semana de treinamento de flexibilidade (com orientação para realizarem os alongamentos domiciliares) que foram intercaladas entre sessões do treinamento aeróbico e resistido. O protocolo teve a seguinte ordem: cada sessão de treinamento aeróbico e resistido teve duração de 60 minutos, com 30 minutos no cicloergômetro, seguido de cinco exercícios resistidos. A sessão de treinamento de flexibilidade (intercalada entre dias de treinamento aeróbio e resistido) teve duração aproximada de 15 minutos, contendo dez exercícios de alongamentos.
O treinamento aeróbico foi controlado por meio da frequência cardíaca de treino (FCT)22, mensurada pelo frequencímetro Polar® FT2. O teste de capacidade cardiorrespiratória foi realizado para controlar a intensidade do treinamento, sendo realizado por meio do protocolo de rampa em cicloergômetro23 (marca ERGOFIT, modelo ERGO 167-FITC CYCLE) com carga inicial 15 watts durante cinco minutos de aquecimento, seguido de estágios incrementais de 60 segundos com acréscimo de 15 watts cada. Após o estágio máximo atingido, foi realizada uma recuperação ativa de três minutos com a carga inicial, e os estágios tiveram de 70 a 90 rotações por minuto (RPM). Durante o treinamento aeróbio, foram mensuradas PA, FC e percepção subjetiva de esforço por meio da escala de Borg (Infor Fisic), para segurança das pacientes.
A intensidade do treinamento aeróbio e resistido seguiu progressões de cargas a cada quatro semanas, sendo: 1ª fase ‒ da 1ª a 4ª semana, com 50% a 60% da FCT no treinamento aeróbio e peso corporal ou 1 kg (halteres e caneleira), banca elástica de intensidade moderada (Theraband) para o treinamento resistido; 2ª fase ‒ da 5ª a 8ª semana, com 70% a 80% da FCT no treinamento aeróbio e aumento de 1 kg e banda elástica de intensidade forte (Theraband) para o treinamento resistido; 3ª fase 3 ‒ da 9ª a 12ª semana, com 80% a 90% da FCT no treinamento aeróbio e manutenção da intensidade da 5ª a 8ª semana para o treinamento resistido. A prescrição respeitou a individualidade biológica no teste capacidade cardiorrespiratória e de repetições máximas para predição da carga inicial24.
A carga do treinamento resistido foi verificada por meio do teste de repetições máximas, com realização de 12 repetições e um intervalo de 72 horas da familiarização25. As pacientes que excederam 12 repetições tiveram intervalo de cinco minutos para incremento de uma nova carga e execução das 12 repetições. O protocolo de treinamento resistido foi de três séries para cada exercício, com 12 repetições e intervalo de um minuto entre séries e repetições. A velocidade de execução de cada movimento foi de três segundos na fase concêntrica e três segundos na fase excêntrica26. Os exercícios foram alternados por segmento e priorizando os grandes grupos musculares. As cargas foram instituídas por meio de caneleiras, halteres, bandas elásticas (Therabands) e o peso do próprio corpo. Os exercícios do treinamento resistido foram: 1) flexão e extensão de quadril; 2) desenvolvimento de ombros; 3) agachamento com bola suíça; 4) tríceps francês; 5) remada curvada. Todos os exercícios resistidos foram realizados em pé, exceto o tríceps francês que foi realizado em decúbito dorsal.
O treinamento de flexibilidade foi ativo (maior amplitude de movimento executado em uma articulação por contração dos agonistas e relaxamento dos antagonistas), sem dor, em que cada exercício teve duração de 20 segundos em três séries24. Os exercícios de flexibilidade foram: 1) adução do ombro com extensão do cotovelo, bilaterais; 2) flexão do ombro e cotovelo com palma da mão nas costas, bilaterais; 3) flexão do punho; 4) extensão do punho; 5) abdução de quadril com joelhos flexionados; 6) sentada, flexão de quadril com adução do ombro e flexão de cotovelo; 7) sentada, pernas estendidas tocando os pés; 8) sentada, pernas estendidas e cruzadas tocando os pés, bilateral; 9) flexão e adução de ombro com mãos unidas em frente do tronco; 10) dorso flexão do pé na parede.
A estatística descritiva foi representada por média e desvio-padrão, já as variáveis dicotômicas e categóricas, por meio de frequências relativa e absoluta. O teste Shapiro-Wilk foi utilizado para verificar a normalidade das variáveis. Apresentaram normalidade as variáveis: idade, estatura, peso, FC, PAS e PAD de repouso em ambos os grupos, dimensão intensidade da dor e depressão no GE e dimensão intensidade da dor, ansiedade e depressão no GC. As demais variáveis apresentaram resultados não paramétricos.
Nas variáveis dependentes e paramétricas, foi aplicado o teste t de Student pareado; já nas variáveis dependentes não paramétricas e ordinais, o teste de Wilcoxon pareado. Nas variáveis pareadas e dicotômicas, foi utilizado o teste do qui-quadrado. Nas variáveis independentes e paramétricas, aplicou-se o teste t de Student não pareado. Nas variáveis independentes, não paramétricas e ordinais, foi utilizado o teste Mann-Whitney, e, nas independentes e dicotômicas, o teste de qui-quadrado.
Nos desfechos secundários que apresentaram normalidade, foi utilizado o teste de correlação de Pearson, e, nos que não apresentaram normalidade, o teste de Spearman, com a classificação de correlação negligenciável (r=<0,2), fraca (r=0,2-0,4), moderada (r=0,4-0,6), forte (r=0,6-0,8) e muito forte (r=>0,80).
A estatística foi realizada no programa Stata 10.0, com α=5%, ou seja, considerou-se como estatisticamente significativo o p<0,05.
RESULTADOS
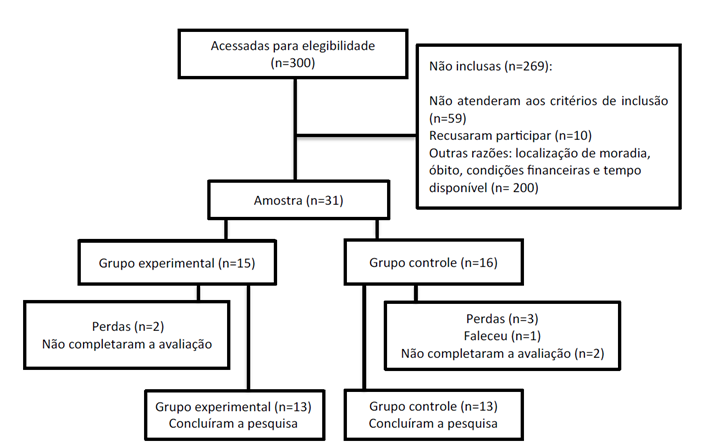
Foram selecionadas 31 pacientes que estavam dentro dos critérios de inclusão para participar da amostra, porém, duas pacientes do GE foram excluídas por não terem completado a avaliação final; e, no GC, uma paciente faleceu, e duas não completaram a avaliação final. Concluíram a pesquisa 26 pacientes (Figura 1).
|
|
|
Figura 1. Fluxograma amostral |
As pacientes do GE comparadas ao GC não apresentaram diferenças significativas nas variáveis demográficas, antropométricas, sociais, hemodinâmicas, tipo de neoplasia, estadiamento do câncer, fase do tratamento, nível de atividade física e período sem treinamento físico, o que demonstra homogeneidade entre os grupos (Tabela 1).
|
Tabela 1. Características antropométricas, sociais, hemodinâmicas, nível de atividade física e período sem prática de treinamento físico em pacientes com câncer de mama (n=26) |
|||
|
Variáveis |
GE (n=13) |
GC (n=13) |
Valor de p |
|
Antropométricaa |
|
|
|
|
Idade (anos) |
46,92±7,40 |
46,85±7,40 |
0,9791 |
|
Estatura (cm) |
153,91±4,77 |
154,85±6,11 |
0,6663 |
|
Peso (kg) |
58,21±9,66 |
65,27±15,61 |
0,1782 |
|
Situação conjugalb |
|
|
|
|
Casada |
6 (46,15%) |
7 (53,85%) |
0,695 |
|
Solteira |
7 (53,85%) |
6 (46,15%) |
|
|
Grau de instruçãob |
|
|
|
|
Ensino Médio |
11 (84,62%) |
12 (92,31%) |
0,539 |
|
Ensino Superior |
2 (15,38%) |
1 (7,69%) |
|
|
Vínculo empregatíciob |
|
|
|
|
Não |
9 (69,23%) |
12 (92,31%) |
0,135 |
|
Sim |
4 (30,77%) |
1 (7,69%) |
|
|
Renda familiarb |
|
|
|
|
Até 2 salários-mínimos |
8 (61,54%) |
10 (76,92%) |
0,395 |
|
>2 salários-mínimos |
5 (38,46%) |
3 (23,08%) |
|
|
Hemodinâmicaa |
|
|
|
|
FC repouso (bpm) |
79,61±7,80 |
74,85±14,44 |
0,3051 |
|
PAS repouso (mmHg) |
117,31±13,60 |
110,38±12,04 |
0,1820 |
|
PAD repouso (mmHg) |
74,07±10,36 |
70,77±9,36 |
0,4016 |
|
Tipo de neoplasiac |
|
|
|
|
Carcinoma ductal |
13 (100%) |
10 (76,92%) |
0,0714 |
|
Neoplasia fusocelular e epitelioide |
0 |
2 (15,38%) |
|
|
Tumor misto da mama |
0 |
1 (7,69%) |
|
|
Estadiamento da doençac |
|
|
|
|
0 |
1 (7,69%) |
0 |
0,6152 |
|
2 |
6 (46,15%) |
9 (69,23%) |
|
|
3 |
6 (46,15%) |
4 (30,77%) |
|
|
4 |
0 |
0 |
|
|
Fase do tratamento e acompanhamentoc |
|
|
|
|
Acompanhamento |
6 (46,15%) |
4 (30,77%) |
0,4231 |
|
Quimioterapia |
5 (38,46%) |
6 (46,15%) |
|
|
Radioterapia |
2 (15,38%) |
3 (23,08%) |
|
|
Nível de atividade físicac |
|
|
|
|
Ativa |
7 (53,85%) |
8 (61,54%) |
0,7254 |
|
Irregularmente ativa |
5 (38,46%) |
4 (30,77%) |
|
|
Muito ativa |
1 (7,69%) |
1 (7,69%) |
|
|
Período sem prática de treinamento físicob |
|
|
|
|
3 a 12 meses |
1 (7,69%) |
1 (7,69%) |
1,000 |
|
>1 ano e nunca praticou |
12 (92,31%) |
12 (92,31) |
|
|
Legendas: GE = grupo experimental; GC = grupo controle; FC = frequência cardíaca; PAS = pressão arterial sistólica; PAD = pressão arterial diastólica. (a) Teste t de Student não pareado. (b) Teste de qui-quadrado. (c) Teste de Mann-Whitney; valores expressos: média ± desvio-padrão, frequência absoluta (frequência relativa). |
|||
Os dados descritivos relativos à ocorrência de ansiedade, depressão, intensidade e interferência da dor nas atividades diárias e dimensões da fadiga estão expostos na Tabela 2. Em todos os escores do GE, houve melhora.
|
Tabela 2. Avaliação da ansiedade, depressão, intensidade dor, interferência da dor nas atividades habituais e dimensões comportamental, afetiva e psicológica da fadiga em pacientes com câncer de mama (n=26), submetidas a treinamento físico |
|||||
|
|
GE (n=13) |
GC (n=13) |
|||
|
|
Basal |
12 semanas |
Basal |
12 semanas |
|
|
Ansiedade |
|
|
|
|
|
|
Improvável |
7 (53,85%) |
11 (84,61%) |
9 (69,23%) |
8 (61,54%) |
|
|
Possível |
4 (30,77%) |
1 (7,69%) |
2 (15,38%) |
4 (30,77%) |
|
|
Provável |
2 (15,38%) |
1 (7,69%) |
2 (15,38%) |
1 (7,69%) |
|
|
Depressão |
|
|
|
|
|
|
Improvável |
8 (61,54%) |
11 (84,61%) |
9 (69,23%) |
8 (61,54%) |
|
|
Possível |
3 (23,07%) |
2 (15,38%) |
3 (23,07%) |
4 (30,77%) |
|
|
Provável |
2 (15,38%) |
0 (0%) |
1 (7,69%) |
1 (7,69%) |
|
|
Intensidade da dor |
|
|
|
|
|
|
Leve |
10 (76,92%) |
11 (84,61%) |
9 (69,23%) |
8 (61,54%) |
|
|
Moderada |
1 (7,69%) |
1 (7,69%) |
2 (15,38%) |
4 (30,77%) |
|
|
Grave |
2 (15,38%) |
1 (7,69%) |
2 (15,38%) |
1 (7,69%) |
|
|
Interferência nas atividades habituais |
|
|
|
|
|
|
Leve |
8 (61,54%) |
10 (76,92%) |
6 (46,15%) |
9 (69,23%) |
|
|
Moderada |
4 (30,77%) |
2 (15,38%) |
4 (30,77%) |
2 (15,38%) |
|
|
Grave |
1 (7,69%) |
1 (7,69%) |
3 (23,07%) |
2 (15,38%) |
|
|
Dimensões da fadiga comportamental |
|
|
|
|
|
|
Leve |
7 (53,85%) |
10 (76,92%) |
7 (53,85%) |
8 (61,54%) |
|
|
Moderada |
3 (23,07%) |
3 (23,07%) |
2 (15,38%) |
1 (7,69%) |
|
|
Intensa |
3 (23,07%) |
0 (0%) |
4 (30,77%) |
4 (30,77%) |
|
|
Afetiva |
|
|
|
|
|
|
Leve |
7 (53,85%) |
11 (84,61%) |
6 (46,15%) |
7 (53,85%) |
|
|
Moderada |
2 (15,38%) |
1(7,69%) |
3 (23,07%) |
4 (30,77%) |
|
|
Intensa |
4 (30,77%) |
1(7,69%) |
4 (30,77%) |
2 (15,38%) |
|
|
Sensorial/cognitiva/emocional |
|
|
|
|
|
|
Leve |
10 (76,92%) |
11 (84,61%) |
6 (46,15%) |
6 (46,15%) |
|
|
Moderada |
1 (7,69%) |
1 (7,69%) |
4 (30,77%) |
6 (46,15%) |
|
|
Intensa |
2 (15,38%) |
1 (7,69%) |
3 (23,07%) |
1 (7,69%) |
|
|
Legendas: GE = grupo experimental; GC = grupo controle. Nota: Valores expressos: frequência absoluta (frequência relativa). |
|||||
As pacientes do GE apresentaram redução significativa na ansiedade (p=0,0242), intensidade da dor (p=0,0290) e dimensão comportamental da fadiga (p=0,0033), enquanto, no GC, essas variáveis permaneceram inalteradas. Houve diferença significativa entre os grupos referente à variável ansiedade após 12 semanas (p=0,0231) (Tabela 3).
Contudo, não foram observadas diferenças na depressão (p=0,0803), interferência da dor nas atividades habituais (p=0,0933) e dimensões afetiva (p=0,0583) e sensorial/cognitiva/emocional (p=0,5525) da fadiga. O GC permaneceu inalterado em todas as variáveis (Tabela 3).
A ansiedade demonstrou correlação positiva forte e significativa com intensidade da dor, interferência da dor nas atividades habituais, depressão e dimensões comportamental e afetiva da fadiga no GE após 12 semanas. Já no GC, intensidade da dor, interferência da dor nas atividades habituais, depressão e dimensão comportamental da fadiga apresentaram moderada e significativa correlação com ansiedade no período basal, o mesmo acontecendo com intensidade da dor, depressão e dimensão afetiva da fadiga após 12 semanas (Tabela 4).
|
Tabela 3. Avaliação de desfechos em pacientes com câncer de mama (n=26), submetidas a treinamento físico |
||||||||
|
Variáveis |
GE (n=13) |
GC (n=13) |
GE versus GC |
|||||
|
Basal |
12 semanas |
Valor de p |
Basal |
12 semanas |
Valor de p |
Basal |
12 semanas |
|
|
Ansiedade e depressão |
|
|
|
|
|
|
|
|
|
Ansiedade |
7±4,69 |
4,54±3,26 |
0,0242*b |
7,46±5,16 |
7,15±3,65 |
0,7407a |
0,8134c |
0,0231*d |
|
Depressão |
5,85±5,30 |
3,46±2,57 |
0,0803a |
5,46±4,27 |
6±4,71 |
0,4069a |
0,8404c |
0,1008c |
|
Dor |
|
|
|
|
|
|
|
|
|
Intensidade |
3,65±2,55 |
2,61±2,53 |
0,0290*a |
3,63±3,15 |
3,69±2,99 |
0,9253a |
0,9865c |
0,3316c |
|
Interferência nas atividades habituais |
3,58±2,87 |
2,47±3,11 |
0,0933b |
4,43±3,42 |
3,31±3,70 |
0,1296b |
0,5016 c |
0,6002d |
|
Fadiga |
|
|
|
|
|
|
|
|
|
Dimensão comportamental |
4,37±3,10 |
1,93±2,50 |
0,0033**b |
4,05±3,70 |
3,79±3,81 |
0,2938b |
0,8123c |
0,1398d |
|
Dimensão afetiva |
3,90±3,92 |
2,03±2,49 |
0,0583b |
4,34±4,13 |
3,57±3,46 |
0,3782b |
0,8339d |
0,2310d |
|
Dimensão sensorial/cognitivo/emocional |
2,75±3,28 |
2,31±2,45 |
0,5525b |
3,94±3,56 |
3,53±2,97 |
0,4631b |
0,7581d |
0,2631c |
|
Legendas: GE = grupo experimental; GC = grupo controle. Nota: Valores expressos: média ± desvio-padrão. (a) Teste t de Student pareado. (b) Teste de Wilcoxon. (c) Teste t de Student não pareado. (d) Teste de Mann-Whitney. (*) p<0,05. (**) p<0,01. |
||||||||
|
Tabela 4. Correlação da ansiedade com os desfechos secundários em pacientes com câncer de mama (n=26), submetidas a treinamento físico |
||||||||
|
Variáveis |
GE (n=13) |
GC (n=13) |
||||||
|
Basal |
12 semanas |
Basal |
12 semanas |
|||||
|
r |
Valor de p |
r |
Valor de p |
r |
Valor de p |
r |
Valor de p |
|
|
Dor |
|
|
|
|
|
|
|
|
|
Dimensão intensidade |
0,5145 |
0,0720a |
0,6105 |
0,0267* b |
0,6896 |
0,0091** a |
0,6446 |
0,0174* a |
|
Dimensão interferência |
0,5138 |
0,0725 a |
0,8283 |
0,0005** b |
0,6227 |
0,0230* a |
0,5450 |
0,0541b |
|
Depressão |
0,7603 |
0,0026** a |
0,7561 |
0,0028** b |
0,8022 |
0,0010** a |
0,6841 |
0,0099** a |
|
Fadiga |
|
|
|
|
|
|
|
|
|
Dimensão comportamental |
0,5006 |
0,0815a |
0,5781 |
0,0385* b |
0,7905 |
0,0013** a |
0,4709 |
0,1043b |
|
Dimensão afetiva |
0,5127 |
0,0732b |
0,6860 |
0,0096** b |
0,5165 |
0,0707b |
0,5977 |
0,0310* a |
|
Dimensão sensorial/cognitiva/emocional |
0,5393 |
0,0572b |
0,5256 |
0,0650b |
0,4721 |
0,1033b |
0,5312 |
0,0617a |
|
Legendas: GE = grupo experimental; GC = grupo controle. (a) Teste de Pearson. (b) Teste de Spearman. (*) p<0,05. (**) p<0,01; correlação negligenciável (r=<0,2), fraca (r=0,2-0,4), moderada (r=0,4-0,6), forte (r=0,6-0,8) e muito forte (r=>0,80). |
||||||||
DISCUSSÃO
Ansiedade e depressão são associadas à menor adesão terapêutica e ao aumento no uso de serviços médicos e de emergência em pacientes com câncer13. Apesar disso, existem diversas barreiras no diagnóstico de distúrbios mentais nessa população, como o medo do diagnóstico psiquiátrico interferir no tratamento oncológico, além da falta de tempo para uma avaliação em saúde mental adequada, disponibilidade limitada de especialistas e serviços psicossociais fragmentados13.
Segundo o Guideline27 da Sociedade Americana de Oncologia Clínica, todos os pacientes com câncer devem ser avaliados quanto à presença de sintomas de ansiedade e depressivos na sua trajetória de cuidado, e falhas na identificação e no tratamento dessas patologias estão relacionadas à má qualidade de vida e ao aumento da morbimortalidade27. A ansiedade pode ainda causar outros efeitos adversos, como fadiga, dificuldade do sono, problemas digestivos, taquicardia, agitação, tensão muscular, sudorese, tremor, mudança no apetite, perda de peso e de energia, além de preocupações patológicas, diminuição da imunidade, sentimento de impotência e pessimismo28.
Apesar de muitos anos de pesquisa, a prevalência de sintomas de ansiedade e depressivos em pacientes com câncer ainda é sujeita a muitos debates, em parte em razão dos diferentes tipos de escalas utilizadas e da heterogeneidade na população, estágios do câncer e tipo de tratamento recebido13. Além disso, estudos demonstram que oncologistas podem ter dificuldades em identificar morbidades psiquiátricas, pois o diagnóstico de ansiedade, em geral, é feito por médicos de atendimento primário (45%) e profissionais de saúde mental (27%), sendo apenas 1% por oncologistas13.
Um dos desfechos principais do presente estudo foi a ansiedade, com uma redução significativa no grupo de intervenção e entre os grupos após as 12 semanas. Uma metanálise, envolvendo 17 ensaios controlados randomizados, gerou a hipótese de que a prescrição de uma sessão de exercícios de resistência mais duas sessões de exercícios aeróbios de intensidade moderada por 20 semanas também são capazes de diminuir ansiedade nessa população4. Outra metanálise, contendo 33 ensaios clínicos randomizados, também observou redução significativa dessa variável29. Ademais, foi referida, em um ensaio clínico com treinamento combinado (aeróbio e resistido), a redução na ansiedade em pacientes no tratamento adjuvante do câncer de mama7.
Verificou-se uma melhora clínica, mas não estatisticamente significativa nos sintomas depressivos no GE, apesar de vários estudos demonstrarem melhora da depressão com exercícios físicos2,4,29. Esses resultados podem ser parcialmente explicados pelos baixos escores de depressão basais e em virtude do tamanho amostral, tornando difícil a conclusão sobre o impacto dos exercícios físicos na depressão.
Alguns autores têm hipotetizado que os efeitos antidepressivos e ansiolíticos dos exercícios são decorrentes de mudanças fisiológicas que resultam em neurogênese hipocampal explicada por diversos mecanismos, como aumento de betaendorfinas, do fator de crescimento vascular endotelial, do fator neurotrófico derivado do cérebro e da serotonina6. Outros mecanismos incluem aumento nos níveis de noradrenalina e alteração no eixo hipotálamo-hipófise-adrenal, pois a secreção aumentada de hormônio liberador da corticotrofina foi associado à depressão, e os exercícios atrasam a resposta do eixo ao estresse físico e mental. Além disso, exercícios aeróbios e de resistência resultam em melhora da autoestima, da imagem corporal e do senso de domínio, que são relacionados à diminuição dos sintomas depressivos6.
Neste estudo, foi observada uma diminuição da intensidade da dor no GE com o protocolo de treinamento combinado, mas não houve melhora significativa na interferência da dor na vida diária, o que talvez possa ser explicado pelo número reduzido da amostra. A diminuição na intensidade da dor pode ser decorrente da realização do treinamento combinado, pois os exercícios aeróbicos aumentam níveis periféricos de betaendorfinas, que reduzem a atividade simpática, aumentam o sono e geram estabilidade psicológica, além de aprimorar o sistema serotoninérgico e a relação entre a área terminal dos nervos com o tamanho de fibras musculares. O exercício resistido produz melhor sincronização de unidades motoras, maior eficiência no recrutamento neural, na ativação do sistema nervoso central e excitabilidade dos motoneurônios, além de deprimir os reflexos inibitórios neurais e gerar inibição dos órgãos tendinosos de Golgi30,31.
No presente estudo, também houve diferença significava apenas na dimensão comportamental da fadiga no GE, apesar de as dimensões afetiva e sensorial/cognitiva/emocional também apresentarem diminuição nos seus escores. A fadiga pode ser causada por descondicionamento físico (diminuição da força muscular e da aptidão física), comorbidades, aumento de citocinas pró-inflamatórias, fatores psicossociais (ansiedade e depressão), desregulação de neurotransmissores, alteração do eixo hipotálamo-hipófise-adrenal e interrupção do sono32.
Alguns autores33 diferenciam a fadiga periférica da central, sendo a primeira causada por anormalidades neuromusculares (por exemplo, alteração na placa muscular de excitação-contração e diminuição da recaptação do cálcio) e a segunda por anormalidades do sistema nervoso central (como falta de automotivação influenciada por fatores psicossociais como depressão). Embora sejam necessários estudos adicionais, a fadiga central tem sido relatada como a principal causa de fadiga em sobreviventes do câncer. Espera-se, assim, que o exercício sem suporte psicossocial melhore a fadiga periférica mais do que a fadiga de origem central, o que pode ter contribuído para os resultados do estudo33.
Os resultados das correlações demonstram que pacientes oncológicos e com ansiedade têm mais depressão, dor e fadiga, resultados observados tanto no GE quanto no GC, o que pode ser explicado pelo impacto da própria doença e da terapêutica empregada na vida das pacientes. Entretanto, correlações mais fortes foram identificadas no GE, demonstrando que exercícios físicos em pacientes com câncer de mama com sintomas ansiosos são benéficos para melhora da dor, depressão e fadiga.
As evidências presentes apoiam a ideia de que intervenções por meio de exercícios físicos são benéficas e seguras para sobreviventes de câncer de mama34,35, alguns estudos36 longitudinais prospectivos demonstram que a atividade física diminui durante o tratamento anticancerígeno. Portanto, a intervenção por meio de exercícios deve ser prescrita para sobreviventes do câncer de mama, encorajando-os a continuar seus exercícios habituais ou a adotar uma prescrição adequada de acordo com suas necessidades28.
Como limitações desta análise, pode-se destacar a investigação do exercício durante diferentes períodos da terapia anticancerígena e o tamanho reduzido da amostra, porém, há dificuldades em pesquisas com pacientes com câncer por conta dos efeitos colaterais dos tratamentos e das condições econômicas das pacientes para acesso aos locais de treinamento físico37, dificultando a generalização dos resultados. Entretanto, como aspectos positivos, foi estudado apenas um tipo de câncer, com resultados significativos apesar do pequeno tamanho amostral e do curto período de intervenção.
CONCLUSÃO
A intervenção combinada envolvendo exercícios aeróbios, de resistência e de flexibilidade, durante 12 semanas, mostra-se segura e viável e apresenta efeitos benéficos sobre a ansiedade, fadiga e dor em pacientes com câncer de mama. A partir deste estudo inicial, novas pesquisas poderão ser realizadas para testar, de maneira mais efetiva, os resultados aqui observados para posterior generalização.
AGRADECIMENTOS
Ao Hospital Aldenora Bello, à Fundação de Amparo à Pesquisa e ao Desenvolvimento Científico e Tecnológico do Maranhão (Fapema) pela bolsa de mestrado, e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), Código de Financiamento 001.
CONTRIBUIÇÕES
Marília de Oliveira Bringel, Andréa Dias Reis e Letícia Campos Aguiar contribuíram substancialmente na concepção e/ou no planejamento do estudo, na obtenção, análise e interpretação dos dados, assim como na redação e revisão crítica com contribuição intelectual. João Batista Santos Garcia participou da redação e revisão crítica com contribuição intelectual. Todos os autores aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Instituto Nacional de Câncer José Alencar Gomes da Silva. Estimativa 2020: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2019 [acesso 2022 fev 12]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//estimativa-2020-incidencia-de-cancer-no-brasil.pdf
2. Rogers LQ, Courneya KS, Anton PM, et al. Effects of a multicomponent physical activity behavior change intervention on fatigue, anxiety, and depressive symptomatology in breast cancer survivors: randomized trial. Psychooncology. 2017;26(11):1901-6. doi: https://doi.org/10.1002/pon.4254
3. American Cancer Society. Cancer treatment & survivorship: facts & figures 2019-2021 [Internet]. Atlanta: American Cancer Society; 2019 [cited 2022 Feb 14]. Available from: https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/cancer-treatment-and-survivorship-facts-and-figures/cancer-treatment-and-survivorship-facts-and-figures-2019-2021.pdf
4. Carayol M, Bernard P, Boiché J, et al. Psychological effect of exercise in women with breast cancer receiving adjuvant therapy: What is the optimal dose needed? Ann Oncol. 2013;24(2):291-300. doi: https://doi.org/10.1093/annonc/mds342
5. Wong P, Muanza T, Hijal T, et al. Effect of exercise in reducing breast and chest-wall pain in patients with breast cancer: a pilot study. Curr Oncol. 2012;19(3):129-35. doi: https://doi.org/10.3747/co.19.905
6. Rethorst CD, Wipfli BM, Landers DM. The antidepressive effects of exercise: a meta-analysis of randomized trials. Sport Med. 2009;39(6):491-511. doi: https://doi.org/10.2165/00007256-200939060-00004
7. Carayol M, Ninot G, Senesse P, et al. Short- and long-term impact of adapted physical activity and diet counseling during adjuvant breast cancer therapy: the “APAD1” randomized controlled trial. BMC Cancer. 2019;19(1):737. doi: https://doi.org/10.1186/s12885-019-5896-6
8. Ramírez-Vélez R, Zambom-Ferraresi F, García-Hermoso A, et al. Evidence-based exercise recommendations to improve mental wellbeing in women with breast cancer during active treatment: a systematic review and meta-analysis. Cancers (Basel). 2021;13(2):264. doi: https://doi.org/10.3390/cancers13020264
9. Travier N, Velthuis MJ, Steins Bisschop CN, et al. Effects of an 18-week exercise programme started early during breast cancer treatment: a randomised controlled trial. BMC Med. 2015;13:121. doi: http://doi.org/10.1186/s12916-015-0362-z
10. Furmaniak AC, Menig M, Markes MH. Exercise for women receiving adjuvant therapy for breast cancer. Cochrane Database Syst Rev. 2016;9(9):CD005001. doi: https://doi.org/10.1002/14651858.CD005001.pub3
11. Conselho Nacional de Saúde (BR). Resolução nº 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos [Internet]. Diário Oficial da União, Brasília, DF. 2013 jun 13 [acesso 2014 jan 1]; Seção 1:59. Disponível em: https://conselho.saude.gov.br/resolucoes/2012/Reso466.pdf
12. Botega NJ, Bio MR, Zomignani MA, et al. Transtornos do humor em enfermaria de clínica médica e validação de escala de medida (HAD) de ansiedade e depressão. Rev Saúde Pública. 1995;29(5):355-63. doi: https://doi.org/10.1590/S0034-89101995000500004
13. Vin-Raviv N, Akinyemiju TF, Galea S, et al. Depression and anxiety disorders among hospitalized women with breast cancer. PLoS One. 2015;10(6):e0129169. doi: https://doi.org/10.1371/journal.pone.0129169
14. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983;67(6):361-70. doi: https://doi.org/10.1111/j.1600-0447.1983.tb09716.x
15. Ferreira KA, Teixeira MJ, Mendonza TR, et al. Validation of brief pain inventory to Brazilian patients with pain. Support Care Cancer. 2011;19(4):505-11. doi: https://doi.org/10.1007/s00520-010-0844-7
16. Cantarero-Villanueva I, Fernández-Lao C, Díaz-Rodríguez L, et al. The piper fatigue scale-revised: translation and psychometric evaluation in Spanish-speaking breast cancer survivors. Qual Life Res. 2014;23(1):271-6. doi: https://doi.org/10.1007/s11136-013-0434-5
17. Mota DDCF, Pimenta CAM, Piper BF. Fatigue in Brazilian cancer patients, caregivers, and nursing students: a psychometric validation study of the Piper Fatigue Scale-Revised. Support Care Cancer. 2009;17(6):645-52. doi: https://doi.org/10.1007/s00520-008-0518-x
18. Fontoura AS, Formentin C, Abech EA. Guia prático de avaliação física: uma abordagem didática, abrangente e atualizada. 2. ed. rev. ampl. São Paulo: Phorte; 2013.
19. Sobin LH, Wittekind C, editors. TNM: classificação de tumores malignos [Internet]. Eisenberg ALA, tradução. 6.ed. Rio de Janeiro: INCA; 2004 [acesso 2022 Mar 3]. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/inca/tnm2.pdf
20. Benedetti TB, Antunes PC, Rodriguez-Añez CR, et al. Reprodutibilidade e validade do Questionário Internacional de Atividade Física (IPAQ) em homens idosos. Rev Bras Med Esporte. 2007;13(1):11-6. doi: https://doi.org/10.1590/S1517-86922007000100004
21. Stringuetta-Belik F, Shiraishi FG, Oliveira e Silva VR, et al. Greater level of physical activity associated with better cognitive function in hemodialysis in end stage renal disease. Braz J Nephrol. 2012;34(4):378-86. doi: https://doi.org/10.5935/0101-2800.20120028
22. Karvonen MJ, Kentala E, Mustala O. The effects of training on heart rate; a longitudinal study. Ann Med Exp Biol Fenn. 1957;35(3):307-15. Cited in: PubMed; PMID 13470504.
23. Neil SE, Klika RJ, Garland J, et al. Cardiorespiratory and neuromuscular deconditioning in fatigued and non-fatigued breast cancer survivors, Support Care Cancer. 2013;21(3):873-81. doi: https://doi.org/10.1007/s00520-012-1600-y
24. Weineck J. Treinamento ideal. 9. ed. São Paulo: Manole; 2003.
25. Guedes DP, Guedes JERP. Manual prático para avaliação em educação física. São Paulo: Manole; 2006.
26. Battaglini C, Bottaro M, Dennehy C, et al. The effects of resistance training on muscular strength and fatigue levels in breast cancer patients. Rev Bras Med Esporte. 2006;12(3):153-8. doi: https://doi.org/10.1590/S1517-86922006000300009
27. Andersen BL, DeRubeis RJ, Berman BS, et al. Screening, assessment, and care of anxiety and depressive symptoms in adults with cancer: an American Society of Clinical Oncology guideline adaptation. J Clin Oncol. 2014;32(15):1605-19. doi: https://doi.org/10.1200/JCO.2013.52.4611
28. Li XM, Zhou KN, Yan H, et al. Effects of music therapy on anxiety of patients with breast cancer after radical mastectomy: a randomized clinical trial. J Adv Nurs. 2012;68(5):1145-55. doi: https://doi.org/10.1111/j.1365-2648.2011.05824.x
29. Zhu G, Zhang X, Wang Y, et al. Effects of exercise intervention in breast cancer survivors: a meta-analysis of 33 randomized controlled trails. Onco Targets Ther. 2016;9:2153-68. doi: https://doi.org/10.2147/OTT.S97864
30. McArdle WD, Katch FI, Katch VL. Fisiologia do exercício: nutrição, energia e desempenho humano. 7. ed. Rio de Janeiro: Guanabara Koogan; 2011.
31. Valim V, Natour J, Xiao Y, et al. Efeitos do exercício físico sobre os níveis séricos de serotonina e seu metabólito na fibromialgia: um estudo piloto randomizado. Rev Bras Reumatol. 2013;53(6):538-41. doi: https://doi.org/10.1016/j.rbr.2013.02.001
32. Rogers LQ, Vicari S, Trammell R, et al. Biobehavioral factors mediate exercise effects on fatigue in breast cancer survivors. Med Sci Sports Exerc. 2014;46(6):1077-88. doi: https://doi.org/10.1249/MSS.0000000000000210
33. Davis MP, Walsh D. Mechanisms of fatigue. J Support Oncol. 2010;8(4):164-74. Cited in: PubMed; PMID 20822034.
34. Deminice R, Rezende LFM, Rosa DD, et al. Physical activity recommendations for cancer prevention and control: a Brazilian consortium. Braz J Oncol. 2022;18:e-20220311. doi: https://doi.org/10.5935/2526-8732.20220311
35. Rock CL, Thomson CA, Sullivan KR, et al. American Cancer Society nutrition and physical activity guideline for cancer survivors. 2022;3:230-62. doi: https://doi.org/10.3322/caac.21719
36. Kwan ML, Sternfeld B, Ergas IJ, et al. Change in physical activity during active treatment in a prospective study of breast cancer survivors. Breast Cancer Res Treat. 2012;131(2):679-90. doi: https://doi.org/10.1007/s10549-011-1788-4
37. Backman M, Wengström Y, Johansson B, et al. A randomized pilot study with daily walking during adjuvant chemotherapy for patients with breast and colorectal cancer. Acta Oncol. 2014;53(4):510-20. doi: https://doi.org/10.3109/0284186X.2013.873820
Recebido em 10/3/2022
Aprovado em 17/5/2022
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde