Índice de Fitoquímicos da Dieta: Aplicação em Pacientes em Tratamento Oncológico
Diet Phytochemical Index: Application in Patients under Oncological Treatment
Índice Fitoquímico Dietético: Aplicación en Pacientes en Tratamiento Oncológico
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n4.2614
Marina Maria de Martino Melo1; Amanda Cristina Torralbo Pugliesi2; Maisa Rodrigues de Paula3; Fabíola Pansani Maniglia4
1-4Universidade de Franca (Unifran). Franca (SP), Brasil.
E-mail: mamartino@hotmail.com. Orcid iD: https://orcid.org/0000-0001-7137-8455
E-mail: amandatorralbo@gmail.com. Orcid iD: https://orcid.org/0000-0003-1061-5853
E-mail: maisarodriguesdepaula@gmail.com. Orcid iD: https://orcid.org/0000-0003-0487-3354
E-mail: fabiola.maniglia@unifran.edu.br. Orcid iD: https://orcid.org/0000-0002-3281-9470
Endereço para correspondência: Maisa Rodrigues de Paula. Av. Dr. Armando Salles Oliveira, 201 – Parque Universitário. Franca (SP), Brasil. CEP 14404-600. E-mail: maisarodriguesdepaula@gmail.com
RESUMO
Introdução: O tratamento do câncer provoca efeitos adversos que podem alterar o consumo alimentar e, consequentemente, a ingestão de vitaminas, minerais, fibras e fitoquímicos. Objetivo: Aplicar o Índice de Fitoquímicos (IF) da dieta nos registros alimentares de pacientes em tratamento oncológico. Método: Estudo transversal com indivíduos em tratamento oncológico. Foram coletadas informações sociodemográficas e clínicas dos participantes para caracterização da população. Os dados alimentares foram obtidos por meio de recordatório alimentar de 24 horas e inseridos no software Nutrabem Pro® para obtenção dos valores de macro e micronutrientes, bem como dos fitoquímicos. Para avaliar o IF, aplicou-se a fórmula proposta por McCarty. Resultados: Participaram do estudo 50 pacientes predominantemente do sexo feminino e com média da idade de 58±12,1 anos. A média geral do IF foi de 20,44±11,55, e a ordem crescente de consumo foi: luteína-zeaxantina, alfacaroteno, licopeno, criptoxantina e betacaroteno. Os alimentos que mais contribuíram para a ingestão dos fitoquímicos foram: beterraba, cenoura e abóbora-japonesa para beta e alfacaroteno; laranja e mamão para betacriptoxantina; molho de tomate, melancia e mamão para licopeno; almeirão e beterraba para luteína/zeaxantina; e maçã, banana e azeite para fitoesterol. O IF não se associou com as variáveis sociodemográficas e clínicas da população. Conclusão: Os pacientes em tratamento oncológico apresentaram baixo consumo de fitoquímicos. Esse resultado condiz com a ingestão insuficiente de frutas e hortaliças, as quais representam as principais fontes de carotenoides nas refeições, além do baixo consumo de oleaginosas e sementes, que configuram uma importante fonte de fitoesteróis.
Palavras-chave: neoplasias; comportamento alimentar; compostos fitoquímicos; dieta saudável.
ABSTRACT
Introduction: Cancer treatment causes adverse effects that can change food consumption and consequently the intake of vitamins, fiber and phytochemicals. Objective: To apply the dietary Phytochemical Index (PI) in the food records of patients undergoing cancer treatment. Method: Cross-sectional study with individuals in cancer treatment. The participants’ sociodemographic and clinical information was collected to characterize the population. Feeding was obtained through a 24-hour dietary recall and entered into the Nutrabem Pro® software to obtain macro and microchemical values, as well as phytochemical data. To evaluate the study with PI, the formula proposed by McCarty was applied. Results: Ten patients, predominantly females, with an average age of 58±2.1 years participated of the study. The overall mean of PI was 20.44±11.55, and the rising order of consumption was: lutein-zeaxanthin, alpha-carotene, lycopene, cryptoxanthin and beta-carotene. The foods that contributed the most for the intake of phytochemicals were: beetroot, carrots and Japanese pumpkin for beta and alpha-carotene; orange and papaya for beta-cryptoxanthin; tomato sauce, watermelon and papaya for lycopene; chicory and beetroot for lutein/zeaxanthin; and apple, banana and olive oil for phytosterol. PI was not associated with sociodemographic and clinical variables of the population. Conclusion: Patients in cancer treatment had a low consumption of phytochemicals. This result is consistent with an insufficient intake of fruits and vegetables, as they represent the main sources of carotenoids in meals, in addition to the low consumption of oilseeds and seeds, which are an important source of phytosterols.
Key word: neoplasms; feeding behavior; phytochemicals; diet, healthy.
RESUMEN
Introducción: El tratamiento del cáncer provoca efectos adversos que pueden modificar el consumo de alimentos y consecuentemente la ingesta de vitaminas, minerales, fibra y fitoquímicos. Objetivo: Aplicar el Índice Fitoquímico dietético (IF) en los registros alimentarios de pacientes en tratamiento oncológico. Método: Estudio transversal con individuos en tratamiento oncológico. Se recopiló la información sociodemográfica y clínica de los participantes para caracterizar la población. Los datos alimentarios se obtuvieron a través de un registro alimentario de 24 horas y se ingresaron al software Nutrabem Pro® para obtener valores de macro y micronutrientes, así como fitoquímicos. Para evaluar la FI se aplicó la fórmula propuesta por McCarty. Resultados: Participaron del estudio 50 pacientes, predominantemente del sexo femenino, con una edad media de 58±12,1 años. La media general de FI fue de 20,44±11,55, y el orden creciente de consumo fue: luteína-zeaxantina, alfacaroteno, licopeno, criptoxantina y betacaroteno. Los alimentos que más contribuyeron a la ingesta de fitoquímicos fueron: remolacha, zanahoria y calabaza japonesa para beta y alfacaroteno; naranja y papaya para betacriptoxantina; salsa de tomate, sandía y papaya para licopeno; achicoria y remolacha para luteína/zeaxantina; y manzana, plátano y aceite de oliva para fitosterol. El FI no se asoció con las variables sociodemográficas y clínicas de la población. Conclusión: Los pacientes en tratamiento oncológico presentaron un bajo consumo de fitoquímicos. Este resultado es consistente con el consumo insuficiente de frutas y verduras, que representan las principales fuentes de carotenoides en las comidas, además del bajo consumo de oleaginosas y semillas, que son una fuente importante de fitoesteroles.
Palabras clave: neoplasias; conducta alimentaria; composés phytochimiques; dieta saludable.
INTRODUÇÃO
De acordo com os dados epidemiológicos, a cada ano, o número de casos de câncer diagnosticados globalmente é de aproximadamente 12,7 milhões, com previsão de aumento para 21,3 milhões de novos casos e 13,1 milhão de mortes até 20302.
Existem vários tipos de câncer, e as opções de tratamento mais comuns para essas neoplasias malignas são: cirurgia, radioterapia e quimioterapia, as quais podem ou não ser associadas3.
Entre as modalidades de tratamento, a quimioterapia é a mais utilizada e consiste na administração de drogas citotóxicas para destruição e morte das células cancerosas. No entanto, essa terapia também agride as células saudáveis, causando diversos efeitos colaterais4. Os efeitos adversos mais apresentados pelos pacientes são: disfagia, dor, diarreia ou constipação, náuseas, xerostomia, alterações no paladar, entre outros. Percebe-se que muitas dessas reações pode afetar o consumo alimentar e, consequentemente, o estado nutricional do paciente5,6.
Sabe-se que a redução do consumo alimentar não é prejudicial somente no que se refere à depleção de tecidos, adiposo e muscular, aumentando a fragilidade do paciente e diminuindo sua tolerância ao tratamento. A literatura mostra que a diminuição da ingestão dietética de nutrientes, como vitaminas e minerais, bem como de compostos bioativos, também agrava o estado nutricional e clínico dos pacientes oncológicos7,8.
Estudos evidenciam o benefício da ingestão de frutas, legumes e verduras pela ação promissora na inibição da progressão do câncer e no aumento de sobrevida após o diagnóstico e o tratamento da doença. Os autores destacam que esses benefícios são atribuídos aos componentes desses alimentos, como vitaminas, minerais, fibras e fitoquímicos9,10.
O termo “fitoquímico” vem do grego phyto, que significa vegetal. Os fitoquímicos são produtos químicos presentes ou originados pelo metabolismo secundário das plantas, podendo auxiliá-las a resistir a infecções causadas por bactérias, fungos e vírus. São substâncias bioativas com ação antioxidante. Para ser considerado um fitoquímico, o composto precisa promover efeitos que sejam benéficos ao organismo, sendo algumas vezes responsável também pela coloração dos alimentos vegetais11,12.
Com base nessas informações, o presente estudo pretende aplicar o Índice de Fitoquímicos da dieta nos registros alimentares de pacientes em tratamento oncológico para estimar a proteção antioxidante da dieta praticada por eles.
MÉTODO
Trata-se de um estudo transversal, realizado com dados alimentares de 50 pacientes em tratamento oncológico ambulatorial em um hospital do interior do Estado de São Paulo. A pesquisa atendeu à Resolução n.º 466/201213 do Conselho Nacional de Saúde e foi aprovada em seus aspectos éticos e metodológicos pelo Comitê de Ética em Pesquisa da instituição sob o n.º de parecer 3.588.356 (CAAE: 17466319.8.0000.5438).
Os dados alimentares foram obtidos por meio de um recordatório alimentar de 24 horas e inseridos no software Nutrabem Pro®14 para a obtenção dos valores de energia, macro e micronutrientes, bem como dos seguintes fitoquímicos: betacaroteno, alfacaroteno, betacriptoxantina, licopeno, luteína-zeaxantina, fitoesteróis, stigmasterol, campesterol e betassitosterol.
Para avaliar o Índice de Fitoquímicos, aplicou-se a fórmula proposta por McCarty15:
![]()
As preferências e aversões alimentares foram questionadas, assim como o uso de suplementação nutricional. Além das informações dietéticas, também foram registrados: sexo, idade, tipo de neoplasia, peso corporal, Índice de Massa Corporal (IMC), circunferência do braço e circunferência da panturrilha. O IMC foi classificado de acordo com a Organização Mundial da Saúde para adultos16 e de acordo com Lipschitz17 para idosos.
Para análise das medidas de circunferência do braço, utilizou-se a tabela de distribuição em percentis da circunferência do braço de Frisancho18 e, para circunferência da panturrilha, foi adotado o ponto de corte de 33 cm para mulheres e 34 cm para homens19.
Após a tabulação dos dados, foram calculadas as medidas de tendência central (média e mediana) e as medidas de dispersão (desvio-padrão, mínimo e máximo) para a análise descritiva. Já para a análise estatística, utilizaram-se os testes t de Student e ANOVA para verificar a diferença dos valores de média do Índice de Fitoquímicos entre os grupos quanto às características descritivas. Foi considerado o nível de significância de 5%, e as análises foram realizadas utilizando o software SPSS.
RESULTADOS
Dos 50 indivíduos que compuseram a amostra do estudo, a maior parte era de mulheres (68%) e a média da idade foi de 58±12,1 anos. Os demais dados sociodemográficos e clínicos dos participantes estão apresentados na Tabela 1.
|
Tabela 1. Dados sociodemográficos e clínicos dos pacientes em tratamento oncológico (n=50). Franca (SP), 2019 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Legendas: TGI = Trato gastrointestinal; IMC = Índice de Massa Corporal. (*) Outros: pâncreas, leucemia, mieloma múltiplo, próstata, endométrio, urotelial e linfoma de Hodgkin. |
A respeito dos dados dos registros alimentares, verificou-se uma média de consumo energético de 1.405,8±536,2 calorias e de 68,2±38,8 gramas de proteína, sendo a média da razão proteína/kg de peso corporal igual a 1 grama.
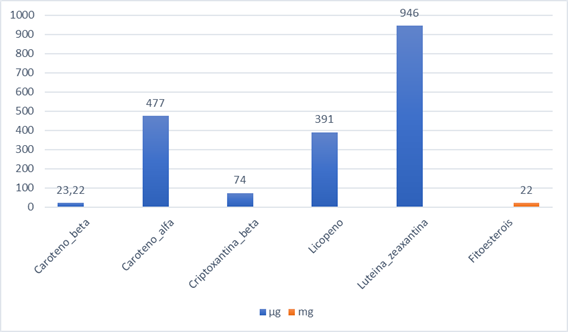
A respeito dos fitoquímicos, a média geral do índice foi de 20,44±11,55. O Gráfico 1 ilustra os fitoquímicos analisados no presente estudo e a média das quantidades presentes na alimentação dos pacientes avaliados.
|
|
|
Gráfico 1. Valores médios dos fitoquímicos avaliados |
Os alimentos que mais contribuíram para a ingestão dos fitoquímicos foram: beterraba, cenoura e abóbora-japonesa para beta e alfacaroteno; laranja e mamão para betacriptoxantina; molho de tomate, melancia e mamão para licopeno; almeirão e beterraba para luteína/zeaxantina; e maçã, banana e azeite para fitoesterol.
A Tabela 2 apresenta os resultados da média do Índice de Fitoquímicos da dieta dos grupos de indivíduos divididos nas categorias das variáveis descritivas, bem como a ausência de diferença estatística entre essas categorias.
|
Tabela 2. Valores de média e desvio-padrão do Índice de Fitoquímicos, conforme as características da população do estudo (n=50). Franca (SP), 2019 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Legendas: TGI = Trato gastrointestinal; IMC = Índice de Massa Corporal |
DISCUSSÃO
Os participantes do estudo eram predominantemente do sexo feminino, divididos igualitariamente entre adultos e idosos e classificados em sua maioria com excesso de peso.
Segundo os dados da última Pesquisa Nacional de Saúde20, 60,3% da população brasileira adulta se encontram com excesso de peso. Já a obesidade foi vista em 21,8% dos homens e 29,5% das mulheres com 18 anos ou mais20. Dessa maneira, verifica-se que mesmo os pacientes oncológicos, que apresentam deficiências importantes do estado nutricional e risco de subnutrição, apresentam acúmulo de gordura corporal. Ressalta-se que a amostra predominantemente de mulheres com câncer de mama também colabora para esse resultado, já que o ganho de peso pode estar presente antes do diagnóstico, mas também pode se agravar durante o tratamento desse tipo de neoplasia21,22.
Os achados na literatura indicam que o excesso de peso da população está atrelado ao consumo de alimentos de alta densidade energética, porém, muitas vezes, de baixo valor nutricional23. Tais alimentos, além de não contribuírem com uma oferta adequada de macro e micronutrientes, também não possibilitam a ingestão dos fitoquímicos23.
Apesar de não existirem pontos de corte para a adequação do Índice de Fitoquímicos na dieta, sua média revelou uma baixa contribuição desses compostos bioativos na alimentação dos pacientes avaliados, quando comparada aos valores sugeridos para uma boa saúde e prevenção de doenças24. Esse baixo consumo é condizente com os achados de uma investigação nacional sobre o consumo de fitoquímicos. Verificou-se uma mediana de ingestão de polifenóis, ajustada para energia, de 204 mg/1.000 kcal/dia. As pesquisadoras verificaram que os alimentos que mais contribuíram para a ingestão dos fitoquímicos foram o café e o suco de laranja, e ainda afirmaram que, de acordo com os valores verificados, a dieta apresentada pelos brasileiros apresentava baixa qualidade25.
Estudiosos que utilizaram o Índice de Fitoquímicos para avaliar a alimentação de pessoas com câncer de mama mostraram que o consumo de frutas, vegetais, legumes, nozes, produtos de soja, azeite e azeitona compreendem alimentos ricos nessa categoria, e sugeriram que o aumento na ingestão desses alimentos esteja ligado a uma menor chance de desenvolver o câncer de mama26. Mesmo com a doença já instalada, pesquisadores apontam o benefício do aumento da ingestão de vegetais para a proteção antioxidante das células não tumorais. Mulheres com câncer de mama que participaram de uma intervenção de aconselhamento sobre maior ingestão de fitoquímicos não só aumentaram os níveis séricos de antioxidantes como tiveram benefícios da composição corporal27.
O fitoquímico mais consumido no presente estudo foi a luteína que, por estar presente em diversos vegetais de cor verde, normalmente aparece na alimentação por meio das verduras28. Já o segundo fitoquímico mais consumido foi o alfacaroteno, um carotenoide presente especialmente em alimentos de cor alaranjada como cenoura, moranga e azeite de dendê28.
Os demais fitoquímicos encontrados na alimentação dos pacientes oncológicos foram o licopeno, a criptoxantina e o betacaroteno, porém, em quantidades menores.
O licopeno é o carotenoide que dá a cor vermelha aos tomates, sendo também encontrado na melancia, goiaba e, em menores quantidades, em outros alimentos como mamão e pitanga. Esse pigmento de ação antioxidante parece ser melhor absorvido quando aquecido e, por isso, o molho e o purê do tomate são fontes mais concentradas e biodisponíveis desse fitoquímico29,30.
Um estudo realizado com 48 pacientes com câncer da cavidade oral e da orofaringe investigou a ingestão de carotenoides e constatou a presença dos pigmentos protetores nos locais acometidos pela neoplasia. Os pesquisadores ainda destacam a importância desse consumo para a diferenciação de células normais e o aumento da apoptose de células neoplásicas31.
Os antioxidantes como vitamina A, E e C, luteína, licopeno e betacaroteno ajudam a diminuir a inflamação crônica, que está sendo cada vez mais constatada como um fator etiológico e proliferativo do câncer. A respeito da neoplasia de mama, um estudo feito com 160 mulheres que se submeteram à cirurgia mostrou que esses antioxidantes podem desempenhar efeitos biológicos no tecido mamário melhorando a inflamação32.
Além dos carotenoides, também foram analisadas as concentrações de fitoesteróis na alimentação dos participantes. Os fitoesteróis são compostos bioativos de origem vegetal que apresentam uma estrutura similar ao colesterol, os quais podem auxiliar no tratamento de dislipidemias. As fontes alimentares desses compostos incluem óleos vegetais, oleaginosas, cereais com gérmen e farelo de trigo e também alguns legumes e frutas como maracujá, laranja e couve-flor33.
O interesse pela busca de fitoquímicos como flavonoides, polifenóis e fitoesteróis se dá pela comprovada ação quimiopreventiva que protege as células sadias do estresse oxidativo provocado pelo tratamento oncológico34.
É importante ressaltar que o presente estudo apresentou limitações que devem ser mencionadas. Primeiramente, nem todos os fitoquímicos foram avaliados pelo software utilizado na pesquisa, uma vez que são escassas as fontes de informações sobre a presença desses elementos nos alimentos. Dessa forma, é possível que os valores do Índice de Fitoquímicos possam ser discretamente superiores. Além disso, como em qualquer pesquisa que se utilize de registros alimentares, a possibilidade de omissão ou esquecimento dos itens consumidos configura um viés importante e já esperado em trabalhos de inquérito alimentar.
CONCLUSÃO
Os pacientes em tratamento oncológico apresentaram baixo consumo de fitoquímicos alimentares. Esse resultado condiz com a ingestão insuficiente de frutas e hortaliças, as quais representam as principais fontes de carotenoides nas refeições, além do baixo consumo de oleaginosas e sementes, que configuram uma importante fonte de fitoesteróis.
Sugere-se que estratégias de educação nutricional com pacientes oncológicos ressaltem os benefícios do consumo de fitoquímicos na alimentação, de modo a promover ação antioxidante e proteger o organismo dos danos excessivos provocados pela doença e pelo tratamento.
CONTRIBUIÇÕES
Marina Maria de Martino Melo e Amanda Cristina Torralbo Pugliesi contribuíram substancialmente na concepção e/ou no planejamento do estudo; e na obtenção, análise e interpretação dos dados. Maisa Rodrigues de Paula e Fabiola Pansani Maniglia contribuíram substancialmente na redação e revisão crítica. Todas as autoras aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
2. Goss P, Brittany LL, Badovinac-Crnjevic T, et al. Planejamento do controle do câncer na América Latina e no Caribe. Lancet Oncol [Internet]. 2013 [acesso 2021 jun 5];14(5):391-436. Disponível em: https://www.ulaccam.org/pdfs/Planning-Cancer-Control-in-Latin-America-and-the-Caribbean_Portuguese.pdf
3. Maniglia FP, Cruz LC, Costa LC, et al. Avaliação da percepção do paladar de pacientes oncológicos: relação com variáveis pessoais e clínicas e comparação com um grupo controle. Rev Bras Cancerol. 2021;67(1):e-11994. doi: https://doi.org/10.32635/2176-9745.RBC.2021v67n1.994
4. Wang JJ, Lei KF, Han F. Tumor microenvironment: recent advances in various cancer treatments. Eur Rev Med Pharmacol Sci. 2018;22(12):3855-64. doi: https://doi.org/10.26355/eurrev_201806_15270
5. Bressan V, Stevanin S, Bianchi M, et al. The effects of swallowing disorders, dysgeusia, oral mucositis and xerostomia on nutritional status, oral intake and weight loss in head and neck cancer patients: a systematic review. Cancer Treat Rev. 2016;45:105-19. doi: https://doi.org/10.1016/j.ctrv.2016.03.006
6. Palmieri BN, Moulatlet EM, Buschinelli LKO, et al. Aceitação de preparações e sua associação com os sintomas decorrentes do tratamento de câncer em pacientes de uma clínica especializada. Cad Saúde Colet [Internet]. 2013 [acesso 2021 set 10];21(1):2-9. Disponível em: https://www.scielo.br/j/cadsc/a/vhSYwPr5ytbN3rFCPRvTbkm/?format=pdf&lang=pt
7. Tessarin MCF, Silva MAM. Nutrigenômica e câncer: uma revisão. Cad UniFOA [Internet]. 2013 [acesso 2021 set 10];8(1 Esp):79-96. Disponível em: https://revistas.unifoa.edu.br/cadernos/article/view/1239/1124
8. Souza RG, Lopes TVC, Pereira SS, et al. Avaliação do estado nutricional, consumo alimentar e capacidade funcional em pacientes oncológicos. Braz J Oncol [Internet]. 2017 [acesso 2021 set 10];13(44):1-11. Disponível em: https://cdn.publisher.gn1.link/brazilianjournalofoncology.com.br/pdf/v13n44a04.pdf
9. Kushi LH, Doyle C, McCullough M, et al. American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity. CA Cancer J Clin. 2012;62(1):30-67. doi: https://doi.org/10.3322/caac.20140
10. Zhu F, Du B, Xu B. Anti-inflammatory effects of phytochemicals from fruits, vegetables, and food legumes: a review. Crit Rev Food Sci Nutr. 2018;58(8):1260-70. doi: https://doi.org/10.1080/10408398.2016.1251390
11. Gomes FS. Carotenóides: uma possível proteção contra o desenvolvimento de câncer. Rev Nutr. 2007;20(5):537-48. doi: https://doi.org/10.1590/S1415-52732007000500009
12. Oliveira RS, Silva WM, Prati WJ, et al. Ação quimiopreventiva dos fitoquímicos por meio da regulação do fator de transcrição Nrf2: revisão integrativa da literatura. Rev Bras Cancerol. 2020;66(1):e-07428. doi: https://doi.org/10.32635/2176-9745.RBC.2020v66n1.428
13. Conselho Nacional de Saúde (BR). Resolução nº 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção 1:59.
14. Nutrabem [Internet]. Versão 3.1.07 São Paulo: Unifesp. 2012 - [atualizado 2016 abr 27; acesso 2021 out 25]. Disponível em: https://nutrabem.unifesp.br/instituto-nutra-bem/
15. McCarty MF. Proposal for a dietary “phytochemical index”. Med Hypotheses. 2004;63(5):813-7. doi: https://doi.org/10.1016/j.mehy.2002.11.004
16. World Health Organization. Obesity: preventing and managing the global epidemic: report of a WHO consultation [Internet]. Geneva: WHO; 2000 [cited 2021 Oct 25]. (WHO technical report series; 894). Available from: https://apps.who.int/iris/handle/10665/42330
17. Lipschitz DA. Screening for nutritional status in the elderly. Prim Care. 1994;21(1):55-67. doi: https://doi.org/10.1016/S0095-4543(21)00452-8
18. Frisancho AR. Anthropometric standards for the assessment of growth and nutritional status. Ann Arbor (MI): University of Michigan; 1990.
19. Heymsfield SB, Gonzalez MC, Lu J, et al. Skeletal muscle mass and quality: evolution of modern measurement concepts in the context of sarcopenia. Proc Nutr Soc. 2015;74(4):355-66. doi: https://doi.org/10.1017/S0029665115000129
20. Instituto Brasileiro de Geografia e Estatística. Pesquisa nacional de saúde: 2019: atenção primária à saúde e informações antropométricas: Brasil [Internet]. Rio de janeiro: IBGE; 2020 [acesso 2021 out 25]. Disponível em: https://biblioteca.ibge.gov.br/visualizacao/livros/liv101758.pdf
21. Capelari P, Ceni GC. Comportamento alimentar e perfil nutricional de pacientes oncológicos em tratamento quimioterápico. Demetra. 2018;13(1):223-40. doi: https://doi.org/10.12957/demetra.2018.30309
22. Oliveira DR, Carvalho ESC, Campos LC, et al. Avaliação nutricional de pacientes com câncer de mama atendidas no Serviço de Mastologia do Hospital das Clínicas, Belo Horizonte (MG), Brasil. Ciênc Saúde Coletiva. 2014;19(05):1573-80. doi: https://doi.org/10.1590/1413-81232014195.02262013
23. Popki BM, Reardon T. Obesity and the food system transformation in Latin America. Obes Rev. 2018;19(8):1028-64. doi: https://doi.org/10.1111/obr.12694
24. Institute of Medicine (US). Dietary reference intakes for vitamin C, vitamin E, selenium, and carotenoids. Washington (DC): National Academies Press (US); 2000. doi: https://doi.org/10.17226/9810
25. Carnauba RA, Hassimotto NMA, Lajolo FM. Estimated dietary polyphenol intake and major food sources of the Brazilian population. Br J Nutr. 2021;126(3):441-8. doi: https://doi.org/10.1017/S0007114520004237
26. Aghababayan S, Mobarakeh ZS, Qorbani M, et al. Dietary phytochemical index and benign breast diseases: a case-control study. Nutr Cancer. 2020;72(6):1067-73. doi: https://doi.org/10.1080/01635581.2019.1658795
27. Cho SW, Kim JH, Lee SM, et al. Effect of 8-week nutrition counseling to increase phytochemical rich fruit and vegetable consumption in korean breast cancer patients: a randomized controlled trial. Clin Nutr Res. 2014;3(1):39-47. doi: https://doi.org/10.7762/cnr.2014.3.1.39
28. Coradin L, Pombo VB, organizadores. Fontes brasileiras de carotenóides: tabela brasileira de composição de carotenóides em alimentos [Internet]. Brasília (DF): Ministério do Meio Ambiente; 2008 [acesso 2021 nov 16]. Disponível em: https://issuu.com/pesquisa-unificada/docs/fontes_brasileiras_de_caroten_ides
29. Shami NJE, Moreira EAM. Licopeno como agente antioxidante. Rev Nutr. 2004;17(2):227-36. doi: https://doi.org/10.1590/S1415-52732004000200009
30. Moritz B, Tramonte VLC. Biodisponibilidade do licopeno. Rev Nutr. 2006;19(2):265-73. doi: https://doi.org/10.1590/S1415-52732006000200013
31. Maio R, Berto JC, Corrêa CR, et al. Ingestão dietética, concentrações séricas e teciduais orais de carotenoides em pacientes com carcinoma epidermoide da cavidade oral e da orofaringe. Rev Bras Cancerol. 2010;56(1):7-15. doi: https://doi.org/10.32635/2176-9745.RBC.2010v56n1.1518
32. Larouche D, Hanna M, Chang SL, et al. Evaluation of antioxidant intakes in relation to inflammatory markers expression within the normal breast tissue of breast cancer patients. Integr Cancer Ther. 2017;16(4):485-95. doi: https://doi.org/10.1177/1534735416676584
33. Cabral CE, Klein MRST. Fitosteróis no tratamento da hipercolesterolemia e prevenção de doenças cardiovasculares. Arq Bras Cardiol. 2017;109(5):475-82. doi: https://doi.org/10.5935/abc.20170158
34. Chikara S, Nagaprashantha LD, Singhal J, et al. Oxidative stress and dietary phytochemicals: role in cancer chemoprevention and treatment. Cancer Lett. 2018;413:122-34. doi: https://doi.org/10.1016/j.canlet.2017.11.002
Recebido em 23/3/2022
Aprovado em 25/7/2022
Editor-associado: Livia Costa de Oliveira. Orcid iD: https://orcid.org/0000-0002-5052-1846
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde