Eficácia e Segurança de Regorafenibe em Pacientes com Características de Bom Prognóstico no Tratamento do Câncer Colorretal Metastático: Análise de Subgrupo do Estudo CORRECT
Efficacy and Safety of Regorafenib in Patients with Characteristics of Good Prognosis in the Treatment of Metastatic Colorectal Cancer: Subgroup Analysis of CORRECT Study
Eficacia y Seguridad de Regorafenib en Pacientes con Características de Buen Pronóstico en Tratamiento del Cáncer Colorrectal Metastásico: Análisis de Subgrupo del Estudio CORRECT
doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n4.2727
Rodrigo Resende Palhares1; Glauco do Canto Britto2; Yun Su3; Marie-Aude Le Berre4; Ricardo Saad Henriques5; Fabricio Volpato Navachi6; Daniela Cristina Foli Pereira7; Helene Ostojic8; Graziella Agostini Azevedo9; Eric Van Cutsem10
1,2,5,6,7,9Bayer Brasil S.A. São Paulo (SP), Brasil. E-mails: rodrigo.palhares@bayer.com; glauco.britto@bayer.com; ricardo.saad@bayer.com; fabricio.navachi@bayer.com; daniela.foli@bayer.com; graziella.azevedo@bayer.com. Orcid iD: https://orcid.org/0000-0003-2613-4405; https://orcid.org/0000-0002-7462-2457; https://orcid.org/0000-0001-8155-888X; https://orcid.org/0000-0001-8606-3325; https://orcid.org/0000-0003-2522-5989; https://orcid.org/0000-0002-4512-5822
3,8Bayer HealthCare Pharmaceuticals Inc, Global Health Economics & Outcomes Research, Oncology, Whippany, USA. E-mails: yun.su@bayer.com; helene.ostojic@bayer.com. Orcid iD: https://orcid.org/0000-0003-1286-7050; https://orcid.org/0000-0002-0448-9195
4Bayer HealthCare SAS, Loos, Lille, France. E-mail: marie-aude.leberre@bayer.com. Orcid iD: https://orcid.org/0000-0001-6832-7147
10Digestive Oncology, KU Leuven University Hospitals Leuven, Leuven, Flanders, Belgium. E-mail: eric.vancutsem@uzleuven.be. Orcid iD: https://orcid.org/0000-0002-6372-1230
Endereço para correspondência: Rodrigo Resende Palhares. Bayer S.A. Rua Domingos Jorge, 1100 – Vila Socorro. São Paulo (SP), Brasil. CEP 04779-900. E-mail: rodrigo.palhares@bayer.com
RESUMO
Introdução: O câncer colorretal (CCR) é o segundo mais incidente e, quando metastático, apresenta taxa de sobrevida de 14% em cinco anos. Regorafenibe é um inibidor de tirosina-quinase (ITQ) aprovado para CCR metastático (CCRm) com aumento comprovado de sobrevida global (SG). Objetivo: Explorar resultados de eficácia e segurança de regorafenibe em pacientes com CCRm e características de bom prognóstico (CBP). Método: Análise de subgrupo do estudo CORRECT, com participantes divididos de acordo com CBP, seguindo os critérios: Eastern Cooperative Oncology Group (ECOG) 0, tempo de doença metastática maior que 18 meses, até três sítios metastáticos e ausência de metástase hepática. Eficácia comparada com teste de log-rank estratificado e hazad ratios (HR) calculados com o modelo de Cox. Resultados: Dos 760 participantes randomizados, 292 (34,5%) apresentavam CBP; 185 (63,4%) receberam regorafenibe; 107 (35,6%), placebo. Para o grupo CBP, a mediana SG foi 10,9 meses (IC95%:8,8-12,3) para regorafenibe e 7,3 meses (IC95%:5,6-9,1) para placebo, com 39% de redução no risco de morte (HR 0,61; IC95%:0,43-0,88; p=0,0069). A mediana de sobrevida livre de progressão (SLP) foi de 3,5 meses (IC95%:3,0-3,9) versus 1,8 mês (IC95%:1,7-1,8) respectivamente, com 61% de redução no risco de progressão da doença ou morte (HR 0,39; IC95%:0,30-0,52; p<0,0001). Os eventos adversos graus 3 e 4 foram mais frequentes para regorafenibe. Após definição de valor basal para escores de qualidade de vida (EQ-5D), estes decaíram menos para regorafenibe comparados com placebo (0,687 versus 0,592) com diferença significativa de 0,09. Conclusão: Pacientes com CBP que receberam regorafenibe melhoraram SG e SLP com menor deterioração da qualidade de vida comparado com placebo.
Palavras-chave: inibidores de proteínas quinases; neoplasias colorretais; metástase neoplásica; análise de sobrevida.
ABSTRACT
Introduction: Colorectal cancer (CRC) is the second most common and when metastatic, it has a five-year survival rate of 14%. Regorafenib is an approved TKI for metastatic colorectal cancer (mCRC) with a proven increase in overall survival (OS). Objective: To investigate the efficacy and safety results of regorafenib in patients with mCRC and good prognostic characteristics (GPC). Method: Subgroup analysis of the CORRECT study, with participants divided according to GPC, following the criteria: Eastern Cooperative Oncology Group (ECOG) 0, duration of metastatic disease greater than 18 months, up to three metastatic sites and absence of liver metastasis. Efficacy compared with stratified log-rank test and hazard ratios (HR) calculated with the Cox model. Results: Of the 760 participants randomized, 292 (34.5%) had GPC; 185 (63.4%) received regorafenib; and 107 (35.6%) received placebo. For the GPC group, the median OS was 10.9 months (95%CI:8.8-12.3) for regorafenib and 7.3 months (95%CI:5.6-9.1) for placebo, with 39% of reduction of the risk of death (HR 0.61; 95% CI:0.43-0.88; p=0.0069). The median progression-free survival (PFS) was 3.5 months (95%CI:3.0-3.9) versus 1.8 months (95%CI:1.7-1.8) respectively, with 61% of reduced risk of disease progression or death (HR 0.39; 95%CI:0.30-0.52; p<0.0001). Grade 3 and 4 adverse events were more frequent for regorafenib. After setting baseline for quality of life scores (EQ-5D), these declined less for regorafenib compared to placebo (0.687 versus 0.592) with a significant difference of 0.09. Conclusion: GPC patients who received regorafenib improved OS and PFS with less deterioration of quality-of-life compared to placebo.
Key words: protein kinase inhibitors; colorectal neoplasms; neoplasm metastasis; survival analysis.
RESUMEN
Introducción: El cáncer colorrectal (CCR) es el segundo más frecuente y cuando presenta metástasis tiene una supervivencia a los cinco años del 14%. Regorafenib es un inhibidor de la tirosina quinasa (ITQ) aprobado para CCR metastásico (CCRm) con un aumento comprobado en la supervivencia general (SG). Objetivo: Explorar los resultados de eficacia y seguridad de regorafenib en pacientes con CCRm y características de buen pronóstico (CBP). Método: Análisis de subgrupos del estudio CORRECT, con participantes divididos según CBP, siguiendo los criterios: Eastern Cooperative Oncology Group (ECOG) 0, duración de la enfermedad metastásica mayor a 18 meses, hasta tres sitios metastásicos y ausencia de metástasis hepática. Eficacia comparada con la prueba de log-rank estratificada y hazad ratios (HR) calculados con el modelo de Cox. Resultados: De los 760 participantes aleatorios, 292 (34,5%) tenían CBP; 185 (63,4%) recibieron regorafenib; 107 (35,6%) recibieron placebo. Para el grupo de CBP, la mediana de SG fue de 10,9 meses (IC95%:8,8-12,3) para regorafenib y de 7,3 meses (IC95%:5,6-9,1) para placebo, con una reducción del riesgo de muerte del 39% (HR 0,61; IC95%:0,43-0,88; p=0,0069). La mediana de supervivencia libre de progresión (PFS) fue de 3,5 meses (IC95%:3,0-3,9) frente a 1,8 meses (IC95%:1,7-1,8) respectivamente, con un 61% de riesgo reducido de progresión de la enfermedad o muerte (HR 0,39; IC95%:0,30-0,52; p<0,0001). Los eventos adversos de grado 3 y 4 fueron más frecuentes con regorafenib. Después de establecer la línea de base para las puntuaciones de calidad de vida (EQ-5D), estas disminuyeron menos con regorafenib en comparación con placebo (0,687 frente a 0,592) con una diferencia significativa de 0,09. Conclusión: Los pacientes con CBP que recibieron regorafenib mejoraron la SG y la SLP con un menor deterioro en la calidad de vida en comparación con el placebo.
Palabras clave: inhibidores de proteínas quinasas; neoplasias colorrectales; metástasis de la neoplasia; análisis de supervivência.
INTRODUÇÃO
O câncer colorretal (CCR) é o terceiro tipo de câncer mais comum no mundo, representando aproximadamente 10% do total de casos. Segundo o GLOBOCAN1, estima-se que 1,9 milhão de novos casos de CCR ocorreu em 2020 no mundo, sendo considerado o segundo tipo de câncer mais letal, com 935 mil mortes estimadas no mesmo ano1. Globalmente, a epidemiologia e a carga do CCR variam entre os países. Recentemente, observa-se incidência e mortalidade estáveis ou decaindo em países com elevado Índice de Desenvolvimento Humano (IDH), com tendências crescentes em países com IDH médio a alto2. Esse declínio é normalmente atribuído às estratégias de detecção e prevenção precoces, principalmente em idosos, embora essa tendência mascare a crescente incidência observada entre os jovens3,4.
Diferentes terapias foram desenvolvidas ao longo dos anos, melhorarando os resultados de sobrevida desses pacientes. Atualmente, existem diferentes opções de tratamento para o manejo do CCR, dependendo do tamanho do tumor, da localização e de características moleculares, do estágio da doença, do perfil clínico do paciente, entre outros. Em estágios iniciais, pacientes apresentam maior percentual de reposta ao tratamento, com indicação de terapia cirúrgica seguida ou não de tratamento sistêmico5,6. Pacientes com CCR com doença localizada apresentam sobrevida em cinco anos em torno de 90%. Já em pacientes diagnosticados com CCR metastático (CCRm), a taxa de sobrevida de cinco anos cai para 14%7.
Mesmo com esforço no diagnóstico precoce, estima-se que 25% dos pacientes são diagnosticados com doença metastática e metade dos pacientes com CCR irá desenvolver metástases8. Além da cirurgia e radioterapia, tratamentos iniciais contam com quimioterapia (fluoropirimidina, oxaliplatina e irinotecano; combinados ou em sequência) e anticorpos monoclonais; e, para doença refratária, regorafenibe e TAS-102 são recomendados5.
O regorafenibe é um inibidor oral da multiquinase com alvo na inibição da tumorigênese (como KIT, RAF, RET), angiogênese tumoral (VEGFR, TIE2, FGFR e PDGFR) e sinalização estromal (PDGFR-ß, FGFR)9. Sua eficácia e segurança para o tratamento do CCRm foi confirmada em dois ensaios clínicos fase III randomizados: CONCUR10 e CORRECT11. O estudo CORRECT11 demostrou uma melhora significativa na sobrevida global (SG) no grupo que recebeu regorafenibe quando comparado com placebo em pacientes com CCRm previamente tratados. Este estudo está registrado no ClinicalTrials.gov sob o número NCT01103323 e ClinicalTrialsRegister.eu, número 2009-012787-14.
O estudo CONCUR10 confirmou a eficácia de regorafenibe na população asiática, com melhoras significativas na SG. Posteriormente, o estudo de fase IIIb, braço único, aberto, CONSIGN12, com mais de 2.700 pacientes, demonstrou que o perfil de eficácia e segurança foi consistente com os observados no estudo CORRECT11.
Mesmo já confirmadas a eficácia e a segurança do regorafenibe, as diferentes condições clínicas como características individuais da doença e do paciente também podem influenciar nos desfechos do tratamento de CCR. Por essa razão, é importante explorar possíveis fatores prognósticos associados a melhores resultados no cenário da vida real, incluindo SG e SLP. O estudo francês REBECCA13, sobre efetividade e segurança de regorafenibe na prática clínica, explorou uma coorte de pacientes com CCRm com características basais semelhantes aos pacientes do estudo CORRECT11 (população Full Analysis Set-CORRECT (FAS-CORRECT)) e mostrou que o desfecho do regorafenibe variou significativamente de acordo com alguns fatores específicos, como Performance Status do Eastern Cooperative Oncology Group (ECOG-PS), tempo desde o diagnóstico de doença metastática, ausência de metástase hepática e número de sítios metastáticos13. Esses fatores foram classificados em um sistema de pontuação para identificar as combinações de características que definem os pacientes com melhor prognóstico e que mais se beneficiam da terapia com regorafenibe13. Mesmo com informações sobre o perfil de pacientes com CCRm que mais se beneficiariam da terapia com regorafenibe já existentes, ainda há poucos dados sobre o seu impacto nos desfechos de sobrevida e segurança. Assim, essa análise de subgrupo do estudo CORRECT11 visa a avaliar os resultados de sobrevida e segurança de pacientes com CCRm tratados com regorafenibe em comparação com placebo com características de bom prognóstico (CBP), conforme a classificação da população FAS-CORRECT especificada no estudo REBECCA13.
MÉTODO
Trata-se de uma análise de subgrupo do estudo CORRECT, com metodologia descrita por Grothey et al.11. A condução deste estudo clínico de fase III atendeu a todos os requisitos legais e regulatórios locais de acordo com os princípios éticos que têm sua origem na Declaração de Helsinque e na diretriz da Conferência Internacional sobre Harmonização (ICH)14 e Boas Práticas Clínicas (BPC)15. Consistiu-se em estudo duplo-cego, de fase III randomizado, controlado por placebo, conduzido em 16 países em todo o mundo. O Brasil não participou deste estudo, porém um dos investigadores principais do CORRECT, Prof. Dr. Eric Van Cutsem, é também autor desta análise de subgrupo e trouxe os dados relatados a seguir11. Os participantes foram considerados elegíveis após consentimento informado; com 18 anos ou mais; ECOG-PS de 0 ou 1; ao menos três meses de expectativa de vida; diagnóstico de adenocarcinoma de cólon ou reto confirmado. Os pacientes deveriam ter recebido terapias-padrão locais aprovadas para a doença e com progressão até três meses após a última administração da terapia. Foram excluídos participantes que receberam regorafenibe previamente ou que apresentaram condições médicas instáveis.
Os participantes receberam melhores cuidados de suporte (MCS), com exceção de terapias antineoplásicas. Foram randomizados para regorafenibe ou placebo, na proporção 2:1, respectivamente. Os participantes receberam 160 mg de regorafenibe, ou placebo, uma vez ao dia durante três semanas de cada ciclo de quatro semanas. A terapia foi interrompida com progressão da doença, toxicidade, retirada do consentimento, decisão dos investigadores ou morte. Os participantes, investigadores e patrocinadores foram cegados para a terapia do estudo, e a randomização ocorreu em bloco pré-alocado de seis participantes, estratificado com base em terapias prévias com VEGF, tempo de diagnóstico de doença metastática e região geográfica.
Os pacientes do estudo CORRECT11 foram divididos conforme o critério de pontuação observado na coorte do estudo REBECCA13, em grupo com CBP (pontuação de 0 ou 1 e alto benefício em SG com uso de regorafenibe) e grupo sem CBP (pontuação de 2 ou mais e baixo benefício com regorafenibe). Os participantes com CBP apresentaram a combinação de pelo menos três de quatro características clínicas avaliadas, sendo estas: ECOG-PS 0, tempo desde o diagnóstico de doença metastática maior do que 18 meses, menos de três sítios metastáticos ou ausência de metástase hepática13.
O desfecho primário do estudo foi a SG, definida como tempo desde a randomização até o óbito por qualquer causa. O desfecho secundário incluíu sobrevida livre de progressão (SLP), definida como tempo desde a randomização até a primeira progressão clínica ou radiológica da doença ou morte. A progressão foi avaliada com base nos Critérios de Avaliação de Resposta em Tumores Sólidos (RECIST, versão 1.1)16 a cada oito semanas para avaliação radiológica, ou com base na avaliação clínica do investigador para progressão clínica. O perfil de segurança foi avaliado como desfecho secundário e incluiu a descrição de eventos adversos (EA), alterações de parâmetros laboratoriais, entre outros. O grau de EA foi definido com base no National Cancer Institute Common Terminology Criteria for Adverse Events (CTCAE) versão 3.017.
A qualidade de vida relacionada à saúde (QVRS) e os valores de utilidade de saúde foram avaliados, usando o European Organisation for Research and Treatment of Cancer Core Quality-of-Life Questionnaire (EORTC QLQ-C30)18, o EuroQol de cinco dimensões (EQ-5D)19 e a escala visual analógica (EVA)20. Como foi observado um leve desequilíbrio dos valores de pontuação na linha de base de ambos os braços, o que traria viés à comparação, calculou-se a média ponderada dos escores iniciais de EQ-5D nos braços regorafenibe e placebo. Após a definição da média ponderada para cada grupo, o valor ao final do tratamento foi descontado da média para cada grupo.
Para a análise de subgrupo, as características demográficas e clínicas dos participantes foram analisadas por meio de estatística descritiva, com medidas de dispersão e tendências centrais para variáveis contínuas e frequência e porcentagem para variáveis categóricas. Para o desfecho primário, a probabilidade e a curva de sobrevivência de Kaplan-meier foram calculadas para cada subgrupo, e as comparações foram realizadas usando o teste log-rank. O hazard ratio (HR) com intervalo de confiança (IC) de 95% foi calculado usando o modelo de regressão de Cox. O nível de significância foi de 5%, considerando um teste bicaudal. As comparações foram realizadas entre o grupo que recebeu regorafenibe e o que recebeu placebo. As análises de eficácia foram baseadas na população com intenção de tratar (intention-to-treat). Nenhuma imputação foi feita para avaliações faltantes, e as análises de segurança incluíram todos os pacientes que receberam pelo menos uma dose do medicamento do estudo.
RESULTADOS
Dos 760 participantes randomizados no estudo CORRECT11 (população intention-to-treat), 292 (34,5%) atingiram os critérios de CBP. Destes, 185 (63,4%) receberam regorafenibe e 107 (35,6%) receberam placebo.
A maioria dos participantes do grupo com CBP era do sexo masculino (60,5% grupo regorafenibe e 63,6% grupo placebo), de cor branca (72,4% grupo regorafenibe e 72,9% grupo placebo) e idade média de 59,2 anos (desvio-padrão [DP] 9,9) para regorafenibe e 60,4 anos (DP=9,5) para placebo (Tabela 1).
Tabela 1. Características demográficas e clínicas dos pacientes dos grupos com CBP e sem CBP
|
|
Pacientes com CBP |
Pacientes sem CBP |
||
|
Características |
Regorafenibe (n=185) |
Placebo (n=107) |
Regorafenibe (n=320) |
Placebo (n=148) |
|
Idade do paciente na randomização (anos) |
||||
|
Média, DP |
59,2 (9,9) |
60,4 (9,5) |
61,6 (10,2) |
59,9 (10,3) |
|
Mediana (IIQ) |
59 (52-67) |
61 (54-67) |
62 (55,0-70,0) |
61 (53,0-67,0) |
|
Mínimo máximo |
34-82 |
27-85 |
22-82 |
25-82 |
|
Sexo, n (%) |
||||
|
Masculino |
112 (60,5) |
68 (63,6) |
199 (62,2) |
85 (57,4) |
|
Feminino |
73 (39,5) |
39 (36,4) |
121 (37,8) |
63 (42,6) |
|
Raça, n (%) |
||||
|
Branco |
134 (72,4) |
78 (72,9) |
258 (80,6) |
123 (83,1) |
|
Preto |
2 (1,1) |
4 (3,7) |
4 (1,3) |
4 (2,7) |
|
Asiático |
36 (19,5) |
19 (17,8) |
40 (12,5) |
16 (10,8) |
|
Outro ou não especificado* |
13 (7,0) |
6 (5,6) |
18 (5,6) |
5 (3,4) |
|
ECOG, n (%) |
||||
|
0 |
154 (83,2) |
91 (85,0) |
111 (34,7) |
55 (37,2) |
|
1 |
31 (16,8) |
16 (15,0) |
209 (65,3) |
93 (62,8) |
|
Local primário da doença, n (%) |
||||
|
Cólon |
111 (60,0) |
70 (65,4) |
212 (66,3) |
102 (68,9) |
|
Reto |
60 (32,4) |
31 (29,0) |
91 (28,4) |
38 (25,7) |
|
Cólon e reto |
14 (7,6) |
6 (5,6) |
16 (5,0) |
8 (5,4) |
|
Mutação KRAS, n (%) |
||||
|
Não |
70 (37,8) |
43 (40,2) |
135 (42,2) |
51 (34,5) |
|
Sim |
103 (55,7) |
63 (58,9) |
170 (53,1) |
94 (63,5) |
|
Desconhecido |
12 (6,5) |
1 (0,9) |
15 (4,7) |
3 (2,0) |
|
Mutação BRAF, n (%) |
||||
|
Não |
20 (10,8) |
13 (12,1) |
21 (6,6) |
12 (8,1) |
|
Sim |
1 (0,5) |
1 (0,9) |
3 (0,9) |
1 (0,7) |
|
Desconhecido |
164 (88,6) |
93 (86,9) |
296 (92,5) |
135 (91,2) |
|
Histologia, n (%) |
||||
|
Adenocarcinoma |
182 (98,4) |
105 (98,1) |
311 (97,2) |
140 (94,6) |
|
Adenocarcinoma in situ |
0 |
0 |
2 (0,6) |
3 (2,0) |
|
Carcinoma adenoescamoso |
0 |
0 |
1 (0,3) |
1 (0,7) |
|
Carcinoma, sem outra especificação |
1 (0,5) |
1 (0,9) |
3 (0,9) |
0 (0,0) |
|
Carcinoma mucinoso |
2 (1,1) |
1 (0,9) |
3 (0,9) |
3 (2,0) |
|
Carcinoma indiferenciado |
0 |
0 |
0 (0,0) |
1 (0,7) |
|
Número de terapias anticâncer sistêmicas anteriores (no ou após o diagnóstico de doença metastática), n (%) |
||||
|
1-2 |
48 (25,9) |
21 (19,6) |
88 (27,7) |
42 (28,3) |
|
3 |
44 (23,8) |
35 (32,7) |
80 (25) |
37 (25) |
|
≥ 4 |
93 (50,3) |
51 (47,7) |
152 (47,3) |
69 (46,7) |
|
Tratamento prévio anti-VEGF, n (%) |
||||
|
Bevacizumabe |
185 (100,0) |
107 (100,0) |
320 (100,0) |
148 (100,0) |
|
Pacientes que interromperam o tratamento anterior por causa da progressão da doença, n (%) |
||||
|
Fluoropirimidina |
80 (43,2) |
48 (44,9) |
176 (55,0) |
87 (58,8) |
|
Bevacizumabe |
53 (28,6) |
35 (32,7) |
106 (33,1) |
53 (35,8) |
|
Irinotecano |
44 (23,8) |
33 (30,8) |
115 (35,9) |
55 (37,2) |
|
Oxaliplatina |
46 (24,9) |
30 (28,0) |
93 (29,1) |
47 (31,8) |
|
Panitumumab ou cetuximab, ou ambos |
34 (18,4) |
22 (20,6) |
65 (20,3) |
31 (20,9) |
|
Tempo desde o diagnóstico de metástases |
||||
|
Mediana (meses, [IIQ]) |
35,1 (24,9-49,4) |
33,6 (24,7-52,6) |
26,1 (17,4-40,9) |
26,1 (17,3-41,0) |
|
<18 meses, n (%) |
7 (3,8) |
8 (7,5) |
84 (26,3) |
41 (27,7) |
|
≥18 meses, n (%) |
178 (96,2) |
99 (92,5) |
236 (73,8) |
107 (72,3) |
|
Número de sítios metastáticos, n (%) |
||||
|
<3 |
167 (90,3) |
98 (91,6) |
112 (35) |
46 (31) |
|
≥3 |
18 (9,7) |
9 (8,4) |
208 (65) |
102 (69) |
|
Presença de metástase hepática, n (%) |
||||
|
Não |
101 (54,6) |
63 (58,9) |
33 (10,3) |
15 (10,1) |
|
Sim |
84 (45,4) |
44 (41,1) |
44 (89,7) |
45 (89,9) |
Legendas: CBP = características de bom prognóstico; IIQ = intervalo interquartil; DP = desvio-padrão; ECOG = Eastern Cooperative Oncology Group.
(*) soma de indigena + nativo do alasca + múltiplo + não relatado.
Em relação às características clínicas, a maioria apresentou escore ECOG 0 (83,2% em regorafenibe e 85,0% em placebo), o local primário da doença foi o cólon (60% em regorafenibe e 65,4% em placebo), houve presença de mutação KRAS (55,7% em regorafenibe e 58,9% no grupo placebo), além de mutação BRAF desconhecida (88,6% em regorafenibe e 86,9% no grupo placebo). O número de sítios metastáticos foi inferior a três em mais de 90% dos indivíduos (90,3% em regorafenib e 91,6% em placebo) e quase 50% apresentaram metástase hepática (45,4% em regorafenibe e 41,1% em placebo).
Sobre os tratamentos prévios, cerca de metade dos pacientes recebeu quatro ou mais terapias anticâncer sistêmicas anteriores (50,3% em regorafenibe e 47,7% em placebo), e todos receberam bevacizumabe.
No grupo sem CBP, as características sociodemográficas foram semelhantes entre os dois grupos. Quanto às características clínicas, o escore ECOG 1 estava presente em 65,3% dos pacientes no grupo regorafenibe e 62,8% em placebo, além de presença de mutação KRAS (53,1% no regorafenibe e 63,5% no placebo), mutação BRAF desconhecida e histologia de adenocarcinoma em mais de 90% dos pacientes (Tabela 1).
Durante o seguimento, o número de pacientes com CBP que receberam pelo menos uma terapia antineoplásica sistêmica subsequente (agentes antineoplásicos e imunomoduladores) foi semelhante entre grupos (32,4% no regorafenibe e 32,7% no placebo). Mas, entre os indivíduos sem CBP, 21,9% dos pacientes do grupo regorafenibe receberam pelo menos uma terapia anticâncer sistêmica versus 26,4% no grupo placebo (Tabela 2).
Tabela 2. Terapia anticâncer sistêmica subsequente entre pacientes do grupo com CBP e sem CBP
|
|
Pacientes do grupo com CBP |
Pacientes do grupo sem CBP |
||
|
Características |
Regorafenibe (n=185) |
Placebo (n=107) |
Regorafenibe (n=320) |
Placebo (n=148) |
|
Número de indivíduos (%) com pelo menos um medicamento, n (%) |
60 (32,4) |
36 (33,6) |
71 (22,2) |
40 (27,0) |
|
Agentes antineoplásicos e imunomoduladores, n (%) |
60 (32,4) |
35 (32,7) |
70 (21,9) |
39 (26,4) |
|
Antraciclinas e substâncias relacionadas |
2 (1,1) |
0 |
0 |
0 |
|
Antimetabólitos |
4 (2,2) |
0 |
1 (0,3) |
0 |
|
Agentes antineoplásicos |
8 (4,3) |
4 (3,7) |
3 (0,9) |
3 (2,0) |
|
Combinações de agentes antineoplásicos |
0 |
2 (1,9) |
0 |
2 (1,4) |
|
Ácido fólico e análogos/derivados |
13 (7,0) |
11 (10,3) |
18 (5,6) |
12 (8,1) |
|
Anticorpos monoclonais |
21 (11,4) |
11 (10,3) |
18 (5,6) |
11 (7,4) |
|
Análogos de mostarda de nitrogênio |
2 (1,1) |
0 |
1 (0,3) |
0 |
|
Outros agentes alquilantes |
1 (0,5) |
0 |
2 (0,6) |
1 (0,7) |
|
Outros agentes antineoplásicos |
9 (4,9) |
8 (7,5) |
6 (1,9) |
10 (6,8) |
|
Outros antibióticos citotóxicos |
19 (10,3) |
11 (10,3) |
19 (5,9) |
18 (12,2) |
|
Outros alcaloides vegetais e produtos naturais |
0 |
1 (0,9) |
0 |
0 |
|
Compostos de platina |
13 (7,0) |
8 (7,5) |
22 (6,9) |
6 (4,1) |
|
Análogos de pirimidina |
42 (22,7) |
23 (21,5) |
52 (16,3) |
29 (19,6) |
|
Inibidores de proteína quinase |
0 |
0 |
3 (0,9) |
0 |
|
Dermatológicos |
0 |
1 (0,9) |
0 |
0 |
|
Sistema musculoesquelético |
0 |
1 (0,9) |
0 |
1 (0,3) |
|
Droga experimental |
1 (0,5%) |
0 |
1 (0,3%) |
0 |
|
Inclassificável |
0 |
1 (0,9) |
0 |
1 (0,7) |
Legenda: CBP = características de bom prognóstico.
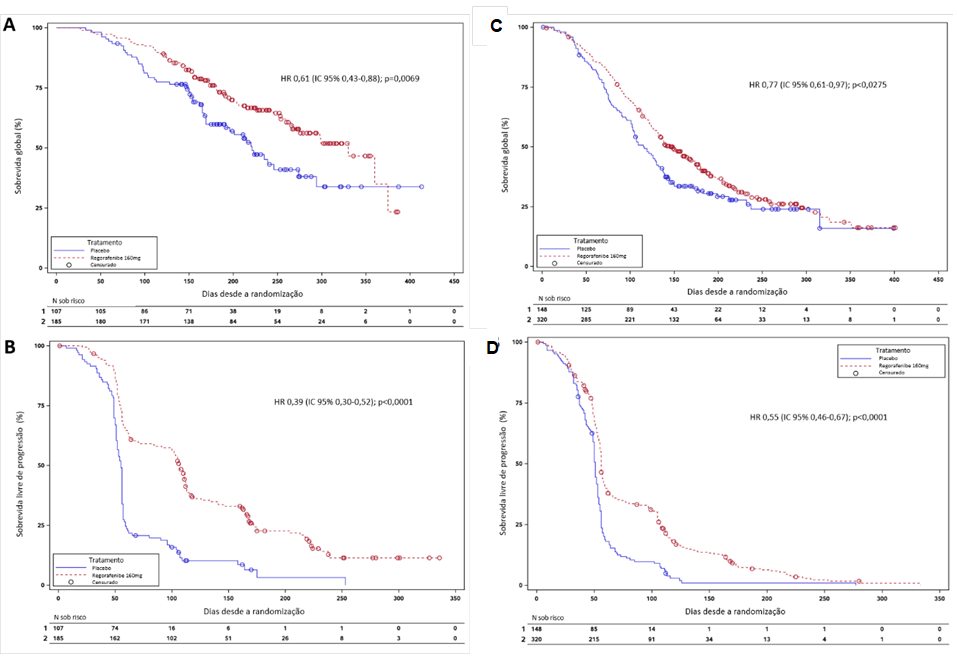
A SG mediana para pacientes com CBP foi de 10,9 meses (IC95%:8,8-12,3 meses) no braço regorafenibe e 7,3 meses (IC95%:5,6-9,1 meses) no braço placebo, mostrando ganho relativo de sobrevida de 3,6 meses com redução de 39% no risco de morte (HR 0,61; IC95% 0,43-0,88; p=0,0069). A mediana de SLP para o regorafenibe foi de 3,5 meses (IC95%:3,0-3,9 meses) e para o grupo placebo foi 1,8 meses (IC95%:1,7-1,8 meses), com redução de 61% no risco de progressão da doença ou morte (HR 0,39; IC95%:0,30-0,52; p<0,0001) quando comparado ao braço placebo (Figura 1).
|
|
|
Figura 1. Análises de SG e SLP Kaplan-Meier de pacientes dos subgrupos. (A) SG e (B) SLP de pacientes com CBP tratados com regorafenibe ou placebo; (C) SG e (D) SLP de pacientes sem CBP tratados com regorafenibe ou placebo Legendas: HR = hazard ratio; IC = intervalo de confiança. Nota: Os valores-p foram estimados com base em testes de long-rank.
|
Pacientes sem CBP no braço de regorafenibe apresentaram redução de 23% no risco de morte (HR 0,77; IC95%:0,61-0,97; p=0,0275) em comparação ao placebo, com SG mediana de 4,8 meses (IC95%:4,4-5,6) versus 3,8 meses no grupo placebo (IC95%:3,4-4,4). Em relação à SLP, houve redução de 45% no risco de progressão da doença ou morte no grupo regorafenibe quando comparado ao placebo (HR 0,55; IC95%:0,4-0,67; p<0,0001). A SLP mediana no grupo regorafenibe foi de 1,9 mês (IC95%:1,8-1,9 mês) versus 1,7 mês no placebo (IC95%:1,6-1,7 mês).
No grupo com CBP, o braço regorafenibe apresentou maior proporção de Evento Adverso Emergente do Tratamento (EAET) graus 3 e 4, correspondendo a 71,7% de todos os EA; enquanto, no braço placebo, EAET ocorreram em 35,8%. EA grau 5 em ambos os braços apresentaram proporções semelhantes (4,9% e 4,7% de todos os EA relatados para regorafenibe e placebo, respectivamente). Além disso, EA que levaram à modificação da dose foram 61,4% no grupo regorafenibe e 7,5% no grupo placebo. Os participantes do grupo de regorafenibe sofreram mais EA que levaram à descontinuação permanente da droga (9,8% em regorafenibe versus 0,9% em placebo). Quando avaliada a duração do tratamento, o tempo médio de uso de regorafenibe foi aproximadamente duas vezes maior comparado ao placebo (mediana de 4,1 ciclos para regorafenibe versus 2,6 ciclos para placebo). O perfil de segurança completo está descrito na Tabela 3.
Tabela 3. Eventos adversos emergentes do tratamento que ocorrem em ≥5% do grupo de pacientes do grupo com CBP e sem CBP desde o início do tratamento até 30 dias após o seu término (população de segurança)
|
|
Pacientes do grupo com CBP |
|||||
|
Regorafenibe (n=184) |
Placebo (n=106) |
|||||
|
Evento adverso |
Qualquer grau |
Grau 3 |
Grau 4 |
Qualquer grau |
Grau 3 |
Grau 4 |
|
Qualquer evento adverso, n (%) |
184 (100) |
114 (62) |
18 (9,8) |
100 (94,3) |
33 (31,1) |
5 (4,7) |
|
Fadiga |
76 (41,3) |
15 (8,2) |
0 |
32 (30,2) |
5 (4,7) |
0 |
|
Astenia |
47 (25,5) |
6 (3,3) |
0 |
17 (16) |
2 (1,9) |
0 |
|
Reação da pele mão-pé |
99 (53,8) |
37 (20,1) |
0 |
6 (5,7) |
0 |
0 |
|
Diarreia |
89 (48,4) |
20 (10,9) |
0 |
19 (17,9) |
2 (1,9) |
0 |
|
Anorexia |
77 (41,8) |
3 (1,6) |
0 |
22 (20,8) |
4 (3,8) |
0 |
|
Alterações de voz |
69 (37,5) |
0 |
0 |
9 (8,5) |
0 |
0 |
|
Hipertensão |
69 (37,5) |
17 (9,2) |
0 |
12 (11,3) |
2 (1,9) |
0 |
|
Inflamação da mucosa |
25 (13,6) |
2 (1,1) |
0 |
2 (1,9) |
0 |
0 |
|
Mucosite oral |
41 (22,3) |
5 (2,7) |
0 |
2 (1,9) |
0 |
0 |
|
Erupção ou descamação |
60 (32,6) |
13 (7,1) |
0 |
4 (3,8) |
1 (0,9) |
0 |
|
Náusea |
49 (26,6) |
0 |
0 |
19 (17,9) |
2 (1,9) |
0 |
|
Perda de peso |
57 (31) |
20 (10,9) |
1 (0,5) |
9 (8,5) |
0 |
0 |
|
Febre |
59 (32,1) |
5 (2,7) |
0 |
13 (12,3) |
0 |
0 |
|
Pele seca |
17 (9,2) |
0 |
0 |
6 (5,7) |
0 |
0 |
|
Alopecia |
18 (9,8) |
0 |
0 |
2 (1,9) |
0 |
0 |
|
Alteração do sabor |
18 (9,8) |
0 |
0 |
2 (1,9) |
0 |
0 |
|
Vômito |
28 (15,2) |
2 (1,1) |
0 |
13 (12,3) |
0 |
0 |
|
Neuropatia sensorial |
11 (6,0) |
1 (0,5) |
0 |
3 (2,8) |
0 |
0 |
|
Sangramento nasal |
14 (7,6) |
0 |
0 |
1 (0,9) |
0 |
0 |
|
Dispneia |
24 (13) |
2 (1,1) |
1 (0,5) |
14 (13,2) |
5 (4,7) |
0 |
|
Tosse |
23 (12,5) |
2 (1,1) |
0 |
13 (12,3) |
0 |
0 |
|
Dor nas costas |
26 (14,1) |
1 (0,5) |
0 |
10 (9,4) |
0 |
0 |
|
Dor muscular |
10 (5,4) |
2 (1,1) |
1 (0,5) |
2 (1,9) |
0 |
0 |
|
Dor de cabeça |
27 (14,7) |
1 (0,5) |
0 |
5 (4,7) |
0 |
0 |
|
Dor, abdômen |
33 (17,9) |
1 (0,5) |
0 |
18 (17,0) |
1 (0,9) |
0 |
|
Prisão de ventre |
38 (20,7) |
0 |
0 |
14 (13,2) |
0 |
0 |
|
Trombocitopenia |
12 (6,5) |
3 (1,6) |
2 (1,1) |
1 (0,9) |
0 |
0 |
|
Hiperbilirrubinemia |
11 (6,0) |
3 (1,6) |
0 |
0 |
0 |
0 |
|
ALT aumentada |
11 (6,0) |
3 (1,6) |
1 (0,5) |
4 (3,8) |
0 |
0 |
|
AST aumentado |
12 (6,5) |
5 (2,7) |
4 (2,2) |
5 (4,7) |
2 (1,9) |
0 |
|
Lipase aumentada |
14 (7,6) |
8 (4,3) |
2 (1,1) |
0 |
0 |
0 |
|
Proteinúria |
16 (8,7) |
4 (2,2) |
0 |
1 (0,9) |
0 |
0 |
|
Anemia |
21 (11,4) |
10 (5,4) |
0 |
4 (3,8) |
1 (0,9) |
0 |
|
|
Pacientes do grupo sem CBP |
|||||
|
|
Regorafenibe (n=316) |
Placebo (n=147) |
||||
|
Evento adverso |
Qualquer grau |
Grau 3 |
Grau 4 |
Qualquer grau |
Grau 3 |
Grau 4 |
|
Qualquer evento adverso, n (%) |
287 (90,8) |
149 (47,2) |
8 (2,5) |
96 (65,3) |
19 (12,9) |
3 (2) |
|
Fadiga |
83 (26,3) |
15 (4,7) |
2 (0,6) |
27 (18,4) |
4 (2,7) |
1 (0,7) |
|
Astenia |
60 (19) |
16 (5,1) |
0 |
15 (10,2) |
5 (3,4) |
0 |
|
Reação da pele mão-pé |
124 (39,2) |
46 (14,6) |
0 |
12 (8,2) |
0 |
0 |
|
Diarreia |
99 (31,3) |
18 (5,7) |
1 (0,3) |
12 (8,2) |
1 (0,7) |
0 |
|
Anorexia |
96 (30,4) |
14 (4,4) |
0 |
26 (17,7) |
5 (3,4) |
0 |
|
Alterações de voz |
76 (24,1) |
0 |
0 |
6 (4,1) |
0 |
0 |
|
Hipertensão |
77 (24,4) |
19 (6) |
0 |
6 (4,1) |
0 |
0 |
|
Inflamação da mucosa |
51 (16,1) |
9 (2,8) |
0 |
1 (0,7) |
0 |
0 |
|
Mucosite oral |
41 (13) |
7 (2,2) |
0 |
4 (2,7) |
0 |
0 |
|
Erupção ou descamação |
44 (13,9) |
11 (3,5) |
0 |
4 (2,7) |
0 |
0 |
|
Náusea |
40 (12,7) |
2 (0,6) |
0 |
17 (11,6) |
0 |
0 |
|
Perda de peso |
40 (12,7) |
0 |
0 |
4 (2,7) |
0 |
0 |
|
Febre |
23 (7,3) |
1 (0,3) |
0 |
5 (3,4) |
0 |
0 |
|
Pele seca |
19 (6) |
0 |
0 |
1 (0,7) |
0 |
0 |
|
Alopecia |
19 (6) |
0 |
0 |
0 |
0 |
0 |
|
Alteração do sabor |
20 (6,3) |
0 |
0 |
4 (2,7) |
0 |
0 |
|
Vômito |
22 (7) |
2 (0,6) |
0 |
8 (5,4) |
0 |
0 |
|
Neuropatia sensorial |
4 (1,3) |
0 |
0 |
0 |
0 |
0 |
|
Sangramento nasal |
26 (8,2) |
0 |
0 |
5 (3,4) |
0 |
0 |
|
Dispneia |
18 (5,7) |
0 |
0 |
2 (1,4) |
0 |
0 |
|
Tosse |
7 (2,2) |
0 |
0 |
2 (1,4) |
0 |
0 |
|
Dor nas costas |
37 (11,7) |
4 (1,3) |
0 |
15 (10,2) |
3 (2) |
1 (0,7) |
|
Dor muscular |
7 (2,2) |
1 (0,3) |
0 |
4 (2,7) |
1 (0,7) |
0 |
|
Dor de cabeça |
11 (3,5) |
2 (0,6) |
0 |
6 (4,1) |
0 |
0 |
|
Dor, abdômen |
0 |
0 |
0 |
0 |
0 |
0 |
|
Prisão de ventre |
27 (8,5) |
0 |
0 |
9 (6,1) |
0 |
0 |
|
Trombocitopenia |
19 (6) |
4 (1,3) |
0 |
3 (2) |
1 (0,7) |
0 |
|
Hiperbilirrubinemia |
16 (5,1) |
4 (1,3) |
0 |
1 (0,7) |
1 (0,7) |
0 |
|
ALT aumentada |
5 (1,6) |
3 (0,9) |
0 |
0 |
0 |
0 |
|
AST aumentado |
12 (3,8) |
4 (1,3) |
0 |
1 (0,7) |
0 |
0 |
|
Lipase aumentada |
14 (4,4) |
5 (1,6) |
4 (1,3) |
3 (2,0) |
1 (0,7) |
1 (0,7) |
|
Proteinúria |
18 (5,7) |
4 (1,3) |
0 |
4 (2,7) |
1 (0,7) |
0 |
|
Anemia |
9 (2,8) |
4 (1,3) |
1 (0,3) |
5 (3,4) |
1 (0,7) |
0 |
Legendas: CBP = características de bom prognóstico; ALT = alanina aminotransferase; AST = aspartato de aminotransferase.
No grupo sem CBP, ambos os braços de tratamento apresentaram alta proporção de EA graus 3 e 4 (99,4% para regorafenibe e 98,6% para placebo). Ao considerar EA de grau 5, o regorafenibe apresentou uma menor proporção quando comparado ao grupo placebo (18,4% e 21,8%, respectivamente). No grupo regorafenibe, 49,7% dos pacientes apresentaram EA relacionados ao tratamento graus 3 ou 4. EA demandando modificação de dose foram observados em 48,4% dos participantes no grupo regorafenibe versus 10,2% para placebo. Participantes dos dois grupos apresentaram EA que levaram à descontinuação permanente do medicamento (7,3% para regorafenibe e 1,4% para placebo).
No grupo com CBP, as pontuações médias iniciais do EORTC QLQ-C30 foram 83,76 (DP=13,16) para pacientes recebendo regorafenibe e 85,10 (DP=12,35) para placebo. As pontuações médias no final do tratamento foram 73,45 (DP=16,72) no grupo regorafenibe e 75,30 (DP=16,95) no grupo placebo. Os resultados do EORTC QLQ-C30 estão apresentados na Tabela 4. Para o EQ-5D, as pontuações médias iniciais foram 0,79 (DP=0,21) para regorafenibe e 0,82 (DP=0,22) para placebo e, ao final, 0,67 (DP=0,29) para regorafenibe e 0,65 (DP=0,32) para placebo. As pontuações médias iniciais da EVA do EQ-5D foram 70,1 (DP=18,7) para regorafenibe e 69,8 (DP=18,3) para placebo e, ao final, 60,4 (DP=20,5) e 59,4 (DP=21,9), respectivamente.
Após observado discreto desequilíbrio dos valores de pontuação inicial em ambos os braços, calculou-se a média ponderada das pontuações de EQ-5D de ambos os braços. Com a definição do valor inicial comum para cada grupo, o resultado ao final do tratamento foi descontado do valor inicial para placebo e regorafenibe, sendo esses valores -0,110 (DP=0,260) e -0,205 (SD 0,292), respectivamente. Foram calculadas as pontuações finais de tratamento de 0,687 para regorafenibe e 0,592 para placebo, demonstrando uma menor deterioração da qualidade de vida no grupo regorafenibe. A diferença entre regorafenibe e placebo naqueles com CBP é de 0,095, sendo considerada uma clinicamente significativa, excedendo o limiar de diferença minimamente importante de 0,0721. Adicionalmente, calculou-se a pontuação de pré-progressão por meio da média ponderada de todos os ciclos antes do ciclo final de tratamento, resultando em 0,745 para regorafenibe e 0,757 para placebo.
No grupo sem CBP, as pontuações médias do EORTC QLQ-C30 no início do estudo foram 76,52 (DP=16,25) para regorafenibe e 77,34 (DP=16,25) para placebo e, ao final do tratamento, foram 64,60 (DP=18,97) e 69,62 (DP=18,72), respectivamente. Os resultados do estado de saúde global e das pontuações de funcionamento físico do EORTC QLQ-C30 estão apresentados na Tabela 4. As pontuações médias iniciais do índice EQ-5D no grupo sem CBP foram 0,69 (DP=0,27) para regorafenibe e 0,68 (DP=0,29) para placebo e, ao final, 0,54 (DP=0,32) e 0,54 (DP=0,36), respectivamente. As pontuações médias iniciais da EVA do EQ-5D foram 62,6 (DP=19,5) para regorafenibe e 63,0 (DP=21,5) para placebo e, ao final, 52,4 (DP=19,8) e 55,4 (DP=21,3), respectivamente (Tabela 4).
|
Tabela 4. Qualidade de vida entre pacientes |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Legendas: CBP = características de bom prognóstico; DP = desvio-padrão; EORTC QLQ-C30 = European Organisation for Research and Treatment of Cancer Core Quality-of-Life Questionnaire; EQ-5D = European Quality of Life Five Dimension; EVA = escala analógica visual. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
DISCUSSÃO
Nesta análise de subgrupo do CORRECT, os pacientes que receberam regorafenibe e tinham CBP foram avaliados em relação ao placebo para verificar se alcançariam melhores resultados durante o tratamento11. Conforme apontado no estudo REBECCA13, indivíduos com menor escore ECOG-PS, maior tempo desde o diagnóstico de metástase, menos de três sítios metastáticos e ausência de metástase hepática tiveram uma maior sobrevida no tratamento com regorafenibe e, pela conclusão desse estudo13, essas características impactaram favoravelmente o resultado de eficácia e foram utilizadas nesta análise de subgrupo para a divisão dos grupos com e sem CBP13. Foram observadas melhoras nas medianas de SG e SLP no grupo com CBP quando comparados ao grupo sem CBP, conforme indicado pelo estudo REBECCA13. Além disso, pacientes tratados com regorafenibe apresentaram melhor eficácia tanto no grupo com CBP quanto no grupo sem CBP em comparação ao placebo, conforme relatado nos estudos CONCUR10 e CORRECT11.
Além do REBECCA13, outros estudos de vida real fornecem evidências para apoiar a seleção da população tratada com regorafenibe que alcança melhora na SG. Os estudos de Aljubran et al.22, Novakova-Jiresova et al.23 e Yamaguchi et al.24 também demonstraram que menor escore ECOG-PS e tempo de diagnóstico ≥18 meses de doença metastática são variáveis que influenciam positivamente na SG e SLP no tratamento com regorafenibe.
Nesta análise, a maior proporção de EA nos pacientes no grupo regorafenibe pode ter sido impactada pela maior duração do tratamento em comparação aos do grupo placebo, e vale considerar que o estudo CORRECT11 foi realizado em 2011 e, posteriormente a essa data, estratégias para melhorar o perfil de segurança e qualidade de vida com o uso de regorafenibe foram implementadas, como o início do tratamento com dose reduzida, a diminuição de dose ou interrupção de tratamento na vigência de EA grau 3, e também o escalonameto de dose incial no primeiro ciclo de tratamento10-13,25. O estudo ReDOS25, com estratégia de escalonamento de dose, encontrou menor incidência de EA de alto grau durante o ciclo 1 e melhora nas pontuações de qualidade de vida com médias significativamente melhores na semana 2 no grupo de escalonamento de dose, comparado ao grupo de dose padrão para fadiga, interferências na atividade geral, humor, caminhada e trabalho normal, sugerindo que a estratégia de escalonamento de dose é benéfica para a qualidade de vida do paciente25. Os dados dessa análise corroboram a existência de uma menor deterioração da qualidade de vida nos pacientes com CBP que utilizaram regorafenibe quando comparado ao placebo.
No grupo com CBP, percentuais semelhantes de pacientes estavam aptos a receber pelo menos uma terapia antineoplásica subsequente (32,7% para placebo e 32,4% para regorafenibe ) e uma maior porcentagem de pacientes do grupo regorafenibe com CBP receberam terapia antineoplásica sistêmica subsequente comparados com os pacientes do grupo regorafenibe sem CBP (32,4% versus 21,9% respectivamente), o que reforça a importância do tratamento com regorafenibe para os pacientes com CBP para proporcionar maiores ganhos de SG e chances de seguimento ao tratamento.
Por fim, o CCRm é uma condição com sobrevida estimada de cinco anos em 14% dos casos, e existem poucas alternativas disponíveis para tratamento de pacientes refretários26. Dessa forma, o regorafenibe é incluído como uma opção de tratamento em guidelines nacionais e internacionais, com base em estudos pivotais, incluindo abordagens alternativas de dose inicial com sobrevida comparável e com menor incidência de EA5,6,25. O regorafenibe está aprovado para uso desde 2012 no mundo27.
Nesta publicação, foi possível observar que determinadas características clínicas impactam positivamente na SG e SLP de pacientes para tratamento com regorafenibe, corroborando dados já existentes na literatura. Esses achados podem impactar a prática clínica, fornecendo uma melhor compreensão de quais pacientes podem melhor se beneficiar da terapia com regorafenibe, apoiando políticas públicas com evidências.
Embora melhores resultados tenham sido observados para os indivíduos com CBP, o regorafenibe permanece como opção eficaz para os pacientes que não apresentam essas características clínicas específicas, principalmente quando refratários a terapias padrão anteriores. Para abordar questões de segurança, a estratégia de escalonamento de dose, juntamente com medidas preventivas e proativas, melhora a frequência de EA e também a qualidade de vida, motivando o paciente a aderir ao tratamento28.
CONCLUSÃO
Nesta análise de subgrupo do estudo CORRECT, pacientes com CCRm do grupo com CBP, com pelo menos três das quatro características clínicas (ECOG-PS escore 0, até três locais de tumor, ≥18 meses desde o diagnóstico de doença metastática e sem metástase hepática), apresentaram um melhor benefício na SG, SLP e menor deterioração da qualidade de vida no tratamento com regorafenibe em comparação com placebo.
AGRADECIMENTOS
Ao Renato Watanabe de Oliveira, Pharm., Consultor Sênior RWE/HEOR/Market access da IQVIA Brasil pela redação médica e assistência editorial, conduzidas de acordo com as diretrizes de Boas Práticas de Publicação (GPP3).
CONTRIBUIÇÕES
Rodrigo Palhares, Glauco Britto, Yun Su, Marie-Aude Le Berre, Ricardo Saad, Fabricio Navachi, Daniela Foli, Helene Ostojic e Graziella Azevedo contribuíram substancialmente na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados, assim como na redação e revisão crítica. Eric Van Cutsem contribuiu substancialmente na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados. Todos os autores aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Rodrigo Resende Palhares, Glauco do Canto Britto, Yun Su; Marie-Aude Le Berre, Ricardo Saad Henriques, Fabricio Volpato Navachi, Daniela Cristina Foli Pereira, Helene Ostojic e Graziella Agostini Azevedo são colaboradores Bayer. Eric Van Cutsem possui função de consultoria ou assessoria Array BioPharma; AstraZeneca; Bayer; Bristol-Myers Squibb; Celgene; halozima; Lilly; Merck KGaA; Merck Sharp & Dohme; Novartis; Roche; SERVIER.
FONTES DE FINANCIAMENTO
Eric Van Cutsem obteve financiamento à pesquisa da Amgen (Inst); Bayer (Inst); Boehringer Ingelheim (Inst); Bristol-Myers Squibb (Inst); Celgene (Inst); Ipsen (Inst); Lilly (Inst); Merck (Inst); Merck KGaA (Inst); Novartis (Inst); Roche (Inst); SERVIER (Inst).
O estudo CORRECT foi patrocinado pela Bayer. O acordo de financiamento garantiu a independência dos autores na concepção do estudo, interpretação dos dados, redação e publicação do relatório. Esta análise de subgrupo foi apoiada pela Bayer sem restrições e sem assistência financeira.
REFERÊNCIAS
1. Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209-49. doi: https://doi.org/10.3322/caac.21660
2. Arnold M, Sierra MS, Laversanne M, et al. Global patterns and trends in colorectal cancer incidence and mortality. Gut. 2017;66(4):683-91. doi: https://doi.org/10.1136/gutjnl-2015-310912
3. Center MM, Jemal A, Ward E. International trends in colorectal cancer incidence rates. Biomarcadores de Epidemiol de Câncer Anterior.2009;18(6):1688-94. doi: https://doi.org/10.1158/1055-9965.EPI-09-0090
4. American Cancer Society [Internet]. Kennesaw (GA): American Cancer Society; c2022. Key statistics for colorectal cancer: How common is colorectal cancer? [revised 2022 Jan 12; cited 2022 May 30]. Available from: https://www.cancer.org/cancer/colon-rectal-cancer/about/key-statistics.html
5. Cutsem E, Cervantes A, Adam R, et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol. 2016;27(8):1386-1422. doi: https://doi.org/10.1093/annonc/mdw235
6. Messersmith WA. NCCN Guidelines updates: management of metastatic colorectal cancer. J Natl Compr Canc Netw. 2019;17(5.5):599-601. doi: https://doi.org/10.6004/jnccn.2019.5014
7. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019;69(1):7-34. doi: https://doi.org/10.3322/caac.21551
8. Van Cutsem E, Cervantes A, Nordlinger B, et al. Metastatic colorectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2014;25(Suppl 3):iii1-9. doi: https://doi.org/10.1093/annonc/mdu260
9. Wilhelm SM, Dumas J, Adnane L, et al. Regorafenib (BAY 73-4506): a new oral multikinase inhibitor of angiogenic, stromal and oncogenic receptor tyrosine kinases with potent preclinical antitumor activity. Int J Cancer. 2011;129(1):245-55. doi: https://doi.org/10.1002/ijc.25864
10. Li J, Qin S, Xu R, et al. Regorafenib plus best supportive care versus placebo plus best supportive care in Asian patients with previously treated metastatic colorectal cancer (CONCUR): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2015;16(6):619-29. doi: https://doi.org/10.1016/S1470-2045(15)70156-7
11. Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013;381(9863):303-12. doi: https://doi.org/10.1016/S0140-6736(12)61900-X
12. Van Cutsem E, Martinelli E, Cascinu S, et al. Regorafenib for patients with metastatic colorectal cancer who progressed after standard therapy: results of the large, single-arm, open-label phase IIIb CONSIGN study. Oncologist. 2019;24(2):185-92. doi: https://doi.org/10.1634/theoncologist.2018-0072
13. Adenis A, de la Fouchardiere C, Paule B, et al. Survival, safety, and prognostic factors for outcome with Regorafenib in patients with metastatic colorectal cancer refractory to standard therapies: results from a multicenter study (REBECCA) nested within a compassionate use program. BMC Cancer. 2016;16:412. doi: https://doi.org/10.1186/s12885-016-2440-9
14. Associação Médica Mundial. Declaração de Helsinque da Associação Médica Mundial (WMA): princípios éticos para pesquisa médica envolvendo seres humanos [Internet]. Jorge MR, tradudor. In: 64ª Assembleia Geral da WMA; 2013 out; Fortaleza. França: World Medical Association; 2013 [acesso 2022 maio 5]. Disponível em: https://arquivos.amb.org.br/_downloads/289493001383134046_DECLARACAODEHELSINQUE.pdf
15. Conselho Internacional para Harmonização de Requisitos Técnicos para Produtos Farmacêuticos de Uso humano. Guia Harmonizado do ICH: adendo integrado ao ICH E6(R1): guia de boas práticas clínicas E6(R2) [Internet]. Versão vigente do passo 4 de 9. Brasília (DF): Anvisa; 2016 nov [acesso 2022 maio 30]. Disponível em: http://antigo.anvisa.gov.br/documents/33836/2492465/Guia+de+Boas+Pr%C3%A1ticas+Cl%C3%ADnicas+ICH+E6%28R2%29+-+Traduzido+para+portugu%C3%AAs%2C+vers%C3%A3o+Anvisa+de+Novembro-2019/93e4d18c-7e86-4e71-9283-7740e42d7ff6
16. Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228-47. doi: https://doi.org/10.1016/j.ejca.2008.10.026
17. National Cancer Institute, Cancer Therapy Evaluation Program. Common Terminology Criteria for Adverse Events v3.0 (CTCAE) [Internet]. Bethesda (MD): CETEP; 2006 Aug 9 [cited 2022 Oct 19]. Available from: https://ctep.cancer.gov/protocoldevelopment/electronic_applications/ctc.htm
18. European Organisation for Research and Treatment of Cancer Quality of Life. EORTC QLQ-C30 [Internet]. Version 3 [place unknown]: EORTC Quality of Life Group; c1995 [cited 2022 May 30]. Available from: https://www.eortc.org/app/uploads/sites/2/2018/08/Specimen-QLQ-C30-English.pdf
19. Health Questionnaire (EQ-5D-5L) [Internet]. United Kingdom: EuroQol; c2009 [cited 2022 May 30]. Available from: https://aci.health.nsw.gov.au/__data/assets/pdf_file/0003/632847/EuroQol-5-Dimension.pdf
20. Visual Analogue Scale (VAS): 3 02 a pain scales [Internet]. Adapted from: Warden V, Hurley AC, Volicer L. Development and psychometric evaluation of the pain assessment in advanced dementia (PAINAD) scale. J Am Med Dir Assoc. 2003;4:9-15 [revised 2011; cited 2022 May 5]. Available from: https://eportfolios.macaulay.cuny.edu/reisf16/files/2016/09/pain-scale-visual.pdf
21. Pickard AS, Neary MP, Cella D. Estimation of minimally important differences in EQ-5D utility and VAS scores in cancer. Health Qual Life Outcomes. 2007;5:70. doi: https://doi.org/10.1186/1477-7525-5-70
22. Aljubran A, Elshenawy MA, Kandil M, et al. Efficacy of regorafenib in metastatic colorectal cancer: a multi-institutional retrospective study. Clin Med Insights Oncol. 2019;13:1179554918825447. doi: https://doi.org/10.1177/1179554918825447
23. Novakova-Jiresova A, Kopeckova K, Boublikova L, et al. Regorafenib for metastatic colorectal cancer: an analysis of a registry-based cohort of 555 patients. Cancer Manag Res. 2020;12:5365-72. doi: https://doi.org/10.2147/CMAR.S255332
24. Yamaguchi K, Komatsu Y, Satoh T, et al. Large-scale, prospective observational study of regorafenib in japanese patients with metastatic colorectal cancer in a real-world clinical setting. Oncologist. 2019;24(7):e450-e457. doi: https://doi.org/10.1634/theoncologist.2018-0377
25. Bekaii-Saab TS, Ou FS, Ahn DH, et al. Regorafenib dose-optimisation in patients with refractory metastatic colorectal cancer (ReDOS): a randomised, multicentre, open-label, phase 2 study. Lancet Oncol. 2019;20(8):1070-82. doi: https://doi.org/10.1016/S1470-2045(19)30272-4
26. Cancer G. Real-world adherence in patients with metastatic colorectal cancer treated with trifluridine plus tipiracil or regorafenib. Oncologist. 2020;25(1):e75-e84. doi: https://doi.org/10.1634/theoncologist.2019-0240
27. Kidd MT, Wilcox RE, Rogers J, et al. Efficacy of chemotherapy after treatment with regorafenib in metastatic colorectal cancer (mCRC). J Clin Oncol. 2015;33(Suppl 3):678-8. doi: https://doi.org/10.1200/jco.2015.33.3_suppl.678
28. Loupakis F, Antonuzzo L, Bachet JB, et al. Practical considerations in the use of regorafenib in metastatic colorectal cancer. Ther Adv Med Oncol. 2020;12:1758835920956862. doi: https://doi.org/10.1177/1758835920956862
Recebido em 1/6/2022
Aprovado em 8/8/2022
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer José Alencar Gomes da Silva | Ministério da Saúde