É Possível Evitar a Biópsia do Linfonodo Sentinela em Pacientes com Câncer de Mama e Linfonodo Axilar Positivo com Resposta Patológica Completa à Quimioterapia Neoadjuvante?
Is it Possible to Avoid Sentinel Lymph Node Biopsy in Breast Cancer Patients with a Positive Axillary Lymph Node with Complete Pathological Response to Neoadjuvant Chemotherapy?
¿Es Posible Evitar la Biopsia del Ganglio Centinela en Pacientes con Cáncer de Mama y Ganglio Axilar Positivo con Respuesta Patológica Completa a la Quimioterapia Neoadyuvante?
doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n1.2759
Helano de Paula Gonçalves Souza1; Francisco das Chagas Medeiros2; Marcos Venício Alves Lima3
1Universidade Federal do Ceará (UFC). Instituto do Câncer do Ceará (ICC). Fortaleza (CE), Brasil. E-mail: helanopgs@hotmail.com. Orcid iD: https://orcid.org/0000-0001-9641-0765
2UFC, Departamento de Saúde da Mulher, da Criança e do Adolescente. Fortaleza (CE), Brasil. E-mail: prof.fcmedeiros@gmail.com. Orcid iD: https://orcid.org/0000-0003-2716-7807
3Instituto Nacional de Câncer (INCA). Rio de Janeiro (RJ), Brasil. E-mail: marcosvalima@hotmail.com. Orcid iD: https://orcid.org/0000-0002-4944-5022
Endereço para correspondência: Helano de Paula Gonçalves. Rua Nunes Valente, 1817, apto. 1304 – Meireles. Fortaleza (CE), Brasil. CEP 60125-035. E-mail: helanopgs@hotmail.com
RESUMO
Introdução: O câncer de mama representa 24,5% dos novos casos de neoplasias em mulheres no mundo. A quimioterapia neoadjuvante é uma importante ferramenta no tratamento dessa patologia, possibilita cirurgias menos agressivas na mama e axila, além de minimizar sequelas. Objetivo: Analisar a possibilidade de se evitar a realização da biópsia do linfonodo sentinela em pacientes com câncer de mama submetidas à quimioterapia neoadjuvante que apresentem resposta patológica completa no tumor primário e na axila, tratadas em uma instituição de referência no Nordeste brasileiro. Método: Estudo prospectivo, observacional, de coorte em pacientes com câncer de mama submetidas à quimioterapia neoadjuvante e operadas no Hospital Haroldo Juaçaba, no período de março de 2019 a julho de 2021. Resultados: Foram incluídas no estudo 45 pacientes, com média de idade de 52,6 anos, sendo todas do sexo feminino. Após quimioterapia neoadjuvante, nove pacientes (21,4%) apresentaram resposta patológica completa na mama e 17 (40,5%), resposta patológica completa nos linfonodos. Os pacientes com resposta completa na mama apresentaram uma prevalência de resposta completa em linfonodo 20,44 vezes superior aos pacientes que não tiveram a mesma resposta. Conclusão: A resposta patológica completa na mama à quimioterapia neoadjuvante mostra uma tendência em predizer uma resposta patológica nos linfonodos axilares, reforçando que, com essa condição, a biópsia do linfonodo sentinela poderia ser evitada sem causar prejuízos ao controle local do câncer de mama.
Palavras-chave: neoplasias da mama; biópsia de linfonodo sentinela; terapia neoadjuvante.
ABSTRACT
Introduction: Breast cancer represents 24.5% of new cases of cancer in women worldwide. Neoadjuvant chemotherapy is an important tool in the treatment of this pathology, allowing less aggressive surgeries at the breast and axilla, minimizing sequelae. Objective: Analyze the possibility of avoiding sentinel lymph node biopsy in patients with breast cancer who have undergone neoadjuvant chemotherapy and who present complete pathological response at the primary tumor and axilla, treated at a reference institution in Brazil’s Northeast. Method: Prospective, observational, cohort study in patients with breast cancer, undergoing neoadjuvant chemotherapy and operated at the Hospital Haroldo Juaçaba, from March 2019 to July 2021. Results: Forty-five female patients were enrolled in the study, with a mean age of 52.6 years. After neoadjuvant chemotherapy, nine patients (21.4%) had complete pathologic response at the breast and 17 (40.5%), complete pathologic response at the lymph nodes. Patients with complete response at the breast had a prevalence of complete response at lymph node 20.44 times higher than patients who did not have the same response. Conclusion: The complete pathologic response to neoadjuvant chemotherapy at the breast shows a tendency to predict the pathologic response at the axillary lymph nodes, reinforcing that, with this condition, sentinel lymph node biopsy could be avoided without causing harm to the local control of breast cancer.
Key words: breast neoplasms; sentinel lymph node biopsy; neoadjuvant therapy.
RESUMEN
Introducción: El cáncer de mama representa el 24,5% de los nuevos casos de neoplasias en mujeres de todo el mundo. La quimioterapia neoadyuvante es una herramienta importante en el tratamiento de esta patología, permitiendo cirugías menos agresivas en la mama y la axila, minimizando las secuelas. Objetivo: Analizar la posibilidad de evitar la biopsia del ganglio centinela en pacientes con cáncer de mama, sometidas a quimioterapia neoadyuvante, con respuesta patológica completa en el tumor primario y en la axila, tratadas en una institución de referencia del noreste de Brasil. Método: Estudio prospectivo, observacional, de cohorte en pacientes con cáncer de mama, sometidas a quimioterapia neoadyuvante y operadas en el Hospital Haroldo Juaçaba, en el período de marzo de 2019 a julio de 2021. Resultados: Se incluyeron 45 pacientes en el estudio, con una edad media de 52,6 años, y todos eran mujeres. Tras la quimioterapia neoadyuvante, nueve pacientes (21,4%) mostraron respuesta patológica completa en la mama y 17 (40,5%), respuesta patológica completa en los ganglios linfáticos. Las pacientes con respuesta completa en la mama presentaron una prevalencia de respuesta completa en el ganglio linfático 20,44 veces mayor que las pacientes que no tuvieron la misma respuesta. Conclusión: La respuesta patológica completa en la mama a la quimioterapia neoadyuvante muestra una tendencia a predecir una respuesta patológica en los ganglios linfáticos axilares, reforzando que, con esta condición, la biopsia del ganglio linfático centinela podría evitarse sin causar daño al control local del cáncer de mama.
Palabras clave: neoplasias de la mama; biopsia del ganglio linfático centinela; terapia neoadyuvante.
INTRODUÇÃO
O câncer de mama, com aproximadamente 2,3 milhões de casos novos estimados em 2020, representando 24,5% dos novos casos de câncer em mulheres, é classificado como a principal causa de morte relacionada à neoplasia no sexo feminino com estimativa de 684.996 óbitos esperados para 2021, perfazendo 15,5% das mortes por câncer em mulheres no mundo1.
No Brasil, foram estimados 73.610 casos novos de câncer de mama para 2023, o que representa uma incidência de 41,89 casos por 100 mil mulheres1. Os óbitos por câncer de mama ocupam o primeiro lugar no país na mortalidade proporcional por câncer em mulheres, correspondendo a 16,5% do total de óbitos em 2022.
Inicialmente indicada no tratamento do câncer de mama localmente avançado, a quimioterapia neoadjuvante, a partir da década de 1990, passou a ser considerada uma opção de tratamento para o câncer de mama operável. Em termos de sobrevida global (SG), ao se comparar a quimioterapia adjuvante com a neoadjuvante no câncer de mama operável, não há diferenças2-4. Entretanto, tem-se a possibilidade de diminuir o volume tumoral e o comprometimento axilar (downstaging) com o tratamento neoadjuvante, aumentando a possibilidade de cirurgia conservadora sem prejuízos à sobrevida, sendo a resposta patológica completa (pCR) um excelente preditor de prognóstico5,6.
Na abordagem axilar das pacientes com câncer de mama, a biópsia do linfonodo sentinela (BLS) foi uma importante ferramenta descrita em 19947. O estado linfonodal axilar é um fator determinante no tratamento do câncer de mama e tem um poderoso significado como fator prognóstico7,8. Estudos randomizados demonstraram que a BLS reflete com boa fidelidade a presença, ou ausência, de metástase axilar; apresentando controle local, sobrevida livre de doença (SLD) e SG semelhantes ao esvaziamento axilar em pacientes com axila clinicamente negativa9,10.
Estudos como ACOSOG Z107111 e AMAROS12 foram um pouco além na defesa da conservação da axila, com a intenção de evitar a mutilação do esvaziamento como sentença incontestável para comprometimento linfonodal metastático da axila. Os dois estudos mostraram resultados semelhantes no controle locorregional e na sobrevida global, ao se comparar BLS associada à radioterapia versus esvaziamento axilar, em pacientes e situações selecionados, com metástase axilar comprovada11-13.
A conduta padrão na axila, após a quimioterapia neoadjuvante, foi, por muitos anos, o esvaziamento axilar14. Porém, Fisher et al.15 observaram que cerca de 40% dos pacientes com linfonodo axilar positivo apresentavam pCR após quimioterapia neoadjuvante, e as taxas aumentavam para mais de 70% com o uso de terapia antifator de crescimento epidérmico humano receptor 2 (HER2).
O estudo ACOSOG Z107111 demonstrou que a BLS era possível em axilas inicialmente positivas (cN1) que negativaram após a quimioterapia neoadjuvante. Com taxa de falso-negativo aceitável, utilizando-se dupla marcação (corante e radioisótopo) e ressecando três ou mais linfonodos sentinelas (ycN0), o procedimento podia ser utilizado com segurança oncológica aceitável11,13.
Com o objetivo de tornar a técnica de BLS pós-quimioterapia neoadjuvante mais confiável, alguns autores16,17 relataram que, marcando o linfonodo suspeito no momento de sua biópsia pré-tratamento com clipe metálico ou semente de iodo 123 (I¹²³) guiada por ultrassonografia, o índice de falso-negativo tornou-se mais aceitável.
Análises recentes demonstraram que a taxa de sobrevivência é mais influenciada pela pCR do que pelo estado clínico inicial, mesmo em pacientes com metástase axilar pré-tratamento, fortalecendo o uso da BLS pós-quimioterapia neoadjuvante18.
Por meio deste estudo, tenta-se correlacionar a resposta do tumor primário de mama com a presença de metástase linfonodal após quimioterapia neoadjuvante em mulheres tratadas em uma instituição de referência no Nordeste Brasileiro. Pretende-se, com a apresentação desses dados, contribuir para a solução da questão: “É possível evitar a BLS pós-quimioterapia neoadjuvante em pacientes com pCR na mama?”
MÉTODO
Trata-se de um estudo prospectivo, observacional, de coorte, realizado no Hospital Haroldo Juaçaba, referência Norte/Nordeste do país no tratamento oncológico, no período de período entre março de 2019 a julho de 2021.
A população foi constituída por 45 mulheres com diagnóstico de câncer de mama, inicialmente sem tratamento, com axila clinicamente positiva, submetidas à quimioterapia neoadjuvante e a tratamento cirúrgico. A amostra é não probabilística por conveniência e constituída por todas as pacientes com câncer de mama que cumpriram os critérios de inclusão da pesquisa descrita a seguir. As variáveis estudadas foram: perfil imuno-histoquímico tumoral; citologia do linfonodo clinicamente positivo inicial; resposta à quimioterapia neoadjuvante em mama e linfonodos, incluindo, nesse critério, a resposta objetiva, que foi considerada como a adição da reposta completa e da resposta parcial; positividade do linfonodo sentinela; estadiamento clínico pré e pós-quimioterapia; coincidência ou não do linfonodo clinicamente positivo pré-quimioterapia, clipado com o linfonodo sentinela ressecado durante a pesquisa do linfonodo sentinela na cirurgia terapêutica.
Foram utilizadas como critérios de inclusão mulheres entre 18 e 75 anos de idade com diagnóstico de carcinoma invasor da mama, tumores maiores do que 2 cm, axila clinicamente positiva, estadiamentos clínicos T2-T3 e N1-N2, que iniciaram o tratamento neoadjuvante com quimioterapia acompanhadas pelo Serviço de Mastologia do Hospital Haroldo Juaçaba e aceitaram participar do estudo mediante assinatura do Termo de Consentimento Livre e Esclarecido.
Foram excluídas da pesquisa pacientes com metástase (M1) no momento do diagnóstico; submetidas à biópsia excisional; com cirurgias axilares prévias; e ultrassonografia axilar normal.
Foram realizadas punção aspirativa sob efeito de anestesia local, xilocaína 4%, guiada por ultrassonografia, com colocação de clipe metálico no linfonodo axilar clinicamente suspeito, palpável, e análise citológica com pesquisa de células neoplásicas antes da realização da quimioterapia neoadjuvante. As pacientes foram acompanhadas e examinadas periodicamente durante a quimioterapia, com a análise clínica de resposta do tumor ao tratamento.
Após conclusão da quimioterapia neoadjuvante, as pacientes foram submetidas ao procedimento cirúrgico, radical ou conservador, da mama e axila, baseado em indicações clínicas, com abordagem axilar e análise anatomopatológica da peça, fornecendo dados mais precisos sobre a resposta da doença ao tratamento quimioterápico.
Para validar a confiabilidade do método pós-quimioterapia neoadjuvante, utilizou-se a dupla marcação para pesquisa do linfonodo sentinela, realizando injeção intradérmica de 0,8 mL do radiofármaco fitato marcado com tecnécio-99, dose de 29,6 MBq (0,8 mCi) e de 0,5 ml de azul patente, periareolar, nos quatro pontos cardeais da mama afetada. O linfonodo sentinela foi localizado com o auxílio de sonda de detecção de radiação gama (probe) e identificação visual, retirado e enviado ao patologista, sendo, então, fatiado em cortes seriados longitudinais de 2 mm ao longo de seu maior eixo, submetendo todas as frações ao exame histológico e verificando, no transcorrer do processo, a presença do clipe metálico.
O estudo respeitou todos os princípios éticos e as diretrizes e normas necessárias, e seguiu rigorosamente a Resolução n.º 466/12 do Conselho Nacional de Saúde (CNS)19, observando a dignidade da pessoa humana e proporcionando a proteção devida na participação de pesquisas científicas. Ademais, seguiu-se a bioética na esfera coletiva e individual de cada participante, respeitando a autonomia, não maleficência, beneficência, justiça e equidade, almejando garantir os direitos e deveres na realização do estudo como preconiza a comunidade científica.
Os dados foram coletados após a aprovação pelo Comitê de Ética em Pesquisa da Universidade Federal do Ceará, Pró-Reitoria de Pesquisa (CEP/UFC/Propesq), e pelo CEP do Instituto do Câncer do Ceará (ICC), Hospital Haroldo Juaçaba, sob o número de parecer 3.227.730 (CAAE: 09507218.4.0000.5054).
As informações e dados obtidos nos prontuários das pacientes foram destinados apenas para fins científicos, sendo garantido o seu sigilo. Os dados foram tabulados em uma planilha padrão no Microsoft Excel e exportados para o software Statistical Package for the Social Sciences (SPSS), no qual as análises foram realizadas adotando um intervalo de confiança de 95%.
Além disso, os dados foram expressos em forma de frequência absoluta e percentual. As frequências de resposta objetiva e completa à neoadjuvância em mama e linfonodos foram associadas às demais características clínicas por meio dos testes qui-quadrado de Pearson ou exato de Fisher.
RESULTADOS
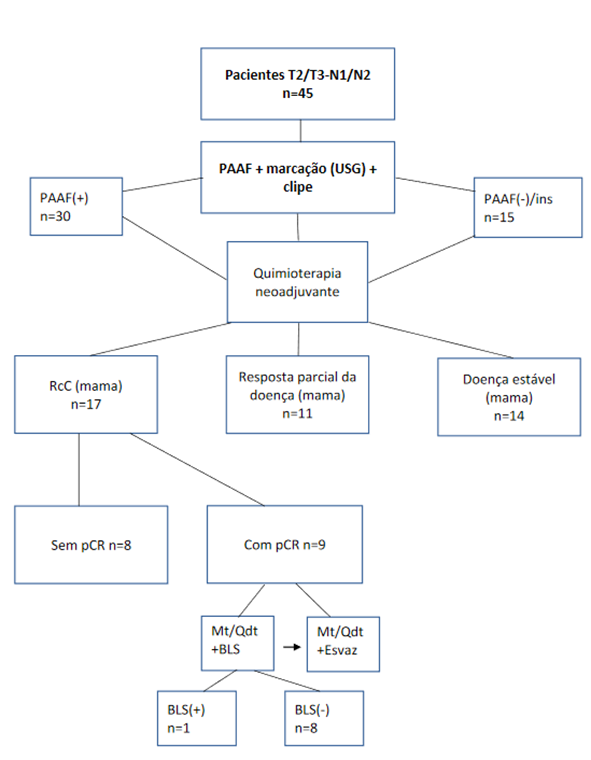
A presente amostra foi composta de 45 pacientes com câncer de mama. A idade média foi de 52,6 ±12,5 anos, variando de 26 a 74 anos, com 30 pacientes (66,7%) de idade superior a 45 anos. O estadiamento T mais prevalente foi o T3 (n=27; 60%) e o estadiamento N mais predominante o N1 (n=32; 71,1%). A imunoexpressão para receptor de estrogênio foi observada em 25 pacientes (55,6%), receptor de progesterona em 24 (53,3%) e HER2 em oito (17,8%). A maior parte das pacientes apresentava fenótipo luminal B (n=22; 48,9%), e 17 pacientes (37,8%) apresentavam tumores triplo-negativos. O grau tumoral mais prevalente foi o II (n=27; 67,5%), em cinco pacientes (11,11%) da amostra não foi definido o grau tumoral. Verificou-se invasão linfovascular em quatro pacientes (9,8%) e nenhuma paciente apresentou invasão perineural; em quatro pacientes da amostra total, não foi definida pela análise anatomopatológica a presença ou ausência de invasão linfovascular e de invasão perineural. Quarenta e duas pacientes foram submetidas à realização da BLS, das quais 38 (90,4%) apresentaram o clipe posicionado no linfonodo sentinela. Três pacientes (6,6%) da amostra inicial de 45 não realizaram BLS, uma delas (2,2%) perdeu seguimento e duas delas (4,4%) apresentaram progressão de doença sistêmica. Todas as 45 pacientes que apresentavam axila clinicamente positiva (N1 ou N2) foram submetidas à punção aspirativa por agulha fina (PAAF) e à análise citológica do linfonodo axilar suspeito de comprometimento; 30 (66,6%) apresentaram resultado positivo para pesquisa de células neoplásicas, dez (22,2%) apresentaram ausência de células neoplásicas e cinco (11,1%) tiveram como resultado amostra insatisfatória (Figura 1).
A maior parte das pacientes apresentou, na mama, resposta patológica parcial (n=19; 45,2%), seguida de doença estável (n=14; 31,13%), e pCR (n=9; 21,4%). No exame clínico, pós-quimioterapia neoadjuvante e pré-cirúrgico, 17 pacientes apresentavam resposta clínica completa (RcC), das quais, como já citado, apenas nove tiveram correlação com pCR na mama. Nenhuma paciente apresentou progressão de doença em mama. Em linfonodos, a maior parte das pacientes apresentou pCR (n=17; 40,5%), seguido de doença estável (n=13; 31,0%), progressão de doença (n=8; 17,8%) e resposta patológica parcial (n=4; 9,5%). A taxa de pCR foi significantemente maior no linfonodo do que na mama (p<0,001) (Tabela 1).
Nos tumores triplo-negativos, a maior parte das respostas patológicas em mama foi doença estável (n=7; 43,8%) e, em linfonodo, as pCR (n=7; 41,2%). No entanto, não houve diferença significante no perfil de resposta patológica de mama e de linfonodo nessas pacientes (p=0,188) (Tabela 1).
|
Tabela 1. Perfil de resposta terapêutica em tumor primário e cadeia linfonodal de mulheres com câncer de mama ou câncer de mama triplo-negativo submetidas à quimioterapia neoadjuvante |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Legendas: RC = resposta completa; RP = resposta parcial; DE = doença estável; PD = progressão de doença. (*) p<0,05, teste exato de Fisher ou qui-quadrado de Pearson. Nota: Dados expressos em forma de frequência absoluta e percentual. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
As pacientes com as pCR em mama apresentaram uma taxa de pCR em linfonodo 20,44 vezes superior (IC95%=2,23-187,69) às pacientes que não tiveram pCR em mama (p=0,002) (Tabela 2).
|
Tabela 2. Influência da resposta terapêutica em tumor primário na resposta terapêutica em cadeia linfonodal de mulheres com câncer de mama submetidas à quimioterapia neoadjuvante |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
Legendas: RC = resposta completa. (*) p<0,05, teste exato de Fisher ou qui-quadrado de Pearson. Nota: Dados expressos em forma de frequência absoluta e percentual. |
||||||||||||||||||||||||||||||
|
|
|
Figura 1. Fluxograma das pacientes na pesquisa Legendas: PAAF = punção aspirativa por agulha fina; USG = ultrassonografia; Ins = material insatisfatório; RcC = resposta clínica completa; pCR = resposta patológica completa; Mt = mastectomia; Qdt = quadrantectomia; BLS = biópsia do linfonodo sentinela; Esvaz = esvaziamento axilar. |
Idade (p=0,161), estadiamento T (p=0,537) e N (p=0,862), expressão para receptor de estrogênio (p=0,483), receptor de progesterona (p=0,591), fenótipo (p=0,588), grau tumoral (p=0,415) e presença de invasão linfovascular (p=0,838) não foram associados à resposta patológica em mama. Contudo, pacientes com positividade para HER2 apresentaram uma taxa de pCR em mama 12,50 vezes maior (IC95%=2,13-73,47) do que pacientes que apresentavam negatividade para essa proteína (p=0,006) (Tabela 3).
Com relação aos linfonodos, idade (p=0,824), estadiamento T (p=0,542) e N (p=0,921), expressão para receptor de estrogênio (p=0,408), receptor de progesterona (p=0,952), fenótipo (p=0,313), grau tumoral (p=0,189) e presença de invasão linfovascular (p=0,531) não foram associados à resposta patológica em axila. No entanto, pacientes com positividade para HER2 apresentaram uma taxa de pCR em linfonodo 36,43 vezes maior (IC95%=1,90-697,60) do que pacientes que apresentaram negatividade para essa proteína (p<0,001) (Tabela 3).
|
Tabela 3. Indicadores de resposta terapêutica completa em tumor primário e cadeia linfonodal de mulheres com câncer de mama submetidas à quimioterapia neoadjuvante |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Legendas: RC = resposta completa; T = tamanho do tumor; N = linfonodo; RE = receptor de estrogênio; RP = receptor de progesterona: HER2 = fator de crescimento epidérmico humano receptor 2; ILV = invasão linfovascular. (*) p<0,05 = teste exato de Fisher ou qui-quadrado de Pearson. Nota: Dados expressos em forma de frequência absoluta e percentual. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nenhuma das variáveis estudadas influenciou significantemente a taxa de pCR em mama, porém, com relação aos linfonodos, apesar da idade (p=0,661), do estadiamento T (p=0,262) e N (p=0,327), da expressão para receptor de progesterona (p=0,204), do fenótipo (p=0,085), do grau tumoral (p=0,056) e da presença de invasão linfovascular (p=0,823) terem mostrado associação significante com a resposta patológica em linfonodo, pacientes com positividade para HER2 apresentaram uma taxa de resposta patológica objetiva em linfonodo 17,73 vezes maior (IC95%=1,03-334,50) do que os pacientes que apresentavam negatividade para essa proteína (p=0,011), e pacientes negativos para RE apresentaram uma taxa de resposta patológica objetiva em linfonodo 4,36 vezes maior (IC95%=1,16-16,32) do que pacientes com a expressão desse receptor (Tabela 4).
|
Tabela 4. Indicadores de resposta terapêutica objetiva (resposta completa ou resposta parcial) em tumor primário e cadeia linfonodal de mulheres com câncer de mama submetidas à quimioterapia neoadjuvante |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Legendas: T = tamanho do tumor; N = linfonodo; RE = receptor de estrogênio; RP = receptor de progesterona: HER2 = fator de crescimento epidérmico humano receptor 2; ILV = invasão linfovascular. (*) p<0,05 = teste exato de Fisher ou qui-quadrado de Pearson. Nota: Dados expressos em forma de frequência absoluta e percentual. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nos tumores triplo-negativos, nenhuma das variáveis estudadas apresentou associação significante com a pCR ou objetiva em mama ou linfonodos.
DISCUSSSÃO
A abordagem cirúrgica do câncer de mama vem passando por um descalonamento. A princípio, tinha-se a mastectomia radical de Halsted20,21, que consistia na exérese total da mama, musculatura peitoral e cadeias ganglionares axilares. Depois, chegou-se a Patey e Dyson22, com a conservação dos músculos peitorais. Evoluiu-se com a cirurgia conservadora mamária de Veronesi et al.23. Na axila, a regra era o esvaziamento ganglionar axilar até, mais recentemente, com Giuliano et al.7, o advento da BLS, que, mesmo sendo menos invasivo, ainda pode causar sequelas24.
O acometimento linfonodal axilar metastático é um dos principais fatores prognósticos no câncer de mama. Essa informação pode ser obtida com a pesquisa do linfonodo sentinela ou com o esvaziamento axilar. Os dois procedimentos, mesmo que em proporções diferentes, são passiveis de apresentar efeitos adversos, como linfedema, hematoma, seroma e infecções9,22,25.
Com o crescente uso da quimioterapia neoadjuvante, o perfil de tratamento vem mudando e surgem novas informações sobre o comportamento da doença. Estudos recentes demonstraram que a taxa de sobrevivência é mais influenciada pela pCR do que pelo estado clínico inicial, inclusive em pacientes que apresentavam linfonodos axilares positivos antes do tratamento18,26.
O estudo ACOSOG Z107111 mostrou que é viável a realização de BLS em axilas que inicialmente eram clinicamente positivas (cN1) e negativaram pós-quimioterapia neoadjuvante (ycN0)11,13,27,28.
Nesta pesquisa, observou-se uma possível correlação entre a resposta do tumor primário da mama à quimioterapia neoadjuvante e a presença de metástase em linfonodos axilares após esse tratamento.
Pacientes com pCR em mama, neste estudo, apresentaram uma taxa de pCR em linfonodo 20,44 vezes superior à em pacientes que não tiveram a mesma resposta na mama. A informação obtida nesta análise norteia a dedução que, se ocorrer resposta patológica na mama, a BLS tem alta probabilidade de ser negativa, podendo assim ser evitada, juntamente com suas possíveis sequelas e efeitos adversos, sem interferência no tratamento sistêmico e no controle local da doença.
No presente estudo, verificou-se a possibilidade de existirem outros fatores relacionados à resposta da doença axilar à quimioterapia neoadjuvante, sendo analisados: idade, tamanho do tumor (T), comprometimento axilar (N), expressão para receptor de progesterona, receptor de estrogênio, HER2, fenótipo (subtipo molecular), grau tumoral e presença de invasão linfovascular.
Entre as variáveis estudadas, a positividade para HER2 apresentou uma forte associação com a pCR em linfonodos axilares, sendo 36,43 vezes maior com a sua presença. A positividade para HER2 também teve expressão na taxa de pCR na mama, apresentando-se 12,50 vezes maior do que em tumores HER2 negativos. A ausência do receptor de estrogênio foi outro aspecto que interferiu taxa de resposta patológica objetiva em linfonodo, sendo 4,36 vezes maior em pacientes sem a expressão desse receptor.
Estudos publicados anteriormente18,29,30 mostraram que pacientes com tumores triplo-negativos e HER2 positivos, com axilas clinicamente negativas na apresentação (cN0), que tiveram pCR na mama, pós-quimioterapia neoadjuvante, apresentaram uma baixa taxa de positividade na BLS (<2%), sugerindo, para essas duas classes tumorais, uma correlação entre RpC pós-quimioterapia neoadjuvante na mama e negatividade para metástase na pesquisa da BLS.
Nos tumores triplo-negativos da pesquisa, nenhuma das variáveis estudadas apresentou associação significante com a pCR ou objetiva em mama ou linfonodos, não coincidindo com dados publicados em outros trabalhos.
Na literatura, são poucos os marcadores tumorais isolados que são preditivos de pCR. Mas verificou-se que a expressão tumoral de HER2, quando associada à terapia de trastuzumabe e à quimioterapia neoadjuvante, atinge uma taxa de 65% de pCR31. A ausência de expressão de estrogênio é outro marcador descrito, associado à taxa de pCR32. Ambos os fatores influenciam na taxa de pCR e estão de acordo com os dados encontrados nesta pesquisa.
Para conferir a associação do N1 clínico com o linfonodo sentinela pós-quimioterapia neoadjuvante, observou-se se o linfonodo sentinela ressecado continha o clipe metálico posicionado antes da quimioterapia, guiado por ultrassonografia, no mesmo momento da realização da PAAF. Como resultado, o linfonodo sentinela continha o clipe metálico em 90,47% dos casos analisados. A situação de não encontrar o clipe metálico durante o procedimento de BLS pode ser atribuída ao tempo decorrido da quimioterapia e seu possível deslocamento, estatística semelhante à encontrada na literatura17,20,33.
A PAAF e a análise citológica para detecção de células neoplásicas no N1 clínico obtiveram uma taxa de positividade de 68,8%. Todas as PAAF dos linfonodos axilares suspeitos de acometimento neoplásico foram guiadas por ultrassonografia.
Na investigação sobre a existência de correlação entre RcC e pCR, encontrou-se uma taxa de concordância em apenas 52,9%.
A partir de dados obtidos, relacionados ao tipo tumoral e à reposta à quimioterapia neoadjuvante, podem ser selecionadas situações em que a pesquisa do linfonodo sentinela tende a ser negativa e, por conseguinte, predizer a ausência de doença metastática axilar adicional, o que possibilita, nessas situações, evitar o procedimento de BLS e suas sequelas18,34.
CONCLUSÃO
No presente estudo, a resposta patológica na mama, a presença da proteína HER2 e a ausência do receptor de estrogênio no tumor primário mostram efeitos em predizer uma boa resposta axilar à quimioterapia neoadjuvante em pacientes virgens de tratamento, com estadiamentos clínicos T2-T3/N1-N2.
Outros fatores analisados como idade, estadiamento T e N inicial, expressão para receptor de progesterona, Ki-67, subtipos moleculares, grau tumoral e presença de invasão linfovascular não mostraram efeitos na predição de reposta axilar à quimioterapia.
A RcC teve uma baixa correlação com a pCR, não podendo, assim, nortear nenhuma tendência sobre abordagem cirúrgica axilar. Isoladamente, a pCR na mama foi o principal fator relacionado à pesquisa negativa para metástase axilar em linfonodo sentinela.
O estudo, limitado pelo tamanho da amostra, não responde ao questionamento inicial, mas reforça a questão: “É possível evitar a BLS pós-quimioterapia neoadjuvante em pacientes com pCR na mama?”
A pesquisa também forneceu dados relacionados à predição de pCR na mama e axila.
Fazem-se necessários estudos com amostras maiores, estatisticamente significantes, e o seguimento desse grupo de pacientes por um período maior para avaliação de recidiva local, SLD, SG e outros desfechos.
Todos os autores contribuíram substancialmente na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Instituto Nacional de Câncer [Internet]. Rio de Janeiro: INCA; [data desconhecida]. Estimativa; 2022 out 12 [atualizado 2022 nov 23; acesso 2023 jan 16]. Disponível em: https://www.gov.br/inca/pt-br/assuntos/cancer/numeros/estimativa
2. Rastogi P, Anderson SJ, Bear HD, et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27. J Clin Oncol. 2008;26(5):778-85. doi: https://doi.org/10.1200/JCO.2007.15.0235
3. Mauri D, Pavlidis N, Ioannidis JP. Neoadjuvant versus adjuvant systemic treatment in breast cancer: a meta-analysis. J Natl Cancer Inst. 2005;97(3):188-94. doi: https://doi.org/10.1093/jnci/dji021
4. Siso C, Torres J, Esgueva-Colmenarejo A, et al. Intraoperative ultrasound-guided excision of axillary clip in patients with node-positive breast cancer treated with neoadjuvant therapy (ILINA Trial): a new tool to guide the excision of the clipped node after neoadjuvant treatment. Ann Surg Oncol. 2018;25(3):784-91. doi: https://doi.org/10.1245/s10434-017-6270-z
5. Bear HD, Anderson S, Brown A, et al. The effect on tumor response of adding sequential preoperative docetaxel to preoperative doxorubicin and cyclophosphamide: preliminary results from National Surgical Adjuvant Breast and Bowel Project Protocol B-27. J Clin Oncol. 2003;21(22):4165-74. doi: https://doi.org/10.1200/JCO.2003.12.005
6. Bear HD, Anderson S, Smith RE, et al. Sequential preoperative or postoperative docetaxel added to preoperative doxorubicin plus cyclophosphamide for operable breast cancer: National Surgical Adjuvant Breast and Bowel Project Protocol B-27. J Clin Oncol. 2006;24(13):2019-27. doi: https://doi.org/10.1200/JCO.2005.04.1665
7. Giuliano AE, Kirgan DM, Guenther JM, et al. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg. 1994;220(3):391-8. doi: https://doi.org/10.1097/00000658-199409000-00015
8. Carter CL, Allen C, Henson DE. Relation of tumor size, lymph node status, and survival in 24,740 breast cancer cases. Cancer. 1989;63(1):181-7. doi: https://doi.org/10.1002/1097-0142(19890101)63:1<181::AID-CNCR2820630129>3.0.CO;2-H
9. Veronesi U, Paganelli G, Viale G, et al. Sentinel-lymph-node biopsy as a staging procedure in breast cancer: update of a randomised controlled study. Lancet Oncol. 2006;7(12):983-90. doi: https://doi.org/10.1016/S1470-2045(06)70947-0
10. Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. Lancet Oncol. 2010;11(10):927-33. doi: https://doi.org/10.1016/S1470-2045(10)70207-2
11. Boughey JC, Suman VJ, Mittendorf EA, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (alliance) clinical trial. JAMA. 2013;310(14):1455-61. doi: https://doi.org/10.1001/jama.2013.278932
12. Straver ME, Meijnen P, van Tienhoven G, et al. Sentinel node identification rate and nodal involvement in the EORTC 10981-22023 AMAROS trial. Ann Surg Oncol. 2010;17(7):1854-61. doi: https://doi.org/10.1245/s10434-010-0945-z
13. Newman EA, Sabel MS, Nees AV, et al. Sentinel lymph node biopsy performed after neoadjuvant chemotherapy is accurate in patients with documented node-positive breast cancer at presentation. Ann Surg Oncol. 2007;14(10):2946-52. doi: https://doi.org/10.1245/s10434-007-9403-y
14. Lyman GH, Giuliano AE, Somerfield MR, et al. American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer. J Clin Oncol. 2005;23(30):7703-20. doi: https://doi.org/10.1200/JCO.2005.08.001
15. Fisher B, Anderson S, Bryant J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med. 2002;347(16):1233-41. doi: https://doi.org/10.1056/NEJMoa022152
16. Caudle AS, Yang WT, Krishnamurthy S, et al. Improved axillary evaluation following neoadjuvant therapy for patients with node-positive breast cancer using selective evaluation of clipped nodes: implementation of targeted axillary dissection. J Clin Oncol. 2016;34(10):1072-8. doi: https://doi.org/10.1200/JCO.2015.64.0094
17. Donker M, Straver ME, Wesseling J, et al. Marking axillary lymph nodes with radioactive iodine seeds for axillary staging after neoadjuvant systemic treatment in breast cancer patients: the MARI procedure. Ann Surg. 2015;261(2):378-82. doi: https://doi.org/10.1097/SLA.0000000000000558
18. Fayanju OM, Ren Y, Thomas SM, et al. The clinical significance of breast-only and node-only Pathologic Complete Response (pCR) After Neoadjuvant Chemotherapy (NACT): a review of 20,000 breast cancer patients in the National Cancer Data Base (NCDB). Ann Surg. 2018;268(4):591-601. doi: https://doi.org/10.1097/SLA.0000000000002953
19. Conselho Nacional de Saúde (BR). Resolução nº 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos [Internet]. Diário Oficial da União, Brasília, DF. 2013 jun 13 [acesso 2021 ago 1]; Seção 1:59. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/cns/2013/res0466_12_12_2012.html
20. Halsted WS. The results of radical operations for the cure of carcinoma of the breast. Ann Surg. 1907;46(1):1-19. doi: https://doi.org/10.1097/00000658-190707000-00001
21. Halsted WS. The results of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June, 1889, to January, 1894. Ann Surg. 1894;20(5):497-555. doi: https://doi.org/10.1097/00000658-189407000-00075
22. Patey DH, Dyson WH. The prognosis of carcinoma of the breast in relation to the type of operation performed. Br J Cancer. 1948;2(1):7-13. doi: https://doi.org/10.1038/bjc.1948.2
23. Veronesi U, Saccozzi R, Del Vecchio M, et al. Comparing radical mastectomy with quadrantectomy, axillary dissection, and radiotherapy in patients with small cancers of the breast. N Engl J Med. 1981;305(1):6-11. doi: https://doi.org/10.1056/NEJM198107023050102
24. Wilke LG, McCall LM, Posther KE, et al. Surgical complications associated with sentinel lymph node biopsy: results from a prospective international cooperative group trial. Ann Surg Oncol. 2006;13(4):491-500. doi: https://doi.org/10.1245/ASO.2006.05.013
25. Warmuth MA, Bowen G, Prosnitz LR, et al. Complications of axillary lymph node dissection for carcinoma of the breast: a report based on a patient survey. Cancer. 1998;83(7):1362-8. doi: https://doi.org/10.1002/(sici)1097-0142(19981001)83:7<1362::aid-cncr13>3.0.co;2-2
26. Hartmann S, Reimer T, Gerber B, et al. Wire localization of clip-marked axillary lymph nodes in breast cancer patients treated with primary systemic therapy. Eur J Surg Oncol. 2018;44(9):1307-11. doi: https://doi.org/10.1016/j.ejso.2018.05.035
27. Balasubramanian R, Morgan C, Shaari E, et al. Wire guided localisation for targeted axillary node dissection is accurate in axillary staging in node positive breast cancer following neoadjuvant chemotherapy. Eur J Surg Oncol. 2020;46(6):1028-33. doi: https://doi.org/10.1016/j.ejso.2019.12.007
28. García-Novoa A, Acea-Nebril B, Díaz Carballada C, et al. Combining wire localization of clipped nodes with sentinel lymph node biopsy after neoadjuvant chemotherapy in node-positive breast cancer: preliminary results from a prospective study. Ann Surg Oncol. 2021;28(2):958-67. doi: https://doi.org/10.1245/s10434-020-08925-5
29. Kim EY, Byon WS, Lee KH, et al. Feasibility of preoperative axillary lymph node marking with a clip in breast cancer patients before neoadjuvant chemotherapy: a preliminary study. World J Surg. 2018;42(2):582-9. doi: https://doi.org/10.1007/s00268-017-4171-8
30. Liedtke C, Mazouni C, Hess KR, et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol. 2008;26(8):1275-81. doi: https://doi.org/10.1200/JCO.2007.14.4147
31. Buzdar AU, Ibrahim NK, Francis D, et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. J Clin Oncol. 2005;23(16):3676-85. doi: https://doi.org/10.1200/JCO.2005.07.032
32. Green MC, Buzdar AU, Smith T, et al. Weekly paclitaxel improves pathologic complete remission in operable breast cancer when compared with paclitaxel once every 3 weeks. J Clin Oncol. 2005;23(25):5983-92. doi: https://doi.org/10.1200/JCO.2005.06.232
33. Mariscal Martínez A, Vives Roselló I, Salazar Gómez A, et al. Advantages of preoperative localization and surgical resection of metastatic axillary lymph nodes using magnetic seeds after neoadjuvant chemotherapy in breast cancer. Surg Oncol. 2021;36:28-33. doi: https://doi.org/10.1016/j.suronc.2020.11.013
34. Laws A, Dillon K, Kelly BN, et al. Node-positive patients treated with neoadjuvant chemotherapy can be spared axillary lymph node dissection with wireless non-radioactive localizers. Ann Surg Oncol. 2020;27(12):4819-27. doi: https://doi.org/10.1245/s10434-020-08902-y
Recebido em 5/7/2022
Aprovado em 6/10/2022
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer | Ministério da Saúde