RELATO DE CASO
Mucocutaneous Hyperpigmentation Associated with Hydroxyurea Therapy in a Patient with Essential Thrombocythemia: Case Report
Hiperpigmentación Mucocutánea Asociada al Tratamiento con Hidroxiurea en un Paciente con Trombocitemia Esencial: Informe de Caso
doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n1.2995
1Fundação Hemominas. Instituto Oncológico de Juiz de Fora. Centro Universitário Presidente Antônio Carlos (Unipac-JF). Juiz de Fora (MG), Brasil. E-mail: danielawerneckhemato@hotmail.com. Orcid iD: https://orcid.org/0000-0003-3062-2954
2,3,4,5Unipac-JF. Juiz de Fora (MG), Brasil. E-mails: augustoapolinario@gmail.com; thais7_@outlook.com; lucas.niess@gmail.com; lucasmathiasi@hotmail.com. Orcid iD: https://orcid.org/0000-0001-5391-3653; Orcid iD: https://orcid.org/0000-0002-1179-0525; Orcid iD: https://orcid.org/0000-0003-3583-7380; Orcid iD: https://orcid.org/0000-0003-4714-6341
6Hospital Eduardo de Menezes. Belo Horizonte (MG), Brasil. E-mail: nathaliachebli@gmail.com. Orcid iD: https://orcid.org/0000-0003-2745-489X
7Serviço de Dermatologia da Prefeitura Municipal de Juiz de Fora. Juiz de Fora (MG), Brasil. E-mail: monica_dealbuquerque@hotmail.com. Orcid iD: https://orcid.org/0000-0002-7254-4379
8,9Faculdade de Ciências Médicas e da Saúde de Juiz de Fora (Suprema). Juiz de Fora (MG), Brasil. E-mails: nathnoyma@hotmail.com; juliacfabri@gmail.com. Orcid iD: https://orcid.org/0000-0003-0725-7223; Orcid iD: https://orcid.org/0000-0003-4710-3667
Endereço para correspondência: Daniela de Oliveira Werneck Rodrigues. Rua Dr. Antônio Carlos, 430, apto. 1400 – Centro. Juiz de Fora (MG), Brasil. CEP 36010-560. E-mail: danielawerneckhemato@hotmail.com
RESUMO
Introdução: A hiperpigmentação mucocutânea é uma condição dermatológica que pode estar relacionada a tratamentos quimioterápicos, a exemplo das terapias com uso de hidroxiureia (HU). A HU é um fármaco citostático de amplo uso nas doenças mieloproliferativas e compõe a principal linha de tratamento da trombocitemia essencial (TE). O presente estudo tem por objetivo relatar um caso raro de hiperpigmentação mucocutânea em um paciente com TE. Relato do caso: Paciente do sexo masculino, 68 anos de idade, 89 kg, com diagnóstico de TE, em uso de HU 2 g/dia. Com três meses de terapia, apresentou lesões hiperpigmentadas de coloração acastanhadas em pele das mãos e mucosa oral (língua). Em decisão partilhada com o médico-assistente, o paciente optou pela continuação do uso do medicamento. Após seis anos de acompanhamento, as lesões mantêm-se estáveis. Conclusão: A hiperpigmentação mucocutânea associada à terapia com HU é um evento benigno secundário ao uso do fármaco e não exige a interrupção de uso, porém, sua retirada, ou redução das doses, geralmente leva à diminuição ou ao desaparecimento das lesões.
Palavras-chave: hiperpigmentação; hidroxiureia; trombocitemia essencial.
ABSTRACT
Introduction: Mucocutaneous hyperpigmentation is a dermatological condition that may be related to chemotherapy treatments, such as therapies using hydroxyurea (HU). HU is a cytostatic drug widely used in myeloproliferative diseases and is the main line of treatment for essential thrombocythemia (ET). The present study aims to report a rare case of mucocutaneous hyperpigmentation in a patient with ET. Case report: Male patient, 68 years old, 89 kg, diagnosed with ET using HU 2 g/day. After three months of therapy, he presented hyperpigmented brownish-colored lesions on the hands and oral cavity (tongue). In a decision shared with the assistant physician, the patient chose to continue using the drug. After six years of follow-up, the lesions remain stable. Conclusion: Mucocutaneous hyperpigmentation associated with HU therapy is a benign event secondary to the use of the drug and does not require discontinuation of use, however, its withdrawal or dose reduction usually leads to the reduction or disappearance of the lesions.
Key words: hyperpigmentation; hydroxyurea; thrombocythemia, essential.
RESUMEN
Introducción: La hiperpigmentación mucocutánea es una condición dermatológica que puede estar relacionada con tratamientos de quimioterapia, como las terapias con hidroxiurea (HU). La HU es un fármaco citostático ampliamente utilizado en enfermedades mieloproliferativas y es la principal línea de tratamiento de la trombocitemia esencial (TE). El presente estudio tiene como objetivo reportar un caso raro de hiperpigmentación mucocutánea en un paciente con TE. Informe del caso: Paciente masculino de 68 años, 89 kg, diagnosticado de TE mediante HU 2 g/día. A los tres meses de tratamiento presenta lesiones hiperpigmentadas de color pardusco en manos y cavidad oral (lengua). En una decisión compartida con el médico asistente, el paciente optó por continuar usando el medicamento. Tras seis años de seguimiento, las lesiones se mantienen estables. Conclusión: La hiperpigmentación mucocutánea asociada a la terapia con HU es un evento benigno secundario al uso del fármaco y no requiere la suspensión de su uso, sin embargo, su retirada o reducción de dosis suele conducir a la reducción o desaparición de las lesiones.
Palabras clave: hiperpigmentación; hidroxiurea; trombocitemia esencial.
INTRODUÇÃO
A hidroxiureia (HU) é um fármaco citostático que inibe a enzima ribonucleotídeo redutase na fase S da replicação celular bloqueando a síntese de DNA e a divisão celular1-3. A HU possui amplo uso nas doenças mieloproliferativas atuando como um agente mielossupressor reversível com eficácia na redução da contagem de plaquetas, com baixo nível de toxicidade hepatorrenal e poucas interações medicamentosas1,3-8.
Os efeitos adversos da HU são dose-dependentes e reversíveis em até 43% dos casos7,9,10. Tecidos com alta taxa de renovação celular, como a pele, mucosas e unhas, são sítios-alvo de ação da droga11. No Quadro 1, estão descritos os efeitos adversos dermatológicos relacionados ao uso da HU2,3,6,7,9,10.
|
Quadro 1. Manifestações dermatológicas e estomatológicas secundárias ao uso de hidroxiureia |
||||
|
A notificação da toxicidade cutânea decorrente da HU é subestimada, visto que a clínica apresentada não é exuberante e possui curso benigno7,10. A melanoníquia constitui a maioria dos casos reportados, e a hiperpigmentação da cavidade oral envolvendo ou não a língua é rara1,3,7,12.
Trombocitemia essencial (TE) é uma neoplasia mieloproliferativa crônica de caráter clonal caracterizada por contagem de plaquetas maior ou igual a 450.000/µL em duas ocasiões distintas; presença de pelo menos uma mutação dos genes Janus kinase 2 (JAK2), calreticulin (CALR) e/ou muscle lim protein (MPL) e exclusão de outras etiologias determinantes de trombocitose4,13. A avaliação da medula óssea é essencial para a realização do diagnóstico diferencial4. A TE se manifesta com eritromelalgia, fenômenos trombóticos, principalmente arteriais, hemorragias e risco de aborto espontâneo4,14.
No tratamento da TE, sugere-se ácido acetilsalicílico para prevenção trombótica em idosos e pacientes que não possuem alto risco para trombose. Caso contrário, a primeira linha de tratamento é a HU, seguida do alfa-interferon peguilado4. Pacientes com contagem plaquetária menor que 150.000/µL não devem receber terapia citorredutora14. A HU, apesar de não modificar a história natural, não prevenir a progressão fibrótica ou leucêmica e não prolongar a sobrevida, é indicada para a prevenção de complicações trombóticas, principalmente nos portadores de mutação JAK24,14.
Os autores relatam um tipo de hiperpigmentação mucocutânea secundária ao uso de HU em paciente com TE, comparam-no com demais relatos de hiperpigmentação de mucosa oral com envolvimento ou não de língua associados à HU, e discutem a literatura sobre a temática. Foi realizada uma breve revisão narrativa da literatura utilizando-se dos bancos de dados PubMed e SciELO, com os descritores “hiperpigmentação” e “hidroxiureia”, em português e inglês, e envolvendo artigos originais, de revisão e relatos de casos publicados entre 1974 e julho/2022. O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Centro Universitário Presidente Antônio Carlos (Unipac-JF), sob o número de parecer 5.515.386 (CAAE: 59254322.0.0000.5156).
RELATO DO CASO
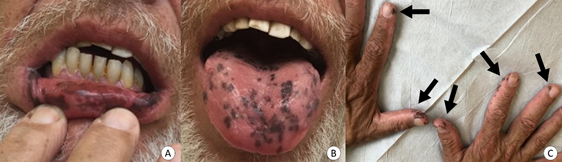
Homem, 68 anos, 89 kg, pardo, com quadro de esplenomegalia em março/2016, apresentando baço com 14,5 cm em seu maior diâmetro em exame ultrassonográfico, encaminhado para avaliação do Serviço de Hematologia. Três exames laboratoriais realizados com 60 dias de intervalo entre eles evidenciaram plaquetose persistente (549.000/µL, 650.000/µL, 1.000.000/µL), elevação dos níveis de desidrogenase láctica (549 UI/L, 690 UI/L e 720 UI/L) e beta2-microglobulina (3,1 g/mL, 3,7 g/mL e 3,8 g/mL), exames relacionados a doenças proliferativas. Foi submetido à biópsia de medula óssea que mostrou hiperplasia megacariocítica. A pesquisa da mutação do JAK2 foi positiva com cariótipo medular normal e rearranjo BCR-ABL negativo. O diagnóstico de TE foi confirmado e o paciente, orientado sobre efeitos adversos da HU por meio do Termo de Consentimento Livre e Esclarecido (TCLE). Após elucidado, autorizou o início do tratamento. Três meses depois, o paciente evoluiu com aparecimento de lesões acastanhadas em mucosa labial, dorso de língua e mãos (Figura 1).
|
|
|
Figura 1. A) hiperpigmentação da mucosa labial; B) hiperpigmentação da superfície dorsal da língua; C) mãos com manchas hipercrômicas no dorso e região palmar, sem envolvimento ungueal associado (setas pretas) |
O paciente já havia sido informado sobre os efeitos adversos da HU e optou pela manutenção do fármaco. Encontra-se em controle há seis anos realizando consultas mensais com hematologista e anuais com dermatologista, em uso de HU 2 g/dia, com bom estado geral, correção da contagem plaquetária e hiperpigmentações mucocutâneas com mesmo aspecto inicial.
DISCUSSÃO
De acordo com o conhecimento dos autores do presente estudo, mundialmente, este relato corresponde ao 12º apresentando hiperpigmentação oral associada à terapia de HU. O Quadro 21,3,8,12,15-21 compara os relatos com acometimento de mucosa oral envolvendo ou não a língua.
|
Quadro 2. Relatos de casos de hiperpigmentação de mucosa oral e/ou língua por hidroxiureia |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(*) Para surgimento da hiperpigmentação. |
A toxicidade cutânea não ulcerativa induzida por HU ocorre em apenas 1,6% dos pacientes22. Entretanto, 96% dos pacientes com doenças mieloproliferativas podem ter lesões cutâneas pela HU, e a hiperpigmentação induzida pode chegar a 50%8,23. Dos 12 relatos de hiperpigmentação mucocutânea de cavidade oral com envolvimento de língua ou não, dez possuem, como doença-base, doenças mieloproliferativas1,3,12,15,16,18-21.
Não há relação estabelecida entre a dose de HU, tempo de uso e surgimento de hiperpigmentação1,3. Ainda, tais lesões cutâneas não possuem distribuição previsível3,7,10. Os efeitos colaterais dermatológicos são mais prevalentes em tratamentos de longo prazo e acredita-se que exista predisposição genética correlacionada à ocorrência3,9-11,22. Dos 12 relatos apresentados no Quadro 21,3,8,12,15-21, o tempo médio de surgimento de hiperpigmentação foi de um ano e seis meses, com moda de três meses. Houve discreta prevalência do sexo masculino. Com relação à idade de acometimento, a média de 11 casos relatados foi de 54,6 anos, com modas de 61 e 68. Com relação à dose de HU, a média das doses não foi estabelecida em virtude da variação de dose por dia ou ausência dessa informação nos relatos de alguns pacientes1,3,8,12,15-21.
Os pacientes que fazem uso do fármaco por longo período devem fazer acompanhamento com dermatologista2,11. E, diante da possibilidade de transformação maligna da ceratose actínica, entendida como uma possível manifestação de maior complexidade relacionada à HU, consultas de controle com dermatologista são de extrema importância2,11. Destarte, o paciente do atual relato realiza consultas anuais com dermatologista.
A pigmentação mucocutânea secundária à terapia com HU não exige a interrupção do tratamento; a retirada ou redução das doses pode diminuir ou determinar o desaparecimento das lesões7,10,11. Em comum acordo entre o hematologista e o paciente relatado, diante das particularidades do caso, foi mantida a dose de HU no tratamento, sendo observada ausência de progressão ou regressão das lesões.
CONCLUSÃO
A elucidação dos pacientes sobre os possíveis efeitos adversos da HU antes do início da terapêutica pode minimizar ou mitigar a ansiedade em face da sua ocorrência. Ressalta-se que a hiperpigmentação mucocutânea associada à terapia com HU é de caráter benigno, sem padrão de dose relacionado ao evento e não exige a interrupção de uso do fármaco. É rara a ocorrência em cavidade oral, porém, quando ocorre, a língua é o sítio mais comum, e os pacientes mais acometidos são os diagnosticados com TE.
CONTRIBUIÇÕES
Daniela de Oliveira Werneck Rodrigues, Augusto Cézar Apolinário dos Santos, Nathália Chebli de Abreu e Monica Albuquerque Costa contribuíram na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica. Thais Sette Espósito, Lucas Augusto Niess Soares Fonseca, Lucas Barra Mathiasi; Nathalia Noyma Sampaio Magalhães e Júlia Campos Fabri contribuíram na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados. Todos os autores aprovaram a versão final a ser publicada.
AGRADECIMENTOS
À Liga Acadêmica de Hematologia (HemoLiga) e ao Serviço de Onco-Hematologia do Instituto Oncológico, ambos de Juiz de Fora.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Neculiseanu E, Harewood J, Sidhu G. Hydroxyurea-induced tongue hypermelanosis and transverse melanonychia. Cureus. 2019;11(12):e6311. doi: https://doi.org/10.7759/cureus.6311
2. Simeonovski V, Breshkovska H, Duma S, et al. Hydroxyurea associated cutaneous lesions: a case report. Open Access Maced J Med Sci. 2018;6(8):1458-61. doi: https://doi.org/10.3889/oamjms.2018.320
3. Veillet-Lemay G, Haber RM. Hydroxyurea-induced oral hyperpigmentation: a case report and review of the literature. J Cutan Med Surg. 2018;23(1):111-3. doi: https://doi.org/10.1177/1203475418803074
4. Tefferi A, Vannucchi AM, Barbui T. Essential thrombocythemia treatment algorithm 2018. Blood Cancer J. 2018;8(2). doi: https://doi.org/10.1038/s41408-017-0041-8
5. Cortelazzo S, Finazzi G, Ruggeri M, et al. Hydroxyurea for patients with essential thrombocythemia and a high risk of thrombosis. N Engl J Med. 1995;332(17):1132-7. doi: https://doi.org/10.1056/NEJM199504273321704
6. Lee KP, Vangipuram RK, Klimas NK, et al. Hydroxyurea-induced hyperpigmentation with iron deposition. Dermatol Online J. 2019;25(10):9. doi: https://doi.org/10.5070/D32510045820
7. Bulte CA, Hoegler KM, Kutlu Ö, et al. Hydroxyurea: a reappraisal of its cutaneous side effects and their management. Int J Dermatol. 2021;60(7):810-7. doi: https://doi.org/10.1111/ijd.15302
8. Kumar B, Saraswat A, Kaur I. Mucocutaneous adverse effects of hydroxyurea: a prospective study of 30 psoriasis patients. Clin Exp Dermatol. 2002;27(1):8-13. doi: https://doi.org/10.1046/j.0307-6938.2001.00947.x
9. Kennedy BJ, Smith LR, Goltz RW. Skin changes secondary to hydroxyurea therapy. Arch Dermatol. 1975;111(2):183-187. doi: https://doi.org/10.1001/archderm.1975.01630140041002
10. Serrano-Falcón C, Pugnaire MAF, Del Mar Serrano-Falcón M, et al. Toxicoderma caused by hydroxyurea. Int J Dermatol. 2011;50(11):1435-7. doi: https://doi.org/10.1111/j.1365-4632.2010.04517.x
11. Salmon-Ehr V, Leborgne G, Vilque JP, et al. Effets secondaires cutanés de l’hydroxyurée: étude prospective de 26 patients consultant dans un service de dermatologie. Rev Med Interne. 2000;21(1):30-4. doi: https://doi.org/10.1016/S0248-8663(00)87226-4
12. Alshammasi B, Albasry Z, Meshikhes F. Oral hyperpigmentation associated with hydroxyurea in a patient with polycythemia vera: a case report. Clin Case Rep. 2020;8(10):1904-9. doi: https://doi.org/10.1002/ccr3.3012
13. Barbui T, Thiele J, Gisslinger H, et al. The 2016 revision of WHO classification of myeloproliferative neoplasms: clinical and molecular advances. Blood Rev. 2016;30(6):453-9. doi: https://doi.org/10.1016/j.blre.2016.06.001
14. Godfrey AL, Campbell PJ, MacLean C, et al. Hydroxycarbamide plus aspirin versus aspirin alone in patients with essential thrombocythemia age 40 to 59 years without high-risk features. J Clin Oncol. 2018;36(34):3361-9. doi: https://doi.org/10.1200/JCO.2018.78.8414
15. Majumdar G, Heard SE, Slater NG. Reversible hyperpigmentation associated with high dose hydroxyurea. BMJ. 1990;300(6737):1468. doi: https://doi.org/10.1136/bmj.300.6737.1468-c
16. Gropper CA, Don PC, Sadjadi MM. Nail and skin hyperpigmentation associated with hydroxyurea therapy for polycythemia vera. Int J Dermatol. 1993(10):731-3. doi: https://doi.org/10.1111/j.1365-4362.1993.tb02745.x
17. Laughon SK, Shinn LL, Nunley JR. Melanonychia and mucocutaneous hyperpigmentation due to hydroxyurea use in an HIV-infected patient. Int J Dermatol. 2000;39(12):928-31. doi: https://doi.org/10.1046/j.1365-4362.2000.00988-2.x
18. Issaivanan M, Mitu PS, Manisha C, et al. Cutaneous manifestations of hydroxyurea therapy in childhood: case report and review. Pediatr Dermatol. 2004;21(2):124-7. doi: https://doi.org/10.1111/j.0736-8046.2004.21207.x
19. Nofal A, El-Din ES. Hydroxyurea-induced dermatomyositis: true amyopathic dermatomyositis or dermatomyositis-like eruption? Int J Dermatol. 2012;51(5):535-41. doi: https://doi.org/10.1111/j.1365-4632.2011.05105.x
20. Murray NP, Echavarría M, Reculé F, et al. Acquired hyperpigmentation of the tongue associated with hydroxyurea: case report of a very rare location of a rare adverse effect. Glob J Dermatol Venereol. 2016;4(1):12-3. doi: https://doi.org/10.12970/2310-998X.2016.04.01.3
21. Algarra AC, Miguel RA, Romero FT, et al. Mucocutaneous lesions and nail pigmentation in a patient with essential thrombocytosis. Aust Fam Physician [Internet]. 2017 [cited 2022 June 30];46(4):222-4. Available from: https://www.racgp.org.au/afp/2017/april/mucocutaneous-lesions-and-nail-pigmentation-in-a-p
22. Latagliata R, Spadea A, Cedrone M, et al. Symptomatic mucocutaneous toxicity of hydroxyurea in Philadelphia chromosome-negative myeloproliferative neoplasms: the Mister Hyde Face of a safe drug. Cancer. 2012;118(2):404-9. doi: https://doi.org/10.1002/cncr.26194
23. Cozzani E, Iurlo A, Merlo G, et al. Essential thrombocythemia: the dermatologic point of view. Clin Lymphoma Myeloma Leuk. 2015;15(12):739-47. doi: https://doi.org/10.1016/j.clml.2015.08.086
Recebido em 24/7/2022
Aprovado em 3/10/2022
Editor-associado: Daniel Cohen Goldemberg. Orcid iD: https://orcid.org/0000-0002-0089-1910
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer | Ministério da Saúde