REVISÃO DA LITERATURA
Gengibre (Zingiber officinale) no Manejo de Náuseas e Vômitos Induzidos por Quimioterapia em Pacientes com Câncer: Revisão Integrativa da Literatura
Ginger (Zingiber officinale) in the Management of Chemotherapy-Induced Nausea and Vomiting in Cancer Patients: Integrative Literature Review
Jengibre (Zingiber officinale) en el Tratamiento de las Náuseas y los Vómitos Inducidos por la Quimioterapia en Pacientes con Cáncer: Revisión Integradora de la Literatura
doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n2.3592
Wagner Andrade Ferreira1; Vivian dos Santos Neves2; Maria Angélica Fiut3; Emília Delesderrier Franco4; Cláudia dos Santos Cople Rodrigues5
1,2Instituto Nacional de Câncer (INCA). Rio de Janeiro (RJ), Brasil. E-mails: wagnerandradenutri@gmail.com; nevesvivian96@gmail.com. Orcid iD: https://orcid.org/0000-0002-6816-9633; Orcid iD: https://orcid.org/0000-0002-1145-6981
3Associação Brasileira de Fitoterapia (Abfit). Rio de Janeiro (RJ), Brasil. E-mail: angelicafiut@bol.com.br. Orcid iD: https://orcid.org/0000-0003-1935-6341
4,5Universidade do Estado do Rio de Janeiro (Uerj). Rio de Janeiro (RJ), Brasil. E-mails: emiliadeles@gmail.com; claudiacople@gmail.com. Orcid iD: https://orcid.org/0000-0002-5787-867X; Orcid iD: https://orcid.org/0000-0001-9497-556X
Endereço para correspondência: Wagner Andrade Ferreira. Praça Cruz Vermelha, 23 – Centro. Rio de Janeiro (RJ), Brasil. CEP 20230-130. E-mail: wagnerandradenutri@gmail.com
RESUMO
Introdução: Náuseas e vômitos induzidos por quimioterapia (NVIQ) são importantes efeitos colaterais dos tratamentos antineoplásicos. Algumas plantas medicinais vêm sendo estudadas no manejo desses efeitos, como o gengibre (Zingiber officinale). Objetivo: Realizar uma revisão acerca do uso via oral do gengibre no manejo de NVIQ em pacientes com câncer. Método: Revisão integrativa da literatura realizada na base de dados MEDLINE, em setembro de 2022, adotando a combinação das palavras-chave “Zingiber officinale” e “Cancer”. Foram também aplicados filtros na seleção para incluir ensaios clínicos aleatórios publicados entre 2012 e 2022. Resultados: Ao todo, foram analisados nove estudos. O gengibre apresenta potencial de reduzir NVIQ em pacientes com câncer, refletindo positivamente na qualidade de vida e na melhora do apetite e da fadiga. Os estudos não observaram efeitos adversos da administração do gengibre. Conclusão: O uso por via oral do gengibre demonstra ser uma estratégia segura para o manejo de NVIQ em pacientes com câncer, na dose de 1 g/dia do gengibre em pó, podendo ser utilizado como terapia complementar juntamente com regimes antieméticos padrões.
Palavras-chave: neoplasias/tratamento farmacológico; gengibre/efeitos adversos; plantas medicinais; fitoterapia.
ABSTRACT
Introduction: Chemotherapy-induced nausea and vomiting (CINV) are important side effects of antineoplastic treatments. Some medicinal plants have been studied in the management of these effects, such as ginger (Zingiber officinale). Objective: Review the oral use of ginger in the management of CINV in cancer patients. Method: Integrative literature review carried out at the MEDLINE database, in September 2022, utilizing the combination of the keywords “Zingiber officinale” and “Cancer”, filters were also applied to include randomized clinical trials published between 2012 and 2022. Results: In all, nine studies were analyzed. Ginger has the potential to reduce CINV in cancer patients, reflecting positively on quality-of-life, improved appetite and fatigue. The studies have not found any adverse effect after administering ginger. Conclusion: The oral use of ginger proves to be an effective strategy for the management of CINV in cancer patients, in the dosage regimen of 1 g/day of powdered ginger, and can be used as a complementary therapy along with standard antiemetic regimens.
Key words: neoplasms/drug therapy; ginger/adverse effects; plants, medicinal; phytotherapy.
RESUMEN
Introducción: Las náuseas y los vómitos inducidos por la quimioterapia (NVIQ) son efectos secundarios importantes de los tratamientos antineoplásicos. Se han estudiado algunas plantas medicinales en el manejo de estos efectos, como el jengibre (Zingiber officinale). Objetivo: Realizar una revisión integradora de la literatura sobre el uso oral del jengibre en el manejo de las NVIQ en pacientes oncológicos. Método: Revisión integradora de la literatura realizada en la base de datos MEDLINE, en septiembre de 2022, adoptando la combinación de las palabras clave “Zingiber officinale” y “Cancer”. También se aplicaron filtros en la selección para incluir ensayos clínicos aleatorizados publicados entre 2012 y 2022. Resultados: En total, se analizaron nueve estudios. El jengibre tiene el potencial de reducir las NVIQ en pacientes con cáncer, lo que se refleja positivamente en la mejora de la calidad de vida, apetito y fatiga. Los estudios no han observado ningún efecto adverso por la administración del jengibre. Conclusión: El uso del jengibre por vía oral demuestra ser una estrategia segura para el manejo de NVIQ en pacientes con cáncer, usando una dosis de 1 g/día de jengibre en polvo, y puede usarse como terapia complementaria junto con los regímenes antieméticos estándar.
Palabras clave: neoplasias/tratamiento farmacológico; jengibre/efectos adversos; plantas medicinales; fitoterapia.
INTRODUÇÃO
O câncer é um termo que abrange um conjunto de mais de 100 diferentes tipos de doenças malignas cujo ponto em comum é o crescimento desordenado de células com potencial de invasão tecidual e de atingir órgãos a distância1. A International Agency for Research on Cancer estimou em 18,1 milhões de novos casos de câncer em todo o mundo no ano de 2020, excluindo câncer de pele não melanoma2. No Brasil, foi estimado que, para cada ano do triênio 2023-2025, ocorrerão 704 mil casos novos de câncer3.
Indivíduos com câncer podem apresentar desnutrição proteico-calórica, desencadeada pelo próprio tratamento antineoplásico. Existem diversas terapêuticas para o câncer, entre elas: quimioterapia, radioterapia, imunoterapia e cirurgia4. A quimioterapia é caracterizada pelo uso de agentes químicos que levam à morte das células em rápida divisão, sejam elas cancerígenas ou não5.
A manutenção e/ou recuperação do estado nutricional desempenha papel fundamental na qualidade de vida e no bem-estar do paciente em quimioterapia, visto que a toxicidade promovida pelo tratamento está associada com o surgimento de efeitos adversos, como as náuseas e os vômitos. A presença desses sintomas compromete a ingestão alimentar e, consequentemente, a eficácia do tratamento e a sobrevida subsequente6.
As náuseas e vômitos induzidos por quimioterapia (NVIQ) são um dos principais efeitos colaterais dos tratamentos antineoplásicos. Por isso, é necessário o controle desses sintomas para promover o melhor tratamento sob o menor impacto na qualidade de vida dos pacientes em quimioterapia, principalmente para os que recebem drogas de alto potencial emetogênico6.
Algumas plantas medicinais vêm sendo estudadas no manejo das náuseas e dos vômitos, como o gengibre (Zingiber officinale), pois apresenta os compostos fenólicos, gingeróis e shogaóis, que agem no trato digestivo, estimulando o peristaltismo e o tônus intestinal7. O uso de plantas medicinais na prática clínica vem ganhando reconhecimento desde a implementação da Política Nacional de Práticas Integrativas e Complementares (PNPIC) que reforçou a utilização da fitoterapia8.
Acredita-se que o gengibre possa ser uma intervenção capaz de melhorar as náuseas e os vômitos das pessoas em tratamento quimioterápico, como descrito em estudos recentes, mas ainda há uma lacuna a respeito das posologias ideais que permitam sua prescrição juntamente com regimes antieméticos6,9. Assim, o presente estudo teve por objetivo realizar uma revisão integrativa da literatura sobre o uso via oral do gengibre (Zingiber officinale) no manejo de NVIQ em pacientes com câncer.
MÉTODO
Foi realizada uma revisão integrativa da literatura científica, incluindo ensaios clínicos randomizados publicados nos últimos dez anos. Para a realização deste estudo, seguiram-se as etapas: definição da pergunta norteadora; elaboração dos critérios de inclusão e exclusão dos artigos para realização da busca na literatura; extração das evidências dos artigos; análise crítica dos estudos incluídos; discussão dos resultados e apresentação da revisão integrativa10.
A pergunta norteadora da pesquisa foi “O gengibre pode ser utilizado como uma estratégia para o manejo de NVIQ em pacientes com câncer?”. Adotou-se o método PICOT para delimitação dos critérios de inclusão e de exclusão dos estudos, em que a população (P) são os pacientes com câncer, a intervenção (I) diz respeito ao uso do gengibre, a comparação (C) entre um grupo que recebeu gengibre e outro placebo (controle), os desfechos (O) referem-se à melhora na náuseas e vômitos, e o tipo de estudo (T) trata dos ensaios clínicos randomizados.
A busca dos artigos foi realizada na base de dados MEDLINE, em setembro de 2022, adotando a combinação das palavras-chave “Zingiber officinale” e “Cancer”, por meio do operador booleano AND, formando o seguinte conjunto de busca: “Zingiber officinale AND Cancer”. Foram aplicados também os filtros para seleção de somente ensaios clínicos randomizados publicados no período entre os anos de 2012 a 2022.
Os critérios de inclusão para a seleção dos artigos foram: ensaios clínicos randomizados disponíveis na íntegra com intervenção por via oral do gengibre para o manejo de náuseas e de vômitos em pessoas com câncer em quimioterapia. Foram excluídos os estudos não disponíveis na íntegra, intervenções feitas por meio de outras práticas integrativas e complementares em saúde (PICS) que não a fitoterapia, os publicados em outro idioma que não fosse o inglês e o português e as pesquisas em andamento. Após a exclusão, os artigos foram analisados por dois avaliadores independentes, que incluíram, na amostra final, apenas os artigos que respondiam integralmente à pergunta norteadora.
Dos artigos, foram extraídos os seguintes itens: autores, ano, desenho do estudo, população, intervenção, duração e desfecho. Na fase de análise e síntese, foi realizada a etapa de leitura crítica, selecionando os dados que atendessem ao objetivo da revisão. O presente estudo reuniu e sintetizou os ensaios clínicos randomizados de forma organizada para apresentação em forma de quadro e a interpretação dos principais resultados encontrados.
RESULTADOS
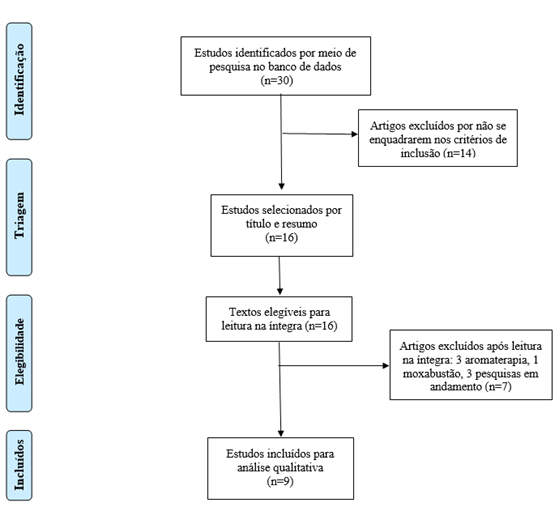
Foram encontrados 30 artigos no levantamento inicial. Após as etapas de seleção e de elegibilidade, a amostra final foi constituída por nove trabalhos (Figura 1). Quanto ao ano de publicação, destaca-se que, em 2016 e 2017, houve duas e quatro publicações respectivamente, enquanto nos anos de 2015, 2018 e 2020 só teve um trabalho publicado em cada ano.
|
|
|
Figura 1. Fluxograma da estratégia de busca proposto pelo checklist PRISMA |
Em relação ao idioma, todos os estudos foram publicados na língua inglesa. Encontraram-se quatro trabalhos com pacientes com câncer de mama, dois com pacientes com tumores sólidos, um com pacientes com câncer de pulmão, um com câncer ginecológico e um com diferentes tipos de tumores submetidos à quimioterapia moderada ou altamente emetogênica. Destaca-se o sexo feminino nos estudos selecionados, dado os tipos de neoplasias encontradas, como o câncer de mama e os tumores ginecológicos.
No Quadro 111-19, estão sintetizadas as informações dos estudos incluídos (autores, ano, desenho do estudo, população, tipo de intervenção, duração da intervenção e principais resultados encontrados).
|
Quadro 1. Características gerais dos ensaios clínicos randomizados incluídos na revisão |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Os nove artigos investigaram ao todo 1.022 pessoas, concentradas nos diferentes tipos de câncer de mama, ginecológico e tumores sólidos. A posologia ofertada variou de 10 mg a 2.000 mg, sendo administrada na forma de planta medicinal em pó (500 mg a 2.000 mg) ou extrato seco padronizado (10 mg a 500 mg). A duração dos estudos teve grande variabilidade, por exemplo, de um a cinco dias antes da quimioterapia até três dias a 12 semanas após a quimioterapia, destacando-se cinco dias de duração da intervenção após o ciclo de quimioterapia.
O uso do gengibre via oral, apesar de apresentar potencial de reduzir NVIQ em pacientes com câncer, ainda apresenta resultados conflitantes variando de acordo com o tipo de câncer e do quimioterápico utilizado. Contudo, os estudos afirmam que não foram observados efeitos adversos da sua administração.
DISCUSSÃO
As informações coletadas na presente revisão não foram suficientes para identificar a posologia nem a forma de apresentação ideal que poderiam contribuir no manejo de NVIQ. Nos estudos analisados, observou-se que doses inferiores a 500 mg/dia de gengibre, na forma de pó de planta ou extrato seco padronizado, não foram suficientes para reduzir a gravidade e frequência de NVIQ em diferentes tipos de tumores e regimes de quimioterapia. Em intervenções com doses superiores a 500 mg/dia e inferiores a 2 g/dia do gengibre em pó, houve redução da gravidade e da frequência das NVIQ. Esses resultados apresentam baixa confiança em razão da heterogeneidade dos estudos.
O gengibre tem sido estudado em pacientes com câncer de mama durante a quimioterapia. Na presente revisão, foram identificados quatro trabalhos nessa população. O trabalho de Thamlikitkul et al.16 evidenciou segurança do uso de gengibre em pó na posologia de 500 mg duas vezes ao dia. Porém, o seu uso não demonstrou benefício na redução da gravidade da náusea em mulheres recebendo adriamicina-ciclofosfamida, mesmo que uma dose similar tenha controlado efetivamente a náusea aguda20.
Os estudos parecem demonstrar que o efeito do gengibre varia de acordo com o tipo de câncer e esquema de quimioterapia estudada. Ansari et al.17 observaram que as pacientes com câncer de mama que receberam gengibre durante os ciclos de doxorrubicina-ciclofosfamida tiveram menos vômitos, mas tal efeito não foi significativo para outros regimes de quimioterapia. Tais achados também foram observados por Sanaati et al.18, com resultados positivos na frequência de vômitos, quando foram utilizados gengibre e camomila, mas destacaram o gengibre (1 g/dia) na redução da frequência de náuseas.
O estudo de Arslan e Ozdemir19 demonstrou a eficácia do gengibre (1 g/dia) nos primeiros três dias de quimioterapia, na promoção da redução da gravidade de náuseas em mulheres com câncer de mama que receberam antraciclina. Por outro lado, quando se trata de tumores ginecológicos, a literatura científica ainda é escassa, mas estudos estão em andamento, como o ensaio clínico de Silva et al.21 com pacientes brasileiras diagnosticadas com câncer do colo uterino tratadas com cisplatina associada à radioterapia e que usaram gengibre para NVIQ.
A adição do gengibre em pó na terapia antiemética padrão de pacientes com câncer ginecológico em regime de quimioterapia com carboplatina e paclitaxel foi eficiente no manejo da náusea aguda11. Tal efeito também foi observado quando se utilizou a decocção de gengibre em conjunto com o regime antiemético padrão em mulheres com câncer ginecológico recebendo regimes à base de cisplatina22.
Tian et al.23, em um estudo experimental com modelos animais com náuseas e vômitos induzidos por cisplatina, em que foi ofertado gingerol em doses baixas, médias e altas, observaram efeito benéfico e dose-dependente do gingerol na melhora dos sintomas. No entanto, ressalta-se que, nesse trabalho, foi ofertado o princípio ativo isolado e não o fitoterápico.
Já em um ensaio clínico randomizado, duplo-cego e controlado, realizado com pacientes com diferentes tipos de tumores não sólido, sólido, de pulmão, entre outros, recebendo cisplatina em combinação com outros agentes quimioterápicos, o uso do gengibre não foi capaz de reduzir as náuseas e vômitos ao ser adicionado (1 g/dia de gengibre em pó) ao tratamento antiemético padrão24. De forma semelhante, os ensaios clínicos de Li et al.12 e Bossi et al.13, que utilizaram o rizoma do gengibre na forma de extrato seco padronizado, também não observaram benefícios quando utilizado concomitantemente ao tratamento com cisplatina.
O gengibre apresenta alguns óleos essenciais entre seus constituintes químicos, sendo os gingeróis e shogaóis os principais. O provável mecanismo de ação para os efeitos benéficos encontrados por Tian et al.23 é a supressão dos níveis de substâncias P e receptores neurocinina-1 (NK1) na área postrema e do íleo. Além disso, o 6-, o 8- e o 10-gingerol e o 6-shogaol exercem sua ação antiemética por meio de antagonismo no receptor 5HT3 do sistema nervoso central que, quando ativado, induz náuseas e vômitos25,26.
Reconhece-se que as náuseas e vômitos pioram a qualidade de vida do paciente com câncer em quimioterapia, por isso, o seu manejo com plantas medicinais se torna relevante na prática clínica6. Desse modo, Bossi et al.13 observaram benefício do uso do gengibre nas atividades de vida diária em mulheres e em pessoas com câncer de cabeça e pescoço, que são consideradas os grupos mais vulneráveis para o desenvolvimento de náuseas e vômitos.
Em três artigos13-15 incluídos na presente revisão, foi investigada a associação entre a suplementação de gengibre e a melhora da fadiga. Enquanto Bossi et al.13 não acharam diferença no questionário Brief Fatigue Inventory (BFI) com o uso do gengibre, Konmun et al.14 e Marx et al.15 encontraram melhora da fadiga com o uso do extrato seco de gengibre. Um ensaio clínico com 162 pacientes em tratamento quimioterápico e randomizados para receber o placebo vs. 1 g ou 2 g de extrato seco de gengibre padronizado em 5% de gingeróis diariamente obteve menos queixas de fadiga nos grupos tratados com gengibre27.
Os trabalhos feitos com extrato seco padronizado com doses de até 300 mg/dia foram efetivos na melhora da qualidade de vida, do apetite e da fadiga, provavelmente em razão dos efeitos anti-inflamatórios do gengibre. No entanto, nenhum dos estudos que avaliou a fadiga e o apetite fez o mesmo para os marcadores inflamatórios. Nos estudos com gengibre em pó e em extrato seco padronizado, sugerem-se maiores investigações relacionadas à meia-vida de eliminação dessas formas farmacêuticas, visto que tal fato provavelmente está influenciando no manejo de NVIQ. Esses estudos não descreveram o fracionamento mais indicado, contudo, a maioria deles ofereceu duas vezes ao dia.
O presente estudo apresenta algumas limitações, como a dificuldade de comparação do tempo de duração da intervenção entre os estudos e heterogeneidade quanto à posologia e à forma de apresentação do gengibre ofertado, bem como a duração da intervenção nos artigos inseridos. Entre as fontes de heterogeneidade clínica, destacam-se também os diferentes esquemas antieméticos, bem como tipos de câncer e, consequentemente, tipos de protocolos de quimioterapia, além de protocolos de intervenção distintos entre si (dose, tempo e forma farmacêutica).
CONCLUSÃO
O uso do gengibre por via oral demonstrou ser uma estratégia segura para o manejo de NVIQ em pacientes com câncer na posologia de 1 g/dia do gengibre em pó, podendo ser utilizado como uma terapia complementar juntamente com regimes antieméticos padrões. Ainda são necessários mais ensaios clínicos randomizados com homogeneidade de dose, do tempo de administração e da forma farmacêutica para fomentar a recomendação de uso do gengibre em diferentes tipos de câncer e de protocolos de quimioterapia, bem como determinar a eficácia dessa intervenção e realizar revisões sistemáticas com metanálise que avaliem separadamente a indicação do gengibre em cada tipo de câncer.
CONTRIBUIÇÕES
Todos os autores contribuíram substancialmente na concepção e/ou no planejamento do estudo; na análise e/ou interpretação dos dados; na redação e/ou revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Instituto Nacional de Câncer [Internet]. Rio de Janeiro: INCA; [data desconhecida]. O que é câncer? 2022 maio 31 [atualizado 2022 jul 14; acesso 2022 out 14]. Disponível em: https://www.gov.br/inca/pt-br/assuntos/cancer/o-que-e-cancer
2. Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3): 209-49. doi: https://doi.org/10.3322/caac.21660
3. Santos MO, Lima FCS, Martins LFL, et al. Estimativa de incidência de câncer no Brasil, 2023-2025. Rev Bras Cancerol. 2023;69(1):e-213700. doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n1.3700
4. Silva MPN. Síndrome da anorexia-caquexia em portadores de câncer. Rev Bras Cancerol. 2006;52(1):59-77. doi: https://doi.org/10.32635/2176-9745.RBC.2006v52n1.1910
5. Link W. Anti-cancer drugs: discovery, development and therapy. In: De Mello R, Mountzios G, Tavares A, editors. International manual of oncology practice. Paris: Springer, Cham; 2019. p. 95-111. doi: https://doi.org/10.1007/978-3-030-16245-0_6
6. Crichton M, Marshall S, Marx W, et al. Efficacy of ginger (Zingiber officinale) in ameliorating chemotherapy-induced nausea and vomiting and chemotherapy-related outcomes: a systematic review update and meta-analysis. J Acad Nutr Diet. 2019;119(12):2055-68. doi: https://doi.org/10.1016/j.jand.2019.06.009
7. Saad GA, Léda PHO, Sá IM, et al. Fitoterapia contemporânea: tradição e ciência na prática clínica. 3 ed. Rio de Janeiro: Guanabara Koogan; 2021.
8. Ministério da Saúde (BR), Gabinete do Ministro. Portaria nº 971, de 03 de maio de 2006. Aprova a Política Nacional de Práticas Integrativas e Complementares (PNPIC) no Sistema único de Saúde. Diário Oficial da União, Brasília, DF. 2006 maio 4 [acesso 2022 out 14]; Seção 1:20. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/gm/2006/prt0971_03_05_2006.html
9. Chang WP, Peng YX. Does the oral administration of ginger reduce chemotherapy-induced nausea and vomiting?: a meta-analysis of 10 randomized controlled trials. Cancer Nurs. 2019;42(6):E14-E23. doi: https://doi.org/10.1097/NCC.0000000000000648
10. Souza MT, Silva MD, Carvalho R. Integrative review: What is it? How to do it? Einstein (São Paulo). 2010;8(1):102-6. doi: https://doi.org/10.1590/S1679-45082010RW1134
11. Uthaipaisanwong A, Oranratanaphan S, Musigavong N. Effects of ginger adjunct to the standard prophylaxis on reducing carboplatin and paclitaxel-induced nausea vomiting: a randomized controlled study. Support Care Cancer. 2020;28(8):3831-8. doi: https://doi.org/10.1007/s00520-019-05201-5
12. Li X, Qin Y, Liu W, et al. Efficacy of ginger in ameliorating acute and delayed chemotherapy-induced nausea and vomiting among patients with lung cancer receiving cisplatin-based regimens: a randomized controlled trial. Integr Cancer Ther. 2018;17(3):747-54. doi: https://doi.org/10.1177/1534735417753541
13. Bossi P, Cortinovis D, Fatigoni S, et al. A randomized, double-blind, placebo-controlled, multicenter study of a ginger extract in the management of chemotherapy-induced nausea and vomiting (CINV) in patients receiving high-dose cisplatin. Ann Oncol. 2017;28(10):2547-51. doi: https://doi.org/10.1093/annonc/mdx315
14. Konmun J, Danwilai K, Ngamphaiboon N, et al. A phase II randomized double-blind placebo-controlled study of 6-gingerol as an anti-emetic in solid tumor patients receiving moderately to highly emetogenic chemotherapy. Med Oncol. 2017;34(4):69. doi: https://doi.org/10.1007/s12032-017-0931-4
15. Marx W, McCarthy AL, Ried K, et al. The effect of a standardized ginger extract on chemotherapy-induced nausea-related quality of life in patients undergoing moderately or highly emetogenic chemotherapy: a double blind, randomized, placebo controlled trial. Nutrients. 2017;9(8):867. doi: https://doi.org/10.3390/nu9080867
16. Thamlikitkul L, Srimuninnimit V, Akewanlop C, et al. Efficacy of ginger for prophylaxis of chemotherapy-induced nausea and vomiting in breast cancer patients receiving adriamycin - cyclophosphamide regimen: a randomized, double-blind, placebo-controlled, crossover study. Support Care Cancer. 2017;25(2):459-64. doi: https://doi.org/10.1007/s00520-016-3423-8
17. Ansari M, Porouhan P, Mohammadianpanah M, et al. Efficacy of ginger in control of chemotherapy induced nausea and vomiting in breast cancer patients receiving doxorubicin-based chemotherapy. Asian Pac J Cancer Prev [Internet]. 2016 [cited 2022 Dec 12];17(8):3877-80. Available from: http://www.koreascience.or.kr/article/JAKO201617847602754.page
18. Sanaati F, Najafi S, Kashaninia Z, et al. Effect of ginger and chamomile on nausea and vomiting caused by chemotherapy in Iranian women with breast cancer. Asian Pac J Cancer Prev [Internet]. 2016 [cited 2022 Dec 12];17(8):4125-9. Available from: http://www.koreascience.or.kr/article/JAKO201617847602969.page
19. Arslan M, Ozdemir L. Oral intake of ginger for chemotherapy-induced nausea and vomiting among women with breast cancer. Clin J Oncol Nurs. 2015;19(5):E92-7. doi: https://doi.org/10.1188/15.CJON.E92-E97
20. Ryan JL, Heckler CE, Roscoe JA, et al. Ginger (Zingiber officinale) reduces acute chemotherapy-induced nausea: a URCC CCOP study of 576 patients. Support Care Cancer. 2012;20(7):1479-89. doi: https://doi.org/10.1007/s00520-011-1236-3
21. Silva RLM, Silva TTM, Pessoa RL, et al. Use of ginger to control nausea and vomiting caused by chemotherapy in patients with cervical cancer undergoing treatment: an experiment. Medicine (Baltimore). 2022;101(24):e29403. doi: https://doi.org/10.1097/MD.0000000000029403
22. Wazqar DY, Thabet HA, Safwat AM. A quasi-experimental study of the effect of ginger tea on preventing nausea and vomiting in patients with gynecological cancers receiving cisplatin-based regimens. Cancer Nurs. 2021;44(6):E513-9. doi: https://doi.org/10.1097/NCC.0000000000000939
23. Tian L, Qian W, Qian Q, et al. Gingerol inhibits cisplatin-induced acute and delayed emesis in rats and minks by regulating the central and peripheral 5-HT, SP, and DA systems. J Nat Med. 2020;74(2):353-70. doi: https://doi.org/10.1007/s11418-019-01372-x
24. Fahimi F, Khodadad K, Amini S, et al. Evaluating the effect of Zingiber officinalis on nausea and vomiting in patients receiving cisplatin based regimens. Iran J Pharm Res. 2011;10(2):379-84. doi: https://doi.org/10.22037/ijpr.2011.969
25. Haniadka R, Saldanha E, Sunita V, et al. A review of the gastroprotective effects of ginger (Zingiber officinale Roscoe). Food Funct. 2013;4(6):845-55. doi: https://doi.org/10.1039/C3FO30337C
26. Marx WM, Teleni L, McCarthy AL, et al. Ginger (Zingiber officinale) and chemotherapy-induced nausea and vomiting: a systematic literature review. Nutr Rev. 2013;71(4):245-54. doi: https://doi.org/10.1111/nure.12016
27. Zick SM, Ruffin MT, Lee J, et al. Phase II trial of encapsulated ginger as a treatment for chemotherapy-induced nausea and vomiting. Support Care Cancer. 2009;17(5):563-72. doi: https://doi.org/10.1007/s00520-008-0528-8
Recebido em 20/12/2022
Aprovado em 28/2/2023
Editor-associado: Fernando Lopes Tavares de Lima. Orcid iD: https://orcid.org/0000-0002-8618-7608
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer | Ministério da Saúde