REVISÃO DE LITERATURA
Síndrome da Rede Axilar após Tratamento para Câncer de Mama: Revisão Sistemática com Metanálise
Occurrence and Risk Factors with Axillary Network Syndrome after Breast Cancer Treatment: Systematic Review with Meta-analysis
Ocurrencia y Factores Asociados con el Síndrome de la Red Axilar después del Tratamiento del Cáncer de Mama: Revisión Sistemática con Metaanálisis
doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n3.3877
Emmanuele Celina Souza dos Santos1; Jurandir da Silva Filho2; Rayane de Nazaré Monteiro Brandão3; Lucas Yuri Azevedo da Silva4; Leonardo Brynne Ramos de Souza5; José Francisco Dias dos Anjos6; Maurício Oliveira Magalhães7; Saul Rassy Carneiro8
1-5,8Universidade Federal do Pará (UFPA), Hospital Universitário João de Barros Barreto (HUJBB), Programa de Residência Multiprofissional em Oncologia. Belém (PA), Brasil. E-mails: manusouzafisio@gmail.com; jurandirsilvaf@gmail.com; rayane0207@gmail.com; lucasazevedo.fisio@gmail.com; brynneleonard@gmail.com; saulfisio@gmail.com. Orcid iD: https://orcid.org/0000-0003-4609-9803; Orcid iD: https://orcid.org/0000-0003-2987-250X; Orcid iD: https://orcid.org/0000-0001-5452-8167; Orcid iD: https://orcid.org/0000-0003-1022-9485; Orcid iD: https://orcid.org/0000-0001-6443-931X; Orcid iD: https://orcid.org/0000-0002-6825-0239
6UFPA, Centro Universitário do Estado do Pará (Cesupa), Programa de Residência Multiprofissional em Saúde da Família. Belém (PA), Brasil. E-mail: jose94dias@gmail.com. Orcid iD: https://orcid.org/0000-0002-7916-2912
7UFPA. Belém (PA), Brasil. E-mail: mauriciomag@ufpa.br. Orcid iD: https://orcid.org/0000-0002-7857-021X
Endereço para correspondência: Emmanuele Celina Souza dos Santos. Vila Mimosa Bechara, 564 – Batista Campos. Belém (PA), Brasil. CEP 66033-173. E-mail: manusouzafisio@gmail.com
Introdução: O câncer de mama é o mais incidente nas mulheres e a cirurgia é o principal tratamento de escolha. A síndrome da rede axilar (SRA) é uma condição recorrente que ocorre em até 86% das pacientes após cirurgia, se apresenta como um único cordão ou múltiplos cordões nos tecidos subcutâneos da axila ipsilateral e gera dor e limitação do movimento. Objetivo: Investigar estudos sobre a ocorrência e fatores associados à SRA após tratamento do câncer de mama. Método: Revisão sistemática com metanálise, nas bases de dados PubMed, LILACS e EMBASE, com a metodologia PECOS, seguindo a diretriz PRISMA. Resultados: Cinco artigos foram selecionados, com taxa de ocorrência da SRA de 35%. Os fatores associados encontrados apresentaram um menor risco relativo (RR) de recorrência para quem realizou biópsia de linfonodo sentinela em comparação aos que se submeteram à dissecção axilar (RR 0,49; IC 95% [0,42; 0,57] I²=95%, p=0,01). Houve uma variação de 35% a 39% de desenvolvimento para a SRA em pacientes que se submeteram à quimioterapia e radioterapia, porém o tipo de cirurgia não teve resultado estatisticamente significativo para o desencadeamento da síndrome. Conclusão: Indivíduos que realizaram biópsia de linfonodo sentinela têm menos chance de desenvolver a SRA quando comparados aos que fizeram dissecção axilar. As terapias oncológicas apresentaram proporções parecidas de aparecimento da SRA e o tipo de cirurgia não interferiu na evolução da patologia.
Palavras-chave: neoplasias da mama; doenças linfáticas; fatores de risco; axila.
ABSTRACT
Introduction: Breast cancer is the most common in women and surgery is the main treatment of choice. Axillary Web Syndrome (AWS) is a recurrent condition that occurs in up to 86% after surgery, presenting as a single cord or multiple cords in the subcutaneous tissues of the ipsilateral axilla, causing pain and limitation of movement. Objective: To investigate studies about the occurrence and factors associated with AWS post breast cancer treatment. Method: Systematic review with meta-analysis based in the PECOS methodology according to PRISMA guidelines at the databases PubMed, LILACS and EMBASE. Results: Five articles were selected with rate of occurrence of 35% of AWS. The associated factors found showed a minor relative risk (RR) of recurrence in those who underwent sentinel lymph node biopsy compared to those who were submitted to axillary dissection (RR 0.49; 95%CI [0.42;0.57] I²=95%, p=0.01). The appearance of AWS ranged from 35% to 39% in patients who submitted to chemotherapy and radiotherapy, but the type of surgery did not have a statistically significant result for triggering the syndrome. Conclusion: Individuals who underwent sentinel lymph node biopsy are less likely to develop the syndrome when compared to those who submitted to axillary dissection. Oncological therapies had similar percentages for the appearance of AWS and the type of surgery did not interfere in the evolution of the pathology.
Key words: breast neoplasms; lymphatic diseases; risk factors; axilla.
Introducción: El cáncer de mama es el más común en las mujeres y la cirugía es el principal tratamiento de elección. El síndrome de la red axilar (SRA) es una condición recurrente que ocurre hasta en un 86% de las pacientes después de la cirugía, se presenta como un cordón único o múltiples cordones en los tejidos subcutáneos de la axila isolateral, y causa dolor y limitación del movimiento. Objetivo: Investigar estudios sobre la ocurrencia y factores asociados al SRA después del tratamiento del cáncer de mama. Método: Revisión sistemática con metaanálisis, en las bases de datos PubMed, LILACS y EMBASE, con la metodología PECOS, siguiendo la guía PRISMA. Resultados: Se seleccionaron cinco artículos, con la tasa de ocurrencia del SRA del 35%. Los factores asociados encontrados mostraron un menor riesgo relativo (RR) de recurrencia para quien realizó biopsia de ganglio centinela en comparación con las que se sometieron a la disección axilar (RR 0,49; IC 95% [0,42;0,57] I²=95%, p=0,01). Hubo una variación del 35% al 39% de desarrollo del SRA en pacientes que se sometieron a la quimioterapia y radioterapia, aunque el tipo de cirugía no tuvo un resultado estadísticamente significativo para desencadenar el síndrome. Conclusión: Las personas que se sometieron a una biopsia de ganglio centinela tienen menos probabilidades de desarrollar el SRA en comparación con aquellas que se sometieron a disección axilar. Las terapias oncológicas presentaron proporciones parecidas de aparición del SRA y el tipo de cirugía no interfirió en la evolución de la patología.
Palabras clave: neoplasias de la mama; enfermedades linfáticas; factores de riesgo; axila.
INTRODUÇÃO
O câncer de mama é o tipo mais incidente em mulheres, sendo considerado um grande problema de saúde pública, com 1.384.155 novos casos estimados em todo o mundo e com 459 mil mortes relacionadas1. Prevê-se que a incidência mundial de câncer de mama feminino chegará a aproximadamente 3,2 milhões de novos casos por ano até 2050. Esses números refletem a magnitude da incidência desse tipo de câncer, seu efeito na sociedade mundial e a necessidade de urgência para medidas preventivas e de tratamento1.
Os fatores de risco para o desenvolvimento do câncer de mama variam em fatores modificáveis e não modificáveis2. O gênero feminino é frequentemente o mais afetado, acontecendo raramente na população masculina em cerca de apenas 1% dos casos. A idade também é considerada um importante fator de risco, a taxa de incidência aumenta significativamente na menopausa e, a seguir, diminui gradualmente ou permanece constante2,3. Fatores hereditários também estão totalmente relacionados, como histórico de câncer na família, densidade mamária elevada etc.2,4. Estilos de vida modernos, como consumo excessivo de álcool, ingestão de gordura na alimentação, exposição ao tabaco e às radiações ionizantes podem aumentar o risco de desenvolvimento4,5.
A cirurgia é o tratamento de escolha podendo ser mastectomia ou cirurgia conservadora1,3. A mastectomia pode ser classificada de três formas, simples: tipo mais comum, nela há a retirada de toda a mama incluindo os mamilos, mas não há remoção de linfonodos axilares; radical modificada: incisão elíptica, incluindo o complexo mamilo-areolar, remoção de todo o tecido mamário, bem como a fáscia peitoral maior, e também a remoção dos linfonodos axilares3,4; e poupadora da pele e dos mamilos: a maior parte da pele é preservada, ela é feita em mulheres que têm tumor menor e em estágio inicial.
Já a cirurgia conservadora pode ser descrita por vários termos, incluindo quadrantectomia, lumpectomia ou mastectomia parcial – que consiste na retirada do segmento ou de um setor da mama onde se encontra o processo tumoral3,4. Muitas vezes, estas incluem biópsia de linfonodo sentinela (BLS): retirada de linfonodos comprometidos apenas – que gera menor dano à cadeia axilar, um componente primordial também no estadiamento de pacientes com câncer de mama em estágio inicial que apresentam linfonodos clinicamente negativos; ou a linfadenectomia/dissecção de linfonodos axilares: retirada dos linfonodos localizados na região tumoral; nesses casos, há um maior envolvimento da cadeia axilar1,2. Além disso, a quimioterapia e radioterapia são utilizadas como adjuvantes no tratamento oncológico1,2. Esses procedimentos são importantes para prever o prognóstico, reduzir a recorrência e promover tratamento adequado1,2. No entanto, a abordagem cirúrgica axilar leva a complicações significativas de curto e longo prazos, como dor, parestesia, linfedema, síndrome da rede axilar (SRA) e diminuição da amplitude de movimento (ADM)1,2.
A SRA é uma condição comum que ocorre em até 86% das pacientes após cirurgia, com dissecção de linfonodos axilares3-5. Ela se apresenta como um único cordão ou múltiplos cordões finos nos tecidos subcutâneos da axila ipsilateral3-5. Alguns autores afirmam que a condição se dá por meio de uma ruptura no sistema linfático durante a ressecção dos linfonodos, havendo a interrupção do fluxo, o que causa trombose e inflamação, gera transformação nas veias e vasos linfáticos, e, assim, a formação das bandas fibróticas3-5. Frequentemente, se torna sintomática entre duas e oito semanas de pós-operatório, mas também pode se desenvolver de meses a anos após a cirurgia3-5. Esses cordões situam-se em uma área da axila até a face medial da parte superior e do antebraço, podendo ser visíveis e palpáveis, isso gera uma limitação da ADM do ombro homolateral ao processo cirúrgico e presença de dor axilar que se estende do cotovelo ao punho3-5.
Apenas alguns estudos investigaram a ocorrência e os principais fatores associados ao desenvolvimento da SRA. Destes, a dissecção de linfonodos axilares, tipo de cirurgia da mama realizada, quimioterapia, radioterapia, entre outros, são atualmente considerados fatores para o seu desenvolvimento6-8. Em razão do aumento observado de mulheres portadoras dessa condição, secundária ao câncer de mama, apresentando limitações que interferem diretamente na qualidade de vida, e também da falta de estudos precisos baseados na literatura científica, faz-se necessário conhecer as causas e os fatores associados, sendo de importante relevância para a prática clínica e manejo adequado. Dessa forma, o objetivo deste artigo é investigar nas bases de dados científicas estudos sobre a ocorrência e fatores associados à SRA após tratamento para câncer de mama.
MÉTODO
Revisão sistemática com metanálise cuja elaboração seguiu as recomendações propostas pela Colaboração Cochrane9 e pelo Preferred Reporting Items for Systematical Review and Meta-Analyses: The PRISMA Statement10,11 por meio do acrônimo PECOS (P=participantes, E=exposição, C=comparação, O=desfecho, S=delineamento dos estudos elegíveis)11, que envolve análise, avaliação e integração da literatura pertinente. Este estudo está registrado na base de revisões sistemáticas do International Prospective Register of Systematic Reviews (PROSPERO) com ID CRD42022349538.
Para atingir todas as evidências relevantes, foram pesquisados estudos observacionais (transversais, coorte e caso-controle) sem restrição quanto ao período de publicação e idioma, que incluíssem na amostra apenas pessoas com câncer de mama, independentemente da idade, sexo feminino, tipo de procedimento cirúrgico, associado à realização de procedimento axilar (linfadenectomia/dissecção axilar ou BLS), que apresentassem a SRA e os fatores relacionados.
Foram excluídos estudos de fontes não primárias, como revisões de literatura, trabalhos que não atendessem à questão norteadora da pesquisa, duplicatas em mais de uma base de dados, pesquisas em animais, estudos in vitro, trabalhos que abordassem outros tipos de câncer, e estudos em que a população não fosse totalmente composta por pessoas com SRA associada ao câncer de mama.
Foram incluídos estudos observacionais, de acordo com a metodologia PRISMA10, por meio do processo de seleção utilizando as linhas de orientação internacional do Cochrane Handbook for Systematic Reviews of Interventions9. Além disso, houve a aplicação do acrônimo PECOS11. Participantes: pacientes com câncer de mama; exposição: ocorrência e fatores associados à SRA (tipo de cirurgia, procedimento axilar realizado etc.); comparação: pacientes que não apresentaram o desfecho da SRA; desfecho: apresentação da SRA; e delineamento dos estudos elegíveis: estudos observacionais.
As etapas de busca ocorreram utilizando as seguintes bases de dados eletrônicas PubMed, EMBASE e LILACS.
Os termos utilizados estão indexados no Descritores em Ciências da Saúde (DeCS) e no Medical Subject Headings (MeSH), e seus correspondentes em inglês e português conectados por meio de operadores booleanos “AND” e “OR”. Os descritores da pesquisa incluíram: neoplasias da mama (lobular carcinoma in situ; breast neoplasms; breast cancer), doenças linfáticas (axillary dissection; axillary lymph node dissection; lymphatic diseases) e fatores de risco (risk factors; risk assessment; risk adjustment).
A busca foi realizada por meio do aplicativo Rayyan com a inclusão de todos os artigos encontrados a partir da estratégia de busca elaborada, analisados por dois revisores de forma independente e, posteriormente, comparados. Inicialmente, os artigos foram selecionados pela leitura do título e resumo; e, em seguida, realizada a leitura integral, permanecendo os que atenderam aos critérios de elegibilidade supracitados.
As informações foram coletadas por um revisor, por meio de um formulário padronizado com dados referentes ao estudo e à amostra: tipo de estudo, tamanho da amostra, perfil das participantes, comorbidades associadas, histórico de doenças, estadiamento clínico da patologia; e detalhes da intervenção: tipo de cirurgia, procedimento axilar, terapia oncológica, presença da SRA, ocorrência e fatores associados, duração do estudo e resultados obtidos, checados por um segundo revisor, com o objetivo de categorizar e organizar os dados encontrados. Qualquer divergência foi discutida até que se alcançasse um consenso, contando com a participação de um terceiro avaliador, caso houvesse necessidade.
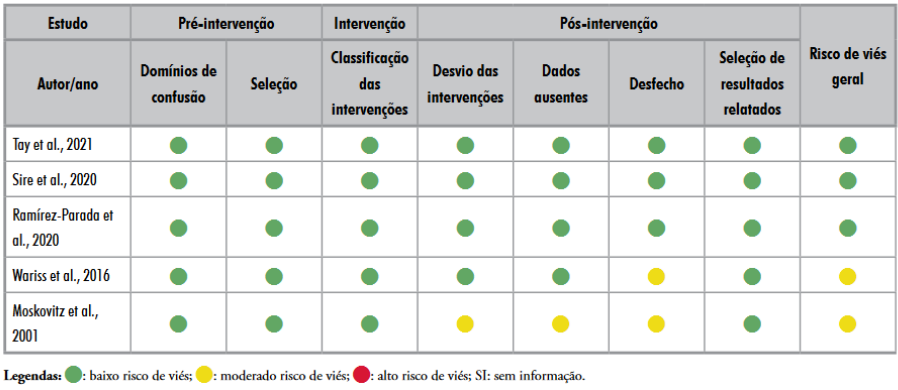
Os estudos foram avaliados quanto ao risco de viés pela ferramenta The Risk of Bias in Non-randomized Studies – of Interventions (ROBINS-I)12. O processo é baseado em domínios e estruturado por meio de perguntas norteadoras para o julgamento de cada domínio, também direcionado à avaliação de desfechos individualmente, por dois pesquisadores de forma independente. Abrange sete domínios, separados em três subcategorias. Antes da intervenção: viés por confundimento; e viés na seleção dos participantes. Na intervenção: viés na classificação das intervenções. Após a intervenção: viés por desvio das intervenções pretendidas; viés por dados faltantes; viés na medida dos desfechos; e viés na seleção dos resultados.
Os dois primeiros avaliam questões que precisam ser comparadas nos grupos em estudo no baseline, antes da implementação da intervenção, e são compostos por viés de confusão e seleção dos participantes. O terceiro classifica a própria intervenção. Já os quatro seguintes avaliam o risco de viés que pode estar presente após a implementação da intervenção: desvio da intervenção pretendida, perda de dados, mensuração do desfecho e relato seletivo dos resultados obtidos. As opções de julgamento de cada domínio são: baixo risco de viés, moderado risco de viés, grave risco de viés, crítico risco de viés ou sem informação. Os julgamentos dentro de cada domínio levam a um risco geral de julgamento de viés para o resultado que está sendo avaliado.
A metanálise foi realizada pelo programa RStudio versão 4.2.1, por intermédio do modelo de efeitos comuns, e as medidas de efeito foram obtidas pelos valores pós-eventos das principais variáveis encontradas em comum nos estudos eleitos. Consideraram-se estatisticamente significativos um valor alfa igual a 0,05 e o intervalo de confiança de 95% (IC 95%). A heterogeneidade estatística dos efeitos de tratamento entre os estudos foi avaliada pelo índice de inconsistência (I²), em que se considerou que valores >25% indicam heterogeneidade substancial.
Os estudos foram avaliados quanto ao nível de evidência por dois avaliadores de forma independente, por meio da ferramenta Grading of Recommendations Assessment, Development and Evaluation (GRADE)13, um sistema universal e sensível para julgar a certeza geral de cada desfecho. A classificação acontece em quatro níveis: alto, moderado, baixo e muito baixo. Dois pesquisadores independentes avaliaram o delineamento do estudo, risco de viés geral, inconsistência, evidência indireta, imprecisão e viés de publicação de acordo com as orientações. Eventuais divergências entre os avaliadores foram resolvidas em reunião de consenso.
RESULTADOS
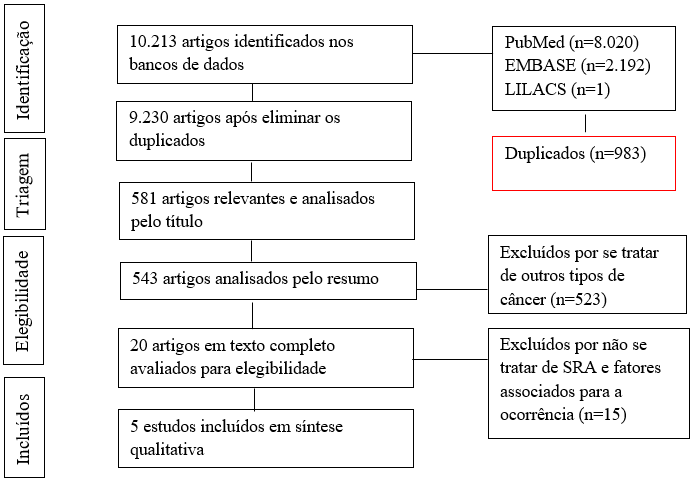
O caminho cursado para a seleção dos estudos iniciou com a pesquisa nas bases de dados com os descritores já mencionados, sendo identificadas 10.213 referências a partir das buscas. Desses estudos, cinco foram considerados de potencial relevância com extração de dados completos, podendo ser realizada a metanálise, conforme fluxograma (Figura 1).
|
|
|
Figura 1. Fluxograma do processo de seleção dos estudos e resultados da triagem |
![]()
![]() Para
calcular o risco de viés, ou seja, avaliar a qualidade metodológica dos
estudos, foi utilizado o ROBINS-I. Três estudos apresentaram risco baixo e dois,
risco moderado. Assim, o resultado final teve 80% de baixo risco de viés e 20% de
algumas preocupações com viés, principalmente os que apresentaram risco
moderado em razão da exclusão das participantes por falta de dados sobre outras
variáveis necessárias para a análise, interferindo diretamente na mensuração
dos resultados obtidos e no tempo de seguimento, sendo os principais fatores
encontrados. Por fim, a avaliação foi ponderada de acordo com o protocolo
ROBINS-I.
Para
calcular o risco de viés, ou seja, avaliar a qualidade metodológica dos
estudos, foi utilizado o ROBINS-I. Três estudos apresentaram risco baixo e dois,
risco moderado. Assim, o resultado final teve 80% de baixo risco de viés e 20% de
algumas preocupações com viés, principalmente os que apresentaram risco
moderado em razão da exclusão das participantes por falta de dados sobre outras
variáveis necessárias para a análise, interferindo diretamente na mensuração
dos resultados obtidos e no tempo de seguimento, sendo os principais fatores
encontrados. Por fim, a avaliação foi ponderada de acordo com o protocolo
ROBINS-I.
Tendo sido avaliados todos os domínios, estabeleceu-se um risco de viés geral para cada estudo (Quadro 1).
Quadro 1. Avaliação do risco de viés (ROBINS-I)
Assim, os estudos foram organizados em tabelas e especificados quanto aos autores, ano, características dos participantes, tipo de cirurgia realizada, tratamento oncológico, presença da SRA, intervenção, tempo para sua ocorrência, assim como resolução, principais fatores associados e resultados obtidos (Tabela 1)14-18. A totalidade dos estudos incluídos nesta revisão é retrospectiva, de coorte ou caso-controle.
Tabela 1. Características e resultados dos estudos selecionados
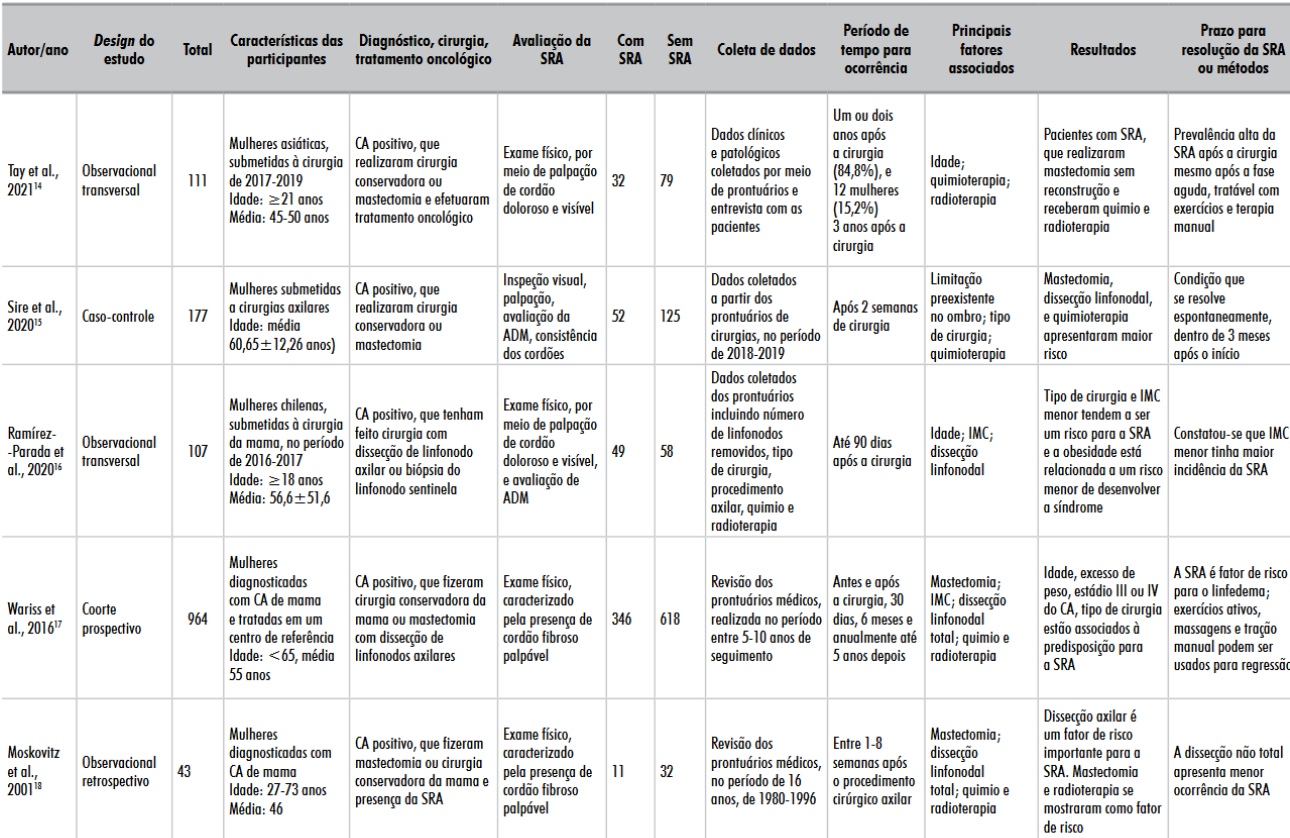
Legendas: CA = câncer; ADM = amplitude de movimento; IMC = índice de massa corporal; SRA = síndrome da rede axilar.
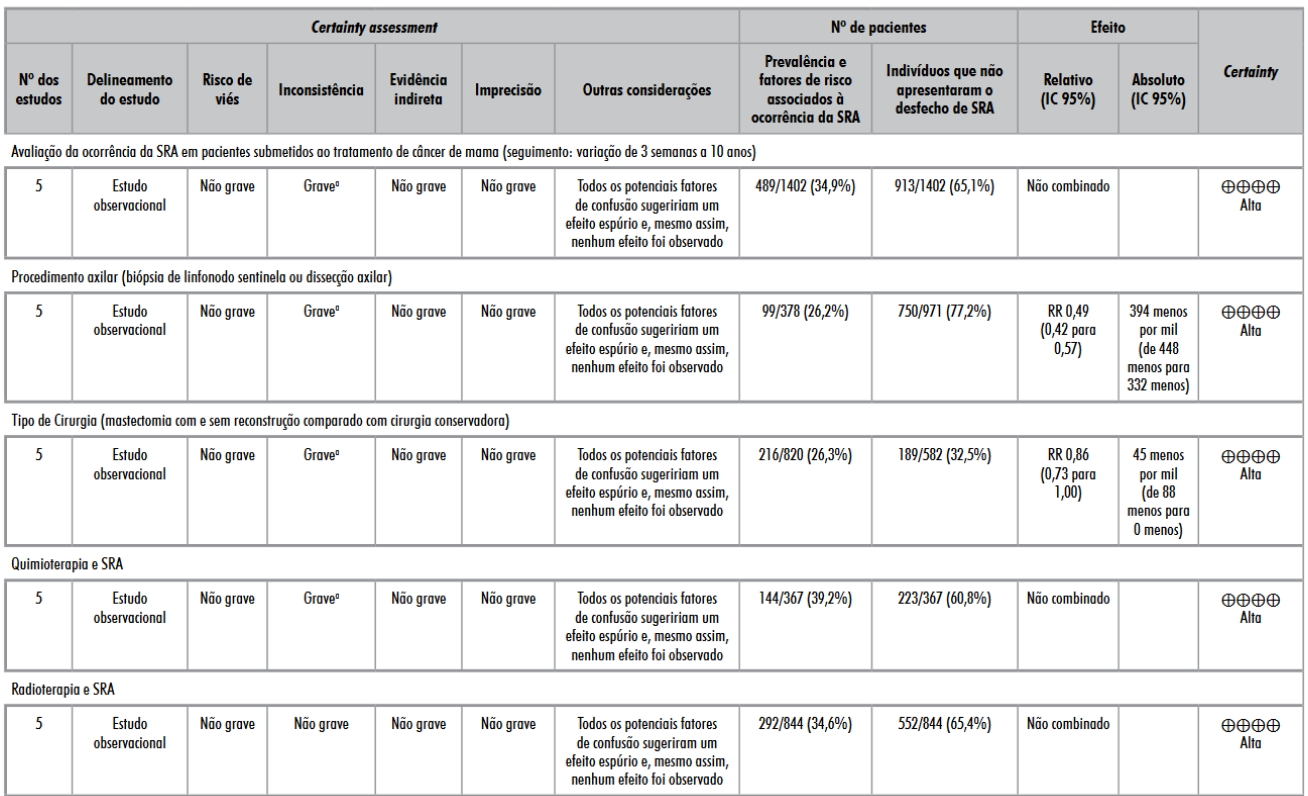
Os resultados foram sintetizados e apresentados contendo nos desfechos a ocorrência e os principais fatores em comum associados à SRA, como a proporção de ocorrência, quimioterapia, radioterapia, tipo de cirurgia, e procedimento axilar. Todas as análises podem ser observadas na Figura 2.
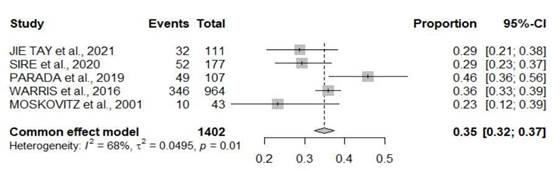
Os cinco artigos selecionados compreenderam 1.402 participantes. O tempo até o diagnóstico da recorrência no grupo exposto aos fatores de risco associados à SRA foi em torno de duas semanas no mínimo e máximo de 60 meses. A Figura 2 mostra a taxa de ocorrência estimada da SRA após tratamento para câncer de mama nos estudos selecionados, evidenciando que 489 (35%) das participantes desenvolveram a síndrome. Proporção = 0,35; IC 95% 0,32-0,37.
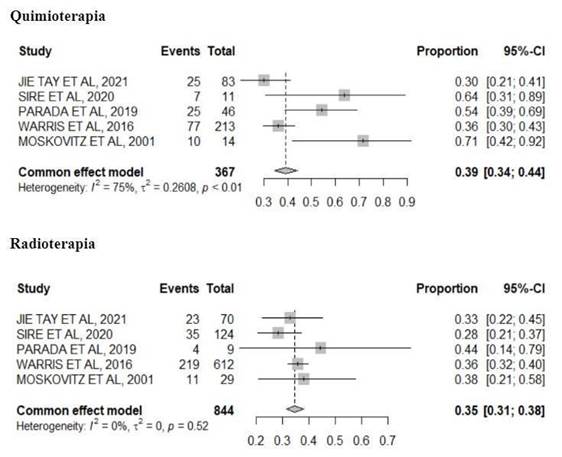
A Figura 2 aponta a apresentação da SRA nas participantes que realizaram quimioterapia ou radioterapia como tratamento oncológico. Obtendo uma proporção de 39% (IC 95%; 0,34-0,44) de desenvolver SRA nas 367 que realizaram quimioterapia. Já as 844 participantes que realizaram radioterapia como terapia oncológica obtiveram uma proporção de 35% (IC 95%; 0,31-0,38) de manifestar a SRA como desfecho. Evidenciando proporções quase que semelhantes de desenvolvimento da síndrome, de acordo com o número total de participantes comparando uma terapêutica a outra.
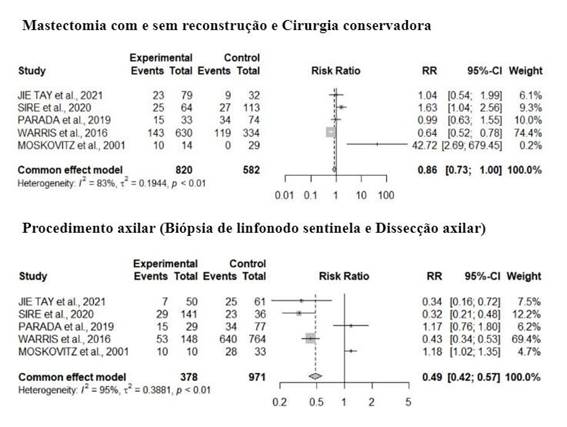
Outra variável analisada foi o tipo de cirurgia. A Figura 2 mostra as 820 participantes que realizaram mastectomia com e sem reconstrução mamária e as 582 que realizaram cirurgia conservadora, sendo observado que não houve diferenças estatisticamente significantes para a SRA independentemente da realização de mastectomia ou cirurgia conservadora. Risco relativo (RR) = 0,86; IC 95%; 0,73-1,00.
Além disso, o tipo de procedimento axilar também foi uma variável de análise comum nos cinco estudos selecionados. Ainda na Figura 2, das 378 participantes que realizaram a BLS, 114 desenvolveram a SRA. E das 971 participantes que realizaram dissecção axilar, 750 desenvolveram a síndrome. Com isso, observou-se que indivíduos que realizaram BLS apresentaram um menor risco (49%) de desenvolver a SRA, comparado à dissecção axilar, sendo este um fator de proteção para o não desencadeamento (RR = 0,49; IC 95%; 0,42-0,57).
|
Taxa de ocorrência da SRA |
|
|
|
Figura 2. Forest plot de todos os desfechos avaliados sobre a ocorrência e os tipos de terapias e intervenções realizadas |
Na avaliação do sistema GRADE, a partir dos desfechos realizados na metanálise, em relação às limitações estruturais, o risco de viés foi considerado não grave para o conjunto das evidências, pois não apresentaram limitações metodológicas referentes ao delineamento ou à execução dos estudos de acordo com o risco de viés geral. O julgamento da inconsistência é baseado na similaridade das estimativas de efeito, na sobreposição dos intervalos de confiança e em critérios estatísticos, como o I2, assim, a inconsistência dos estudos foi considerada grave na maioria dos desfechos em razão da grande heterogeneidade, com variação de 95% a 68%.
No entanto, isso é inerente à metanálise de estudos observacionais, ocorrendo principalmente em virtude de o tempo de seguimento dos acompanhamentos terem sido diferentes, e a forma de diagnóstico da SRA e os resultados terem sido apresentados de maneira dissemelhantes. A evidência indireta foi considerada não grave, pois os desfechos avaliados foram substancialmente baseados na ocorrência e fatores associados à SRA, sem a necessidade de realizar comparações indiretas. A imprecisão foi classificada como não grave em razão da amplitude do IC 95% e do número de eventos ocorridos.
O viés quanto à publicação não foi realizado em razão do pequeno número de artigos científicos incluídos na metanálise. Além disso, a grande magnitude do efeito e o gradiente-dose-resposta não se aplicaram ao estudo, porém os potenciais fatores de confusão, como exclusão de pacientes no decorrer do estudo, sugeriram um efeito espúrio e, mesmo assim, este não foi observado. As composições de todos os desfechos examinados na metanálise obtiveram nível de evidência alto em relação à ocorrência e aos fatores associados à SRA comparados com indivíduos que não tiveram a síndrome como resposta (Tabela 2).
|
Tabela 2. Sistema GRADE aplicado nos estudos selecionados |
|
|
|
Legendas: SRA = síndrome da rede axilar; IC = intervalo de confiança; RR = razão de risco. (a) Todas as metanálises apresentaram alta heterogeneidade, embora isso seja inerente às metanálises de estudos observacionais. |
DISCUSSÃO
Esta revisão sistemática com metanálise incluiu cinco estudos observacionais, nos quais a ocorrência da SRA foi de 35% em um total de 1.402 pacientes envolvidos, evidenciando que ela se faz presente após tratamento para câncer de mama, podendo se manifestar tanto de forma imediata quanto tardia. Isso mostra que a SRA é uma consequência que pode acontecer rotineiramente, de forma secundária ao câncer de mama. Os principais fatores associados encontrados foram terapia oncológica realizada, tipo de cirurgia e procedimento axilar.
No estudo prospectivo de Wariss et al.17, a fisiopatologia da SRA é pressuposta pela descontinuação dos linfáticos axilares por três mecanismos: lesão linfovenosa por retração e posicionamento do paciente durante a dissecção ou linfadenectomia axilar; liberação de fatores teciduais que podem causar hipercoagulação em razão da estase e instabilidade nos tecidos circundantes; e por estase de canais linfovenosos de obstrução de saída, induzida por remoção dos linfáticos axilares que drenam o braço, bem como o linfedema, no qual a fisiopatologia é descrita pela interrupção do sistema linfático, resultando em diminuição do fluxo linfático.
O estudo retrospectivo de Tay et al.14 assegurou que mulheres que realizaram cirurgia correm o risco de desenvolver a SRA, com uma ocorrência de 28,9% nas 111 mulheres avaliadas, entre as quais a maioria apresentou a síndrome um ou dois anos após a cirurgia (84,8%), e 12 pacientes (15,2%) apresentaram três anos após a cirurgia. Um estudo de coorte prospectivo de Koehler et al.19 com 36 pacientes obteve uma prevalência cumulativa de 50% da SRA em 18 meses após a cirurgia, enquanto outro estudo de coorte prospectivo de O′ Toole et al.20 encontrou uma incidência de 31,5% em 24 meses de pós-operatório, o que afirma que a SRA pode se apresentar como uma complicação tardia. Isso pode se dar pela falha na investigação por parte das pacientes e pelo não monitoramento de forma constante e vígil, em virtude do desconhecimento da condição14.
No estudo de caso-controle de Sire et al.15, as 177 mulheres avaliadas apresentaram uma ocorrência de 29,5% da SRA em até duas semanas de pós-operatório. A localização mais frequente foi em nível axilar (59,6%), braço (17,3%), na fossa cubital (11,5%) e no antebraço (11,5%), evidenciando que a SRA é mais presente na região onde ocorre a remoção dos linfonodos e menos comum no decorrer do seu trajeto.
Observou-se que, na metanálise em questão, houve uma ocorrência de 39% da SRA nas pacientes que realizaram quimioterapia como tratamento adjuvante. No estudo retrospectivo de Jeong et al.21, 189 pacientes elegíveis foram recrutadas, e submetidas à cirurgia, entre 2019 e 2020, das quais 117 (62%) realizaram quimioterapia, com 25 (43,10%) pacientes tendo como desfecho a SRA. Já o estudo de Bergmann et al.22 teve 193 mulheres que realizaram quimioterapia neoadjuvante e radioterapia, e apontou que não houve aumento no risco de desenvolvimento, com apenas 17 indivíduos que manifestaram a SRA. Contudo, no caso-controle de Sire et al.15, das 177 mulheres submetidas à cirurgia, 11 fizeram o uso de quimioterapia neoadjuvante e 57 de quimioterapia com taxanos, e apresentaram maior risco de desenvolvimento da SRA, com 13,5% e 46,1%, respectivamente.
Em contraponto, no estudo retrospectivo de Moskovitz et al.18, entre as 43 mulheres avaliadas, das 14 que realizaram quimioterapia, dez apresentaram a SRA. Hassan et al.23 afirmam em sua revisão que o principal objetivo do tratamento adjuvante sistêmico é controlar qualquer doença micrometastática, reduzir a taxa de recorrência e melhorar a sobrevida de longo prazo geral. Ademais, no estudo retrospectivo de Chou et al.24 com um total de 173 pacientes, a incidência da SRA foi de 18%, havendo diferença predominante na idade (p=0,004), número de linfonodos removidos (p=0,044), e se estavam recebendo quimioterapia (p=0,002) entre pacientes com e sem a síndrome. Esses três fatores foram associados a um risco aumentado de desenvolver a SRA, evidência de que a quimioterapia pode ser um fator de risco isolado ou combinado.
A metanálise mostra que 35% das pacientes que realizaram radioterapia como tratamento oncológico apresentaram a SRA como desfecho. Hennequin et al.25 relatam que, após cirurgia de carcinoma infiltrante, a radioterapia deve ser realizada sistematicamente, independentemente das características da doença, pois diminui a taxa de recidiva local e, com isso, a mortalidade.
No estudo transversal de Tay et al.14, 59,5% das 111 pacientes que receberam radioterapia apresentaram a SRA. Já no estudo de coorte prospectivo de Bergmann et al.22 com 193 mulheres, 52 realizaram a radioterapia como tratamento oncológico, das quais apenas duas participantes tiveram a SRA, exibindo que esse fator não aumentou o risco de desenvolvimento. Fukushima et al.26 realizaram um estudo observacional transversal com 97 mulheres maiores de 18 anos, entre 2011 e 2012, em que 28 participantes apresentaram a SRA, das quais apenas três tinham realizado a radioterapia como tratamento oncológico, distinguindo que este não é fator de risco que necessariamente cause a patologia em questão.
Por outro lado, o estudo transversal de Ramirez-Parada et al.16 relata a incidência da SRA em 107 pacientes, das quais nove realizaram radioterapia, quatro destas apresentaram a síndrome como consequência, havendo uma prevalência relativamente alta em relação ao número total, porém não se deve deixar de levar em consideração a quantidade pequena de participantes incluídas no estudo que fizeram esse tratamento de forma isolada. Realizando a comparação entre os dois tipos de tratamentos oncológicos utilizados no câncer de mama, as proporções de aparecimento da SRA obtidas na metanálise são relativamente parecidas, com variação de 35% a 39%, evidenciando que podem ocorrer os sinais e sintomas da doença independentemente da terapia utilizada para abordar o câncer de mama.
Ademais, a metanálise aborda que a SRA pode se desenvolver independentemente do tipo de abordagem cirúrgica realizada. A cirurgia é classificada como o tratamento primário para o câncer de mama1,27. A classificação consiste em: mastectomia simples, radical modificada, poupadora de pele e mamilos27,28. Já a cirurgia conservadora tornou-se a alternativa eletiva no tratamento do câncer de mama, porém, para alcançar margens livres das neoplasias e reduzir o risco de recidiva local, em caso de lesões grandes, o procedimento muitas vezes pode comprometer o resultado estético, para mamas pequenas ou ressecção de mais de 30% do volume mamário. As vantagens do uso de técnicas cirúrgicas conservadoras são preservação da maior parte do parênquima mamário, redução da morbidade, e redução do impacto cirúrgico no seu funcionamento19,27,29.
No estudo observacional de Tay et al.14, das 111 mulheres avaliadas, 79 realizaram a mastectomia, 23 (30%) apresentaram a SRA, em comparação às 32 participantes que realizaram cirurgia conservadora, e apenas nove (27,9%) desenvolveram a SRA, apontando que, independentemente do tipo de cirurgia realizada, as pacientes apresentaram proporções parecidas de desencadeamento. No estudo de caso-controle de Sire et al.15, foram recrutadas 177 pacientes, das 64 que realizaram mastectomia, 48,1% desenvolveram a SRA e, entre as 113 que sucederam pela cirurgia conservadora, 51,9% apresentaram como desfecho a SRA, ambos os resultados em até duas semanas de pós-operatório, evidenciando também que a SRA pode aparecer nos dois tipos de procedimentos cirúrgicos.
Porém, no estudo retrospectivo de Moskovitz et al.18, as mulheres que realizaram cirurgia conservadora não apresentaram a SRA como desfecho, mas não se deve deixar de levar em consideração o número pequeno de participantes incluídos e que este foi o primeiro estudo a verificar a prevalência da SRA em mulheres com câncer de mama.
O procedimento cirúrgico associado à dissecção da cadeia linfonodal pode influenciar a frequência relatada da SRA, pois essa abordagem é mais agressiva do que a BLS, como pode ser evidenciado na metanálise, com ocorrência menor da SRA (49%) em BLS em comparação à dissecção de linfonodos axilares. Anatomicamente, os gânglios linfáticos axilares são divididos em três níveis, com o músculo peitoral menor como demarcação. Os linfonodos localizados lateralmente ao peitoral menor são os axilares nível I, que incluem o grupo mamário lateral, o grupo central e o grupo subescapular; os localizados posteriormente à superfície profunda do peitoral menor são nível II; e os localizados medialmente ao peitoral menor são nível III30,31.
A dissecção de linfonodos axilares níveis I e II é o tratamento clínico ideal do câncer de mama positivo para linfonodos axilares. A dissecção do nível III pode levar à dormência pós-operatória, à deformidade axilar, ao linfedema, à SRA etc. Com isso, a BLS tem um efeito profundo na redução do trauma axilar, por causar menos lesão linfonodal. Na maioria dos casos, a BLS substituiu a dissecção axilar em pacientes com linfonodos clinicamente negativos21,30,31.
No estudo transversal de Tay et al.14, entre as 61 pacientes que foram submetidas à dissecção linfonodal, havia 25 (41,0%) com desenvolvimento da SRA e, das 50 que realizaram a BLS, apenas sete (14%) desenvolveram a SRA. O aumento do risco de SRA associada à dissecção axilar se dá por ser uma intervenção cirúrgica mais invasiva, na qual há o risco de interrupção dos linfáticos axilares ou vasos linfáticos trombosados, causando fibrose no local. Ademais, o estudo de caso-controle de Sire et al.15 avaliou 141 participantes que realizaram BLS, com 29 (21%) positivos para SRA, e, das 36 que fizeram dissecção axilar, 23 (64%) desenvolveram a síndrome, mostrando que a dissecção axilar é um fator de risco importante para o desenvolvimento da SRA.
O estudo apresenta limitações no que se refere à dificuldade para conseguir uma amostra homogênea em relação ao tempo de acompanhamento e à deficiência metodológica dos artigos por trazerem formas diferentes e não tão esclarecidas na descrição dos resultados obtidos. Dessa forma, sugerem-se estudos futuros para a investigação mais detalhada da SRA, e seus métodos e técnicas de evasão, sendo necessárias mais pesquisas atuais nesse público-alvo.
CONCLUSÃO
Assim, observou-se que indivíduos que realizam tratamento para câncer de mama possuem uma taxa de ocorrência de 35% de desenvolver a SRA tanto da forma aguda quanto tardia. Esses achados sugerem que pacientes que fazem BLS têm um risco menor de apresentar a síndrome em comparação à dissecção linfonodal. O tipo de tratamento oncológico – quimioterapia ou radioterapia – mostra resultados quase equivalentes, 39% e 35% para o desencadeamento, e tanto a mastectomia quanto a cirurgia conservadora obtêm resultados que não são estatisticamente significantes para a SRA.
CONTRIBUIÇÕES
Todos os autores contribuíram em todas as etapas do artigo e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Koehler LA, Haddad TC, Hunter DW et al. Axillary web syndrome following breast cancer surgery: symptoms, complications, and management strategies. Breast Cancer (Dove Med Press); 2018;11:13-9. doi: https://doi.org/10.2147/BCTT.S146635
2. Sun YS, Zhao Z, Yang ZN, et al. Risk factors and preventions of breast cancer. Int J Biol Sci. 2017;13(11):1387-97. doi: https://doi.org/10.7150/ijbs.21635
3. Silva JDD, Oliveira RR, Silva MT, et al. Breast cancer mortality in young women in Brazil. Front Oncol. 2021;10:569933. doi: https://doi.org/10.3389/fonc.2020.569933
4. Dinas K, Kalder M, Zepiridis L, et al. Axillary web syndrome: incidence, pathogenesis, and management. Curr Probl Cancer. 2019;43(6):100470. doi: https://doi.org/10.1016/j.currproblcancer.2019.02.002
5. Alkabban FM, Ferguson T. Breast cancer. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 [updated 2022 Sept 26; cited 2022 Aug 21]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK482286
6. Luz CM, Deitos J, Siqueira TC, et al. Management of axillary web syndrome after breast cancer: evidence-based practice. Rev Bras Ginecol Obstet. 2017;39(11):632-9. doi: https://doi.org/10.1055/s-0037-1604181
7. Harris SR. Axillary web syndrome in breast cancer: a prevalent but under-recognized postoperative complication. Breast Care (Basel). 2018;13(2):132-5. doi: https://doi.org/10.1159/000485023
8. Shim YU, Chae YW, Park JW. Effectiveness of physical therapy management of axillary web syndrome following sentinel lymph node biopsy in breast cancer patients: case study. J Kor Phys Ther. 2016;28(2):142-8. doi: https://doi.org/10.18857/jkpt.2016.28.2.142
9. Cochrane Brasil [Internet]. São Paulo: The Cochrane Collaboration; c2022. Como fazer uma revisão sistemática Cochrane; [acesso 2021 ago 11]. Disponível em: https://brazil.cochrane.org/como-fazer-uma-revis%C3%A3o-sistem%C3%A1tica-cochrane
10. Moher D, Liberati A, Tetzlaff J, et al. Principais itens para relatar revisões sistemáticas e meta-análises: a recomendação PRISMA. Epidemiol Serv Saúde. 2015;24(2):335-42. doi: https://doi.org/10.5123/S1679-49742015000200017
11. Ministério da Saúde (BR). Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Ciência e Tecnologia. Coordenação-Geral de Gestão do Conhecimento. Diretrizes metodológicas: elaboração de revisão sistemática e metanálise de estudos observacionais comparativos sobre fatores de risco e prognóstico [Internet]. Brasília (DF): Ministério da Saúde; 2014 [acesso 2022 ago 15]. Disponível em: https://bvsms.saude.gov.br/bvs/ct/PDF/diretrizes_metodologias_estudos_observacionais.pdf
12. Sterne JA, Hernán MA, Reeves BC, et al. ROBINS-I: a tool for assessing risk of bias in non-randomised studies of interventions. BMJ. 2016;355:i4919. doi: https://doi.org/10.1136/bmj.i4919
13. Ministério da Saúde (BR). Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Ciência e Tecnologia. Diretrizes metodológicas: sistema GRADE: manual de graduação da qualidade da evidência e força de recomendação para tomada de decisão em saúde [Internet]. Brasília (DF): Ministério da Saúde; 2014 [acesso 2022 jul 10]. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/diretrizes_metodologicas_sistema_grade.pdf
14. Tay MRJ, Wong CJ, Aw HZ. Prevalence and associations of axillary web syndrome in Asian women after breast cancer surgery undergoing a community-based cancer rehabilitation program. BMC Cancer. 2021;21(1):1019. doi: https://doi.org/10.1186/s12885-021-08762-z
15. Sire A, Losco L, Cisari C, et al. Axillary web syndrome in women after breast cancer surgery referred to an Oncological Rehabilitation Unit: which are the main risk factors? A retrospective case-control study. Eur Rev Med Pharmacol Sci. 2020;24(15):8028-35. doi: https://doi.org/10.26355/eurrev_202008_22486
16. Ramírez-Parada K, Garay-Acevedo D, Mella-Abarca W, et al. Axillary web syndrome among Chilean women with breast cancer: incidence and possible predisposing factors. Support Care Cancer. 2020;28:2941-7. doi: https://doi.org/10.1007/s00520-019-05190-5
17. Wariss BR, Costa RM, Pereira ACPR, et al. Axillary web syndrome is not a risk factor for lymphoedema after 10 years of follow-up. Support Care Cancer. 2016;25:465-70. doi: https://doi.org/10.1007/s00520-016-3424-7
18. Moskovitz AH, Anderson BO, Yeung RS, et al. Axillary web syndrome after axillary dissection. Am J Surg. 2001;181(5):434-9. doi: https://doi.org/10.1016/s0002-9610(01)00602-x
19. Koehler LA, Blaes AH, Haddad TC, et al. Movement, function, pain, and postoperative edema in axillary web syndrome. Phys Ther. 2015;95(10):1345-53. doi: https://doi.org/10.2522/ptj.20140377
20. O'Toole J, Miller CL, Specht MC, et al. Cording following treatment for breast cancer. Breast Cancer Res Treat. 2013;140(1):105-11. doi: https://doi.org/10.1007/s10549-013-2616-9
21. Jeong S, Song BJ, Rhu J, et al. A risk factor analysis of axillary web syndrome in patients after breast cancer surgery: a single center study in Korea. Ann Rehabil Med. 2021;45(5):401-9. doi: https://doi.org/10.5535/arm.21092
22. Bergmann A, Mendes VV, Dias RA, et al. Incidence and risk factors for axillary web syndrome after breast cancer surgery. Breast Cancer Res Treat. 2012;131(3):987-92. doi: https://doi.org/10.1007/s10549-011-1805-7
23. Hassan MSU, Ansari J, Spooner D, et al. Chemotherapy for breast cancer (Review). Oncol Rep. 2010;24(5):1121-31. doi: https://doi.org/10.3892/or_00000963
24. Chou YH, Liao SF, Chen DR, et al. Axillary web syndrome after surgery for breast cancer. Research Square [Preprint]. 2022. doi: https://doi.org/10.21203/rs.3.rs-1866360/v1
25. Hennequin C, Belkacémi Y, Bourgier C, et al. Radiotherapy of breast cancer. Cancer Radiother. 2022;26(1-2):221-30. doi: https://doi.org/10.1016/j.canrad.2021.11.013
26. Fukushima KFP, Carmo LA, Borinelli AC, et al. Frequency and associated factors of axillary web syndrome in women who had undergone breast cancer surgery: a transversal and retrospective study. Springerplus. 2015;4:112. doi: https://doi.org/10.1186/s40064-015-0889-7
27. Pereira AP, Santos GR, Furtado LFT, et al. Mastectomia e mamoplastia na vida das mulheres com câncer de mama. Rev Cad Med. 2019;2(1):38-52.
28. Czajka ML, Pfeifer C. Breast cancer surgery. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 [updated 2023 Feb 8; cited 2022 June 10]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK553076
29. Tournieux TT. Fatores preditivos para um bom resultado estético em cirurgias conservadoras por câncer de mama. Rev Bras Cir Plást. 2012;27(1):37-48. doi: https://doi.org/10.1590/S1983-51752012000100008
30. Hu J, Xia X, Yang H, et al. Dissection of level III axillary lymph nodes in breast cancer. Cancer Manag Res. 2021;13:2041-6. doi: https://doi.org/10.2147/CMAR.S290345
31. Toomey A, Lewis CR. Axillary lymphadenectomy. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 [updated 2023 Feb 5; cited 2023 Feb 20]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK557873
Recebido em 28/3/2023
Aprovado em 26/6/2023
Editor-associado: Fernando Lopes Tavares de Lima. Orcid iD: https://orcid.org/0000-0002-8618-7608
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer | Ministério da Saúde