RELATO DE CASO
Fotobiomodulação na Síndrome de Stevens-Johnson no Câncer de Mama Metastático: Relato de Caso
Photobiomodulation in Stevens-Johnson Syndrome in a Metastatic Breast Cancer: Case Report
La Fotobiomodulación en el Síndrome de Stevens-Johnson en el Cáncer de Mama Metastásico: Informe de Caso
doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n3.4148
Marcela Ponzio Pinto e Silva1; Mariana Maia de Oliveira Sunemi2; Juliana Lenzi3; Maria Teresa Pace do Amaral4; Mariana Almada Bassani5
1,5Universidade Estadual de Campinas (Unicamp), Centro de Atenção Integral à Saúde da Mulher (Caism), Hospital da Mulher Professor Doutor José Aristodemo Pinotti. Campinas (SP), Brasil. E-mails: mponzio@unicamp.br; bassanimariana@hotmail.com. Orcid iD: https://orcid.org/0000-0003-0602-0910; Orcid iD: https://orcid.org/0009-0009-1516-3017
2Universidade Federal de Minas Gerais (UFMG), Escola de Educação Física, Fisioterapia e Terapia Ocupacional, Departamento de Fisioterapia. Belo Horizonte (MG), Brasil. E-mail: marimfo@yahoo.com.br. Orcid iD: https://orcid.org/0000-0001-6910-9387
3Clínica Pelvien. Campinas (SP), Brasil. E-mail: julianalenzi@terra.com.br. Orcid iD: https://orcid.org/0000-0002-9454-0440
4Universidade Federal de São Paulo (Unifesp), Departamento de Ciências do Movimento Humano. Santos (SP), Brasil. E-mail: mtp.amaral@unifesp.br. Orcid iD: https://orcid.org/0000-0003-2563-5822
Endereço para correspondência: Maria Teresa Pace do Amaral. Rua Silva Jardim, 136, térreo – Vila Mathias. Santos (SP), Brasil. CEP 11015-020. E-mail: mtp.amaral@unifesp.br
RESUMO
Introdução: A síndrome de Stevens-Johnson é uma condição rara e potencialmente fatal que requer diagnóstico precoce e tratamento adequado para garantir bom prognóstico. Em virtude da complexidade da síndrome e da falta de tratamento padrão para as feridas, o uso da fotobiomodulação tem sido discutido. Relato do caso: Mulher, 30 anos, com câncer de mama metastático, portadora das síndromes de Stevens-Johnson e de Li-Fraumeni Like, em uso da fotobiomodulação como estratégia adjuvante no tratamento da dor e das feridas na pele. As feridas cutâneas eritematosas envolveram quase toda a superfície corpórea, com lesões escamosas, crostosas e bolhosas, dolorosas, com pontos hemorrágicos em região posterior de ambos os lóbulos das orelhas e na região occipital, dificultando a acomodação da paciente em decúbito lateral e em posição semirreclinada. Foram realizadas duas aplicações da fotobiomodulação (vermelho, com comprimento de onda de 660 nm) nas regiões occipital e de orelhas, com dose de 2 Joules por ponto; e 4 Joules em região escapular para analgesia (infravermelho, com comprimento de onda de 808 nm). Ambas as aplicações foram seguidas de mobilização e liberação miofascial na região escapular. Em 48 horas, houve regressão das lesões cutâneas e melhora da dor, facilitando posicionamento adequado e indolor no leito. Após 15 sessões de fisioterapia, a paciente recebeu alta hospitalar. Conclusão: O uso da fotobiomodulação se mostrou eficaz para o tratamento complementar da fase aguda da síndrome de Stevens-Johnson no que diz respeito à regeneração tecidual e analgesia.
Palavras-chave: síndrome de Stevens-Johnson; terapia com luz de baixa intensidade; neoplasias da mama; especialidade de fisioterapia.
ABSTRACT
Introduction: Stevens-Johnson syndrome is a rare but potentially fatal condition, which requires early diagnosis and treatment to ensure good prognosis. Due to the complexity of the syndrome and the lack of a standard wound care treatment, the use of photobiomodulation has been discussed. Case report: A 30-year-old woman with metastatic breast cancer and Stevens-Johnson and Li-Fraumeni Like syndromes using photobiomodulation as an adjuvant strategy in the treatment of pain and skin wounds. The erythematous cutaneous lesions involved almost the entire body surface with painful, scaly, crusted and bullous lesions with bleeding spots in the posterior region of both ears lobes and in the occipital region which made it difficult to accommodate the patient in lateral decubitus and in semi-recumbent position. Two photobiomodulation applications (red, with a wavelength of 660 nm) were performed, where lesions in the occipital region and ears were treated with a dose of 2 Joules per point and 4 Joules in the scapular region for pain relief (infrared, with a wavelength of 808 nm), followed by mobilization and myofascial release in the scapular region. In 48 hours, the cutaneous lesions reduced, and the pain improved, which facilitated the adequate and painless positioning in bed. After 15 physiotherapy sessions, the patient was discharged. Conclusion: Photobiomodulation has been shown to be effective in the complementary treatment of the acute phase of Stevens-Johnson Syndrome regarding tissue regeneration and analgesia.
Key words: Stevens-Johnson syndrome; low-level light therapy; breast neoplasms; physical therapy specialty.
RESUMEN
Introducción: El síndrome de Stevens-Johnson es una condición rara y potencialmente fatal que requiere diagnóstico temprano y tratamiento adecuado para asegurar un buen pronóstico. Debido a la complejidad del síndrome y la falta de un tratamiento estándar de las heridas, se ha discutido el uso de fotobiomodulación. Informe del caso: Mujer, 30 años, con cáncer de mama metastásico, portadora de los síndromes de Stevens-Johnson y Li-Fraumeni Like en uso de la fotobiomodulación como estrategia adyuvante para el tratamiento del dolor y las heridas cutáneas. Las heridas cutáneas eritematosas comprometían casi toda la superficie corporal, con lesiones dolorosas, descamativas, costrosas y ampollosas, con puntos hemorrágicos en la región posterior de ambos lóbulos de las orejas y en la región occipital, que dificultaban la acomodación del paciente en decúbito lateral y en posición cómoda semirrecostada. Se realizaron dos aplicaciones de fotobiomodulación (rojo, con longitud de onda de 660 nm) en región occipital y auricular con dosis de 2 Joules por punto; y 4 Joules en la región escapular para analgesia (infrarrojo, con longitud de onda de 808 nm). Ambas aplicaciones fueron seguidas de movilización y liberación miofascial en la región escapular. En 48 horas hubo una regresión de las lesiones cutáneas y mejoría del dolor, lo que facilitó una adecuada e indolora posición en la cama. Después de 15 sesiones de fisioterapia, la paciente fue dada de alta del hospital. Conclusión: El uso de la fotobiomodulación demostró ser efectivo para el tratamiento complementario de la fase aguda del síndrome de Stevens-Johnson en lo que respecta a la regeneración tisular y la analgesia.
Palabras clave: síndrome de Stevens-Johnson; terapia por luz de baja intensidad; neoplasias de la mama; especialidad de fisioterapia.
INTRODUÇÃO
A síndrome de Stevens-Johnson (SSJ) é uma condição severa, potencialmente fatal1, que necessita de diagnóstico precoce e tratamento adequado para garantir bom prognóstico ao paciente2. Com incidência anual de um a dois casos por milhão de pessoas e mortalidade de 1% a 9%3, tem a sepse como causa principal de óbito2. Sua manifestação envolve mal-estar e febre, evoluindo com dolorosas lesões cutâneas e da membrana mucosa (ocular, oral e genital) que se caracterizam por exantema eritematoso disseminado4. As lesões podem aumentar de tamanho e número, coalescer, e a pele pode se desprender totalmente3,5, favorecendo o risco de infecção e alterando a estrutura acometida.
A hipersensibilidade mediada por imunocomplexos e desencadeada por drogas, infecções virais e neoplasias é a principal característica da SSJ1. Isso torna o paciente oncológico mais suscetível ao desenvolvimento da síndrome, pois o câncer e a terapia medicamentosa são importantes desencadeadores dessa condição1. Comorbidades, idade avançada, suscetibilidade genética e doenças imunes são fatores predisponentes. Anticonvulsivantes aromáticos, alopurinol e antibióticos, especialmente sulfonamidas, são as causas mais comuns da SSJ1.
Não há protocolo de tratamento estabelecido, mas sabe-se que a atuação de equipe multiprofissional pode aumentar a sobrevida3. O tratamento inclui retirada do fármaco causador, terapia supressora, suporte intensivo, comunicação de informações e apoio emocional1.
Nesse sentido, a fotobiomodulação (FBM) pode contribuir para melhorar lesões dermatológicas e dores decorrentes da SSJ. Efeitos analgésicos, de regeneração tecidual e de modulação do processo inflamatório estão estabelecidos na literatura para aplicação em diversas afecções6,7, inclusive em quadros oncológicos 8.
Embora os estudos incluídos em revisões sistemáticas9-11 sobre o uso da FBM em pacientes oncológicos apresentem desfecho positivo para complicações da radioterapia e quimioterapia, há divergência entre as respectivas metodologias. Essas revisões apontam ausência de informação sobre parâmetros utilizados e diversidade de protocolos9, insuficiência de dados e baixa qualidade de evidências10, e estudos com curto tempo de seguimento11, limitando, assim, a recomendação para uso da FBM na prática clínica oncológica.
Em razão da complexidade da SSJ associada à condição oncológica e à falta de um tratamento padrão, a FBM vem sendo discutida nessa condição.
Este projeto foi submetido ao Comitê de Ética em Pesquisa da Faculdade de Ciências Médicas, da Universidade Estadual de Campinas (Unicamp), e aprovado com o número de parecer 6.109.618 (CAAE: 69233923.0.0000.5404), em atendimento à Resolução 466/1212 do Conselho Nacional de Saúde para pesquisas com seres humanos. Justificou-se ao Comitê a dispensa da assinatura do Termo de Consentimento Livre e Esclarecido.
RELATO DO CASO
Mulher, 30 anos, diagnosticada em 2017 com câncer mamário e acompanhada no Centro de Atenção Integral à Saúde da Mulher (CAISM) da Unicamp. Nesse momento, realizou-se o sequenciamento genético comprovando presença da síndrome de Li-Fraumeni Like, condição autossômica dominante de predisposição a diversos tumores malignos em idade precoce. A síndrome associa-se a anormalidades no gene TP53 que codifica a proteína tumoral p5313.
Como tratamento oncológico, indicou-se quimioterapia neoadjuvante – quatro ciclos de adriamicina e ciclofosfamida, e 11 de carbocitabina e taxol. Em junho de 2018, a paciente foi submetida à mastectomia à direita com preservação de pele, biópsia do linfonodo sentinela e implante de dermoexpansor, sem indicação de terapia adjuvante.
Em março de 2019, durante exames pré-operatórios para o segundo tempo da reconstrução mamária, diagnosticou-se metástase óssea (calota craniana e terço médio do fêmur direito), visceral (fígado e pulmão), linfonodal, em tecido subcutâneo, em mama contralateral, e no sistema nervoso central (SNC), sendo indicadas radioterapia paliativa para SNC e quimioterapia com capecitabina.
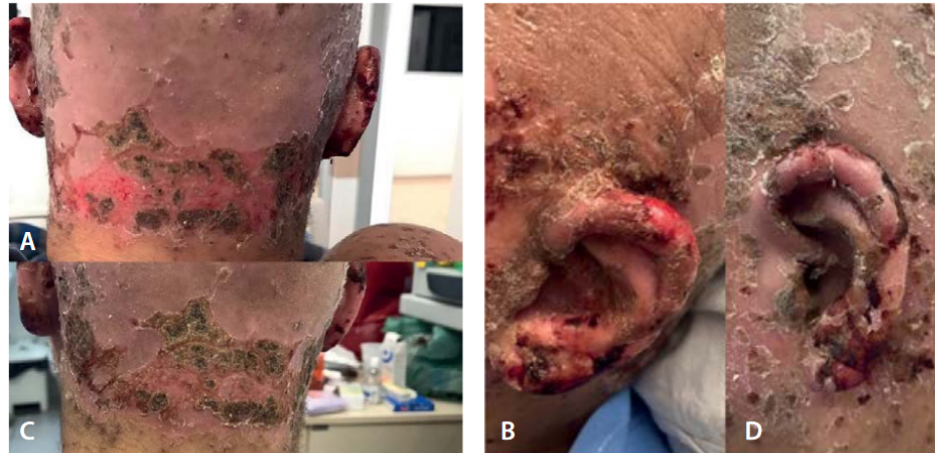
No mês seguinte, a paciente retornou ao hospital referindo crise convulsiva, sendo prescrita a fenitoína. Em maio de 2019, retornou ao CAISM com sinais e sintomas característicos da SSJ, provavelmente secundária à fenitoína. Além das alterações dermatológicas, observaram-se dispneia e dor aguda em bordo inferior da escápula direita. Após avaliação dermatológica e oftalmológica, o diagnóstico da SSJ foi confirmado. A fenitoína foi substituída por ácido valproico e indicou-se hidratação ocular em virtude da ceratoconjuntivite. As lesões cutâneas eritematosas envolveram quase toda superfície corporal. Lesões descamativas crostosas, bolhosas com pontos sangrantes e muito dolorosas surgiram em região occipital e posterior do lobo das orelhas (Figura 1, A e B, respectivamente), dificultando posicionamento nos decúbitos dorsal e lateral, e na posição semirreclinada.
Como escolha terapêutica para reparação tecidual das regiões das orelhas e occipital, a equipe de fisioterapia do CAISM optou por utilizar FBM portátil (da marca DMC®), com 100 MW de potência e spot size de 0,03 cm2, e os parâmetros: 2 Joules por ponto de aplicação com comprimento de onda vermelho de 660 nm; e, para analgesia em região escapular, 4 Joules com comprimento de onda infravermelho de 808 nm. Duas aplicações foram realizadas com intervalo de 24 horas e exercícios em pequenas amplitudes para ombros, mobilização escapular e liberação miofascial foram feitos nas duas sessões.
Após 48 horas dessas condutas, houve regressão das lesões cutâneas (Figura 1, C e D), diminuição da dor, e conforto durante as mudanças de decúbito, segundo relato da paciente. Simultaneamente à fisioterapia, suspendeu-se a ciclosporina. Entretanto, a paciente permaneceu internada para acompanhamento oncológico, oftalmológico e fisioterapêutico. Após 16 dias de internação e 15 sessões de fisioterapia, a paciente recebeu alta com orientação para retorno nas respectivas áreas.
|
|
|
Figura 1. Lesões em occipital (A); posterior de lóbulo da orelha (B); antes e após duas aplicações de FBM (C e D) |
DISCUSSÃO
O manejo dos sintomas da SSJ durante a fase aguda é complexo e a combinação de diferentes terapias parece ser efetiva. No entanto, o tratamento padrão ainda não está estabelecido3,5.
A FBM no processo de reparação tecidual tem evidência científica e o mecanismo de ação mais aceito é baseado no fotoaceptor mitocondrial, citocromo C oxidase e cromóforos na membrana plasmática das células. A interação do comprimento de onda no espectro vermelho com o fotoaceptor desencadeia vias de sinalização celular, alterando o metabolismo celular e sua proliferação14.
Encontraram-se estudos relacionados à SSJ associada à FBM para controle de lesões agudas cutâneas na literatura, demonstrando que esse recurso pode acelerar a reparação tecidual, aliviar a dor, reduzindo complicações e melhorando a qualidade de vida15,16. Simões et al.16 descreveram resultados positivos para analgesia e cicatrização em paciente pediátrico com SSJ, corroborando Rocha et al.17, que utilizaram FBM em mucosa oral com comprimento de onda vermelho e verificaram desfecho positivo. O estudo de Broughton et al.18 demonstra que a FBM acelera a fase aguda da inflamação, estimula a proliferação celular, aumenta a contração da ferida na pele e acelera a reepitelização, promovendo regeneração tecidual. Em casos oncológicos, a FBM vem sendo utilizada para manejar sintomas decorrentes da toxicidade do tratamento como mucosite oral, linfedema, radiodermite e neuropatia periférica induzida por quimioterapia. Porém, o desafio é saber se há ou não crescimento de células tumorais remanescentes a partir do estímulo promovido pela luz, aumentando o risco de recidivas ou desenvolvimento de segundo tumor primário11.
Analisaram-se os resultados de um estudo19 experimental randomizado, controlado e transversal, com grupos de ratas com câncer mamário induzido, seguido de mastectomia, aplicação de estimulação elétrica nervosa transcutânea (Tens), corrente interferencial ou FBM em região da ferida operatória. Verificou-se que, no grupo da FBM, não houve recorrência tumoral, diferentemente do resultado encontrado para Tens e corrente interferencial. Em outro estudo20, que avaliou a segurança da FBM aplicada na cabeça de pacientes com câncer de cabeça e pescoço, também não foi observado o desenvolvimento de recorrências tumorais e/ou novos tumores primários.
Entretanto, em uma revisão sistemática11 sobre segurança oncológica e FBM na prevenção e/ou tratamento de complicações relacionadas à terapia antineoplásica (mucosite oral, radiodermite, linfedema e neuropatia periférica induzida por quimioterapia), os autores sugerem que seu uso é seguro, mas concluem que estudos com protocolos de aplicação de FBM semelhantes e com acompanhamento em longo prazo são necessários para confirmar a segurança oncológica. Para esses autores, o tempo de seguimento inferior a dois anos pode ser considerado fator limitante relevante quando se trata de neoplasia maligna11.
Diante da ausência de consenso na literatura em relação à FBM e à segurança oncológica, somado à Síndrome de Li-Fraumeni Like, a equipe de fisioterapia discutiu exaustivamente se esse recurso deveria ser aplicado nas lesões cutâneas e na região dolorosa. As condições física e emocional em que a paciente se encontrava – com múltiplas metástases, sofrimento decorrente da dor nas lesões, dificuldade para movimentação e sono prejudicado – contribuiu fortemente para a decisão de utilizar a FBM. A melhora significativa dos sintomas em 48 horas, com alta da paciente pela equipe da dermatologia, teve um desfecho positivo para este caso.
CONCLUSÃO
Em razão da ausência de consenso na literatura sobre a utilização da FBM em situações oncológicas, os profissionais envolvidos devem discutir e considerar potenciais riscos e benefícios aos pacientes. Para este caso, a FBM foi efetiva como tratamento complementar em relação à regeneração tecidual e à analgesia, promovendo melhora à paciente. Estudos mais robustos devem ser realizados para melhor compreensão da FBM em condições oncológicas, permitindo avanço na definição de parâmetros com segurança.
CONTRIBUIÇÕES
Todas as autoras contribuíram substancialmente na concepção e/ou no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
1. Lin CC, Chen CB, Wang CW, et al. Stevens-Johnson syndrome and toxic epidermal necrolysis: risk factors, causality assessment and potential prevention strategies. Expert Rev Clin Immunol. 2020;16(4):373-87. doi: https://doi.org/10.1080/1744666X.2020.1740591
2. Lerch M, Mainetti C, Beretta-Piccoli BT, et al. Current perspectives on Stevens-Johnson syndrome and toxic epidermal necrolysis. Clin Rev Allergy Immunol. 2018;54(1):147-76. doi: https://doi.org/10.1007/s12016-017-8654-z
3. Papp A, Sikora S, Evans M, et al. Treatment of toxic epidermal necrolysis by a multidisciplinary team. A review of literature and treatment results. Burns. 2018;44(4):807-15. doi: https://doi.org/10.1016/j.burns.2017.10.022
4. Bay C, Vissing AC, Thaysen-Petersen D, et al. Skin reactions after photodynamic therapy are unaffected by 839 nm photobiomodulation therapy: a randomized, double-blind, placebo-controlled, clinical trial. Lasers Surg Med. 2017;49(9):810-8. doi: https://doi.org/10.1002/lsm.22690
5. Cartotto R. Burn Center Care of Patients with Stevens-Johnson syndrome and toxic epidermal necrolysis. Clin Plast Surg. 2017;44(3):583-95. doi: https://doi.org/10.1016/j.cps.2017.02.016
6. Fallah A, Mirzaei A, Gutknecht N, et al. Clinical effectiveness of low-level laser treatment on peripheral somatosensory neuropathy. Lasers Med Sci. 2017; 32(3):721-8. doi: https://doi.org/10.1007/s10103-016-2137-y
7. Heiskanen V, Hamblin MR. Photobiomodulation: lasers vs. light emitting diodes? Photochem Photobiol Sci. 2018;17(8):1003-17. doi: https://doi.org/10.1039/c8pp90049c
8. Zecha JAEM, Raber-Durlacher JE, Nair RG, et al. Low level laser therapy/photobiomodulation in the management of side effects of chemoradiation therapy in head and neck cancer: part 1: mechanisms of action, dosimetric, and safety considerations. Support Care Cancer. 2016;24(6):2781-92. doi: https://doi.org/10.1007/s00520-016-3152-z
9. Rocha SR, Ferreira SAC, Ramalho A, et al. Photobiomodulation therapy in the prevention and treatment of radiodermatitis in breast cancer patients: systematic review. J Lasers Med Sci. 2022;(13):e42. doi: https://doi.org/10.34172/jlms.2022.42
10. Wang Y, Ge Y, Xing W, et al. The effectiveness and safety of low-level laser therapy on breast cancer-related lymphedema: an overview and update of systematic reviews. Lasers Med Sci. 2022;37(3):1389-413. doi: https://doi.org/10.1007/s10103-021-03446-3
11. Paglioni MP, Araújo ALD, Arboleda LPA, et al. Tumor safety and side effects of photobiomodulation therapy used for prevention and management of cancer treatment toxicities. A systematic review. Oral Oncol. 2019;(93):21-8. doi: https://doi.org/10.1016/j.oraloncology.2019.04.004
12. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos [Internet]. Diário Oficial da União, Brasília, DF. 2013 jun 13 [acesso 2023 ago 2]; Seção I:59. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/cns/2013/res0466_12_12_2012.html
13. Andrade RC. Caracterização molecular de pacientes com suspeita clínica de síndrome de Li-Fraumeni e Li-Fraumeni like [tese na Internet]. Rio de Janeiro: Instituto Nacional de Câncer; 2016 [acesso 2023 mar 20]. Disponível em: https://docs.bvsalud.org/biblioref/coleciona-sus/2016/36016/36016-1385.pdf
14. Freitas LF, Hamblin MR. Proposed mechanisms of photobiomodulation or low-level light therapy. IEEE J Sel Top Quantum Electron. 2016;22(3):1-37. doi: https://doi.org/10.1109/JSTQE.2016.2561201
15. Jadhav P, Rogers JE, Shroff R. A case report - Stevens-Johnson syndrome as an adverse effect of capecitabine. J Gastrointest Cancer. 2018;49(3):349-50. doi: https://doi.org/10.1007/s12029-016-9916-3
16. Simões A, Freitas PM, Bello-Silva MS, et al. Laser phototherapy for Stevens-Johnson syndrome: a case report. Photomed Laser Surg. 2011;29(1):67-9. doi: https://doi.org/10.1089/pho.2009.2671
17. Rocha BA, Melo Filho MR, Santos LAN, et al. Terapia de fotobiomodulação no tratamento das lesões orais da síndrome de Stevens-Johnson: relato de caso. HU Rev. 2019;45(4):478-82. doi: https://doi.org/10.34019/1982-8047.2019.v45.25799
18. Broughton G, Janis JE, Attinger CE. The basic science of wound healing. Plast Reconstr Surg. 2006;117(7Suppl.):12-34. doi: https://doi.org/10.1097/01.prs.0000225430.42531.c2
19. Rezende LF, Costa ECS, Lenzi J, et al. Transcutaneous electrical stimulation, interferential current and photobiomodulation may lead to the recurrence of breast cancer in rats? Rev Bras Cancerol. 2022;68(3):e-022383. doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n3.2383
20. Brandão TB, Morais-Faria K, Ribeiro ACP, et al. Locally advanced oral squamous cell carcinoma patients treated with photobiomodulation for prevention of oral mucositis: retrospective outcomes and safety analyses. Support Care Cancer. 2018;26(7):2417-23. doi: https://doi.org/10.1007/s00520-018-4046-z
Recebido em 20/6/2023
Aprovado em 11/7/2023
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer | Ministério da Saúde