ARTIGO ORIGINAL
Modelagem Matemática da Imunoterapia para Tumores: Análise Computacional da Terapia Celular Adotiva com Interleucina-2
Mathematical Modeling of Immunotherapy for Tumors: Computational Analysis of Adoptive Cell Therapy with Interleukin-2
Modelización Matemática de la Inmunoterapia de Tumores: Análisis Computacional de la Terapia Celular Adoptiva con Interleucina-2
https://doi.org/10.32635/2176-9745.RBC.2024v70n1.4446
Jeferson Miguel Melo Antunes1; Valeria Mattos da Rosa2
1Universidade Federal de Juiz de Fora (UFJF), Faculdade de Medicina. Juiz de Fora (MG), Brasil. E-mail: jefersonmmantunes@gmail.com. Orcid iD: https://orcid.org/0000-0003-1388-9825
2UFJF, Instituto de Ciências Exatas, Departamento de Matemática. Juiz de Fora (MG), Brasil. E-mail: valeria.rosa@ufjf.br. Orcid iD: https://orcid.org/0000-0002-6007-0380
Endereço para correspondência: Jeferson Miguel Melo Antunes. Via Local, 880 – São Pedro. Juiz de Fora (MG), Brasil. CEP 36036-900. E-mail: jefersonmmantunes@gmail.com
RESUMO
Introdução: O câncer é uma das principais causas de óbito no mundo, mas ainda há aspectos desconhecidos da sua dinâmica. Uma importante ferramenta para seu estudo é a modelagem matemática, que analisa e projeta o comportamento tumoral. Um modelo deve ser validado in silico para ser útil. Objetivo: Validar um modelo matemático para imunoterapia contra tumores, avaliar como a composição celular da terapia celular adotiva interfere na resposta e qual o esquema mais adequado para administração de interleucina-2 quanto à dose e ao tempo de uso. Método: Foi desenvolvido um modelo de equações diferenciais ordinárias. Os parâmetros foram obtidos da literatura, adaptados ou simulados. As soluções foram encontradas usando o software Octave 8.1.0 e comparadas com a literatura. Resultados: Os resultados, comparados com dados de ensaios clínicos e outras modelagens, mostram que o modelo é válido para reproduzir a dinâmica tumoral. Ademais, a infusão da terapia celular adotiva com predomínio de linfócitos T CD8+ parece ligeiramente mais vantajosa do que a infusão com predomínio de linfócitos T CD4+; doses altas, porém toleráveis, de interleucina-2 geram melhor resposta antitumoral; e a administração de interleucina-2 por mais tempo maximiza a resposta. Conclusão: O modelo é válido para estudo da dinâmica tumoral e pode auxiliar no desenvolvimento de novas pesquisas. Adicionalmente, a imunoterapia com predomínio de linfócitos T CD8+ em relação a linfócitos T CD4+ e com interleucina-2 em doses mais altas e por mais tempo, respeitando a tolerância, apresentou melhores resultados in silico.
Palavras-chave: Modelos Teóricos; Simulação por Computador; Imunoterapia Adotiva; Neoplasias/epidemiologia.
ABSTRACT
Introduction: Cancer is one of the main causes of death in the world, but there are still unknown aspects of its dynamics. An important tool for its study is mathematical modeling, which analyzes and projects tumor behavior. A model must be validated in silico to be useful. Objective: Validate a mathematical model for immunotherapy against tumors, to evaluate how the cellular composition of the adoptive cell therapy interferes with the response and which is the most appropriate scheme for administering interleukin-2 in terms of dose and time of use. Method: An ordinary differential equation model was developed. The parameters were obtained from the literature, adapted or simulated. The solutions were found using Octave 8.1.0 software and compared with the literature. Results: The results, compared with data from clinical trials and other modeling, show that the model is valid for reproducing tumor dynamics. In addition, infusion of adoptive cell therapy with a predominance of CD8+ T lymphocytes appears slightly more advantageous than infusion with a predominance of CD4+ T lymphocytes; high but tolerable doses of interleukin-2 generate a better anti-tumor response; and longer administration of interleukin-2 maximizes the response. Conclusion: The model is valid for studying tumor dynamics and can help in the development of new research. In addition, immunotherapy with a predominance of CD8+ T lymphocytes over CD4+ T lymphocytes and with interleukin-2 in higher doses and for longer periods, respecting tolerance, showed better results in silico.
Key words: Models, Theoretical; Computer Simulation; Immunotherapy, Adoptive; Neoplasms/epidemiology.
RESUMEN
Introducción: El cáncer es una de las principales causas de muerte en todo el mundo, pero aún se desconocen aspectos de su dinámica. Una herramienta importante para su estudio es la modelización matemática, que analiza y proyecta el comportamiento tumoral. Para que un modelo sea útil debe ser validado in silico. Objetivo: Validar un modelo matemático de inmunoterapia contra tumores, evaluar cómo interfiere la composición celular de la terapia celular adoptiva en la respuesta y cuál es el esquema más adecuado de administración de interleuquina-2 en cuanto a dosis y tiempo de utilización. Método: Se desarrolló un modelo de ecuaciones diferenciales ordinarias. Los parámetros se obtuvieron de la literatura, se adaptaron o se simularon. Las soluciones se hallaron con el software Octave 8.1.0 y se compararon con las de la bibliografía. Resultados: Los resultados, comparados con datos de ensayos clínicos y otras modelizaciones, muestran que el modelo es válido para reproducir la dinámica tumoral. Además, la infusión de terapia celular adoptiva con predominio de linfocitos T CD8+ parece ligeramente más ventajosa que la infusión con predominio de linfocitos T CD4+; dosis altas pero tolerables de interleuquina-2 generan una mejor respuesta antitumoral; y la administración de interleuquina-2 durante más tiempo maximiza la respuesta. Conclusión: El modelo es válido para estudiar la dinámica tumoral y podría ayudar en el desarrollo de nuevas investigaciones. Además, la inmunoterapia con predominio de linfocitos T CD8+ sobre linfocitos T CD4+ y con interleuquina-2 en dosis más altas y durante más tiempo, respetando la tolerancia, mostró mejores resultados in silico.
Palabras clave: Modelos Teóricos; Simulación por Computador; Inmunoterapia Adoptiva; Neoplasias/epidemiología.
INTRODUÇÃO
Com o envelhecimento da população e a evolução no diagnóstico e tratamento de outras doenças, o câncer vem se destacando nas últimas décadas como uma das principais causas de óbito no mundo. Além de ter se tornado a principal causa de morte em metade dos Estados Unidos e em alguns países da Europa Ocidental, já é a principal causa de óbito em quase 10% das cidades brasileiras¹. Embora tenha havido muitos desenvolvimentos em terapias contra o câncer, ainda há muito que se desconhece sobre a dinâmica de como as células cancerosas surgem, propagam-se e são destruídas².
Nesse contexto, tem crescido a busca da comunidade científica por modelos matemáticos capazes de auxiliar na previsão do comportamento de tumores e, consequentemente, no desenvolvimento de estudos experimentais para tratamentos. Modelos teóricos apresentam vantagens sobre trabalhos experimentais e estudos clínicos por serem muito menos caros, menos demorados e possibilitarem alterar as influências ambientais e escalas de parâmetros com mais facilidade³. Com base na experiência sobre a dinâmica evolutiva dos tumores, a modelagem matemática emerge como uma ferramenta essencial para criar testes de hipóteses eficientes4. Embora esses modelos tenham fornecido informações úteis sobre a ação do sistema imunológico no controle do crescimento do tumor, ainda há uma grande necessidade de aprimorar os modelos existentes para incorporar novos desenvolvimentos clínicos e descobertas biológicas². A escolha de um modelo de crescimento apropriado pode levar a uma melhor compreensão da interação entre as células tumorais e as células do sistema imunológico, bem como ao efeito de diferentes tratamentos no crescimento ou inibição do câncer5. Nesse sentido, o trabalho sugere uma adaptação do modelo apresentado por Usman e Cunningham6, um aprimoramento do modelo de Kirschner e Panetta7, aplicável principalmente ao melanoma metastático e ao carcinoma de células renais6 (RCC) sob imunoterapia com interleucina-2 (IL-2) e terapia celular adotiva (ACT).
Kirschner e Panetta7 desenvolveram seu modelo a partir da análise de modelos anteriores e de dados experimentais, com o intuito de incorporar os conceitos mais importantes da dinâmica tumoral sob imunoterapia da forma mais simples possível. Usman e Cunningham6 trabalharam sobre esse modelo para torná-lo mais compatível com a realidade observada em um ensaio clínico para monoterapia com IL-28. Entretanto, a ACT na forma de linfócitos infiltrantes de tumor (TIL) tem sido de crescente interesse como tratamento oncológico na última década9, além de mostrar-se mais eficaz quando há a associação entre infusão de linfócitos T (LT) e terapia com IL-210. Ademais, estudos clínicos sugerem que a composição da infusão de TIL quanto ao tipo celular tem papel importante sobre a resposta terapêutica10-12. Por isso, é proposta uma adaptação do modelo para permitir a análise da composição celular da infusão de TIL, e foi feita a aplicação para a terapia conjunta com TIL e IL-2, avaliando a compatibilidade dos resultados com ensaios clínicos mais recentes, a fim de testar sua validade.
Ao longo do desenvolvimento da ACT, foram elaboradas técnicas que permitiram a expansão em grande escala de TIL e muitos ensaios clínicos foram realizados por diferentes centros. A ACT envolvendo um regime tripartido com quimioterapia de linfodepleção, administração de células T e alta dose de IL-2 mostrou-se capaz de mediar regressão tumoral durável em várias instituições10. Entretanto, houve variações significativas nos protocolos, de modo que várias questões importantes em relação à reprodutibilidade da terapia, e as melhores práticas permanecem abertas, como o número de TIL infundidos, a dose de IL-2 e a duração dos TIL cultivados13. Portanto, é importante a validação de modelos matemáticos que possam ser utilizados para análises prévias in silico, a fim de escolher estratégias terapêuticas mais viáveis e com maior chance de sucesso para novas pesquisas experimentais.
O objetivo primário deste estudo é analisar a validade da adaptação proposta ao modelo discutido por Usman e Cunningham6 para estudo da imunoterapia antitumoral. Como objetivo secundário, busca avaliar como a composição celular da ACT interfere no tratamento e qual o esquema mais adequado para administração de IL-2, concomitantemente, avaliando a dose e o tempo de tratamento.
MÉTODO
O modelo apresentado por Usman e Cunningham6 utiliza equações diferenciais ordinárias (EDO) para descrever a taxa de crescimento das células efetoras, das células tumorais e da IL-2. A adaptação proposta separa as células efetoras em duas EDO, a fim de permitir a análise da composição celular da ACT quanto à presença de LT CD4+ e LT CD8+. O modelo propõe as seguintes EDO para descrever o crescimento dos LT CD4+, LT CD8+, das células tumorais e da IL-2, respectivamente:
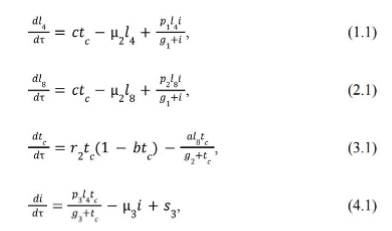
onde ![]() representa os LT CD4+;
representa os LT CD4+; ![]() os LT CD8+; tc as células tumorais;
e i a IL-2 no espaço tumoral. Com relação aos demais parâmetros: τ
é o tempo; c é a antigenicidade do tumor; µ2 é a taxa
de morte natural dos linfócitos; pi são as taxas de formação
dos linfócitos e da IL-2; gi são as capacidades de suporte; si
é o controle, ou seja, a taxa de injeção de TIL e de IL-2; r2
é a taxa de crescimento do tumor; b é o inverso da capacidade de carga
do tumor; a é a intensidade da resposta imune; µ3 é a
taxa de eliminação de IL-2.
os LT CD8+; tc as células tumorais;
e i a IL-2 no espaço tumoral. Com relação aos demais parâmetros: τ
é o tempo; c é a antigenicidade do tumor; µ2 é a taxa
de morte natural dos linfócitos; pi são as taxas de formação
dos linfócitos e da IL-2; gi são as capacidades de suporte; si
é o controle, ou seja, a taxa de injeção de TIL e de IL-2; r2
é a taxa de crescimento do tumor; b é o inverso da capacidade de carga
do tumor; a é a intensidade da resposta imune; µ3 é a
taxa de eliminação de IL-2.
Nas equações 1.1 e 2.1, o primeiro termo representa a proliferação dos linfócitos diante da presença de células tumorais. A presença dessas células aumenta a apresentação de antígenos tumorais para as células imunológicas. Ademais, a antigenicidade dessas moléculas definirá a intensidade da ativação imune. Assim, os antígenos tumorais ativam células T imaturas para tornarem-se linfócitos T citotóxicos (CTL) efetores. O segundo reproduz a morte natural dos linfócitos e o terceiro modela sua expansão e maturação pela ação estimulatória da IL-2. A dose de TIL é introduzida no modelo como condição inicial (s1 para LT CD4+ e s2 para LT CD8+), uma vez que é aplicada em infusão única no dia 0 após regime de linfodepleção que reduziria a quantidade local de células imunes a um valor desprezível diante da grande quantidade aplicada na terapia. O primeiro termo da equação 3.1 modela a expansão tumoral na forma de crescimento logístico, ao passo que o segundo reproduz a morte das células tumorais pela ação imune. Na equação 4.1, o primeiro termo representa a produção de IL-2 pelos linfócitos T helper (Th) em resposta à presença do tumor. O segundo modela a eliminação natural de IL-2 pelo organismo. O terceiro representa a infusão de IL-2. Tal infusão ocorre na prática a cada oito horas. No entanto, com o intuito de manter a avaliação dos resultados na forma diária, simplificou-se um valor único de IL-2 adicionado por dia.
Realizou-se revisão bibliográfica com artigos relacionados ao tema levantados nas bases de indexação MEDLINE, SciELO e LILACS e, em seguida, foram feitas análise, comparação e descrição das informações encontradas. Os dados e parâmetros foram obtidos da literatura e aplicados às equações matemáticas do modelo (Tabela 1). Foram selecionados os valores para parâmetros encontrados em trabalhos baseados em modelos semelhantes ao discutido aqui e aplicáveis para imunoterapia6,7,14-18. Quando necessário, os parâmetros foram ajustados ou estimados à proposta do modelo e aos resultados parciais encontrados, a fim de torná-los mais próximos da realidade. Quando possível, foram priorizados trabalhos desenvolvidos sobre a terapia com TIL em relação às demais formas de ACT com o intuito de selecionar dados mais consistentes para a análise e mais relevantes para estudos futuros. Nos parâmetros sujeitos a variações, foram selecionados os valores mais compatíveis com cada situação analisada. O estudo tomou como referência o esquema de doses composto por linfodepleção prévia, infusão única de TIL no dia 0 e infusões de IL-2 nos dias seguintes, por até 15 doses19,20. Além disso, utilizou como base um esquema de TIL composto por 40% de LT CD4+ e 60% de LT CD8+, modificado apenas nas simulações específicas voltadas para composição percentual. Ademais, considerou uma população inicial de células tumorais altas, levando-se em conta que esse tratamento tem sido sugerido principalmente para pacientes com câncer avançado13.
Tabela 1. Parâmetros utilizados nas simulações
|
Parâmetro |
Significado |
Valor |
Unidade |
Referência do valor |
|
μ2 |
Taxa de morte natural de LT |
0,03 |
dias⁻¹ |
6 |
|
μ3 |
Taxa de eliminação de IL-2 |
10 |
dias⁻¹ |
6 |
|
p1 |
Taxa de formação de LT CD4+ |
0,1245 |
dias⁻¹ |
6 |
|
p2 |
Taxa de formação de LT CD8+ |
2,241 |
dias⁻¹ |
Estimado pelos autores |
|
p3 |
Taxa de formação de IL-2 |
5 |
dias⁻¹ |
6 |
|
g1 |
Capacidade de suporte para LT |
2×10⁷ |
mL⁻¹ |
6 |
|
g2 |
Capacidade de suporte para células tumorais |
10⁵ |
mL⁻¹ |
6 |
|
g3 |
Capacidade de suporte para IL-2 |
10³ |
mL⁻¹ |
6 |
|
a |
Intensidade da resposta imune |
1,3 |
mL×dias⁻¹ |
Estimado pelos autores |
|
b |
Inverso da capacidade de carga do tumor |
10⁻⁹ |
mL⁻¹ |
6 |
|
c |
Antigenicidade do tumor |
0,00005 |
dias⁻¹ |
6 |
|
r2 |
Taxa de crescimento do tumor |
0,18 |
dias⁻¹ |
6 |
|
s1 |
Dose de LT CD4+ |
0,4×2,5× |
dias⁻¹ |
Estimado pelos autores |
|
s2
|
Dose de LT CD8+ |
0,6×2,5× |
dias⁻¹ |
Estimado pelos autores |
|
s3 |
Dose de IL-2 |
9,6× |
dias⁻¹ |
Estimado pelos autores |
Legendas: LT = linfócitos T; IL-2 = interleucina-2; LT
CD4+ = linfócitos T CD4+;
LT CD8+ = linfócitos T CD8+; mL = mililitros.
As soluções foram encontradas por meio do software Octave 8.1.021, utilizando código desenvolvido pelos autores em linguagem C++. Os resultados foram analisados de acordo com a literatura vigente, com ênfase na comparação com resultados de ensaios clínicos e outras modelagens. As modelagens utilizadas foram selecionadas por ter alguma semelhança com o presente trabalho, por exemplo, ao simular o mesmo tratamento, ter princípios matemáticos comuns, ou analisar os mesmos parâmetros. Os ensaios utilizados foram obtidos pela busca nas bases de dados citadas. Foram incluídos estudos com TIL convencional e IL-2 em alta dose. Para exclusão, foram descartados trabalhos publicados antes do ano de 2011 e com amostras menores do que 30 pacientes.
O GNU Octave é um software de código aberto sob a licença GNU General Public License (GPL), desenvolvido pela comunidade Octave, com contribuições significativas de desenvolvedores voluntários. Foi utilizado neste trabalho por ser uma ferramenta gratuita e de código aberto de computação numérica e visualização de dados compatível com o MATLAB. Possui ferramentas para resolver problemas de álgebra linear numérica, encontrar raízes de equações não lineares, integrar funções ordinárias, manipular polinômios e integrar EDO e equações algébricas diferenciais. Pode ser personalizado por meio de funções definidas pelo usuário escritas na própria linguagem do Octave ou usando módulos em C++, C, Fortran e outras linguagens.
De acordo com a Resolução n.º 510/201622, do Conselho Nacional de Saúde (CNS), pesquisas que utilizam bases de dados públicas, sem identificação de pacientes, estão isentas da necessidade de análise ética.
RESULTADOS
As simulações com predomínio de LT CD8+ apresentaram resultados ligeiramente melhores do que as simulações com predomínio de LT CD4+, entretanto, a diferença foi pouco perceptível visualmente nos gráficos. Especificamente, as simulações caracterizadas por um predomínio de 70% de LT CD8+ apresentaram uma resposta ligeiramente mais rápida, após 106 dias, enquanto a simulação com 70% de LT CD4+ obteve remissão completa após 108 dias. Além disso, a simulação com 70% de LT CD8+ obteve um pico de células tumorais menor (9,62×108 células tumorais) em comparação às que tinham um predomínio de 70% de LT CD4+ (9,71×108 células tumorais).
Os resultados das simulações com doses mais elevadas de IL-2 apresentaram resposta antitumoral mais robusta. Nas simulações, doses mais baixas não alcançaram respostas satisfatórias, conforme demonstrado na Figura 1, enquanto doses elevadas promoveram uma diminuição mais rápida e eficiente do tumor (Figura 2). É importante destacar que os resultados não detectaram sinal de descontrole na quantidade de IL-2, um evento potencialmente relacionado à síndrome de liberação de citocinas.
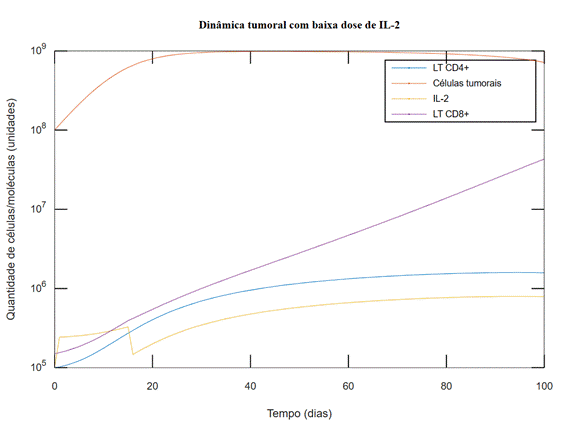
Figura 1.
Simulação com baixa dose de IL-2 durante 15 dias: Dose mais baixa de IL-2 não
gerou resposta satisfatória no período avaliado (s3 = 9,6×![]() /5)
/5)
Legendas: IL-2 = Interleucina-2; LT CD4+ = linfócitos T CD4+; LT CD8+ = linfócitos T CD8+.
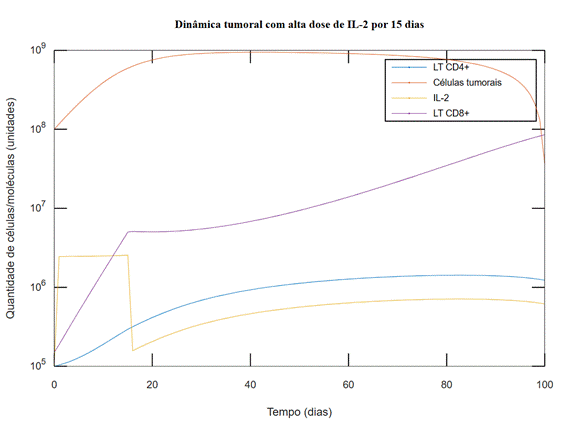
Figura 2. Simulação
com alta dose de IL-2 durante 15 dias: Dose mais alta de IL-2 gerou resposta
mais cedo e mais intensa (s3 = 9,6×![]() /4). Observa-se também o comportamento tumoral e imune
com aplicação da IL-2 durante 15 dias. A simulação gerou resposta antitumoral,
sem gerar descontrole na quantidade de IL-2
/4). Observa-se também o comportamento tumoral e imune
com aplicação da IL-2 durante 15 dias. A simulação gerou resposta antitumoral,
sem gerar descontrole na quantidade de IL-2
Legendas: IL-2 = Interleucina-2; LT CD4+ = linfócitos T CD4+; LT CD8+ = linfócitos T CD8+.
Os resultados mostram diferença de resposta a depender do intervalo de aplicação da IL-2 seguindo a infusão de TIL na modulação da resposta antitumoral. As simulações indicam uma resposta antitumoral mais pronunciada ao maximizar a duração da administração de IL-2, mantendo a dose constante. A infusão de IL-2 por 15 dias (Figura 2) gerou resposta mais robusta e mais rápida do que a infusão por apenas sete dias (Figura 3). Notavelmente, uma resposta mais eficiente é evidenciada ao estender o uso de IL-2, seguindo um limite estabelecido de 15 dias (Figura 2).
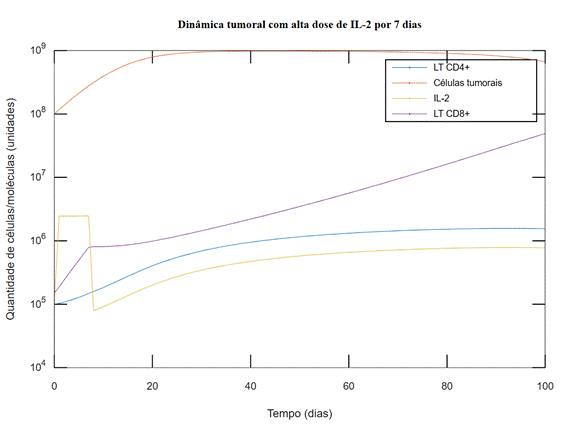
Figura 3. Simulação com alta dose de IL-2
durante sete dias: Comportamento tumoral e imune com aplicação da IL-2 (s3
= 9,6×![]() /4) durante sete dias. No período testado, não foi
observada resposta desejável
/4) durante sete dias. No período testado, não foi
observada resposta desejável
Legendas: IL-2 = Interleucina-2; IL-2 = interleucina-2; LT CD4+ = linfócitos T CD4+; LT CD8+ = linfócitos T CD8+.
DISCUSSÃO
Optou-se por uma abordagem consagrada ao utilizar modelagem matemática para simular o comportamento de tumores sólidos sob tratamento, realizada em ampla gama de pesquisas2,6,7,14-16. Porém, este trabalho amplia os estudos de Kirschner e Panetta7 e Usman e Cunningham6 sobre o comportamento do melanoma metastático e do RCC. Foi feita uma análise específica da ACT com IL-2 nesses dois tipos de câncer e, assim, ampliaram-se as possibilidades ao estudar a influência da composição celular da infusão de TIL na resposta terapêutica. Os autores dos modelos que inspiraram este trabalho6,7 desenvolveram um modelo simplificado da dinâmica tumoral sob imunoterapia7 e adaptaram esse modelo para monoterapia com IL-26. Este estudo expande o escopo ao simular o tratamento combinado com ACT e IL-2, considerando diferentes proporções de LT CD4+ e LT CD8+ na infusão de TIL. Apesar de a composição celular da ACT ser considerada importante por trabalhos clínicos10-12, os modelos prévios6,7 não permitiam seu estudo por utilizarem equação única para representar as células imunológicas. Além disso, o estudo investigou o efeito da dose e da duração da administração de IL-2, não deixando de investigar o papel da citocina na resposta terapêutica. As simulações realizadas fornecem informações sobre a eficácia da terapia em diferentes cenários, sugerindo posologias adequadas de IL-2 e a composição mais eficiente da infusão de TIL para maximizar a resposta antitumoral.
A validação de modelos matemáticos contribui para entender a qualidade de um modelo em função dos objetivos estabelecidos, alinhando-o com os dados observados23. As simulações do modelo proposto apresentam comportamento semelhante ao relatado na literatura nos principais pontos, como tempo para gerar resposta entre dois e quatro meses24, possibilidade de sucesso ou fracasso no tratamento, tempo de aplicação da terapia e possibilidade de sucesso sem gerar toxicidade. Embora os modelos sejam ferramentas poderosas para capturar complexidades da realidade, é fundamental reconhecer suas limitações. Em vez de buscar uma validação absoluta, deve-se buscar entender e quantificar as incertezas associadas a um modelo, permitindo uma interpretação mais responsável dos seus resultados25. Assim, os resultados de experimentos teóricos são úteis, mas não devem ser tomados como previsões25.
A composição da infusão de TIL, particularmente a proporção entre LT CD4+ e LT CD8+, parece desempenhar algum papel na modulação da resposta à ACT com IL-2. Embora os LT CD8+ sejam frequentemente os principais efetores na eliminação de células tumorais26, a presença e a proporção de LT CD4+ podem ser fundamentais para potencializar a eficácia antitumoral27. De fato, outro estudo28 sugere que uma proporção equilibrada entre LT CD4+ e LT CD8+ pode ser crucial para a homeostase e a função ótima durante a ACT. Além disso, a IL-2, usada em conjunto com a terapia, favorece a expansão e sobrevivência dos linfócitos T29. No entanto, o percentual ideal de LT CD4+ e LT CD8+ que maximiza a eficácia terapêutica ainda é tema de investigação contínua e pode variar de acordo com o contexto clínico.
As simulações realizadas sugerem que um predomínio na quantidade de LT CD8+ em relação aos LT CD4+ pode ser capaz de induzir a melhor resposta antitumoral, com tempo e pico de tamanho menores, embora a diferença observada tenha sido pequena. Estudos observaram que um predomínio de LT CD8+ pode levar a uma maior atividade antitumoral10-12. De fato, muitos LT CD8+ podem ser necessários para destruir grandes quantidades de células afetadas, ao passo que um número relativamente pequeno de LT CD4+ produtores de citocinas pode ser suficiente30. Em contraste, enquanto os LT CD4+ são fundamentais para a coordenação da resposta imune, uma proporção excessiva em relação aos LT CD8+ pode não conferir o mesmo efeito citotóxico direto contra as células tumorais11. No entanto, ainda não se chegou a um consenso sobre o impacto exato da composição percentual nos resultados. A variação na composição da infusão não conseguiu distinguir de maneira conclusiva e definitiva os pacientes que tiveram respostas positivas daqueles que não tiveram, embora tenha sido observada tendência de melhor resposta quando há predomínio de LT CD8+10.
A dose de IL-2 administrada é um fator determinante para a eficácia da ACT. As simulações sugerem que doses baixas de IL-2 geram resposta insuficiente para combater o tumor, enquanto as melhores respostas são observadas com o uso de doses mais altas de IL-2 (Figura 2). Esse resultado é compatível com um estudo clínico8, que concluiu que doses elevadas de IL-2 podem induzir a rápida expansão dos linfócitos T, potencialmente melhorando a atividade antitumoral. Outros estudos in vivo10,11,13 e in silico15 também apontam que doses maiores de IL-2 tendem a gerar melhor resposta antitumoral. No entanto, doses muito altas podem gerar efeitos colaterais significativos, como a síndrome de liberação de citocinas, o que pode limitar sua aplicabilidade em alguns pacientes14. Apesar disso, observa-se que doses toleráveis muitas vezes são suficientes para causar remissão do tumor nas simulações computacionais. Nos estudos clínicos com TIL+IL-2, 41% dos pacientes apresentaram resposta objetiva diante de protocolos de tratamento toleráveis13. Por isso, o presente estudo não simulou doses extremamente altas e não encontrou sinais que poderiam sugerir síndrome de liberação de citocinas, uma vez que não ultrapassou os limiares para toxicidade na quantidade de IL-2 sugeridos6. Isso confirma outro estudo31, que afirma que os efeitos adversos são importantes, mas a exposição sequencial é segura e pode valer a pena. Diante disso, os resultados sugerem que a dose de IL-2 ideal seria a dose máxima para a qual os efeitos adversos são toleráveis. Esse valor é variável entre cada paciente, destacando a importância do acompanhamento dos efeitos colaterais.
A duração da administração de IL-2 parece desempenhar um papel significativo na modulação da resposta da ACT. O estudo observou que um tempo de uso muito curto da IL-2 pode prejudicar a obtenção de uma resposta antitumoral efetiva (Figura 3). Ao mesmo tempo, a infusão da citocina por até 15 dias gerou um resultado mais satisfatório (Figura 2), com resposta mais efetiva, sem sugestão da ocorrência de efeitos adversos. Há algum tempo já se destacava que a persistência prolongada da IL-2 pode resultar em uma expansão mais extensa de linfócitos T transferidos, potencialmente aprimorando a atividade antitumoral8. No entanto, há a necessidade de impor um limite ao tempo de uso da IL-2 pelo seu duplo papel como imunomodulador, uma vez que a exposição contínua pode também favorecer a expansão e função dos linfócitos T reguladores, que podem suprimir a resposta imunológica antitumoral32. Nesse sentido, foram considerados 15 dias como o tempo máximo para infusão de IL-2. Além disso, a duração da administração de IL-2 pode impactar a incidência de efeitos colaterais, e tratamentos prolongados e com doses altas têm potencial para exacerbar reações adversas como o extravasamento capilar32. Portanto, otimizar a duração do tratamento com IL-2 é crucial para balancear entre potência terapêutica e segurança do paciente.
Apesar de trazer informações importantes sobre a dinâmica da resposta tumoral e aprofundar o conhecimento sobre os tumores estudados, o estudo reconhece algumas limitações na abordagem que poderão ser reconsideradas em trabalhos futuros. Este trabalho não considera as variações na taxa de proliferação dos linfócitos T ao longo do tempo, nem a formação de uma população de células T de memória em seu modelo, com o intuito de simplificar a análise e não necessitar estimar uma grande quantidade de parâmetros novos, o que poderia gerar imprecisões importantes na dinâmica. Mantendo fixa a taxa de proliferação dos linfócitos, o controle tumoral eventualmente ocorrerá, mesmo que em longo prazo, por isso o trabalho simula um período mais curto para avaliar se há resposta em um tempo considerado significativo clinicamente. Em geral, estudos de modelagem matemática buscam simplificar a dinâmica tumoral, mas pesquisas futuras poderão incrementar o modelo para investigar mais sobre o comportamento imune.
CONCLUSÃO
A modelagem matemática mostra-se como uma ferramenta importante para o estudo e a compreensão da dinâmica tumoral. Este trabalho propôs um modelo adaptado para simular tumores sólidos sob imunoterapia. Os resultados indicam que o modelo discutido é válido para previsão do comportamento tumoral diante da imunoterapia. Além disso, o trabalho sugere que a infusão da ACT com predomínio de LT CD8+ pode ser mais vantajosa do que a infusão com predomínio de LT CD4+, embora tenha encontrado diferença muito pequena. Quanto ao esquema de administração da IL-2, os resultados apontam que se deve almejar o uso de doses altas de IL-2 durante um tempo mais prolongado, respeitando-se a tolerância do paciente. Nesse sentido, o trabalho conclui que doses altas de IL-2, porém toleráveis, geraram boa resposta antitumoral, de modo que não há necessidade de buscar o uso de doses muito altas que poderiam gerar efeitos adversos importantes. Ademais, mostrou-se desejável o uso da IL-2 pelo máximo de tempo possível até 15 dias após a administração dos TIL, também respeitando a tolerância apresentada pelo paciente. Assim, o estudo observa alguns pontos importantes para nortear a escolha do caminho a ser seguido por novos estudos na área e considera o modelo como uma ferramenta útil para subsidiar outros estudos. Estudos futuros podem avaliar os melhores esquemas terapêuticos para diferentes condições do tumor e do organismo, a fim de auxiliar na assertividade do tratamento imunoterápico.
AGRADECIMENTOS
Ao Programa Voluntariado de Iniciação Científica da Universidade Federal de Juiz de Fora (VIC-UFJF) pela oportunidade de participação e apoio fornecidos durante esta pesquisa.