ARTIGO ORIGINAL
Fármacos Anticorpos Monoclonais para o Tratamento do Câncer: uma Perspectiva Brasileira
Monoclonal Antibody Drugs for Cancer Treatment: a Brazilian Perspective
Fármacos Anticuerpos Monoclonales para el Tratamiento del Cáncer: una Perspectiva Brasileña
https://doi.org/10.32635/2176-9745.RBC.2024v70n1.4462
Júlia Teixeira de Menezes1; Maria Carolina Theisen2; Vanessa da Costa Flores3; Fernando Fumagalli4
1Universidade Federal de Santa Maria (UFSM), Curso de Farmácia. Santa Maria (RS), Brasil. E-mail: juliateix@hotmail.com. Orcid iD: https://orcid.org/0009-0005-1446-8047
2UFSM, Programa de Pós-Graduação em Ciências Farmacêuticas. Santa Maria (RS), Brasil. E-mail: maria.theisen@acad.ufsm.br. Orcid iD: https://orcid.org/0000-0002-6181-9381
3Hospital Universitário de Santa Maria (HUSM)/EBSERH. Santa Maria (RS), Brasil. E-mail: vacflores@hotmail.com. Orcid iD: https://orcid.org/0009-0000-6082-2573
4UFSM, Departamento de Farmácia Industrial. Santa Maria (RS), Brasil. E-mail: fernando.fumagalli@ufsm.br. Orcid iD: https://orcid.org/0000-0002-0622-4481
Endereço para correspondência: Fernando Fumagalli. Av. Roraima, 1000, prédio 26A, sala 1101 – Camobi. Santa Maria (RS), Brasil CEP 97105-900. E-mail: fernando.fumagalli@ufsm.br
RESUMO
Introdução: Os anticorpos monoclonais (mAb) são alternativa terapêutica importante no tratamento do câncer. Porém, o acesso a essa terapia é desigual entre países com diferentes rendas. Objetivo: Comparar os fármacos mAb aprovados para uso contra câncer nos EUA com os aprovados no Brasil e discutir, por meio do mecanismo de ação, alternativas terapêuticas disponíveis. Método: A lista de fármacos mAb aprovados pelo FDA foi coletada de publicação prévia e complementada com dados presentes no site dessa agência, assim como mecanismo de ação, data de aprovação e indicações clínicas foram obtidos das bulas dos medicamentos nesse mesmo site. Da mesma forma, os dados de data de aprovação pela Anvisa foram obtidos em consultas ao site dessa agência. Os fármacos foram tabelados e organizados conforme características estruturais e separados em quatro grandes grupos, conforme seu mecanismo de ação. Resultados: Até 2022, 48 mAb foram aprovados para uso contra o câncer pelo FDA. Destes, 37 foram aprovados pela Anvisa para uso no Brasil, com tempo médio entre aprovação no exterior e no Brasil próximo a dois anos. A maioria dos mAb são humanos ou humanizados (77%) e variam bastante com relação ao mecanismo de ação, sendo o antígeno de linfócitos B CD20 e o checkpoint imunológico PD-1/PD-L1 os principais alvos dos mAb avaliados. Conclusão: Apesar de alguns fármacos aprovados no exterior ainda não estarem aprovados no Brasil, o atraso para registro não parece estar relacionado à demora da Anvisa. Além disso, para a maioria dos casos de fármacos ainda não aprovados no Brasil, existem alternativas terapêuticas disponíveis.
Palavras-chave: Agência Nacional de Vigilância Sanitária; Aprovação de Drogas; Antineoplásicos/normas; Anticorpos Monoclonais.
ABSTRACT
Introduction: Monoclonal antibodies (mAb) are an important therapeutic alternative in cancer treatment. However, access to this therapy is unequal in countries with heterogeneous incomes. Objective: Compare the mAb approved for cancer in the USA with those already approved in Brazil, as well as to discuss, through the mechanism of action, the available therapeutic alternatives. Method: The list of mAb approved by the US FDA were collected from previously publication and the agency’s site. Mechanism of action, date of approval and clinical indications were obtained from the drug labels on the FDA website and the date of ANVISA approval was obtained from this agency's website. The drugs were organized according to their structural characteristics (murine, chimeric, humanized and human) and separated into four major groups, according to their mechanism of action. Results: Until 2022, 48 mAb have been approved for cancer by the FDA. Of these, 37 have already been approved by ANVISA for use in Brazil, with an average time between approval abroad and in Brazil close to two years. The majority of these mAb are human or humanized (77%) and vary greatly in terms of their mechanism of action, with the B lymphocyte antigen CD20 and the immune checkpoint PD-1/PD-L1 as the main targets of the mAb evaluated. Conclusion: Although some drugs approved abroad are not yet approved in Brazil, the delay in the registration does not seem to be related to ANVISA's delay. Furthermore, for most of the cases of drugs not yet approved in Brazil, therapeutic alternatives are available.
Key words: Brazilian Health Surveillance Agency; Drug Approval; Antineoplastic/standards; Antibodies, Monoclonal.
RESUMEN
Introducción: Los anticuerpos monoclonales (mAb) son una importante alternativa terapéutica en el tratamiento del cáncer. Sin embargo, el acceso a esta terapia es desigual en países con diferentes ingresos. Objetivo: Este trabajo buscó comparar los mAb aprobados para su uso contra el cáncer en los EUA con los ya aprobados en Brasil, así como discutir, por el mecanismo de acción, las alternativas terapéuticas disponibles. Método: La lista de mAb aprobados por la FDA fue recopilada de publicación anterior y complementada con datos presentes en el sitio web de esta agencia. El mecanismo de acción, la fecha de aprobación y las indicaciones clínicas se obtuvieron de los prospectos del medicamento en el sitio web de la FDA y los datos sobre la fecha de aprobación por parte de la Anvisa se obtuvieron de consultas en el sitio web de esta agencia. Los fármacos fueron tabulados y organizados según sus características estructurales (murinos, quiméricos, humanizados y humanos) y separados en cuatro grandes grupos, según su mecanismo de acción. Resultados: Hasta 2022, la FDA ha aprobado 48 mAb para su uso contra el cáncer. De ellos, 37 ya fueron aprobados por Anvisa para su uso en Brasil, con el tiempo promedio entre la aprobación en el extranjero y en Brasil es de alrededor de dos años. La mayoría de estos mAb son humanos o humanizados (77%) y varían mucho en cuanto a su mecanismo de acción, siendo el antígeno de linfocitos B CD20 y el checkpoint inmunológico PD-1/PD-L1 las principales dianas farmacológicas de los mAb evaluados. Conclusión: Aunque algunos medicamentos aprobados en el exterior aún no están aprobados en Brasil, la tardanza en ese registro no parece estar relacionada con demora por parte de Anvisa. Además, para la mayoría de los casos de estos medicamentos aún no aprobados en Brasil, existen alternativas terapéuticas disponibles.
Palabras clave: Agencia Nacional de Vigilancia Sanitaria; Aprobación de Drogas; Antineoplásico/normas; Anticuerpos Monoclonales.
INTRODUÇÃO
Após 25 anos da aprovação pela Agência Nacional de Vigilância Sanitária (Anvisa) do primeiro fármaco anticorpo monoclonal (mAb – do inglês, monoclonal antibodies) para o tratamento do câncer (rituximabe), o uso desses fármacos biológicos já é uma realidade nos esquemas terapêuticos para essa doença1.
Estruturalmente, os mAb podem ser classificados em quatro tipos: murinos, quiméricos, humanizados e humanos (Figura 1a)4,5. Esses três últimos resultaram de algumas alterações nas formas de desenvolvimento, com a finalidade de aumentar a semelhança dos mAb com os anticorpos humanos e, assim, reduzir a ocorrência de eventos adversos comuns aos totalmente murinos2. Além disso, alguns mAb são conjugados a fármacos (ADC – Antibodies Conjugated to Drugs) ou radiomarcados, apresentando um papel importante no diagnóstico e na terapia, além de servirem para o direcionamento de fármacos citotóxicos até as células tumorais3.
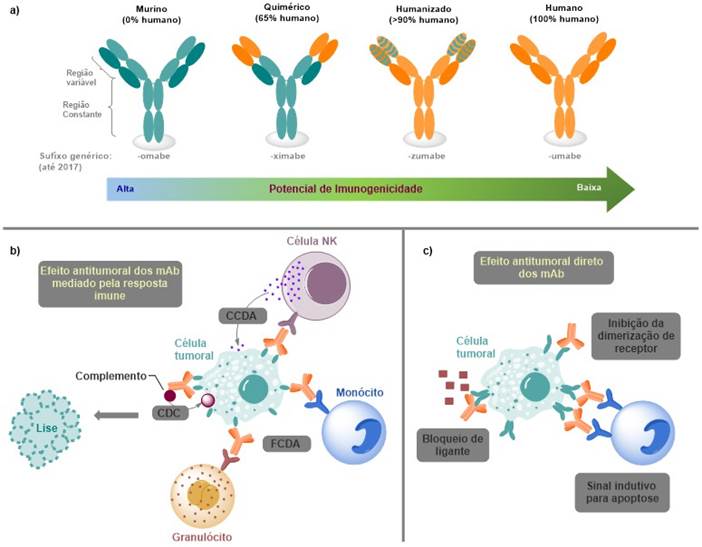
Figura 1. a) Diferenças estruturais e de nomenclatura dos diversos mAb; b e c) Mecanismos de ação dos mAb utilizados no tratamento do câncer
Fonte: Adaptado de Lythgoe4, Weiner5, Chiavenna SM, Jaworski JP, Vendrell A6.
Legendas: mAb = anticorpos monoclonais; CCDA = citotoxicidade celular dependente de anticorpo; FCDA = fagocitose celular dependente de anticorpo; CDC = citotoxicidade dependente de complemento.
Quanto à ação desses fármacos no organismo, seus efeitos antitumorais podem ser mediados pela resposta imune ou pela ação direta do mAb (Figura 1b e 1c)6. Os mAb podem levar à citotoxicidade na célula cancerígena pela ativação da cascata do complemento para que ocorra a citólise ou pela ação de células efetoras do sistema imune, como as células natural killers, provocando a lise da célula marcada pelo mAb. Outra estratégia é marcar a célula tumoral para que ela sofra opsonização pelas células fagocíticas. Os mAb também podem ter efeitos diretos nas células cancerígenas, bloqueando a ligação de seus mediadores de sobrevivência ou inibindo a dimerização de um receptor e, assim, bloqueando um sinal de ativação, ou, ainda, induzindo um sinal apoptótico pela ligação ao receptor5.
Evidentemente, a eficiência dessa terapia trouxe grandes avanços no tratamento do câncer, mas a disponibilidade desses medicamentos nas diferentes regiões do mundo, bem como o poder aquisitivo do país e de sua população, impedem o acesso de grupos com menor renda a esses tratamentos7. Buscando esclarecer a situação brasileira nesse cenário, este trabalho traz um panorama atualizado sobre a disponibilidade no Brasil dessa terapia comparada com um país desenvolvido. Além disso, apresenta discussão pautada no mecanismo de ação e doença-alvo, a fim de verificar se a população brasileira possui alternativas terapêuticas baseadas em mAb para os fármacos dessa classe ainda não registrados/aprovados no Brasil.
Estudo retrospectivo, no qual todos os novos fármacos mAb aprovados para o tratamento do câncer nos Estados Unidos da América (EUA) desde 1997 foram obtidos de um artigo de revisão5, combinados e complementados com dados presentes no site do Food and Drug Administration (FDA)8. Foram considerados somente medicamentos que continham novos mAb ou mAb com novos fármacos conjugados, sendo excluídos aqueles que apenas traziam novas associações de mAb já comercializados.
Para os mAb aprovados pelo FDA até 2022, variáveis como data de aprovação pelo FDA (primeiro registro do fármaco na agência), nome comercial, tipo de anticorpo monoclonal, mecanismo de ação e indicações clínicas foram extraídas integralmente das bulas dos medicamentos consultadas no site do FDA9, com última conferência em junho de 2023. A busca foi realizada pelo nome do fármaco no campo de busca Product names. A data de aprovação pela Anvisa foi obtida do site de consultas10, buscando pelo nome do fármaco, com última conferência em junho de 2023. Fármacos sem resposta na pesquisa foram considerados “não aprovados pela Anvisa” em oposição aos que tiveram resposta, e, portanto, “aprovados pela Anvisa”, com a primeira data de registro como data de aprovação pela Anvisa.
Os fármacos foram tabelados, organizados e quantificados conforme as suas características estruturais, assim como separados em quatro grandes grupos conforme o seu mecanismo de ação, para facilitar a discussão. A diferença entre os anos de aprovação Anvisa vs. FDA para cada fármaco definiu o tempo de demora para registro no Brasil. Foram considerados como “alternativa terapêutica” os fármacos mAb comercializados no Brasil que não são biossimilares e que possuem o mesmo mecanismo de ação ou mesmo câncer-alvo dos mAb apenas aprovados pelo FDA. Foram considerados fármacos descontinuados todos aqueles com registro Anvisa vencido ou aqueles não registrados no Brasil e que possuem comunicados públicos das empresas informando a descontinuação do medicamento.
De acordo com a Resolução n.º 510/201611, do Conselho Nacional de Saúde (CNS), pesquisas que utilizam bases de dados públicas, sem identificação de pacientes, estão isentas da necessidade de análise ética.
RESULTADOS
A coleta de dados permitiu identificar que 48 mAb foram aprovados pelo FDA para tratamento de câncer até 2022 (Quadros 1 a 3). Entre os anos de 1997 e 2013, não mais que dois mAb antineoplásicos eram aprovados por ano, sendo que em cinco desses anos não houve aprovação de nenhum representante dessa classe de fármacos. Esse cenário mudou a partir de 2014, quando, em média, três mAb foram aprovados anualmente para o tratamento do câncer e, em todos os anos, foram aprovados ao menos dois mAb antitumorais.
Entre os 48 mAb apresentados, 8% são do tipo murino, 15%, quimérico, 33%, humano, e 44%, humanizado. Uma parcela considerável desses fármacos (13 mAb, 27%) possui algum outro agente antineoplásico conjugado ao anticorpo e quatro (8%) são biespecíficos, se ligando a dois antígenos diferentes. No Brasil, houve o registro e aprovação pela Anvisa de 37 (77%) dos 48 mAb aprovados pelo FDA. A média do intervalo de tempo entre a aprovação pela agência americana e pela Anvisa foi de aproximadamente dois anos, e, nos últimos cinco anos, esse tempo médio não passou de um ano e meio.
Entre os 48 mAb analisados, a indicação clínica mais comum foi carcinoma de pulmão de células não pequenas (NSCLC) com 11 mAb (23%) e carcinoma hepatocelular (HCC) com seis mAb (12,5%). Entretanto, o mieloma múltiplo (MM) teve mais fármacos (cinco mAb, 10%) aprovados exclusivamente para esse tumor. Os fármacos com mais indicações clínicas foram nivolumabe e pembrolizumabe (Quadros 2 e 3, respectivamente). Considerando o mecanismo de ação dos 48 fármacos, 10 mAb (20,8%) agem em checkpoints imunológicos/modulação da resposta imune, 16 mAb (33,4%) têm mecanismo relacionado com ação em células B, 10 mAb (20,8%) marcam ou se ligam a antígenos de membrana e 12 mAb (25%) agem em receptores do tipo tirosina quinase (Figura 2).
Quadro 1. Fármacos antineoplásicos do tipo anticorpo monoclonal murino e quimérico
|
Anticorpos monoclonais murinos |
||||
|
Nome do fármaco |
Nome comercial |
Aprovação FDA |
Aprovação Anvisa |
Indicação clínica |
|
Ibritumomabe tiuxitano |
Zevalin |
2002 |
- |
NHL |
|
Tositumomabe |
Bexxar |
2003 |
- |
NHL |
|
Blinatumomabe |
Blincyto |
2014 |
2017 |
ALL |
|
Moxetumomabe pasudotox |
Lumoxiti |
2018 |
2020 |
HCL |
|
Anticorpos monoclonais quiméricos |
||||
|
Nome do fármaco |
Nome comercial |
Aprovação FDA |
Aprovação Anvisa |
Indicação clínica |
|
Rituximabe |
Mabthera |
1997 |
1998 |
NHL, CLL |
|
Cetuximabe |
Erbitux |
2004 |
2006 |
mCRC, HNSCC |
|
Brentuximabe vedotina |
Adcetris |
2011 |
2014 |
cHL; sALCL; pcALCL; PTCL |
|
Dinutuximabe/ betadinutuximabe |
Unituxin/ Qarziba* |
2015 |
2021 |
NB |
|
Isatuximabe |
Sarclisa |
2020 |
2021 |
MM |
|
Margetuximabe |
Margenza |
2020 |
- |
mBrC |
|
Mirvetuximabe soravtansina |
Elahere |
2022 |
- |
OVC, FTC, PPC |
Legendas: NHL = linfoma não-Hodgkin; ALL = leucemia linfocítica aguda; HCL = leucemia de células pilosas; CLL = leucemia linfocítica crônica; mCRC = câncer colorretal metastático; HNSCC = carcinoma de células escamosas de cabeça e pescoço; cHL = linfoma Hodgkin clássico; sALCL = linfoma anaplásico sistêmico de grandes células; pcALCL = linfoma anaplásico cutâneo primário de grandes células; PTCL = linfomas periféricos de células T; NB = neuroblastoma; MM = mieloma múltiplo; mBrC = câncer de mama metastático; OVC = câncer de ovário, FTC = câncer de tuba uterina; PPC = câncer peritoneal primário.
*No Brasil, o fármaco dinutuximabe é vendido como betadinutuximabe (Qarziba®).
Quadro 2. Fármacos antineoplásicos do tipo anticorpo monoclonal humano
|
Nome do fármaco |
Nome comercial |
Aprovação FDA |
Aprovação Anvisa |
Indicação clínica |
|
Panitumumabe |
Vectibix |
2006 |
2010 |
mCRC |
|
Ofatumumabe |
Arzerra |
2009 |
2015 |
CLL |
|
Ipilimumabe |
Yervoy |
2011 |
2012 |
RCC, mCRC, HCC, NSCLC, mMEL, MPM |
|
Ramucirumabe |
Cyramza |
2014 |
2016 |
mGC, NSCLC, mCRC, HCC |
|
Nivolumabe |
Opdivo |
2014 |
2016 |
MEL, NSCLC, MPM, RCC, CRC, HCC, ESCC, HNSCC, UC |
|
Daratumumabe |
Darzalex/ Dalinvi* |
2015 |
2017 |
MM |
|
Necitumumabe |
Portrazza |
2015 |
- |
NSCLC |
|
Olaratumabe |
Lartruvo |
2016 |
2017 |
STS |
|
Avelumabe |
Bavencio |
2017 |
2018 |
MCC, UC, RCC |
|
Durvalumabe |
Imfinzi |
2017 |
2017 |
NSCLC, BTC, SCLC |
|
Cemiplimabe |
Libtayo |
2018 |
2019 |
cSCC, BCC e NSCLC |
|
Enfortumabe vedotina |
Padcev |
2019 |
2022 |
mUC |
|
Amivantamabe |
Rybrevant |
2021 |
2021 |
NSCLC |
|
Tisotumabe vedotina |
Tivdak |
2021 |
- |
CVC |
|
Nivolumabe + relatlimabe |
Opdualag |
2022 |
- |
mMEL |
|
Tremelimumabe |
Imjudo |
2022 |
2023 |
HCC, NSCLC |
Legendas: CLL = leucemia linfocítica crônica; mCRC = câncer colorretal metastático; mMEL = melanoma metastático; mGC = carcinoma gástrico metastático; CRC = carcinoma colorretal; HCC = carcinoma hepatocelular; NSCLC = carcinoma de pulmão de células não pequenas; SCLC = carcinoma de pulmão de células pequenas; MEL = melanoma; UC = carcinoma urotelial; mUC = carcinoma urotelial; HNSCC = carcinoma de células escamosas de cabeça e pescoço; RCC = carcinoma de células renais; MM = mieloma múltiplo; BTC = carcinoma do trato biliar; STS = sarcoma de tecidos moles; MCC = carcinoma de células Merkel; cSCC = carcinoma espinocelular cutâneo; BCC = carcinoma basocelular; CVC = câncer cervical; MPM = mesotelioma pleural maligno; ESCC = carcinoma esofágico de células escamosas.
*No Brasil, o fármaco daratumumabe é vendido como Dalinvi®.
Quadro 3. Fármacos antineoplásicos do tipo anticorpo monoclonal humanizado
|
Nome do fármaco |
Nome comercial |
Aprovação FDA |
Aprovação Anvisa |
Indicação clínica |
|
Trastuzumabe |
Herceptin |
1998 |
1999 |
BrC, mGC |
|
Gentuzumabe ozogamicina |
Mylotarg |
2000 e 2017 |
2001 e 2021 |
AML |
|
Alemtuzumabe |
Campath |
2001 |
2006 |
CLL |
|
Bevacizumabe |
Avastin |
2004 |
2005 |
mCRC, NSCLC, mBrC, mRCC, GBM |
|
Pertuzumabe |
Perjeta |
2012 |
2013 |
mBrC |
|
Trastuzumabe entansina |
Kadcyla |
2013 |
2014 |
mBrC |
|
Obinutuzumabe |
Gazyva |
2013 |
2015 |
CLL, FL |
|
Pembrolizumabe |
Keytruda |
2014 |
2016 |
MEL, SCLC, HL, NSCLC, HNSCC, PMBCL, CRC, GC, CVC, EC, TNBC, UC, MCC, HCC, RCC, cSCC, ESCA, MSI-H, dMMR, TMB-H |
|
Elotuzumabe |
Empliciti |
2015 |
2017 |
MM |
|
Atezolizumabe |
Tecentriq |
2016 |
2017 |
UC, NSCLC, SCLC, HCC, MEL |
|
Inotuzumabe ozogamicina |
Besponsa |
2017 |
2019 |
ALL |
|
Polatuzumabe vedotina |
Polivy/ RoPolivy |
2019 |
2019 |
DLBCL |
|
Trastuzumabe deruxtecano |
Enhertu |
2019 |
2021 |
BrC |
|
Sacituzumabe govitecano |
Trodelvy |
2020 |
2022 |
TNBC, mUC |
|
Tafasitamabe |
Monjuvi |
2020 |
- |
DLBCL |
|
Belantamabe mafodotina |
Blenrep |
2020 |
- |
MM |
|
Naxitamabe |
Danyelza |
2020 |
2023 |
NB |
|
Loncastuximabe tesirina |
Zynlonta |
2021 |
- |
DLBCL |
|
Dostarlimabe |
Jemperli |
2021 |
2022 |
EC |
|
Teclistamabe |
Tecvayli |
2022 |
2023 |
MM |
|
Mosunetuzumabe |
Lunsumio |
2022 |
- |
FL |
Legendas: AML = leucemia mieloide aguda; BrC = câncer de mama; mBrC = câncer de mama metastático; CLL = leucemia linfocítica crônica; FL = linfoma folicular; mCRC = câncer colorretal metastático; CRC = carcinoma colorretal; mGC = carcinoma gástrico metastático; GC = câncer gástrico; HCC = carcinoma hepatocelular; NSCLC = carcinoma de pulmão de células não pequenas; SCLC = carcinoma de pulmão de células pequenas; MEL = melanoma; UC = carcinoma urotelial; mUC = carcinoma urotelial; HNSCC = carcinoma de células escamosas de cabeça e pescoço; mRCC = carcinoma de células renais metastático; RCC = carcinoma de células renais; ESCA = carcinoma de esôfago; TNBC = câncer de mama triplo negativo; ALL = leucemia linfocítica aguda; MM = mieloma múltiplo; HL = linfoma Hodgkin; NB = neuroblastoma; MCC = carcinoma de células Merkel; cSCC = carcinoma espinocelular cutâneo; DLBCL = linfoma difuso de grandes células B; EC = câncer de endométrio; GBM = glioblastoma; PMBCL = linfoma primário de células B do mediastino, MSI-H = tumores sólidos com alta instabilidade de microsatélites; dMMR = tumores sólidos com disfunção nos genes de reparo; TMB-H = tumores sólidos com alta taxa de mutação tumoral.
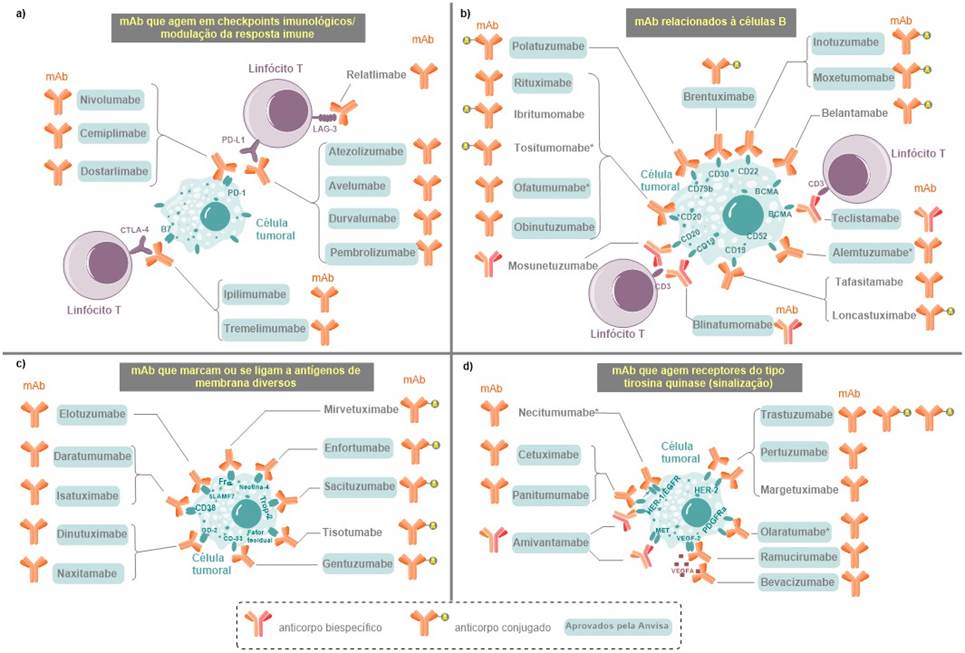
Figura 2. Representação dos mecanismos de ação dos fármacos mAb utilizados no tratamento do câncer
Legenda: mAb = anticorpos monoclonais.
*Fármacos removidos do mercado.
DISCUSSÃO
As terapias com mAb revolucionaram o tratamento de doenças como o câncer, por sua alta especificidade atrelada a poucos efeitos colaterais. No entanto, o acesso a essa classe de medicamentos no Brasil é bastante limitado em razão de seu alto custo, sendo um obstáculo aos pacientes12.
Nos últimos dez anos, houve um aumento significativo na aprovação de novas terapias com mAb para o câncer tanto no Brasil quanto nos EUA13. Verificou-se que mais de 70% (35 de 48 no FDA e 29 de 35 na Anvisa) dos mAb antineoplásicos foram aprovados para uso em humanos na última década. Entretanto, alguns desses fármacos (5 de 48, 10%) não são mais comercializados para o tratamento do câncer. Razões comerciais são comumente utilizadas como justificativa para empresas retirarem seus produtos do mercado, como é o caso dos fármacos tositumomabe14, necetumumabe15, alemtuzumabe16 e ofatumumabe17. Para esses dois últimos, as empresas investiram na aprovação no FDA e na Anvisa para outra doença, a esclerose múltipla. Para além de questões de mercado, o fármaco olaratumabe também foi descontinuado por falta de eficácia terapêutica18. Um último caso envolve o fármaco gentuzumabe que teve um histórico de aprovação, retirada do mercado por questões comerciais e nova aprovação para o mesmo tratamento anos depois19.
Quando analisados os fármacos aprovados pelo FDA e ainda não aprovados pela Anvisa (11 de 48, 23%), apenas três foram lançados há mais de cinco anos (sendo dois deles já com uso descontinuado), os outros oito mAb foram apenas recentemente aprovados pelo FDA (menos de três anos). Portanto, embora leve em média até dois anos para que os mAb aprovados no exterior sejam aprovados no Brasil, aparentemente não há uma situação de falta de interesse no mercado brasileiro.
Considerando os fármacos ainda não aprovados no Brasil, o fármaco mirvetuximabe não possui outro mAb aprovado com mesmo mecanismo de ação. Ele é indicado para o tratamento de cânceres de ovário, de tuba uterina ou peritoneal. Seu mecanismo de ação (Figura 2c) envolve a ligação ao receptor de folato alfa (Frα) e a atividade citotóxica do agente conjugado ravtansina (DM4)20. No entanto, dostarlimabe (Figura 2a)21 e pembrolizumabe (Figura 2a) podem ser utilizados em associação a outros medicamentos para o tratamento de câncer de ovário. A associação com outros agentes antineoplásicos se faz necessária, uma vez que esses mAb que agem no checkpoint imunológico PD-1/PD-L1 possuem modesta ação como monoterapia para esse câncer22. Embora não conste na bula do medicamento, o inibidor de angiogênese bevacizumabe (se liga ao VEGFA – fator de crescimento endotelial vascular, Figura 2d) também pode ser utilizado em combinações medicamentosas para tratamento do câncer de ovário23.
Ainda abordando cânceres que acometem mulheres, para o câncer de mama não foi registrado no Brasil o margetuximabe (Figura 2d). Porém, já estão disponíveis no mercado brasileiro medicamentos com os mAb pertuzumabe e trastuzumabe (Figura 2d), que possuem o mesmo mecanismo de ação. Esses três mAb agem se ligando ao receptor de fator de crescimento epidérmico 2 (HER2). Além disso, podem desencadear a citotoxicidade celular dependente de anticorpos (CCDA)24. Para os tumores de câncer de mama triplo-negativo há apenas o sacituzumabe (Figura 2c), que é um mAb acoplado ao inibidor de topoisomerase I (SN-38, metabólito ativo do irinotecano) e que se liga ao antígeno do trofoblasto Trop-2 expresso na maioria dos cânceres de mama25.
Quando analisados os tratamentos baseados em mAb para linfoma não Hodgkin, no Brasil ainda não houve o registro do ibritumomabe, porém o rituximabe, que se liga ao mesmo alvo (CD-20)26 (Figura 2b), está disponível para o tratamento de brasileiros acometidos pela doença. Se ligando ao mesmo alvo, porém com indicação para linfoma folicular, há disponível mundialmente dois fármacos mAb, obinutuzumabe e mosunetuzumabe (Figura 2b)27. No entanto, este último ainda não possui registro na Anvisa.
Outro câncer que acomete células B é o linfoma difuso de grandes células B (DLBCL). Recentemente, três mAb (Figura 2b) passaram a fazer parte do arsenal terapêutico dessa doença e, dos três, apenas o polatuzumabe já tem aprovação para uso no Brasil, na sua forma conjugada com um agente antimitótico (monometil auristatina E – MMAE)28. Por sua vez, os fármacos tafasitamabe e loncastuximabe têm como alvo o CD-19, que é comumente superexpresso em células B tumorais, e o primeiro ativa a CCDA29 e o segundo libera seu agente de intercalação de DNA (tesirine, SG3199) para induzir a morte da célula tumoral30.
Quanto aos pacientes com MM, desde 2015 existem mAb para o tratamento dessa malignidade. Entre os cinco fármacos mAb já aprovados pelo FDA para MM, o elotuzumabe (Figura 2c) age tanto ativando as células natural killer, quanto marcando células plasmáticas tumorais pela ligação à proteína SLAMF731. Já os fármacos isatuximabe e daratumumabe (Figura 2c) se ligam ao cluster de diferenciação CD38 e desencadeiam a CCDA32. Além desses dois alvos, o tratamento de MM baseado em mAb pode ser pela ligação ao antígeno de maturação de células B (BCMA)31. Neste caso, dois fármacos foram recentemente aprovados pelos FDA, teclistamabe e belantamabe (Figura 2b), e este último ainda não possui aprovação de uso pela agência regulatória brasileira. Belantamabe é um mAb conjugado ao agente antimitótico MMAE33, enquanto o teclistamabe é biespecífico se ligando também ao CD3 de células T e, assim, direciona essas células para desencadear a lise da célula tumoral que contém BCMA34.
Um outro medicamento ainda não registrado na Anvisa é o tisotumabe (Figura 2c). Tal mAb é conjugado ao agente antimitótico MMAE e se liga ao fator tecidual da célula tumoral. Essa glicoproteína de membrana está superexpressa em células de câncer cervical e está associada ao mau prognóstico da doença35. Embora o tisotumabe seja uma terapia de primeira linha, outros fármacos mAb podem ser utilizados, como o pembrolizumabe36.
Um último mAb ainda não aprovado para uso no Brasil é o relatlimabe, que é capaz de bloquear LAG-3, proteína que regula negativamente as células T (Figura 2a). Esse mAb é vendido em associação com o nivolumabe (anti-PD-1) para tratamento de melanoma metastático (mMEL), atuando de forma sinérgica para manutenção da atividade das células T contra a célula tumoral37. Essa não é a única alternativa terapêutica baseada em mAb para mMEL. Pembrolizumabe e ipilimumabe foram anteriormente aprovados para o tratamento desse câncer38. Esse último também previne o sinal de inibição de células T, porém por meio da ligação ao antígeno 4 de linfócito T citotóxico (CTLA-4)39.
Analisando todos os fármacos mAb aprovados para câncer e ainda em comercialização, uma das principais indicações clínicas dos fármacos mAb é para NSCLC40. Sete deles agem mantendo o processo de ação antitumoral das células T, no qual pembrolizumabe, nivolumabe, cemiplimabe, atezolizumabe e durvalumabe (Figura 2a) agem se ligando ao sistema PD-1/PD-L1 e ipilimumabe e tremelimumabe se ligam ao CTLA-4 (Figura 2a)41. Ainda há dois mAb que agem inibindo a angiogênese, ramucirumabe e bevacizumabe (Figura 2c)42. Além disso, há o anticorpo biespecífico amivantamabe (Figura 2c) que bloqueia o processo de sinalização de divisão celular43.
Outros fármacos ainda não discutidos neste trabalho têm indicação para outros tipos de câncer. Por exemplo, dinutuximabe e naxitamabe (Figura 2c) se ligam ao glicoesfingolipídeo de membrana GD2 em células tumorais de neuroblastomas, levando à CCDA44. Além deles, o gemtuzumabe (Figura 2c) é um mAb conjugado ao agente citotóxico de ligação ao DNA caliqueamicina que se liga ao CD33 presente nos mieloblastos leucêmicos em pacientes com leucemia mieloide aguda45.
Ainda há outros mAb que estão relacionados às células B (Figura 2b). Inotuzumabe e blinatumomabe (Figura 2b) são indicados para leucemia linfocítica aguda. O primeiro é um mAb conjugado ao agente antitumoral caliqueamicina que se liga ao CD22, enquanto o segundo é um antígeno biespecífico que se liga tanto ao CD19 quanto ao CD3 dirigindo a ação das células T efetoras contra o tumor46. Para leucemia de células pilosas, há o moxetumomabe que também é um anticorpo conjugado (exotoxina A de pseudomonas, PE38) que se liga ao CD2247. Além destes, o brentuximabe (Figura 2b) também é um mAb conjugado ao MMAE que se liga à proteína CD30, sendo indicado para linfoma de Hodgkin e linfoma anaplásico sistêmico de grandes células (ALCL)48.
Para cânceres que acometem o sistema geniturinário, o enfortumabe (Figura 2c) e o avelumabe (inicialmente aprovado para carcinoma de Merkel49, Figura 2a) podem ser utilizados para carcinoma urotelial, bem como o sacituzumabe, já citado anteriormente para tratamento de câncer de mama. O primeiro é um mAb conjugado com MMAE que se liga ao receptor de superfície celular nectina-450, enquanto o segundo age no checkpoint imunológico PD-1/PD-L151.
Por fim, ainda não foram mencionados dois fármacos que se ligam ao receptor epidérmico humano HER1, panitumumabe e cetuximabe. Além de se ligarem ao mesmo receptor, esses dois mAb também possuem indicação clínica em comum, o câncer colorretal52.
CONCLUSÃO
A disponibilidade de fármacos mAb para tratamento de câncer no Brasil vem crescendo na última década em consonância com os EUA. Os fármacos ainda não registrados no país, na sua grande maioria, foram apenas recentemente aprovados pelo FDA. Em vista disso, a não disponibilidade desses fármacos no mercado brasileiro aparenta não estar atrelada à demora de registro pela Anvisa, que vem reduzindo esse tempo de análise para registro nos últimos anos. Além disso, na maioria dos casos, há alternativas terapêuticas baseadas em mAb para os fármacos ainda não comercializados no Brasil.
CONTRIBUIÇÕES
Júlia Teixeira de Menezes e Fernando Fumagalli contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica. Vanessa da Costa Flores e Maria Carolina Theisen contribuíram na concepção e no planejamento do estudo; na redação e revisão crítica. Todos os autores aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Zahavi D, Weiner L. Monoclonal antibodies in cancer therapy. Antibodies. 2020;9(3):34. doi: https://doi.org/10.3390/antib9030034
2. Wang W, Wang E, Balthasar J. Monoclonal antibody pharmacokinetics and pharmacodynamics. Clin Pharmacol Ther. 2008;84(5):548-58. doi: https://doi.org/10.1038/clpt.2008.170
3. Schumacher D, Hackenberger CPR, Leonhardt H, et al. Current status: site-specific antibody drug conjugates. J Clin Immunol. 2016;36(S1):100-7. doi: https://doi.org/10.1007/s10875-016-0265-6
4. Lythgoe MP. No New ‘Mabs’ in medicine - new nomenclature for monoclonal antibodies. British J Pharmacology. 2022;179(24):5338-9. doi: https://doi.org/10.1111/bph.15953
5. Weiner GJ. Building better monoclonal antibody-based therapeutics. Nat Rev Cancer. 2015:15(6):361-70. doi: https://doi.org/10.1038/nrc3930
6. Chiavenna SM, Jaworski JP, Vendrell A. State of the art in anti-cancer mabs. J Biomed Sci. 2017;24(1):15. doi: https://doi.org/10.1186/s12929-016-0311-y
7. Morin S, Segafredo G, Piccolis M, et al. Expanding access to biotherapeutics in low-income and middle-income countries through public health non-exclusive voluntary intellectual property licensing: considerations, requirements, and opportunities. Lancet Glob Health. 2023;11(1):e145-54. doi: https://doi.org/10.1016/S2214-109X(22)00460-0
8. FDA: Food and Drug Administration [Internet]. Maryland: Departamento de Saúde e Serviços Humanos dos Estados Unidos; c1906-2023. New Drugs at FDA: CDER’s new molecular entities and new therapeutic biological products. [acesso 2023 nov 9]. https://www.fda.gov/drugs/development-approval-process-drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products
9. FDA Label: FDALabel: Full-Text Search of Drug Product Labeling. Versão 2.8.1. Maryland: Departamento de Saúde e Serviços Humanos dos Estados Unidos; 2023. [acesso 2023 nov 13]. Disponível em: https://nctr-crs.fda.gov/fdalabel/ui/search
10. ANVISA: Agência Nacional de Vigilância Sanitária. Consulta Anvisa [sem versão]. Brasília, DF: Anvisa; [sem data]. [acesso 2023 nov 13]. Disponível em: https://consultas.anvisa.gov.br/#/medicamentos/
11. Conselho Nacional de Saúde (BR). Resolução n° 510, de 7 de abril de 2016. Dispõe sobre as normas aplicáveis a pesquisas em Ciências Humanas e Sociais cujos procedimentos metodológicos envolvam a utilização de dados diretamente obtidos com os participantes ou de informações identificáveis ou que possam acarretar riscos maiores do que os existentes na vida cotidiana, na forma definida nesta Resolução [Internet]. Diário Oficial da União, Brasília, DF. 2016 maio 24 [acesso 2023 ago 9]; Seção I:44. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/cns/2016/res0510_07_04_2016.html
12. Leonel RM, Reis FMD, Andolfatto D, et al. Assistência farmacêutica a pacientes oncológicos em uso de anticorpos monoclonais em um hospital de referência do Oeste de Santa Catarina. Rev Bras Cancerol. 2022;68(3):e152316. https://doi.org/10.32635/2176-9745.RBC.2022v68n3.2316
13. Mullard A. FDA approves 100th monoclonal antibody product. Nat Rev Drug Discov. 2021;20(7):491-5. doi: https://doi.org/10.1038/d41573-021-00079-7
14. Prasad V. The withdrawal of drugs for commercial reasons: the incomplete story of tositumomab. JAMA Intern Med. 2014;174(12):1887-8. https://doi.org/10.1001/jamainternmed.2014.5756
15. European Medicines Agency. Portrazza: termo de autorização de introdução no mercado na União Europeia. 2021 jul 9. [acesso 2023 nov 9]. Disponível em: https://www.ema.europa.eu/en/documents/public-statement/public-statement-portrazza-expiry-marketing-authorisation-european-union_en.pdf
16. European Medicines Agency. MabCampath (alemtuzumab): Retirada da autorização de introdução no mercado na União Europeia. 2012 ago 14. [acesso 2023 nov 9]. Disponível em: https://www.ema.europa.eu/en/documents/public-statement/public-statement-mabcampath-alemtuzumab-withdrawal-marketing-authorisation-european-union_en.pdf
17. FDA: Food and Drug Administration [Internet]. Maryland: Departamento de Saúde e Serviços Humanos dos Estados Unidos; c1906-2023. Novartis Withdraws Chronic leukemia drug arzerra from non-U.S. markets. [acesso 2023 nov 9]. Disponível em: https://www.fdanews.com/articles/185419-novartis-withdraws-chronic-leukemia-drug-arzerra-from-non-us-markets
18. Bou Zerdan M, Bidikian AH, Alameh I, et al. Olaratumab’s Failure in Soft Tissue Sarcoma. Rare Tumors 2021;13:203636132110341. doi: https://doi.org/10.1177/20363613211034115
19. Jin S, Sun Y, Liang X, et al. Emerging new therapeutic antibody derivatives for cancer treatment. Sig Transduct Target Ther. 2022;7(1):39. doi: https://doi.org/10.1038/s41392-021-00868-x
20. Moore KN, Martin LP, O’Malley DM, et al. A review of mirvetuximab soravtansine in the treatment of platinum-resistant ovarian cancer. Future Oncology. 2018;14(2):123-36. doi: https://doi.org/10.2217/fon-2017-0379
21. Singh V, Sheikh A, Abourehab MAS et al. Dostarlimab as a miracle drug: rising hope against cancer treatment. Biosensors. 2022;12(8):617. doi: https://doi.org/10.3390/bios12080617
22. Liao JB, Gwin WR, Urban RR, et al. Pembrolizumab with low-dose carboplatin for recurrent platinum-resistant ovarian, fallopian tube, and primary peritoneal cancer: survival and immune correlates. J Immunother Cancer. 2021;9(9):e003122. doi: https://doi.org/10.1136/jitc-2021-003122
23. Oncology Times. FDA Approves Avastin Plus Chemotherapy for Ovarian Cancer. Oncol Times. 2014;36(23):10. doi: https://doi.org/10.1097/01.COT.0000459154.18451.1e
24. Alasmari MM. A Review of margetuximab-based therapies in patients with HER2-Positive metastatic breast cancer. Cancers. 2022;15:(1):38. doi: https://doi.org/10.3390/cancers15010038
25. Bardia A, Hurvitz AS, Tolaney SM, et al. Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2021;384(16):1529-41. doi: https://doi.org/10.1056/NEJMoa2028485
26. Buske C, Weigert O, Dreyling M, et al. Current Status and Perspective of Antibody Therapy in Follicular Lymphoma. Hematológica. 2006;91(1):104-12.
27. Budde LE, Sehn LH, Matasar M, et al. Safety and efficacy of mosunetuzumab, a bispecific antibody, in patients with relapsed or refractory follicular lymphoma: a single-arm, multicentre, phase 2 study. Lancet Oncol. 2022;23(8):1055-65. doi: https://doi.org/10.1016/S1470-2045(22)00335-7
28. Deeks ED. Polatuzumab vedotin: first global approval. Drugs 2019;79(13):1467-75. doi: https://doi.org/10.1007/s40265-019-01175-0
29. Düll J, Topp M, Salles G. The use of tafasitamab in diffuse large b-cell lymphoma. Therapeut Advanc Hematol. 2021;12:204062072110274. doi: https://doi.org/10.1177/20406207211027458
30. Jain N, Stock W, Zeidan A, et al. Loncastuximab tesirine, an anti-cd19 antibody-drug conjugate, in relapsed/refractory b-cell acute lymphoblastic leukemia. Blood Advanc. 2020;4(3);449-57. doi: https://doi.org/10.1182/bloodadvances.2019000767
31. Romano A, Storti P, Marchica V, et al. Mechanisms of action of the new antibodies in use in multiple myeloma. Front Oncol. 2021;11:684561. doi: https://doi.org/10.3389/fonc.2021.684561
32. Moreno L, Perez C, Zabaleta A, et al. The mechanism of action of the anti-CD38 monoclonal antibody isatuximab in multiple myeloma. Clinic Cancer Res. 2019;25(10):3176-87. doi: https://doi.org/10.1158/1078-0432.CCR-18-1597
33. Lassiter G, Bergeron C, Guedry R, et al. Belantamab mafodotin to treat multiple myeloma: a comprehensive review of disease, drug efficacy and side effects. Current Oncolog. 2021;28(1):640-60. doi: https://doi.org/10.3390/curroncol28010063
34. Moreau P, Garfall AL, Van De Donk NWCJ, et al. Teclistamab in relapsed or refractory multiple myeloma. N Engl J Med. 2022;387(6):495-505. doi: https://doi.org/10.1056/NEJMoa2203478
35. Markham A. Tisotumab vedotin: first approval. Drugs 2021;81(18):2141-7. doi: https://doi.org/10.1007/s40265-021-01633-8
36. Song Z, Zou K, Zou L. Immune checkpoint blockade for locally advanced or recurrent/metastatic cervical cancer: an update on clinical data. front Oncol. 2022;12:1045481. doi: https://doi.org/10.3389/fonc.2022.1045481
37. Tawbi HÁ, Schadendorf D, Lipson EJ, et. Relatlimab and nivolumab versus nivolumab in untreated advanced melanoma. N Engl J Med. 2022;386(1):24-34. doi: https://doi.org/10.1056/NEJMoa2109970
38. Bhandaru M, Rotte A. Monoclonal Antibodies for the Treatment of Melanoma: Present and Future Strategies. In: Steinitz M, editor. Human monoclonal antibodies: methods in molecular biology. New York: Springer New York; 2019. p 83-108. v.1904 doi: https://doi.org/10.1007/978-1-4939-8958-4_4
39. Tarhini A, Lo E, Minor DR. Releasing the brake on the immune system: ipilimumab in melanoma and other tumors. cancer biotherapy and radiopharmaceuticals. 2010;25(6):601-13. doi: https://doi.org/10.1089/cbr.2010.0865
40. Yang T, Xiong Y, Zeng Y, et al. Current status of immunotherapy for non-small cell lung cancer. Front Pharmacol. 2022;13:989461. doi: https://doi.org/10.3389/fphar.2022.989461
41. Dantoing E, Piton N, Salaün M, et al. Anti-PD1/PD-L1 immunotherapy for non-small cell lung cancer with actionable oncogenic driver mutations. IJMS. 2021;22(12):6288. doi: https://doi.org/10.3390/ijms22126288
42. Cheng WC, Shen YC, Chen CL, et al. Bevacizumab versus Ramucirumab in EGFR-mutated metastatic non-small-cell lung cancer patients: a real-world observational study. Cancers. 2023;15(3):642. doi: https://doi.org/10.3390/cancers15030642
43. Vyse S, Huang PH. Amivantamab for the treatment of EGFR Exon 20 insertion mutant non-small cell lung cancer. Expert Rev Anticancer Therap. 2022;22(1):3-16. doi: https://doi.org/10.1080/14737140.2022.2016397
44. Furman WL. Monoclonal antibody therapies for high risk neuroblastoma. BTT 2021;15:205-19. doi: https://doi.org/10.2147/BTT.S267278
45. Massumoto CM, Pinheiro RF, Pinheiro Júnior ED, et al. Gemtuzumab Ozogamicina: uma opção no tratamento de leucemia mielóide aguda CD33+. Rev Bras Hematol Hemoter. 2004;26(4):235-8. doi: https://doi.org/10.1590/S1516-84842004000400002
46. Contreras CF, Higham CS, Behnert A, et al. Clinical utilization of blinatumomab and inotuzumab immunotherapy in children with relapsed or refractory B‐acute lymphoblastic leukemia. Pediatr Blood Cancer. 2021;68(1):e28718. doi: https://doi.org/10.1002/pbc.28718
47. Dhillon S. Moxetumomab pasudotox: first global approval. Drugs. 2018;78(16):1763-7. doi: https://doi.org/10.1007/s40265-018-1000-9
48. Younes A, Yasothan U, Kirkpatrick P. Brentuximab Vedotin. Nat Rev Drug Discov. 2012;11(1):19-20. doi: https://doi.org/10.1038/nrd3629
49. Shirley M. Avelumab: a review in metastatic merkel cell carcinoma. Targ Oncol. 2018;13(3)409-16. doi: https://doi.org/10.1007/s11523-018-0571-4
50. Alt M, Stecca C, Tobin S, et al. Enfortumab Vedotin in urothelial cancer. Therapeut Advanc Urol. 2020;12:175628722098019. doi: https://doi.org/10.1177/1756287220980192
51. Powles T, Park SH, Voog E, et al. Avelumab maintenance therapy for advanced or metastatic urothelial carcinoma. N Engl J Med. 2020;383(13):1218-30. doi: https://doi.org/10.1056/NEJMoa2002788
52. García-Foncillas J, Sunakawa Y, Aderka D, et al. Distinguishing features of cetuximab and panitumumab in colorectal cancer and other solid tumors. Front Oncol. 2019;9:849. doi: https://doi.org/10.3389/fonc.2019.00849
Recebido em 26/12/2023
Aprovado em 14/3/2024
Editor-associado: Mario Jorge Sobreira da Silva. Orcid iD: https://orcid.org/0000-0002-0477-8595
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.