RELATO DE CASO
Reativação de Tuberculose Pulmonar em uma Paciente com Câncer de Orofaringe Tratada com Nivolumabe: Relato de Caso
Reactivation of Pulmonary Tuberculosis in a patient with Oropharyngeal Cancer Treated with Nivolumab: Case Report
Reactivación de la Tuberculosis Pulmonar en una Paciente con Cáncer de Orofaringe Tratado con Nivolumab: Informe de Caso
https://doi.org/10.32635/2176-9745.RBC.2023v69n4.4477
Fernanda Navarro Loiola1; Henrique Zanoni Fernandes2
1,2Instituto de Oncologia do Vale (IOV). São José dos Campos (SP), Brasil.
1E-mail: fernloiola@hotmail.com. Orcid iD: https://orcid.org/0009-0003-9369-2295
2E-mail: henrique.zanoni@gmail.com. Orcid iD: https://orcid.org/0009-0006-6772-6967
Endereço para correspondência: Fernanda Navarro Loiola. Rua Major Antônio Domingues, 472 – Centro. São José dos Campos (SP), Brasil. CEP 12245-750. E-mail: fernloiola@hotmail.com
RESUMO
Introdução: Os inibidores de checkpoints imunológicos (ICI) são uma classe de medicamentos cada vez mais utilizados para tratar o câncer. No entanto, eles têm sido associados a um risco aumentado de reativação da tuberculose (TB) em pacientes com infecção tuberculosa latente (ILTB). Relato do caso: Mulher, 61 anos, com câncer de orofaringe desenvolveu reativação de TB pulmonar enquanto recebia nivolumabe. Acredita-se que a reativação da TB em pacientes em ICI seja em virtude da inibição da via PD-1 que desempenha um papel no controle da ILTB. A incidência de reativação da TB em pacientes em ICI é maior do que na população geral. Conclusão: O uso crescente de ICI provavelmente levará a um aumento no número de casos de reativação da TB. Sugere-se proceder ao rastreamento rotineiro para ILTB nos pacientes que estão sendo considerados para tratamento com ICI, especialmente em países com alta incidência de TB.
Palavras-chave: inibidores de checkpoint imunológico; tuberculose pulmonar; tuberculose latente.
ABSTRACT
Introduction: Immune checkpoint inhibitors (ICI) are a class of drugs that are increasingly used to treat cancer. However, they have been associated with an increased risk of tuberculosis (TB) reactivation in patients with latent TB infection (LTBI). Case report: 61-year-old woman with oropharyngeal cancer who developed TB reactivation while receiving Nivolumab. The reactivation of TB in patients receiving ICI is thought to be due to the inhibition of the PD-1 pathway, which plays a role in the control of LTBI. The incidence of TB reactivation in patients receiving ICI is higher than in the general population. Conclusion: The increasing use of ICI is likely to lead to an increase in the number of cases of TB reactivation. It is suggested that routine screening for LTBI should be performed in patients who are being considered for treatment with ICI, especially in countries with a high incidence of TB.
Key words: immune checkpoint inhibitors; tuberculosis, pulmonary; latent tuberculosis.
RESUMEN
Introducción: Los inhibidores de puntos de control inmunológico (ICI) son una clase de medicamentos que se utilizan cada vez más para tratar el cáncer. Sin embargo, se han asociado con un mayor riesgo de reactivación de la tuberculosis (TBC) en pacientes con infección tuberculosa latente (ILTB). Informe del caso: Mujer, 61 años, con cáncer de orofaringe que desarrolló reactivación de tuberculosis pulmonar mientras recibía Nivolumab. Se cree que la reactivación de la tuberculosis en pacientes con ICI se debe a la inhibición de la vía PD-1, que desempeña un papel en el control de la ILTB. La incidencia de reactivación de la tuberculosis en pacientes con ICI es mayor que en la población general. Conclusión: El uso cada vez mayor de ICI probablemente conducirá a un aumento en el número de casos de reactivación de la tuberculosis. Se sugiere realizar pruebas de detección sistemática de ILTB en los pacientes que están siendo considerados para recibir tratamiento con ICI, especialmente en países con una alta incidencia de tuberculosis.
Palabras clave: inhibidores de puntos de control inmunológico; tuberculosis pulmonar; tuberculosis latente.
INTRODUÇÃO
Os inibidores de checkpoint imune (ICI), anti-PD-1 ou PD-L1, são atualmente as principais classes de drogas utilizadas no tratamento de neoplasias sólidas e hematológicas. O nivolumabe é um inibidor de PD-1 indicado para o tratamento de diversos tumores sólidos, como câncer de pulmão, câncer de cabeça e pescoço, melanoma, rim, urotelial e linfomas. O perfil de toxicidade das ICI é melhor quando comparado à quimioterapia citotóxica convencional, porém baseia-se em efeitos imunomediados, sendo o mais comum o hipotireoidismo, e outros menos comuns, como a colite, hepatite, nefrite e pneumonite.
Recentemente, observou-se um crescente no número de publicações chamando a atenção para os diagnósticos de tuberculose (TB) na forma de relatos de casos1,2, revisões sobre o tema3-6, inclusive sistemática sobre reativação de TB em pacientes tratados com ICI7.
Muito ainda se tem estudado e levantado hipóteses, mas a reativação, assim como a severidade da TB, muito provavelmente, está relacionada ao papel do PD-1 no controle da infecção tuberculosa latente (ILTB), como sugerido em ensaios pré-clínicos8-10.
A preocupação com a reativação de TB e com uso cada vez mais ampliado dos ICI vem levantando questionamentos em como conduzir o rastreio da ILTB nessa população, e a publicação de experiências regionais são exemplos disso11,12. O rastreamento para o tratamento precoce de infecção latente do Micobacterium tuberculosis (M tuberculosis) é rotineiro, por exemplo, antes do início do tratamento com agentes antifator de necrose tumoral (TNF)-alfa na conduta em psoríase, doença de Crohn e artrite reumatoide13,14.
De acordo com o relatório da Organização Mundial da Saúde (OMS) sobre a TB em 2022, um quarto da população mundial está infectada pelo bacilo da TB, sendo a incidência da doença maior nos países em desenvolvimento. No Brasil, em 2021, o coeficiente de incidência foi de 32,0 casos/100 mil habitantes15. Por causa dessa alta taxa de incidência (acima de dez casos), é importante identificar a ILTB em pacientes oncológicos candidatos a iniciar o tratamento com drogas que possam reativar a doença.
Com base no aumento de dados na literatura sobre a reativação da TB em pacientes tratados com ICI, relata-se o caso de uma paciente brasileira com neoplasia maligna de orofaringe que foi diagnosticada com TB durante o tratamento com nivolumabe. Entende-se que relatos de casos nesse contexto trarão uma compreensão futura da necessidade do rastreamento de ILTB antes de iniciar o tratamento com essa classe de drogas, especialmente em países onde a incidência de TB é alta.
Esta pesquisa foi aprovada pelo Comitê de Ética em Pesquisa (CEP) do Instituto de Ciência e Tecnologia de São José dos Campos da Universidade Estadual Paulista (Unesp) sob o número de parecer 6506181 (CAAE: 75367923.0.0000.0077) e seguiu todos os requisitos éticos relacionados com estudos envolvendo seres humanos, necessários ao seu bom êxito e resguardo relacionados ao sigilo das informações, conforme evidenciado na Resolução n.º 466/1216 do Conselho Nacional de Saúde.
RELATO DO CASO
Paciente, sexo feminino, 61 anos, com diagnóstico de neoplasia maligna de orofaringe confirmada por biópsia excisional de linfonodo cervical nível II com carcinoma espinocelular (CEC) moderadamente diferenciado – p16 positivo. História de mais de 40 maços-ano de consumo de tabaco e ausência de outras comorbidades relevantes; negava tratamentos prévios ou profilaxia para TB. O estadiamento inicial foi sem doença metastática a distância. A paciente foi submetida a tratamento curativo com radioterapia e quimiossensibilização com cisplatina.
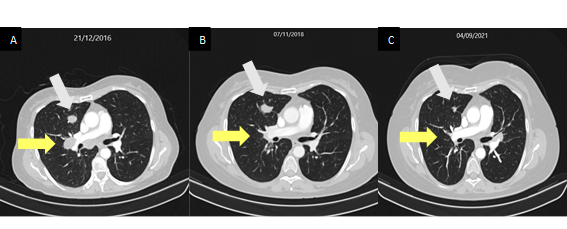
Um ano após o término do tratamento, a paciente apresentou linfonodomegalias mediastinais, evidenciadas em tomografia computadorizada (TC); a maior do hilo pulmonar esquerdo medindo 2,7x2,0 cm, além de nódulos pulmonares sugestivos de acometimento secundário, o maior no lobo inferior direito de 2,5x1,6 cm (Figura 1A). Considerou-se, então, doença recidivada a distância, e iniciou tratamento com carboplatina, fluorouracil e cetuximabe, com doença estável por seis meses de tratamento, quando evoluiu com progressão da doença pulmonar e linfonodal, sendo iniciado tratamento de segunda linha com paclitaxel. Essas lesões apresentaram resposta parcial na segunda linha, durante 15 meses de tratamento, e voltaram a crescer (Figura 1B).
Em virtude da progressão de doença e de a paciente manter-se em excelente performance status, foi proposto nivolumabe como terceira linha de tratamento. As lesões pulmonares e mediastinais entraram em resposta quase completa e duradoura por cerca de 37 meses (Figura 1C), quando apresentou novo alargamento de linfonodo mediastinal peri-hilar esquerdo único, denominado oligoprogressão. Submeteu-se a lesão à radioterapia corporal estereotáxica (SBRT) e manteve-se o tratamento com nivolumabe, com excelente controle local por mais quatro meses. Como toxicidade relacionada à imunoterapia, a paciente desenvolveu hipotireoidismo controlado com levotiroxina, cerca de quatro meses após o início do tratamento.
|
|
|
Figura 1. Presença de nódulo pulmonar no lobo inferior direito (seta branca) e linfonodomegalias hilares à direita (seta amarela), momento considerado o início da doença neoplásica metastática recidivante (A). Exames de imagem antes de iniciar o tratamento com nivolumabe, depois de já ter recebido duas linhas diferentes de quimioterapia com resposta parcial (B). Controle por imagem, após cerca de 37 meses de tratamento com nivolumabe, mostrando excelente resposta pulmonar (C) |
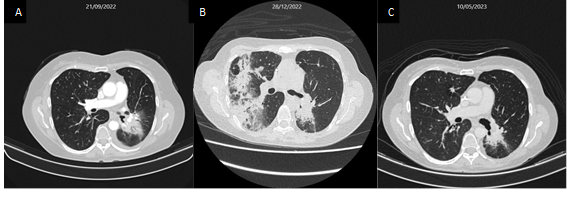
Dois meses após o término da radioterapia, iniciou tosse produtiva e episódios de broncoespasmo, e a TC mostrou imagem de consolidação pulmonar com broncograma aéreo em lobo inferior esquerdo sem plano de clivagem e linfonodomegalias associadas no hilo pulmonar do mesmo lado (Figura 2A). Recebeu tratamento sequencial com azitromicina e ceftriaxona, porém, com o agravamento dos sintomas respiratórios com dispneia, emagrecimento e sudorese noturna, houve necessidade de internação para suporte clínico (Figura 2B). Foi levantada a hipótese de TB ativa, confirmada com a pesquisa do bacilo álcool-ácido resistente (BAAR) no escarro. Após o início do esquema rifampicina-isoniazida-pirazinamida-etambutol (RIPE) de tratamento para TB, a paciente apresentou melhora clínica significativa.
Em razão das questões de financiamento do tratamento, até o último contato com o paciente – aproximadamente três meses após o início do tratamento anti-TB –, a imunoterapia não havia sido reiniciada. O controle por imagem após quatro meses de tratamento para TB mostrou excelente recuperação da infecção pulmonar, mas já com sugestão de crescimento de metástase pulmonar (Figura 2C).
|
|
|
Figura 2. Início dos sintomas com tosse produtiva e broncoespasmo, dois meses após ter sido submetida à radioterapia estereotáxica-SBRT no hilo direito (A). Imagem de internação hospitalar após piora clínica com tosse produtiva, dispneia, emagrecimento e sudorese noturna (B). Controle de imagem após quatro meses de tratamento anti-TB (C) |
DISCUSSÃO
O diagnóstico de TB pulmonar nessa paciente durante o tratamento com nivolumabe, sem outros fatores de risco para o desenvolvimento da infecção, levou à revisão da literatura sobre a relação entre o uso de ICI e a reativação de ILTB. Foram encontrados vários relatos7,17,18 levantando a preocupação sobre as consequências, gravidade e como prevenir novos casos semelhantes no futuro.
A maioria das reativações de TB em pacientes tratados com ICI parece ser pulmonar, como no caso em questão7, porém, a maior parte dos casos tem o diagnóstico da reativação nos três primeiros meses de tratamento17. A paciente do presente caso já estava tratando há quase 40 meses quando iniciou sintomas respiratórios e sudorese noturna. Reagiu bem e prontamente ao tratamento anti-TB, como na maioria dos pacientes descritos tratados, apesar de relatos de evoluções rápidas e fulminantes.
Foram revisados relatos de experiências de rastreamento para ILTB e uma série recente publicada de 70 pacientes em um serviço dermato-oncológico na Alemanha19. Um país com incidência baixa para TB avaliou a aderência ao rastreamento para TB latente durante o período de dois anos, nos pacientes que receberiam tratamento com inibidores de checkpoint com o seguinte resultado: 73% dos pacientes foram avaliados e 9% testaram positivo para infecção latente.
Liu K et al.7, em sua revisão sistemática com 27 estudos, evidenciaram 35 casos de TB em pacientes tratados com inibidores de checkpoint, e conseguiram calcular a incidência estimada de casos de TB em pacientes submetidos à terapia com ICI – a incidência pode chegar a incríveis dois mil casos/100 mil habitantes, 35 vezes maior do que na população geral. No entanto, os dados coletados foram predominantemente de países com baixa incidência de TB – considerada baixa quando é inferior a dez casos/100 mil habitantes.
No Brasil, em 2021, foram notificados 68.271 casos novos de TB na população geral, enquanto, em países como França e Estados Unidos, esse número não chega a dez mil no mesmo período18, o que leva a crer na importância da discussão de medidas preventivas contra a reativação dessa infecção nos pacientes que receberão ICI.
O controle imunológico da ILTB requer um equilíbrio de células imunes para inibir o crescimento do bacilo, mas, ao mesmo tempo, não gera uma resposta inflamatória intensa a ponto de causar dano tecidual. A inibição da via PD-1 pode estimular múltiplos tipos de células imunes no granuloma, resultando no colapso dessa estrutura com perda do controle da infecção latente18,20,21. Tereza et al.9, em um modelo tridimensional de cultura celular de TB humana, demonstraram que o PD-1 regula a resposta imune na TB, e a inibição de PD-1 acelera o crescimento de M. tuberculosis por meio da secreção excessiva de TNF-α.
O rastreio da ILTB e, por consequência, a quimioprofilaxia da TB já estão bem estabelecidos em pacientes de alto risco para o desenvolvimento de TB ativa, por exemplo, antes de tratamentos com medicações anti-TNF-α22-24, seja na forma do teste tuberculínico (PPD) e mais recentemente pelo teste de liberação interferon-gama (do inglês, IGRA), em razão das consequências potencialmente fatais da reativação da TB.
Na atualidade, não existe nenhuma recomendação prática para o rastreio ou quimioprofilaxia para os pacientes que estão sendo considerados para tratamento com ICI sugerida pelas sociedades especializadas. Na literatura atual, encontrou-se apenas uma recomendação clínica publicada, patrocinada pelo departamento de saúde chinês, que discute as recomendações para diagnóstico e conduta de infecções relacionadas ao uso dos ICI25. Inclusive, no levantamento do estudo de casos de Langan et al.19, os autores detalham que os protocolos de pesquisa durante o desenvolvimento de alguns ICI não incluíram exames de rastreamento de ILTB nos pacientes que desenvolveram TB ativa.
No Brasil, há tempos, utiliza-se o teste PPD. Mais recentemente, o teste IGRA foi disponibilizado, inclusive, na rede pública para pacientes de alto risco de desenvolvimento de TB (crianças ≥ 2 anos <10 anos que tiveram contato com casos de TB ativa, pacientes HIV com contagem de linfócitos-CD4 >350 células/mm3 e pessoas candidatas a transplante de células-tronco)13.
Além disso, ressalta-se a importância da inclusão da TB como diagnóstico diferencial para pacientes que desenvolvem quadro pulmonar em terapia com inibidores da PD-126-28, além da pneumonite imunomediada – esta última uma situação rara –, com frequência inferior a 1%, cujo tratamento inclui o uso de corticosteroides, às vezes, em altas doses.
O caso vigente foi também um desafio de conduta, pois ainda não há um consenso geral se a terapia com ICI deveria ser continuada, temporariamente interrompida ou permanentemente suspensa, no contexto de infecção aguda por M tuberculosis ou reativação19. De acordo com uma revisão sistemática, o tempo para reiniciar a imunoterapia variou de um a quatro meses e não houve interferência do tratamento anti-TB na efetividade do tratamento antineoplásico12.
CONCLUSÃO
O número de relatos de associação da reativação da TB ao tratamento com inibidores de PD-1 vem aumentando com a globalização do uso desses medicamentos, por isso, sugere-se, com este caso típico, levantar a discussão sobre a indicação de rotina do rastreamento de infecção latente, principalmente em países de alta incidência de TB como o Brasil, previamente ao tratamento com medicações ICI.
CONTRIBUIÇÕES
Ambos os autores contribuíram na concepção e/ou no planejamento do estudo; na obtenção, análise e/ou interpretação dos dados; na redação e/ou revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Kim Y, Lee J, Kim SJ, et al. Development of tuberculosis in cancer patients receiving immune checkpoint inhibitors. Respr Med. 2020;161:105853. doi: https://doi.org/10.1016/j.rmed.2019.105853
2. Fujita K, Kim YH, Kanai O, et al. Emerging concerns of infectious diseases in lung cancer patients receiving immune checkpoint inhibitor therapy. Respir Med. 2019;146:66-70. doi: https://doi.org/10.1016/j.rmed.2018.11.021
3. Chan GH, Gwee YX, Low JL, et al. Immune checkpoint inhibition for non-small cell lung cancer in patients with pulmonary tuberculosis or hepatitis B: experience from a single Asian Centre. Lung Cancer. 2020;146:145-53. doi: https://doi.org/10.1016/j.lungcan.2020.05.020
4. Zaemes J, Kim C. Immune checkpoint inhibitor use and tuberculosis: a systematic review of the literature. Eur J Cancer. 2020;132:168-75. doi: https://doi.org/10.1016/j.ejca.2020.03.015
5. Anastasopoulou A, Ziogas DC, Samarkos M, et al. Reactivation of tuberculosis in cancer patients following administration of immune checkpoint inhibitors: current evidence and clinical practice recommendations. J Immunother Cancer. 2019;7(1):239. doi: https://doi.org/10.1186/s40425-019-0717-7
6. Suliman AM, Bek SA, Elkhatim MS, et al. Tuberculosis following programmed cell death receptor-1 (PD-1) inhibitor in a patient with non-small cell lung cancer. Case report and literature review. Cancer Immunol Immunother. 2021;70(4):935-44. doi: https://doi.org/10.1007/s00262-020-02726-1
7. Tousif S, Singh Y, Prasad DV, et al. T cells from programmed death-1 deficient mice respond poorly to mycobacterium tuberculosis infection. PLoS One. 2011;6(5):e19864. doi: https://doi.org/10.1371/journal.pone.0019864
8. Barber DL, Sakai S, Kudchadkar RR, et al. Tuberculosis following PD-1 blockade for cancer immunotherapy. Sci Transl Med. 2019;11(475):eaat2702. doi: https://doi.org/10.1126/scitranslmed.aat2702
9. Tezera LB, Bielecka MK, Ogongo P, et al. Anti-PD-1 immunotherapy leads to tuberculosis reactivation via dysregulation of TNF-α. Elife. 2020;9:e52668. doi: https://doi.org/10.7554/elife.52668
10. Bagcchi S. WHO's Global Tuberculosis Report 2022. Lancet Microbe. 2023;4(1):e20. doi: https://doi.org/10.1016/s2666-5247(22)00359-7
11. Van Eeden R, Rapaport BL, Smit T, et al. Tuberculosis infection in a patient treated with nivolumab for non-small cell lung cancer: case report and literature review. Front Oncol. 2019;9:659. doi: https://doi.org/10.3389/fonc.2019.00659
12. Shi J, Li J, Wang Q, et al. The safety and efficacy of immunotherapy with anti-programmed cell death 1 monoclonal antibody for lung cancer complicated with Mycobacterium tuberculosis infection. Transl Lung Cancer Res. 2021;10(10):3929-42. doi: https://doi.org/10.21037/tlcr-21-524
13. Ministério da Saúde (BR). Protocolo de vigilância da infecção latente pelo Mycobacterium tuberculosis no Brasil. 2. ed. Brasília, DF: Ministério da Saúde; 2022.
14. Ministério da Saúde (BR). Tuberculose. Boletim Epidemiol [Internet]. 2023 [acesso em 2023 jun 1];Número Especial:1-64. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/especiais/2023/boletim-epidemiologico-de-tuberculose-numero-especial-mar.2023/
15. Liu K, Wang D, Yao C, et al. Increased tuberculosis incidence due to immunotherapy based on PD-1 and PD-L1 blockade: a systematic review and meta-analysis. Front Immunol. 2022;13:727220. doi: https://doi.org/10.3389/fimmu.2022.727220
16. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
17. Bae S, Kim YJ, Kim MJ, et al. Risk of tuberculosis in patients with cancer treated with immune checkpoint inhibitors: a nationwide observational study. J Immunother Cancer. 2021;9(9):e002960. doi: https://doi.org/10.1136/jitc-2021-002960
18. Ramakrishnan L. Revisiting the role of the granuloma in tuberculosis. nat rev immunol. 2012;12(5):352-66. doi: https://doi.org/10.1038/nri3211
19. Langan EA, Graetz V, Allerheiligen J, et al. Immune checkpoint inhibitors and tuberculosis: an old disease in a new context. Lancet Oncol. 2020;21(1):e55-e65. doi: https://doi.org/10.1016/s1470-2045(19)30674-6
20. Xu J, Lin X, Liu W, et al. Lung adenocarcinoma with active pulmonary tuberculosis: a case report of successful immunotherapy and systematical review. Research Square [Preprint]. 2021 [posted 2021 set 28]. doi: https://doi.org/10.21203/rs.3.rs-936584/v1
21. Ahmed M, Tezera LB, Elkington PT, et al. The paradox of immune checkpoint inhibition re-activating tuberculosis. Eur Respir J. 2022;60:2102512. doi: https://doi.org/10.1183/13993003.02512-2021
22. Cantini F, Nannini C, Niccoli L, et al. Guidance for the management of patients with latent tuberculosis infection requiring biologic therapy in rheumatology and dermatology clinical practice. Autoimmun Rev. 2015;14(6):503-9. doi: https://doi.org/10.1016/j.autrev.2015.01.011
23. Getahun H, Matteelli A, Abubakar I, et al. Management of latent Mycobacterium tuberculosis infection: WHO guidelines for low tuberculosis burden countries. Eur Respir J. 2015;46(6):1563-76. doi: https://doi.org/10.1183/2F13993003.01245-2015
24. Pahal P, Pollard EJ, Sharma S. PPD Skin Test [Internet]. Treasure Island: StatPearls Publishing; 2023. [acesso 2023 dez 12]. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK556037/
25. Lu M, Zhang L, Li Y, et al. Recommendation for the diagnosis and management of immune checkpoint inhibitor related infections. Thorac Cancer. 2020;11:805-9. doi: https://doi.org/10.1111/1759-7714.13313
26. Bukamur H, Katz H, Alsharedi M, et al. Immune checkpoint inhibitor-related pulmonary toxicity: focus on nivolumab. South Med J. 2020;113(11):600-5. doi: https://doi.org/10.14423/SMJ.0000000000001166
27. Hamashima R, Uchino J, Morimoto Y, et al. Association of immune checkpoint inhibitors with respiratory infections: a review. Cancer Treat Rev. 2020;90:102109. doi: https://doi.org/10.1016/j.ctrv.2020.102109
28. Cadranel J, Canellas A, Matton L, et al. Pulmonary complications of immune checkpoint inhibitors in patients with nonsmall cell lung cancer. Eur Respir Rev. 2019;28(153):190058. doi: https://doi.org/10.1183/16000617.0058-2019
Recebido em 27/11/2023
Aprovado em 8/1/2024
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.
©2019 Revista Brasileira de Cancerologia | Instituto Nacional de Câncer | Ministério da Saúde