Eficácia e Segurança do Blinatumomabe no Tratamento da Leucemia Linfoblástica Aguda: Revisão Sistemática da Literatura
Efficacy and Safety of Blinatumomab in the Treatment of Acute Lymphoblastic Leukemia: Systematic Literature Review
Eficacia y Seguridad de Blinatumomab en el Tratamiento de la Leucemia Linfoblástica Aguda: Revisión Sistemática de la Literatura
https://doi.org/10.32635/2176-9745.RBC.2024v70n1.4482
Renan do Nascimento Gonçalves¹; Aline do Nascimento2; Raphael Duarte Chança3; Laura Augusta Barufaldi4
1Hospital Municipal de Juína. Juína (MT), Brasil. E-mail: renan.nascimento@farmacia.ufjf.br. Orcid iD: https://orcid.org/0000-0002-4184-0220
2-4Instituto Nacional de Câncer (INCA), Coordenação de Prevenção e Vigilância (Conprev), Divisão de Avaliação de Tecnologias em Saúde (DATS). Rio de Janeiro (RJ), Brasil. E-mails: aline.nascimento@inca.gov.br; raphael.chanca@inca.gov.br; laura.barufaldi@inca.gov.br. Orcid iD: https://orcid.org/0000-0001-8801-6012; Orcid iD: https://orcid.org/0000-0002-1023-245X; Orcid iD: https://orcid.org/0000-0001-9040-4399
Endereço para correspondência: Laura Augusta Barufaldi. Rua Marquês de Pombal 125, 7º andar – Centro. Rio de Janeiro (RJ), Brasil. CEP 20230-240. E-mail: laura.barufaldi@inca.gov.br
RESUMO
Introdução: As opções de tratamento convencionais para leucemia linfoblástica aguda (LLA) são a quimioterapia, a transfusão de sangue e o transplante de medula óssea. O blinatumomabe é uma forma mais recente de tratamento que utiliza a tecnologia de um anticorpo biespecífico para o combate da LLA. Objetivo: Avaliar a eficácia e a segurança do blinatumomabe para tratamento de pacientes com LLA por meio de uma revisão sistemática. Método: Estudos sobre a temática foram pesquisados nas bases de dados Cochrane, Embase, LILACS e PubMed. Foram utilizadas as ferramentas Rayyan e EndNote para o gerenciamento de referências. Etapas de seleção, extração e avaliação da qualidade foram conduzidas em dupla e as divergências foram resolvidas por consenso. A qualidade das evidências obtidas e o risco de viés foram avaliados com as ferramentas GRADE e RoB 2 da Cochrane. Resultados: Foram incluídos para análise cinco artigos científicos referentes a três ensaios clínicos randomizados multicêntricos e internacionais. Os resultados relacionados à sobrevida global, à sobrevida livre de progressão e a eventos adversos foram superiores no grupo blinatumomabe comparado com a quimioterapia convencional. A análise de risco de viés mostrou algumas preocupações para os desfechos sobrevida livre de progressão e eventos adversos, principalmente em razão do cegamento dos participantes, o que também determinou que o grau de certeza das evidências fosse classificado como moderado. Conclusão: Aumento da sobrevida e menor taxa de eventos adversos foram observados para o grupo blinatumomabe, sugerindo que o medicamento é mais eficaz e seguro quando comparado à quimioterapia convencional para o tratamento da LLA.
Palavras-chave: Leucemia Aguda Bifenotípica; Anticorpos Biespecíficos; Technology Assessment, Biomedical; Revisão.
ABSTRACT
Introduction: The conventional treatment options for acute lymphoblastic leukemia (ALL) are chemotherapy, blood transfusion, and bone marrow transplant. Blinatumomab is a novel form of treatment that uses bispecific antibody technology to fight ALL. Objective: Systematic literature review to evaluate the efficacy and safety of blinatumomab for the treatment of patients with ALL. Method: Studies on the topic were searched in the Cochrane, Embase, LILACS and PubMed databases. The Rayyan and EndNote tools were used for reference management. The selection, extraction and quality assessment stages were conducted in pairs and disagreements were resolved by consensus. The quality of the evidence obtained and the risk of bias were assessed using Cochrane's GRADE and RoB 2 tools. Results: Five scientific articles referred to three multicenter and international randomized clinical trials were included for analysis. The results related to overall survival, progression-free survival and adverse events were better in the blinatumomab group compared with conventional chemotherapy. The analysis of risk of bias raised some concerns for the progression-free survival and adverse events outcomes, mainly due to the blinding of participants, which also determined that the degree of certainty of the evidence was classified as moderate. Conclusion: Increased survival and lower rate of adverse events were observed for the blinatumomab group, suggesting that it is more effective and safer when compared to conventional chemotherapy for the treatment of ALL.
Key words: Leukemia, Biphenotypic, Acute; Antibodies, Bispecific; Evaluación de la Tecnología Biomédica; Review.
RESUMEN
Introducción: Las opciones de tratamiento convencionales para la leucemia linfoblástica aguda (LLA) son la quimioterapia, la transfusión de sangre y el trasplante de médula ósea. Blinatumomab es una nueva forma de tratamiento que utiliza tecnología de anticuerpos biespecíficos para combatir la LLA. Objetivo: Evaluar la eficacia y seguridad de blinatumomab para el tratamiento de pacientes con LLA mediante una revisión sistemática. Método: Se buscaron estudios sobre el tema en las bases de datos Cochrane, Embase, LILACS y PubMed. Para la gestión de referencias se utilizaron las herramientas Rayyan y EndNote. Las etapas de selección, extracción y evaluación de la calidad se realizaron por parejas y los desacuerdos se resolvieron por consenso. La calidad de la evidencia obtenida y el riesgo de sesgo se evaluaron mediante las herramientas GRADE y RoB 2 de Cochrane. Resultados: Se incluyeron para el análisis cinco artículos científicos referentes a tres ensayos clínicos aleatorizados, multicéntricos e internacionales. Los resultados relacionados con la supervivencia general, la supervivencia libre de progresión y los eventos adversos fueron superiores en el grupo de blinatumomab en comparación con la quimioterapia convencional. El análisis de riesgo de sesgo mostró algunas preocupaciones sobre los resultados de supervivencia libre de progresión y eventos adversos, principalmente debido al cegamiento de los participantes, lo que también determinó que el grado de certeza de la evidencia se clasificara como moderado. Conclusión: Se observó una mayor supervivencia y una menor tasa de eventos adversos para el grupo de blinatumomab, lo que sugiere que blinatumomab es más eficaz y seguro en comparación con la quimioterapia convencional para el tratamiento de la LLA.
Palabras clave: Leucemia Bifenotípica Aguda; Anticuerpos Biespecíficos; Evaluación de Tecnologías Sanitarias; Revisión.
INTRODUÇÃO
As displasias, hiperplasias e metaplasias são tipos de crescimento celular, decorrentes de respostas controladas ao estímulo que os tecidos estão sendo submetidos. Quando essa resposta ocorre de maneira desordenada e não se reverte ao término do estímulo, existe o tipo celular chamado neoplasia1. As neoplasias constituem centenas de doenças que comprometem a fisiologia do organismo humano. Entre as que acometem o tecido sanguíneo, as leucemias são uma das mais conhecidas, tendo em vista sua elevada incidência no mundo. Dessa forma, a detecção e o tratamento precoce são de extrema importância para um bom prognóstico do paciente que é acometido com essa doença2.
As leucemias são doenças clonais dos linfócitos e têm como mecanismo fisiopatológico a ocorrência de alterações genéticas na célula-tronco hematopoiética ou progenitora3. Segundo o Instituto Nacional de Câncer (INCA)4, existem mais de 12 tipos de leucemia, e as principais são leucemia mieloide aguda (LMA), leucemia mieloide crônica (LMC), leucemia linfoblástica crônica (LLC) e leucemia linfoblástica aguda (LLA).
Nas leucemias agudas, ocorre uma interrupção na maturação das células hematopoiéticas e, assim, as células primitivas não se desenvolvem, permanecendo em sua forma blástica. As células imaturas seguem por um processo de proliferação clonal e se acumulam no tecido sanguíneo5.
Segundo dados da Agência Internacional de Pesquisa em Câncer6, as leucemias ocupam o 13º lugar entre os cânceres mais incidentes mundialmente, com 437.033 casos novos. Em relação à mortalidade, ocorreram 309.006 óbitos, o que representou 3,5% para todas as localizações.
No Brasil, o INCA4 estimou, para cada ano do triênio 2023-2025, 6.250 casos novos de todas as leucemias em homens e 5.290 em mulheres, totalizando 11.540 casos. Esses valores representam um risco estimado de 5,90 casos novos a cada 100 mil homens e 4,78 casos novos para cada 100 mil mulheres. A LLA resulta da proliferação clonal de precursores linfoides anormais na medula óssea. Ocorre uma transformação maligna e a proliferação de células progenitoras linfoides na medula óssea, sangue e locais extramedulares7. Sua principal característica consiste nas anormalidades cromossômicas e genéticas envolvidas na diferenciação e proliferação de células precursoras linfoides8. Essa doença pode ocorrer em pessoas de qualquer idade, entretanto, a incidência é maior em crianças de dois a cinco anos, diminuindo na adolescência e em adultos jovens, mas tem crescido após os 60 anos de idade7.
As opções de tratamento convencionais para a LLA são a quimioterapia, transfusão de sangue, transplante de medula óssea e também terapias-alvo, por meio dos inibidores da tirosina quinase (mesilato de imatinibe, nilotinibe e dasatinibe), caso o paciente apresente o cromossomo Philadelphia5,9.
O cenário do tratamento do câncer vem mudando consideravelmente nas últimas décadas, sendo inovadoras terapias celulares menos citotóxicas comparadas às quimioterapias clássicas10. Nesse contexto, o blinatumomabe, um anticorpo biespecífico11, foi desenvolvido para o tratamento de pacientes com LLA. Atualmente seu registro na Agência Nacional de Vigilância Sanitária (Anvisa) tem indicação para o tratamento de LLA de linhagem B recidivada e para o tratamento de adultos com LLA de células B com doença residual mínima (DRM) positiva, que já atingiram remissão completa12. O blinatumomabe promove a formação de uma sinapse citolítica entre a célula tumoral e a célula T, que, por sua vez, irá liberar enzimas proteolíticas para eliminar tanto as células tumorais em proliferação quanto as que estão em repouso. Após a destruição das células B alvo, a mesma molécula do fármaco fica disponível para a identificação de outras células B malignas, iniciando novamente o processo de indução de morte celular11. A ligação de blinatumomabe à célula T ativa as vias de sinalização responsáveis por induzir a proliferação celular e, dessa forma, aumenta o número de células T circulantes capazes de se ligar às células B malignas13.
Diante dos possíveis benefícios que essa tecnologia apresenta no tratamento de pacientes com LLA, o objetivo desta revisão sistemática é avaliar a eficácia e a segurança do blinatumomabe para o tratamento de pacientes com LLA em população pediátrica e adulta.
MÉTODO
Revisão sistemática da literatura, registrada pelo número CRD42022327491 na plataforma International Prospective Register of Systematic Reviews (PROSPERO)14. Esta se fundamenta na versão mais atualizada das Diretrizes Metodológicas para Elaboração de Revisão Sistemática e Meta-Análise de Ensaios Clínicos Randomizados15 e segue as recomendações do Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)16.
A pesquisa é pautada no acrônimo PICOS (Quadro 1). A pergunta norteadora deste trabalho é: “O blinatumomabe é mais eficaz e seguro em pacientes com leucemia linfoblástica aguda quando comparado ao tratamento quimioterápico padrão?”
Quadro 1. Definição do acrônimo PICOS
|
Acrônimo |
Definição |
|
P: População |
Pacientes adultos e pediátricos com leucemia linfoblástica aguda |
|
I: Intervenção |
Blinatumomabe |
|
C: Comparador |
Quimioterapia padrão |
|
O: Desfecho (outcome) |
Sobrevida livre de progressão, sobrevida global, taxa de resposta, qualidade de vida e eventos adversos |
|
S: Desenho de estudo (study) |
Ensaios clínicos randomizados |
Foram incluídos estudos que atenderam ao acrônimo PICOS, ou seja, ensaios clínicos randomizados que avaliaram pacientes com LLA, com blinatumomabe como intervenção e quimioterapia convencional como comparador. Não foram incluídos outros desenhos de estudo, como artigos de opinião e editoriais, além das publicações que não disponibilizaram todos os dados necessários, como resumos de congresso. Não houve restrição quanto ao período em que os estudos foram realizados, quanto à idade da população de estudo e idiomas dos estudos publicados.
As buscas de estudos foram realizadas nas seguintes bases: MEDLINE (via PubMed), Embase, LILACS e Cochrane utilizando palavras-chave e descritores controlados, em português e em inglês, específicos para cada plataforma. Foram consideradas as singularidades de cada base de dados.
Os resultados obtidos foram armazenados em arquivos pessoais e exportados para as ferramentas EndNote17 para o gerenciamento de referências e Rayyan18 para a seleção dos estudos. As etapas de seleção dos estudos e de extração dos dados, feita a partir de um formulário em planilha Microsoft Office Excel previamente elaborado, foram executadas em dupla e de forma independente, com discussão e consenso sobre as discordâncias.
As informações extraídas dos artigos selecionados incluíram autor e ano de publicação, sigla do estudo e localidade. As variáveis coletadas foram: local, tipo de desenho de estudo, critérios de inclusão e de exclusão, o número de participantes, intervenções, média de idade, sexo dos pacientes, o tempo de acompanhamento, os desfechos, formas de medição e resultados obtidos.
A ferramenta Risk of Bias, versão 2.0 (RoB 2), da Cochrane19, foi utilizada para avaliação do risco de viés dos estudos. Essa etapa também foi realizada de forma independente por uma dupla de pesquisadores e as divergências discutidas para obtenção de consenso. Para avaliar a qualidade das evidências, foi utilizada a ferramenta Grading of Recommendations Assessment, Development and Evaluation (GRADE)20.
RESULTADOS
Como produto da estratégia de busca elaborada, 274 estudos foram identificados nas bases de dados eletrônicas, os quais foram avaliados quanto aos critérios de elegibilidade. Destes, apenas cinco estavam adequados aos critérios de inclusão e foram eleitos para o estudo21-25. A Figura 1 descreve o processo de seleção das publicações incluídas nesta revisão.
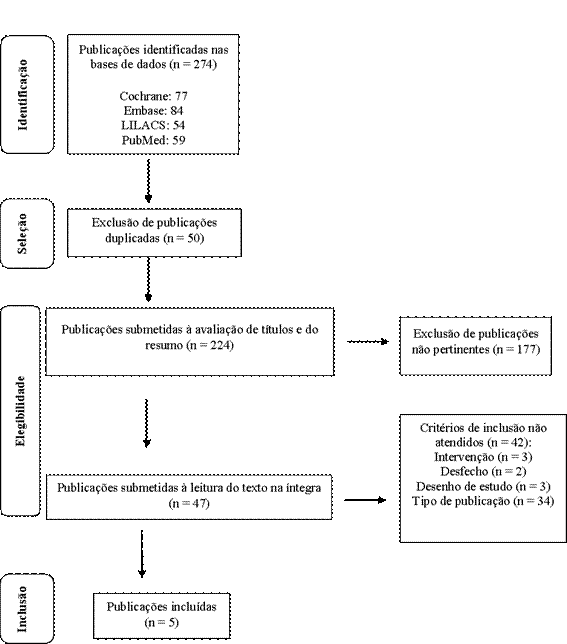
Figura 1. Fluxograma PRISMA representativo do processo de identificação, seleção e elegibilidade dos estudos
Adaptado de PRISMA 202016.
Foram selecionados cinco artigos científicos referentes a três ensaios clínicos randomizados multicêntricos e internacionais, sendo um publicado no ano de 2017, dois em 2018 e dois em 2021.
Os resultados obtidos após o processo de seleção dos estudos estão sintetizados no Quadro 2.
Quadro 2. Principais achados dos estudos selecionados
|
Autor / Ano |
Local |
População |
Número de participantes |
Desfechos e Principais achados |
|
Brown et al., 202121 |
Estados Unidos, Canadá, Austrália e Nova Zelândia |
Crianças, jovens e adultos com primeira recaída de LLA de células B |
208 |
SLP: 54,4% dos pacientes do grupo blinatumomabe vs. 39% para o grupo QT convencional (HR de 0,70 [IC 95%, 0,47-1,03]) não apresentaram progressão da doença por 2 anos, entretanto sem diferença estatisticamente significativa; SG: 71,3% para o grupo blinatumomabe vs. 58,4% para o grupo QT (HR de 0,62 [IC 95%, 0,39-0,98]), ou seja, em dois anos, a SG foi maior no grupo blinatumomabe; EA: Ciclo 1: 76% no grupo blinatumomabe e 91% no grupo QT; Ciclo 2: 56% no grupo blinatumomabe e 84% no grupo QT. EA foram mais frequentes em pacientes que receberam a QT convencional |
|
Kantarijian et al., 201722 Estudo TOWER |
101 centros em 21 países |
Adolescentes e adultos previamente tratados para LLA de células B |
405 |
SLP: 31% dos pacientes do grupo blinatumomabe vs. 12% para o grupo QT convencional (HR de 0,55 [IC95%, 0,43-0,71]) não apresentaram progressão da doença por 6 meses. SG: Mediana de 7,7 meses no grupo blinatumomabe; no grupo QT foi de 4 meses (HR, 0.71; 95% IC, 0,55 a 0.93; p = 0,01); EA: EA de grau 3 ou superior foram relatados em 87% dos pacientes no grupo de blinatumomabe e em 92% dos pacientes do grupo de QT |
|
Locatelli et al., 202123 |
47 centros em 13 países |
Crianças e adolescentes com alto risco de recaída de LLA de células B |
105 |
SLP: A taxa de risco de sobrevivência livre de eventos foi de 0,33 (IC 95%, 0,18-0,61) a favor do blinatumomabe (modelo de risco proporcional estratificado de Cox). Pela estimativa de Kaplan-Meier, a SLP foi 66,2% (IC 95%), no grupo de blinatumomabe e 27,1% (IC 95%) no grupo QT, em 24 meses. SG: HR foi de 0,43 (IC 95%, variando de 0,18-1,01); EA: 24,1% para o grupo blinatumomabe vs. 43,1%, no grupo QT, e a incidência de EA maior ou igual ao grau 3 foi 57,4% para o grupo blinatumomabe e 82,4% para o grupo QT convencional |
|
Stein et al., 201824 Estudo TOWER |
101 centros em 21 países |
Adultos e idosos de 18 a 80 anos |
376 |
EA: taxas foram maiores no braço blinatumomabe em comparação com QT para SLC (16% vs. 0%), eventos neurológicos (61% vs. 50%) e síndrome de lise tumoral (4% vs. 1 %), mas foram menores para citopenias (60% vs. 72%). Distúrbios gastrointestinais: 56% para o grupo blinatumomabe vs. 80% para o grupo QT. EA de grau 3: 87% para o grupo blinatumomabe vs. 92% para o grupo QT; Infecções: 34% para o grupo blinatumomabe vs. 52% para o grupo QT; SLC: 5% no grupo blinatumomabe, sem ocorrência (0%) para o grupo QT |
|
Topp et al., 201825 Estudo TOWER |
101 centros em 21 países |
Adultos |
247 |
QV: Pacientes que receberam blinatumomabe (n = 152) relataram melhor QVRS pós-tratamento em todas as subescalas EORTC QLQ-C30, com base na alteração média descritiva da linha de base, do que aqueles que receberam quimioterapia (n = 95). As razões de risco para TTD de 10 pontos da linha de base na QVRS ou morte variaram de 0,42 a 0,81 em favor de blinatumomabe, com os limites superiores do intervalo de confiança de 95% < 1,0 em todas as medidas, exceto insônia, funcionamento e dificuldades financeiras |
Legendas: LLA = leucemia linfoblástica aguda; SLP = sobrevida livre de progressão; SG = sobrevida global; EA = eventos adversos; QT = quimioterapia; IC = intervalo de confiança; HR = hazard ratio; SLC = síndrome de liberação de citocinas; TTD = tempo até a deterioração; QV = qualidade de vida; QVRS = qualidade de vida relacionada à saúde; EORTC QLQ-C30 = European Organization for Research and Treatment of Cancer Quality of Life Questionnaire Core 30.
No estudo de Brown et al.21, 208 pacientes com idade entre 1 e 30 anos na primeira recaída de LLA foram randomizados para receber quimioterapia de reindução de quatro semanas, seguido por dois ciclos de blinatumomabe (n = 105), ou quimioterapia de reindução de quatro semanas, seguido por dois ciclos de quimioterapia multiagente (n = 103). Kantarjian et al.22 randomizaram 405 adolescentes e adultos com LLA para receber blinatumomabe ou quimioterapia convencional. Os desfechos analisados em ambos os estudos foram sobrevida global (SG), sobrevida livre de progressão (SLP) e eventos adversos (EA).
Crianças e adolescentes de 1 a 17 anos de 47 centros de oncologia em 13 países fizeram parte da amostra do ensaio clínico de Locatelli et al.23. Um total de 105 indivíduos foram randomizados para receber blinatumomabe ou quimioterapia padrão. O desfecho primário foi a sobrevida livre de eventos (recidiva, morte, segunda malignidade ou falha em atingir a remissão completa). Outro desfecho importante foi a SG. Remissão residual mínima da doença e incidência de EA também foram avaliados.
Além dos ensaios clínicos supracitados, fizeram parte desta revisão sistemática os artigos de Stein et al.24 e Topp et al.25. Esses artigos se referem aos resultados do estudo TOWER de Kantarijian et al.22. Em ambos, os pacientes foram randomizados para receber quimioterapia padrão ou blinatumomabe. Conforme descrito no Quadro 2, os resultados desses estudos também apontaram vantagens no uso do blinatumomabe em comparação à quimioterapia.
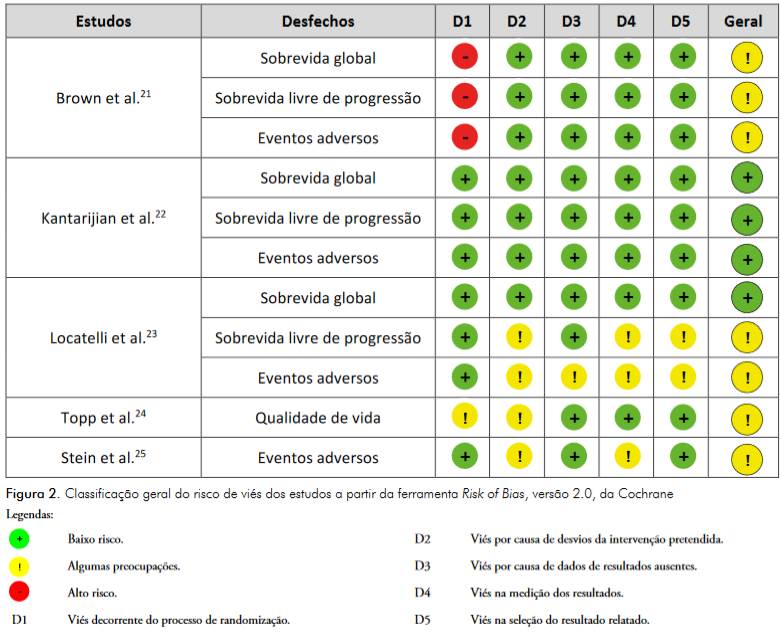
Sobre a avaliação do risco de viés, para o desfecho de SG, o risco de viés foi classificado como baixo nos estudos de Locatelli et al.23 e Kantarijian et al.22, e com algumas preocupações no estudo de Brown et al.21. Para o desfecho de SLP, o estudo de Kantarijian et al.22 foi considerado com baixo risco de viés, enquanto os estudos de Brown et al.21 e Locatelli et al.23 apresentaram algumas preocupações. No estudo de Kantarijian22, o desfecho de EA foi considerado de baixo risco de viés, e para os demais estudos a classificação foi de algumas preocupações. Por fim, o desfecho de qualidade de vida (QV) foi avaliado apenas no estudo de Topp et al.25, o qual foi considerado com algumas preocupações relacionadas à randomização e ao cegamento.
A Figura 2 mostra o resultado obtido após análise do risco de viés utilizando a ferramenta RoB 2 da Cochrane.
Quadro 3. Avaliação da certeza da evidência para os desfechos de sobrevida global, sobrevida livre de progressão, eventos adversos e qualidade de vida
|
Avaliação da qualidade |
Impacto |
Qualidade da evidência |
Importância |
|||||||
|
Número de estudos |
Delineamento do estudo |
Risco de viés |
Inconsistência |
Evidência indireta |
Imprecisão |
Outras considerações |
||||
|
Sobrevida global (seguimento: variação de 11,7 meses para 34,8 meses – avaliado com HR) |
||||||||||
|
321-23 |
Ensaios clínicos randomizados |
Não gravea |
Não graveb |
Não gravec |
Não graved |
Nenhum |
Brown et al.21: Desfecho avaliado para n = 135 resultando em uma SG de 71,3% para o grupo blinatumomabe e 58,4% para o grupo QT padrão. Tempo definido: 24 meses. HR = 0,62. IC 95% = 0,39 - 0,98 |
⨁⨁⨁◯ Moderada |
Crítico |
|
|
Kantarijian et al.22: Desfecho avaliado para 100 pacientes, resultando em uma SG de 31% para o grupo blinatumomabe 12% para o grupo QT padrão. Tempo definido: 6 meses. HR = 0,71. IC 95% = 0,18-1,01 |
⨁⨁⨁◯ Moderada |
Crítico |
||||||||
|
Locatelli et al.23: Desfecho avaliado para 24 pacientes, resultando em uma SG de 85,2% para o grupo blinatumomabe e 70,4% para o grupo QT padrão. Tempo definido: 19,5 meses. HR = 0,43. IC 95% = 0,18-1,01 |
⨁⨁⨁◯ Moderada |
Crítico |
||||||||
|
Sobrevida livre de progressão (seguimento: variação de 7,8 meses a 24 meses; avaliado com o tempo desde a randomização até a falha do tratamento) |
||||||||||
|
321-23 |
Ensaios clínicos randomizados |
Não gravee |
Não gravef |
Não gravec |
Não graveg |
Nenhum |
Brown et al.21: A taxa de sobrevida livre de doença em 2 anos foi de 54,4% para o blinatumomabe vs. 39,0% para o grupo de quimioterapia (taxa de risco para progressão da doença ou mortalidade = 0,70 [IC 95%, 0,47-1,03]) |
⨁⨁⨁◯ Moderada |
Crítico |
|
|
Kantarijian et al.22: As estimativas de 6 meses foram de 31% no blinatumomabe e 12% no grupo de quimioterapia, e a HR para uma recaída após atingir uma remissão completa com tratamento completo, parcial ou incompleto recuperação hematológica, ou morte, foi de 0,55 (IC 95%, 0,43 a 0,71; p < 0,001) |
⨁⨁⨁◯ Moderada |
Crítico |
||||||||
|
Locatelli et al.23: O tempo médio de acompanhamento para a sobrevida livre de progressão foi de 22,4 meses. A sobrevida livre de eventos foi significativamente prolongada para o grupo blinatumomabe em comparação à QT
|
⨁⨁⨁◯ Moderada |
Crítico |
||||||||
|
Eventos adversos (seguimento: variação de 11,7 meses a 34,8 meses; avaliado com reações adversas de grau 3 ou superior) |
||||||||||
|
421-25 |
Ensaios clínicos randomizados |
Não gravee |
Não graveh |
Não gravec |
Não gravei |
Nenhum |
Os pacientes não eram cegados (open-label treatment) nos estudos de Locatelli et al.23, Stein et al.24 e Kantarijan et al.22, os grupos tinham conhecimento do que iriam receber. Para Brown et al.21, apenas os pesquisadores sabiam a alocação dos grupos |
⨁⨁⨁◯ Moderada |
Crítico |
|
|
Qualidade de vida (seguimento: variação 1 mês a 12 meses; avaliado com questionário autoaplicável (EORTC QLQ-C30)) |
||||||||||
|
125 |
Ensaios clínicos randomizados |
Não gravej |
Não gravei |
Não gravec |
Não grave |
Nenhum |
Os pacientes não eram cegados (open-label treatment) nos estudos de Locatelli et al.23, Stein et al.24 e Kantarijan et al.22, os grupos tinham conhecimento do que iriam receber. Em Brown et al.21, apenas os pesquisadores sabiam a alocação dos grupos |
⨁⨁⨁◯ Moderada |
Crítico |
|
Legendas: SG = sobrevida global; QT = quimioterapia; IC = intervalo de confiança; HR = hazard ratio; EORTC QLQ-C30 = European Organization for Research and Treatment of Cancer Quality of Life Questionnaire Core 30.
aDúvida em relação ao processo de randomização e cegamento, entretanto cegamento pouco importante para o desfecho avaliado.
bSendo o estudo aberto, a avaliação da qualidade de vida pode ser influenciada pelo conhecimento do grupo tratamento.
cNão houve incoerência na seleção, visto que o “P” de PICOS abrange pacientes adultos e pediátricos com leucemia linfoblástica aguda.
dLargos intervalos de confiança. Estudo de Locatelli et al. 2021, inclusive, apresentando resultado não significativo (p = 1).
eNão aleatoriedade da alocação dos participantes pode ter favorecido os participantes que receberam blinatumomabe. Neste caso, o não cegamento pode influenciar o resultado.
fO desfecho sobrevida global teve seu efeito avaliado para a mesma direção em ambos os estudos, todos favorecendo o blinatumomabe.
gLargos intervalos de confiança.
hEmbora os resultados para eventos adversos terem sido apresentados de maneira distintas, não houve conflito entre os resultados dos estudos, todos apontando melhores resultados de eventos adversos para os grupos que receberam blinatumomabe.
iFormas distintas de descrever os eventos adversos.
jDúvidas no processo de randomização. Cegamento dos participantes.
DISCUSSÃO
Esta revisão sistemática apresenta os principais desfechos de cinco artigos provenientes de três ensaiosclínicos randomizados de fase 3. Conforme esperado, não havia muitas publicações sobre o blinatumomabe, por se tratar de uma tecnologia relativamente nova, visto que apenas no ano 2014 o medicamento foi aprovado no escopo de opções para manejo da LLA26.
Analisando as referências que compõem a presente revisão sistemática, observa-se que a eficácia e a segurança do blinatumomabe para tratamento da LLA baseia-se nos principais desfechos normalmente enfatizados para tumores hematológicos, que são: SG, SLP e EA. Vale ressaltar que a definição de segurança de um medicamento é relativa e diversos fatores estão envolvidos nesse conceito, portanto as conclusões apontadas após as análises, consideram a margem terapêutica de um medicamento, isto é, a dose eficaz habitual e a dose que produz efeitos colaterais graves ou de risco à vida27. Os estudos analisados pelos autores tiveram uma boa classificação na escala de riscos de viés, porém, as heterogeneidades, principalmente em relação à população estudada e algumas particularidades referentes à condução dos estudos, devem ser pontuadas. Em razão dessa heterogeneidade, não foi executada uma metanálise dos dados obtidos, visto que a população estudada em cada estudo eleito se difere uma da outra, principalmente quanto à faixa etária.
Os resultados obtidos pelo estudo de Brown et al.21 favoreceram o uso do blinatumomabe para a população entre 1 e 30 anos com LLA inicial refratária recidivante. O desfecho primário foi a sobrevida livre de doença e o desfecho secundário foi a SG, ambos desde o momento da randomização. Também foram avaliados EA, e os achados apontam vantagens para o uso do blinatumomabe.
O ensaio clínico randomizado de Kantarijian et al.22, TOWER, subsidiou a aprovação pela Anvisa do blinatumomabe para tratamento de recidiva de LLA proveniente de células B. Os resultados corroboram os achados de Brown et al.21 fortalecendo a hipótese de que o blinatumomabe possui benefícios superiores à quimioterapia convencional empregada para LLA.
Conforme já observado em outras literaturas, o blinatumomabe se mostrou superior em relação ao tratamento convencional também no ensaio clínico de Locatelli et al.23, visto que os pacientes do grupo intervenção apresentaram melhores respostas nos desfechos analisados.
Os estudos de Stein al.24 e Topp et al.25 avaliaram a eficácia e a segurança do blinatumomabe e tiveram como foco principal os desfechos QV e EA. Embora os achados de Stein et al. 24 tenham apontado maiores EA para o braço blinatumomabe, os resultados a longo prazo apoiam ainda mais o papel do blinatumomabe como uma opção de tratamento eficaz e bem tolerada para pacientes LLA, levando em consideração que os EA apresentados diminuíam conforme o tratamento progredia e os tipos de EA observados foram consistentes com os relatados por outros autores para o blinatumomabe.
Quando se trata da comparação de duas tecnologias, é esperado que o processo de randomização ocorra de forma aleatória e que todo esse processo esteja claro na metodologia e na publicação dos resultados. Isso ocorreu no estudo de Kantarjian et al.22, mas não nos demais estudos. Por essa razão, para todos os desfechos analisados, foi considerado um alto risco de viés para o estudo de Brown et al.21. Apesar disso, as características basais dos participantes do estudo apresentadas apontam para um equilíbrio em termos das características fisiopatológicas da amostra estudada, assim, o par de analistas definiu em consenso que a classificação final do risco de viés para este estudo fosse apenas como “algumas preocupações”.
Analisando o estudo de Topp25, em especial o primeiro domínio, que avalia vieses provenientes do processo de randomização, algumas preocupações foram pontuadas, visto que esses autores avaliaram a QV dos pacientes tratados com quimioterapia padrão ou blinatumomabe, e o não cegamento pode impactar nesse desfecho.
Dados referentes ao cegamento dos participantes da pesquisa não foram mencionados na publicação de Locatelli et al.23, logo, foi considerado que não houve cegamento, então o risco de viés global ficou classificado como algumas preocupações em razão dos desfechos de SLP e EA. Para o desfecho SG, o risco de viés foi classificado como baixo, pois o cegamento ou não dos participantes do estudo ou cuidadores não pode impactar no desfecho (morte) analisado.
A ausência de informações relacionadas ao cegamento também evidenciou um viés no estudo de Locatelli et al.23, para o terceiro domínio, que avalia vieses relacionados a dados ausentes.
O estudo de Stein et al.24 também teve sua classificação geral de risco de viés como algumas preocupações, principalmente em função do cegamento dos participantes em relação ao desfecho avaliado. Esse estudo teve como foco a avaliação dos EA comparando o blinatumomabe com a quimioterapia convencional. O fato de o estudo ter sido aberto evidencia que as reações adversas relacionadas ao trato gastrointestinal e eventos neurológicos como insônia, por exemplo, podem ser influenciadas pelo não cegamento de ambos os grupos participantes do estudo.
Conforme os resultados observados na figura obtida pela ferramenta RoB 2, após análise por pesquisadores independentes e obtenção de consenso, o primeiro domínio avaliado evidenciou um baixo risco de viés para a maioria dos estudos. Tal fato excetua-se para o estudo de Brown et al.21, que, na explanação da sequência de alocação dos participantes da pesquisa, definiu o grupo intervenção e o grupo controle com base nas características de risco de cada paciente, ou seja, os pesquisadores sabiam qual grupo iria receber cada tratamento e podem ter tendenciado à randomização para que os indivíduos com menores chances de apresentarem os desfechos analisados recebessem a intervenção com o blinatumomabe.
A avaliação da qualidade das evidências por meio da ferramenta GRADE considerou processos críticos na condução de um ensaio clínico e, de maneira geral, todos os estudos apoiaram o uso do blinatumomabe quando comparado à quimioterapia convencional, com qualidade de evidência moderada, por fatores relacionados, principalmente, ao processo de randomização e cegamento dos participantes nos estudos. Da mesma forma que foi pontuado para a análise de risco de viés pela RoB 2, o processo de randomização ou cegamento dos participantes teria pouca ou nenhuma influência nos desfechos avaliados pelos autores. Além disso, as características basais dos participantes apresentadas nos estudos não são discrepantes.
Em março de 2022, o plenário da Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde (Conitec) em sua 106ª reunião ordinária publicou um relatório28 com recomendação preliminar favorável à incorporação de blinatumomabe para o tratamento de LLA de células B derivada em primeira recidiva medular de alto risco em crianças. As principais considerações dos membros levaram em consideração que o tratamento com o anticorpo biespecífico está associado a um maior benefício em termos de SG, sobrevida livre de doença, além de menos EA quando comparado à quimioterapia convencional28. Em conclusão, foi registrado, em consulta pública, cerca de 99% de concordância com a recomendação preliminar inicial da Conitec, e as justificativas dos usuários corroboram as explicações dos participantes do plenário. Diante disso, a Portaria SCTIE/MS n.º 5129, de 1º de junho de 2022, tornou pública a decisão de incorporar no âmbito do Sistema Único de Saúde (SUS) o blinatumomabe para LLA B derivada pediátrica em primeira recidiva medular de alto risco, conforme o protocolo estabelecido pelo Ministério da Saúde.
CONCLUSÃO
Com os achados desta revisão sistemática, pode-se observar o crescente avanço das tecnologias inovadoras para o tratamento da LLA, com menores EA para os pacientes, maior QV e redução significativa no desfecho morte que ainda está acentuadamente presente nos cenários estatísticos apresentados por instituições de referência de informações sobre o câncer.
A análise dos estudos selecionados para esta revisão aponta diversos benefícios, como aumento da sobrevida, menores chances de falha terapêutica, EA graves menos frequentes e melhores resultados em QV utilizando diferentes escalas para os pacientes tratados com o blinatumomabe, que, muito além da diminuição da prevalência de óbitos por LLA, melhora a QV dos pacientes acometidos por essa doença. Esses resultados apontam para uma melhor eficácia e segurança do blinatumumabe quando comparado à quimioterapia padrão.
Contudo, cabe ressaltar que poucos estudos foram encontrados sobre o tema e que a análise de risco de viés e a avaliação da qualidade das evidências apontam alguns pontos falhos na execução dos estudos, o que limita a confiança nos achados.
Assim, conclui-se que é de extrema importância os esforços atuais de atualização do tratamento da LLA em âmbito internacional e no SUS. Os resultados observados reforçam a hipótese de que seria interessante que os Protocolos Clínicos e Diretrizes Terapêuticas, assim como as Diretrizes Diagnósticas e Terapêuticas para LLA, permitissem que a população adulta também se beneficiasse do uso do blinatumomabe, tendo em vista que a Conitec já emitiu parecer favorável para a utilização da tecnologia para a população pediátrica.
CONTRIBUIÇÕES
Laura Augusta Barufaldi e Renan do Nascimento Gonçalves contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica. Raphael Duarte Chança contribuiu na obtenção, análise e interpretação dos dados; na redação e revisão crítica. Aline do Nascimento contribuiu na obtenção, análise e interpretação dos dados; na redação e revisão crítica. Todos os autores aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTE DE FINANCIAMENTO
Aline do Nascimento e Raphael Duarte Chança receberam bolsa de desenvolvimento institucional do Instituto Nacional de Câncer (INCA) durante a elaboração deste artigo.
REFERÊNCIAS
1. Instituto Nacional de Câncer. ABC do câncer: abordagens básicas para o controle do câncer. 6. ed. rev. atual. Rio de Janeiro: INCA; 2020.
2. Associação Brasileira de Linfoma e Leucemia [Internet]. São Paulo: Revista ABRALE; 2019. Mota T. Guia das leucemias; 2019 abr 4. [acesso 2023 fev 21]. Disponível: https://revista.abrale.org.br/saude/2019/04/guia-das-leucemias/
3. Tognon R, Nunes NS, Castro FA. Apoptosis deregulation in myeloproliferative neoplasms. Einstein. 2013;11(4):540-4. doi: https://doi.org/10.1590/S1679-45082013000400025
4. Instituto Nacional de Câncer. Estimativa 2023: incidência de câncer no Brasil. Rio de Janeiro: INCA; 2022.
5. Ministério da Saúde (BR). Portaria n° 705, de 12 de agosto de 2014. Aprova as Diretrizes Diagnósticas e Terapêuticas da Leucemia Mieloide Aguda do Adulto. Diário Oficial da União, Brasília, DF. 2014 ago 13; Seção I.
6. International Agency for Research on Cancer. [Internet]. Lyon: IARC; c2020. Leukaemia. [acesso 2022 mar 09]. Disponível em: https://gco.iarc.fr/today/data/factsheets/cancers/36-Leukaemia-fact-sheet.pdf
7. Terwilliger T, Abdul-Hay M. Acute lymphoblastic leukemia: a comprehensive review and 2017 update. Blood Cancer J. 2017;7(6):e577. doi: https://doi.org/10.1038/bcj.2017.53
8. Mullighan C, Goorha S, Radtke I, et al. Análise genômica ampla de alterações genéticas na leucemia linfoblástica aguda. Natureza. 2007;446:758-64. doi: https://doi.org/10.1038/nature05690
9. Associação Brasileira de Linfoma e Leucemia [Internet]. São Paulo: ABRALE; c2023. Quais os tratamentos para a Leucemia Linfóide Aguda? [acesso 2023 fev 21]. Disponível: https://www.abrale.org.br/doencas/leucemia/lla/tratamentos/#1583784552697-b5464ca0-8ae1fb35-83e5e4f6-4203cd9c-df38
10. Teachey DT, Hunger SP. Immunotherapy for ALL takes the world by storm. Nat Rev Clin Oncol. 2017;15(2):69-70.
11. Yuraszeck T, Kasichayanula S, Benjamin JE. Translation and clinical development of bispecific t-cell engaging antibodies for cancer treatment. Clin Pharmacol Ther. 2017;101(5):634-45. doi: https://doi.org/10.1002/cpt.651
12. Agência Nacional de Vigilância Sanitária (BR). Brasília, DF: ANVISA; c2022. Consultas: blincyto. [acesso 2022 dez 20]. Disponível em: https://consultas.anvisa.gov.br/#/medicamentos/25351769941201466/
13. Nagorsen D, Baeuerle PA. Immunomodulatory therapy of cancer with T cell-engaging BiTE antibody blinatumomab. Exp Cell Res. 2011;317(9):1255-60.
14. University of York. Centre for Reviews and Dissemination. New York: University of York; 2019. PROSPERO - International prospective register of systematic reviews. 2023. [acesso 2023 ago 31]. Disponível em: https://www.crd.york.ac.uk/PROSPERO/
15. Ministério da Saúde (BR). Diretrizes metodológicas: elaboração de revisão sistemática e meta-análise de ensaios clínicos randomizados. Brasília, DF: Ministério da Saúde; 2021.
16. Page MJ, McKenzie JE, Bossuyt PM, et al. A declaração PRISMA 2020: diretriz atualizada para relatar revisões sistemáticas. Rev Panam Salud Publica. 2022;46:e112. doi: https://doi.org/10.26633%2FRPSP.2022.112
17. EndNote [Internet]. Filadélfia: Clarivate; c2023. [acesso 2021 set 10]. Disponível em: https://endnote.com/
18. Ouzzani M, Hammady H, Fedorowicz Z, et al. Rayyan-a web and mobile app for systematic reviews. Syst Rev. 2016;5(1):210. doi: https://doi.org/10.1186/s13643-016-0384-4
19. Sterne JAC, Savović J, Page MJ, et al. RoB 2: a revised tool for assessing risk of bias in randomised trials. BMJ. 2019;366:l4898. doi: https://doi.org/10.1136/bmj.l4898
20. GRADEpro GDT: GRADEpro guideline development tool [Internet]. Hamilton: McMaster University and Evidence Prime; 2022. [acesso em 2023 ago 23]. Disponível em: https://www.gradepro.org/
21. Brown PA, Ji L, Xu X, et al. Effect of postreinduction therapy consolidation with blinatumomab vs chemotherapy on disease-free survival in children, adolescents, and young adults with first relapse of B-Cell acute lymphoblastic leukemia: a randomized clinical trial. JAMA. 2021;325(9):833-42. doi: https://doi.org/10.1001/jama.2021.0669
22. Kantarjian H, Stein A, Gökbuget N, et al. Blinatumomab versus Chemotherapy for advanced acute lymphoblastic leukemia. N Engl J Med. 2017;376(9):836-47. doi: https://doi.org/10.1056/nejmoa1609783
23. Locatelli F, Zugmaier G, Rizzari C, et al. Effect of Blinatumomab vs Chemotherapy on event-free survival among children with high-risk first-relapse B-Cell acute lymphoblastic leukemia: a randomized clinical trial. JAMA. 2021;325(9):843-54. doi: https://doi.org/10.1001/jama.2021.0987
24. Stein AS, Larson RA, Schuh AC, et al. Exposure-adjusted adverse events comparing blinatumomab with chemotherapy in advanced acute lymphoblastic leukemia. Blood Adv. 2018;2(13):1522-31. doi: https://doi.org/10.1182/bloodadvances.2018019034
25. Topp MS, Zimmerman Z, Cannell P, et al. Health-related quality of life in adults with relapsed/refractory acute lymphoblastic leukemia treated with blinatumomab. Blood. 2018;131(26):2906-14. doi: https://doi.org/10.1182/blood-2017-09-804658
26. Drugsite Trust [Internet]. New Zealand: Drugsite Trust; 2000-2024. Blincyto FDA Approval History. 2023 [acesso 2023 mar 20]. Disponível em: https://www.drugs.com/history/blincyto.html
27. Lynch SS. Manual MSD versão saúde para a família: eficácia e segurança do medicamento [Internet]. Nova Jersey: Merck & Co, Inc.; c2022. [acesso 2022 jun 12]. Disponível em: https://www.msdmanuals.com/pt-br/casa/medicamentos/considera%C3%A7%C3%B5es-gerais-sobre-medicamentos/efic%C3%A1cia-e-seguran%C3%A7a-do-medicamento
28. Conselho Nacional de Incorporação de Tecnologias no Sistema Único de Saúde (BR). Relatório de recomendação: medicamento Blinatumomabe para leucemia linfoblástica aguda (LLA) B derivada pediátrica em primeira recidiva medular de alto risco. Brasília, DF: MS; 2022. Disponível em: https://www.gov.br/conitec/pt-br/midias/consultas/relatorios/2022/20220401_relatorio_cp_11_blinatumomabe_leucemia_linfoblastica_aguda.pdf
29. Ministério da Saúde (BR). Portaria SCTIE/MS Nº 51, de 1º de junho de 2022. Torna pública a decisão de incorporar, no âmbito do Sistema Único de Saúde - SUS, o blinatumomabe para leucemia linfoblástica aguda (LLA) B derivada pediátrica em primeira recidiva medular de alto risco, conforme protocolo estabelecido pelo Ministério da Saúde. Brasília, DF. 2022 jun 3; seção I:78.
Recebido em 7/12/2023
Aprovado em 8/3/2024
Editor-associado: Fernando Lopes Tavares de Lima. Orcid iD: https://orcid.org/0000-0002-8618-7608
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.