REVISÃO DE LITERATURA
Inibidores BTK e BCL-2 no Tratamento de Primeira Linha da Leucemia Linfocítica Crônica em Pacientes de Alto Risco: Revisão Sistemática e Meta-Análise em Rede
BTK and BCL-2 Inhibitors in the First-Line Treatment of Chronic Lymphocytic Leukemia in High-Risk Patients: Systematic Review and Network Meta-Analysis
Inhibidores de BTK Y BCL-2 en el Tratamiento de Primera Línea de la Leucemia Linfocítica Crónica en Pacientes de Alto Riesgo: Revisión Sistemática y un Metaanálisis en Red
https://doi.org/10.32635/2176-9745.RBC.2024v70n2.4501
Rita de Cássia Ribeiro de Albuquerque1; Cláudia Lima Vieira2; Isabel Cristina de Almeida Santiago3; Aline do Nascimento4; Raphael Duarte Chança5; Bernardo Rangel Tura6; Marcelo Goulart Correia7; Laura Augusta Barufaldi8
1,5-8Instituto Nacional de Câncer (INCA), Coordenação de Prevenção e Vigilância (Conprev), Divisão de Avaliação de Tecnologias em Saúde. Rio de Janeiro (RJ), Brasil.
E-mails: rita.albuquerque@inca.gov.br; claudia.lima@inca.gov.br; isantiago@inca.gov.br; aline.nascimento@inca.gov.br; raphael.chanca@inca.gov.br; laura.barufaldi@inca.gov.br. Orcid iD: https://orcid.org/0000-0002-3174-3689; Orcid iD: https://orcid.org/0000-0002-9514-5178; Orcid iD: https://orcid.org/0000-0002-8066-5357; Orcid iD: https://orcid.org/0000-0001-8801-6012; Orcid iD: https://orcid.org/0000-0002-1023-245X; Orcid iD: https://orcid.org/0000-0001-9040-4399
6,7Instituto Nacional de Cardiologia, Núcleo de Bioestatística e Bioinformática. Rio de Janeiro (RJ), Brasil. E-mails: btura@gmail.com; mgoulart.inc@gmail.com. Orcid iD: https://orcid.org/0000-0002-6890-0705; https://orcid.org/0000-0002-3446-5741
Endereço para correspondência: Rita de Cássia Ribeiro de Albuquerque. Rua Marquês de Pombal, 125, 7º andar – Centro. Rio de Janeiro (RJ), Brasil. CEP 20230-240. E-mail: rita.albuquerque@inca.gov.br
RESUMO
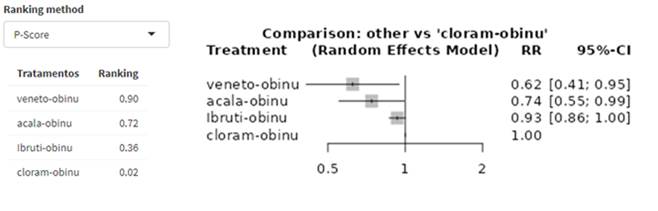
Introdução: Pacientes com leucemia linfocítica crônica (LLC) com alto risco têm menores taxas de resposta, curso clínico mais agressivo e resistência à quimioterapia padrão, representando um desafio para o tratamento. Os inibidores da tirosina quinase de Bruton (BTK – ibrutinibe e acalabrutinibe) e o inibidor BCL-2 (venetoclax) podem ser utilizados nesses casos. Objetivo: Identificar e avaliar a eficácia e a segurança do uso de ibrutinibe, acalabrutinibe e venetoclax no tratamento de primeira linha em pacientes com LLC de alto risco. Método: Revisão sistemática de ensaios clínicos randomizados que avaliaram pacientes adultos com LLC, portadores de deleção 17p ou mutação TP53 e sem tratamento prévio. Foram pesquisadas as bases PubMed, EMBASE, LILACS e Cochrane Library, e realizadas avaliação do risco de viés pela ferramenta RoB 2 da Cochrane e avaliação da qualidade da evidência pelo GRADE. Resultados: Na meta-análise em rede para sobrevida livre de progressão (SLP), venetoclax + obinutuzumabe (RR: 0,62; IC 95% 0,41-0,95; p = 0,027) e acalabrutinibe + obinutuzumabe (RR: 0,74; IC 95% 0,55-0,99; p = 0,043) apresentaram menor risco de progressão ou óbito, com significância considerada limítrofe. Ibrutinibe + obinutuzumabe (RR: 0,93; IC 95% 0,86-1,00; p = 0,054) não apresentou diferença significativa na SLP para pacientes com LLC de alto risco. Conclusão: O tratamento de primeira linha com inibidores de BTK (ibrutinibe e acalabrutinibe) e o inibidor BCL-2 (venetoclax), associados a agentes monoclonais anti-CD20 – especialmente o obinutuzumabe –, tem sido proposto como padrão para a maioria dos pacientes com LLC. Entretanto, pelos resultados desta revisão com meta-análise em rede, não foi possível confirmar essa recomendação.
Palavras-chave: Leucemia Linfocítica Crônica de Células B; Inibidores de Proteína Tirosina Quinase; Protocolos Antineoplásicos; Revisão Sistemática; Metanálise em Rede.
Abstract
Introduction: Patients with high-risk chronic lymphocytic leukemia (CLL) have lower response rates, a more aggressive clinical course, and resistance to standard chemotherapy, representing a treatment challenge. Bruton's tyrosine kinase inhibitors (BTK – ibrutinib and acalabrutinib) and the BCL-2 inhibitor (venetoclax) can be used in these cases. Objective: To identify and evaluate studies on the efficacy and safety of the use of ibrutinib, acalabrutinib and venetoclax in first-line treatment in patients with high-risk CLL. Method: Systematic review of randomized clinical trials that evaluated adult patients with CLL, carriers of 17p deletion or TP53 mutation and without prior treatment. The PubMed, EMBASE, LILACS and Cochrane Library databases were searched, and the risk of bias was assessed using the Cochrane RoB 2 tool and the quality of evidence was assessed with GRADE. Results: In the network meta-analysis for progression-free survival (PFS) venetoclax + obinutuzumab (RR: 0.62; 95%CI 0.41-0.95; p value 0.027) and acalabrutinib + obinutuzumab (RR: 0. 74; 95% CI 0.55-0.99; p value 0.043) presented a lower risk of progression or death, with significance considered borderline. Ibrutinib + obinutuzumab (RR: 0.93; 95% CI 0.86-1.00; p value 0.054) did not show a significant difference in PFS for patients with high-risk CLL. Conclusion: First-line treatment with BTK inhibitors (ibrutinib and acalabrutinib) and the BCL-2 inhibitor (venetoclax) associated with anti-CD20 monoclonal agents – especially obinutuzumab – have been proposed as the standard for most patients with CLL. However, based on the results of this review with network meta-analysis, it was not possible to confirm this recommendation.
Key words: Leukemia, Lymphocytic, Chronic, B-Cell; Tyrosine Protein Kinase Inhibitors; Antineoplastic Protocols; Systematic Review; Network Meta-Analysis.
Resumen
Introducción: Los pacientes con leucemia linfocítica crónica (LLC) de alto riesgo tienen tasas de respuesta más bajas, un curso clínico más agresivo y resistencia a la quimioterapia estándar, lo que representa un desafío para el tratamiento. En estos casos se pueden utilizar los inhibidores de la tirosina quinasa de Bruton (BTK - ibrutinib y acalabrutinib) y el inhibidor de BCL-2 (venetoclax). Objetivo: Identificar y evaluar estudios sobre la eficacia y seguridad del uso de ibrutinib, acalabrutinib y venetoclax en el tratamiento de primera línea en pacientes con LLC de alto riesgo. Método: Revisión sistemática de ensayos clínicos aleatorios que evaluaron pacientes adultos con LLC, portadores de deleción 17p o mutación TP53 y sin tratamiento previo. Se realizaron búsquedas en las bases de datos PubMed, EMBASE, LILACS y Cochrane Library y se evaluó el riesgo de sesgo mediante la herramienta Cochrane RoB 2 y la calidad de la evidencia se evaluó mediante GRADE. Resultados: En el metaanálisis en red para la supervivencia libre de progresión (SSP) venetoclax + obinutuzumab (RR: 0,62; IC 95% 0,41-0,95; valor de p 0,027) y acalabrutinib + obinutuzumab (RR: 0,74; IC 95%). 0,55-0,99; valor de p 0,043) presentaron un menor riesgo de progresión o muerte, con una significación considerada límite. Ibrutinib + obinutuzumab (RR: 0,93; IC del 95 %: 0,86-1,00; valor de p 0,054) no mostró una diferencia significativa en la SSP para pacientes con LLC de alto riesgo. Conclusión: El tratamiento de primera línea con inhibidores de BTK (ibrutinib y acalabrutinib) y el inhibidor de BCL-2 (venetoclax), asociados con agentes monoclonales anti-CD20, especialmente obinutuzumab, se ha propuesto como estándar para la mayoría de los pacientes con LLC. Sin embargo, según los resultados de esta revisión con metaanálisis en red, no fue posible confirmar esta recomendación.
Palabras clave: Leucemia Linfocítica Crónica de Células B; Inhibidores de la Tirosina Proteína Quinasa; Protocolos Antineoplásicos; Revisión Sistemática; Metaanálisis en Red.
INTRODUÇÃO
Na leucemia linfocítica crônica (LLC), ocorre acúmulo de linfócitos B redondos monomórficos no sangue, medula óssea e órgãos linfoides1. Sua manifestação clínica e evolução são bastante variáveis. Para a maioria dos pacientes, trata-se de uma doença assintomática ao diagnóstico e não requer tratamento. Contudo, para outros, se apresenta em estado de progressão e há a necessidade de tratamento logo após o diagnóstico. Os achados clínicos mais usuais incluem: anemia, trombocitopenia, linfadenopatias palpáveis e/ou esplenomegalia, fadiga, febre, sudorese noturna, perda de peso não intencional e plenitude abdominal com saciedade precoce. Também pode haver maior suscetibilidade a infecções2,3.
O diagnóstico de LLC é mais frequente em homens, caucasianos, com idade entre 65 e 74 anos. Entre os anos de 2016 e 2020, a taxa de incidência ajustada por idade nos Estados Unidos foi de 4,6 por 100 mil indivíduos por ano. No mesmo período, a taxa de mortalidade ajustada por idade correspondeu a 1,1 por 100 mil indivíduos por ano. A taxa de sobrevivência relativa em cinco anos (2013-2019) foi de 88%. Segundo o Surveillance, Epidemiology, and End Results (SEER), foram estimados 18.740 casos novos e 4.490 (0,7%) óbitos para o ano de 20234.
No Brasil, considerando todas as leucemias combinadas, visto que não há estimativas específicas para LLC, a taxa de mortalidade, ajustada para a população mundial em 2020, foi de 3,18 óbitos por 100 mil habitantes, o que correspondeu a 6.738 óbitos por leucemias. Para o período de 2023 a 2025, são esperados 11.540 casos novos para cada ano, o que corresponde a um risco estimado de 5,33 por 100 mil habitantes5.
Para o tratamento, são avaliados marcadores prognósticos citogenéticos, uma vez que, em até 80% dos pacientes com LLC, são encontradas alterações cromossômicas, como: deleção 13q, deleção 11q, deleção 17p e trissomia 12. A deleção 13q é a alteração mais comum, ocorre em 55-60% dos casos e está associada a um curso benigno da doença, quando detectada de forma isolada. A deleção 11q está presente em aproximadamente 10% dos casos em estádio inicial, e 25% em pacientes com estádios avançados da doença e sem tratamento prévio com quimioterapia. Geralmente, os portadores dessa alteração apresentam progressão rápida e prognóstico menos favorável. A deleção 17p é observada em 5-8% dos pacientes virgens de quimioterapia e frequentemente ocorre em associação com a inativação do gene supressor de tumor TP53. A trissomia 12 é verificada entre 10-20% dos pacientes e está associada a um prognóstico intermediário6.
A deleção 17p e a mutação TP53 são marcadores preditivos e prognósticos importantes para a tomada de decisão no tratamento da LLC, pois esses perfis tendem a ter menores taxas de resposta e curso clínico mais agressivo, com diminuição da sobrevida livre de progressão (SLP) e sobrevida global (SG). Além disso, esses pacientes apresentam resistência à quimioterapia padrão e resposta prejudicada à quimioimunoterapia. Por esse motivo, a investigação de mutações genéticas é recomendada em pacientes com LLC antes do início do tratamento3,7.
Estudos apontam que, para esses pacientes com pior prognóstico, no presente estudo denominados pacientes de alto risco, o uso de inibidores da tirosina quinase de Bruton (BTK), tais como ibrutinibe e acalabrutinibe, e o inibidor BCL-2 (venetoclax) podem ser utilizados. Esta revisão sistemática e meta-análise em rede busca identificar e avaliar estudos sobre eficácia e segurança do uso de ibrutinibe, acalabrutinibe e venetoclax no tratamento de primeira linha em pacientes com LLC de alto risco.
Para a elaboração desta revisão sistemática, foram seguidas as recomendações do Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)8. O protocolo (CRD42023417320) foi previamente registrado no repositório International Prospective Register of Systematic Reviews (PROSPERO)9.
Foi definida a seguinte pergunta de estudo: “a utilização de inibidores BTK (ibrutinibe e acalabrutinibe) e inibidor de BCL-2 (venetoclax) é mais eficaz e segura do que quimioimunoterapia (clorambucil + obinutuzumabe) para o tratamento de primeira linha da LLC em pacientes com deleção 17P ou mutação TP53?”
A população de interesse foram pacientes adultos com diagnóstico de LLC, com deleção 17p ou mutação TP53 e sem tratamento prévio; as intervenções investigadas foram inibidores BTK (ibrutinibe e acalabrutinibe) e inibidor de BCL-2 (venetoclax); os desfechos avaliados foram eficácia (sobrevida) e segurança (eventos adversos – EA graus 3-4, suspensão do tratamento e óbito), e o desenho de estudo considerado foram ensaios clínicos randomizados (ECR).
Em 24 de abril de 2023, foram realizadas buscas nas bases de dados eletrônicas PubMed, EMBASE, LILACS e Cochrane Library, sendo atualizadas posteriormente em 2 de agosto de 2023. As estratégias de busca estão disponíveis no material suplementar. Foram utilizados descritores indexados no Descritores em Ciências da Saúde (DeCS), Medical Subject Headings (MeSH) e Embase Subject Headings (Emtree). Não houve restrição para data e idioma das publicações. Foi utilizado filtro para ECR. O processo de elaboração das estratégias de busca atendeu às recomendações do Peer Review of Electronic Search Strategies (PRESS)10.
A seleção foi realizada por dois pesquisadores (RCRA e CLV) de forma independente, primeiro pela leitura de títulos e resumos e, em seguida, pela avaliação dos textos na íntegra, utilizando o programa Rayyan11. As divergências foram discutidas e resolvidas em consenso. A lista dos estudos excluídos está disponível no material suplementar.
Para a extração dos dados, foi utilizado um formulário previamente elaborado em planilha Microsoft Office Excel. As informações extraídas dos artigos selecionados incluíram: autor e ano de publicação, localidade, especificações do desenho do estudo, critérios de inclusão e exclusão, número total de participantes, intervenções, idade, sexo, tempo de acompanhamento e desfechos de eficácia e segurança. A extração dos dados também foi realizada de forma independente pela mesma dupla de pesquisadores, sendo as divergências resolvidas em consenso.
Para a avaliação do risco de viés dos ensaios clínicos selecionados, foi utilizada a ferramenta Risk of Bias (RoB 2), versão 2.0, da Cochrane12. A etapa de avaliação do risco de viés também foi realizada de forma independente pela mesma dupla de pesquisadores e as divergências discutidas e resolvidas por consenso. A avaliação da qualidade da evidência foi realizada pela ferramenta Grading of Recommendations Assessment, Development and Evaluation (GRADE)13.
Na meta-análise em rede, foram combinadas estimativas diretas e indiretas dos efeitos dos tratamentos em uma única análise utilizando abordagem frequentista. Esse método utilizou modelagem estatística para estimar os efeitos relativos comparando todos os tratamentos entre si; assim como gerar probabilidades, dadas as suposições subjacentes de que um tratamento específico é melhor do que os outros14,15. A meta-análise em rede tem vantagens sobre a meta-análise em pares, como o esclarecimento de resultados inconsistentes de vários estudos, incluindo múltiplos comparadores comuns e o cálculo de efeito indireto na falta de comparações diretas ausentes entre tratamentos importantes. Além disso, pode fornecer maior poder estatístico e validação cruzada do efeito de tratamento observado de conexões fracas com conectividade de rede razoável e tamanhos de amostra suficientes. No entanto, seu uso inadequado pode ocasionar resultados equivocados e manifestar baixa conectividade de rede e, portanto, baixo poder estatístico. Além disso, as evidências indiretas ainda são observacionais e devem ser interpretadas com cautela14. A análise foi realizada no web aplicativo Shiny16.
Os dados foram extraídos e sintetizados utilizando um modelo de efeitos randômicos e foram gerados forest plots (gráficos em floresta) para fornecer uma representação visual das comparações indiretas entre os diferentes estudos. A SLP foi medida desde o início do tratamento até a progressão da doença ou morte por qualquer causa aos 48 meses. Esse ponto de corte foi estabelecido pelos autores para padronizar o tempo de seguimento entre os estudos. Um determinado tratamento foi considerado eficaz quando o limite superior do intervalo de confiança de 95% (IC 95%) para risco relativo (RR) não ultrapassou o valor de 1,0. Adicionalmente, foram calculados P-scores para avaliar a classificação dos tratamentos por meio da certeza de que um tratamento é melhor do que outro, pelo cálculo da média de todos os tratamentos concorrentes17,18.
RESULTADOS
Foram identificados 2.360 registros e, entre estes, foram excluídas 506 duplicatas, sobrando 1.854 registros para a leitura de títulos e resumos. Nessa etapa, 1.799 registros não cumpriram os critérios de elegibilidade e foram excluídos, restando 55 registros para a leitura de texto completo. Por fim, permaneceram seis estudos referentes a três ECR (Figura 1). A listagem dos artigos excluídos, após leitura do texto completo, é apresentada no material suplementar.
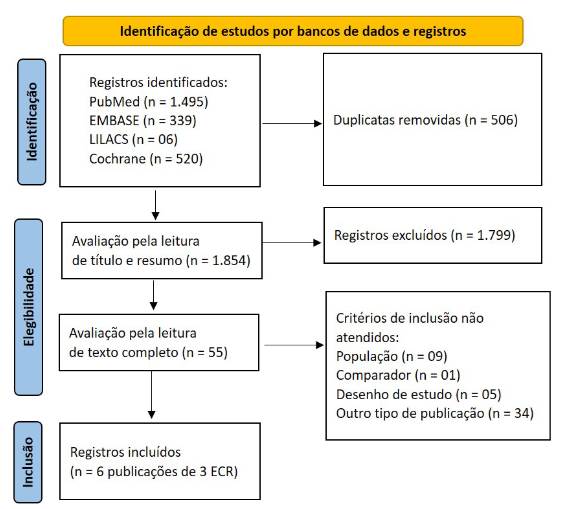
Figura 1. Fluxograma de seleção e elegibilidade dos estudos
Fonte: Adaptado de PRISMA 20208.
No Quadro 1, são apresentadas as características dos estudos selecionados e, no Quadro 2, os resultados para SLP nos três ECR multicêntricos de fase III para pacientes com LLC de alto risco.
A população total do estudo CLL1419 foi composta por 432 pacientes com diagnóstico de LLC e, destes, 49 pacientes possuíam deleção 17p e/ou mutação TP53. A mediana de idade dos participantes foi de 72 anos, com variação de 41 a 89 anos. Nesse ECR, foi comparado o uso de venetoclax + obinutuzumabe vs clorambucil + obinutuzumabe. Os pacientes com deleção 17p e/ou mutação TP53 que receberam venetoclax + obinutuzumabe apresentaram redução de 52% no risco de óbito ou progressão da doença em comparação aos pacientes que receberam clorambucil + obinutuzumabe (hazard ratio – HR: 0,48; IC 95% 0,24-0,94).
No estudo ELEVATE-TN20, a população total foi formada por 535 pacientes com diagnóstico de LLC e, destes, 50 pacientes possuíam deleção (17p) (p13.1) e/ou mutação TP53. A idade mediana de toda a população foi de 70 anos, variando entre 41 e 91 anos. O ECR avaliou a utilização de acalabrutinibe + obinutuzumabe vs acalabrutinibe em monoterapia vs clorambucil + obinutuzumabe. Os pacientes que receberam acalabrutinibe + obinutuzumabe apresentaram redução de 83% no risco de óbito ou progressão da doença (HR: 0,17; IC 95% 0,07-0,42; p < 0,0001) quando comparados aos pacientes que receberam clorambucil + obinutuzumabe.
Por fim, o estudo iLLUMINATE21 teve a participação de 229 pacientes, destes, 148 apresentavam características genéticas de alto risco, como: del[17p], del[17p] /mutação TP53, del[11q] e/ou IGHV não mutado. A idade mediana dos participantes foi de 71 anos, com intervalo interquartil de 66 a 76 anos. Esse ECR comparou o uso do ibrutinibe + obinutuzumabe vs clorambucil + obinutuzumabe. O grupo de pacientes que utilizou o ibrutinibe + obinutuzumabe apresentou redução de 83% no risco de óbito ou de progressão da doença em comparação ao grupo que recebeu clorambucil + obinutuzumabe (HR: 0,17; IC 95% 0,10-0,28).
O tempo de seguimento nos três estudos variou de 48 a 72 meses. Para a subpopulação de interesse, pacientes de alto risco, os três estudos apresentaram somente dados para SLP (Quadro 2).
Quadro 1. Caracterização dos ensaios clínicos selecionados para inclusão na revisão sistemática
|
Estudo |
País |
Total de participantes |
População |
Intervenções |
Sexo masculino |
Idade |
Tempo de seguimento* |
|
CLL14 Study (NCT02242942)
|
Multicêntrico (21 países) |
432 pacientes
|
Pacientes de ambos os sexos com 18 anos ou mais com LLC ativa não tratada anteriormente; exigindo tratamento de acordo com os critérios iwCLL |
Venetoclax + obinutuzumabe Clorambucil + obinutuzumabe
|
Venetoclax + obinutuzumabe: (146; 67,6%) Clorambucil + obinutuzumabe: (143; 66,2%) |
Venetoclax + obinutuzumabe: 72 (43–89) Clorambucil + obinutuzumabe: 71 (41–89) |
72 meses
|
|
(NCT02475681)
|
Multicêntrico (18 países) |
535 pacientes |
Pacientes de ambos os sexos com idade ≥65 anos ou 18–65 anos com comorbidades (escala cumulativa de classificação de doença-geriátrica > 6, depuração de creatinina 30–69 mL/min por Cockcroft-Gault), status de desempenho ECOG de 0, 1 ou 2 e outros |
Acalabrutinibe + obinutuzumabe Acalabrutinibe Clorambucil + obinutuzumabe
|
Acalabrutinibe + obinutuzumabe: (111; 62%) Acalabrutinibe: (111; 62%) Clorambucil + obinutuzumabe: (106; 59,9%) |
Acalabrutinibe + obinutuzumabe: 70 (41–88) Acalabrutinibe: 70 (44–87) Clorambucil + obinutuzumabe: 71 (46–91) |
59 meses |
|
iLLUMINATE (NCT02264574)
|
Multicêntrico (16 países) |
229 pacientes |
Pacientes de ambos os sexos com LLC não tratada anteriormente; exigindo tratamento de acordo com os critérios do iwCLL; com idade ≥ 65 anos ou < 65 anos (pontuação de classificação de doença cumulativa > 6, depuração de creatinina < 70 mL/min, status de desempenho do ECOG de 0-2) |
Ibrutinibe + obinutuzumabe Clorambucil + obinutuzumabe |
Ibrutinibe + obinutuzumabe: (67; 59%) Clorambucil + obinutuzumabe: (79; 68%) |
Ibrutinibe + obinutuzumabe: 70 (66–75) Clorambucil + obinutuzumabe: 72 (66–77) |
48 meses |
Legendas: LLC = leucemia linfocítica crônica; iwCLL = International Workshop on Chronic Lymphocytic Leukemia; e ECOG = Eastern Cooperative Oncology Group.
*Dados das publicações mais recentes (maior tempo de seguimento) e para toda a população com LLC (independentemente de deleção e mutação).