ARTIGO ORIGINAL
Sobrevida do Paciente com Melanoma Cutâneo Primário: Estudo de Base Populacional em Goiânia
Survival of Patients with Primary Cutaneous Melanoma: a Population-based Study in Goiânia
Sobrevida del Paciente con Melanoma Cutáneo Primario: Estudio de Base Poblacional en Goiânia
https://doi.org/10.32635/2176-9745.RBC.2024v70n2.4577
Yasmin Ricarda e Azevedo Géa1; Ana Clara Goulart Ferreira2; Beatriz Nascente Silva3; Thiago Vinícius Lemos Gonçalves4; Ana Maria Quinteiro Ribeiro5
1-4Universidade Federal de Goiás (UFG), Faculdade de Medicina. Goiânia (GO), Brasil. E-mails: yasminricarda@discente.ufg.br; anaferreira@discente.ufg.br; beatriznascente@discente.ufg.br; thiagoleader@discente.ufg.br. Orcid iD: https://orcid.org/0000-0003-0144-5653; Orcid iD: https://orcid.org/0009-0005-7485-3609; Orcid iD: https://orcid.org/0009-0007-1548-7017; Orcid iD: https://orcid.org/0009-0001-4850-3622
5UFG, Instituto de Patologia Tropical e Saúde Pública (IPTSP). Goiânia (GO), Brasil. E-mail: anamqribeiro@gmail.com. Orcid iD: https://orcid.org/0000-0001-9872-0476
Endereço para correspondência: Yasmin Ricarda e Azevedo Géa. Rua 38, número 105, Residencial Celeste, casa 02 – Jardim Goiás. Goiânia (GO), Brasil. CEP 74805-400. E-mail: yasminricarda@discente.ufg.br
RESUMO
Introdução: Embora seja causa importante de óbitos por neoplasia no Brasil, o perfil de sobrevida dos pacientes com melanoma cutâneo primário em locais considerados de baixa incidência necessita de descrição mais recente. Objetivo: Descrever o perfil de sobrevida do paciente com melanoma cutâneo primário na cidade de Goiânia entre os anos de 2003 e 2016. Método: Estudo de base populacional realizado com dados do Registro de Câncer de Base Populacional de Goiânia (RCBP-GO). Foram incluídos casos novos de melanoma cutâneo diagnosticados no período. Os dados foram coletados e analisados segundo sexo, faixa etária, cor da pele, profissão, CID-10, data do diagnóstico, status vital, localização da lesão primária, metástase e tipo histológico. A análise estatística foi realizada com o pacote SPSS. A distribuição segundo o status vital foi testada pelo teste qui-quadrado. As curvas de sobrevida foram realizadas e testadas por meio do teste de log rank. O nível de significância adotado foi de 5%. Resultados: Foram registrados 653 novos casos de melanoma cutâneo em Goiânia no período. Os fatores relacionados à menor sobrevida dos pacientes foram: sexo masculino, idade igual ou superior a 60 anos, cor parda, atividades externas e metástase. Conclusão: O perfil de sobrevida encontrado reforça a necessidade de estratégias que incentivem homens de cor parda com idade superior a 60 anos a realizarem o diagnóstico precoce.
Palavras-chave: Melanoma/epidemiologia; Análise de Sobrevida; Demografia.
ABSTRACT
Introduction: Although it is a significant cause of death from neoplasms in Brazil, the survival profile of patients with primary cutaneous melanoma in areas considered of low incidence requires a more recent description. Objective: To describe the survival profile of patients with primary cutaneous melanoma in the city of Goiânia between the years 2003 and 2016. Method: Population-based study conducted with data from the Population-Based Cancer Registry of Goiânia (RCBP-GO). New cases of cutaneous melanoma diagnosed during the period were included. Data were collected and analyzed according to sex, age group, skin color, occupation, ICD-10, date of diagnosis, vital status, location of the primary lesion, metastasis, and histological type. Statistical analysis was performed using the SPSS package. The distribution according to vital status was tested using the chi-square test. Survival curves were constructed and tested using the log rank test. The significance level adopted was 5%. Results: 653 new cases of cutaneous melanoma were recorded in Goiânia during the period. Factors related to lower patient survival were: male sex, age equal to or greater than 60 years, brown skin color, outdoor activities, and metastasis. Conclusion: The survival profile found reinforces the need for strategies to encourage Brown males, older than 60 years, to be diagnosed earlier.
Key words: Melanoma/epidemiology; Survival Analysis; Demography.
RESUMEN
Introducción: Aunque sea una causa importante de muerte por neoplasia en el Brasil, el melanoma cutáneo primario carece de una descripción más reciente del perfil de sobrevida de los pacientes en lugares considerados de baja incidencia. Objetivo: Describir el perfil de sobrevida del paciente con melanoma cutáneo primario en la ciudad de Goiânia entre los años 2003 y 2016. Método: Estudio de base poblacional realizado con datos del Registro de Cáncer de Base Poblacional de Goiânia (RCBP-GO). Se incluyeron casos nuevos de melanoma cutáneo diagnosticados en el período. Los datos fueron recolectados y analizados según sexo, grupo de edad, color de piel, profesión, CID-10, fecha de diagnóstico, estado vital, ubicación de la lesión primaria, metástasis y tipo histológico. El análisis estadístico se realizó con el paquete SPSS. La distribución según el estado vital fue evaluada mediante la prueba de ji al cuadrado. Las curvas de sobrevida fueron elaboradas y probadas mediante la prueba de log rank. El nivel de significancia adoptado fue del 5%. Resultados: Se registraron 653 nuevos casos de melanoma cutáneo en Goiânia en el período. Los factores relacionados con una menor sobrevida de los pacientes fueron: sexo masculino, edad igual o superior a 60 años, color de piel pardo, profesión externa y metástasis. Conclusión: El perfil de sobrevida encontrado refuerza la necesidad de estrategias que atraigan a individuos masculinos, con edad superior a 60 años y de color de piel pardo para realizarse el diagnóstico temprano.
Palabras clave: Melanoma/epidemiología; Análisis de Supervivencia; Demografía.
INTRODUÇÃO
O câncer de pele é a neoplasia mais comum na maioria dos países, inclusive no Brasil. Essa neoplasia é dividida em dois tipos: câncer de pele melanoma e câncer de pele não melanoma1. O melanoma representa 3-4% dos casos de câncer de pele no Brasil, porém tem elevada taxa de metástase e de óbito. E representa 65-80% das mortes por câncer de pele no país2,3. As maiores incidências de melanoma cutâneo (MC) estão concentradas na Austrália, na Nova Zelândia e nos países do Norte, Centro e Leste Europeus4. No Brasil, a Região Sul é o local de maior incidência de MC segundo o Instituto Nacional de Câncer (INCA). Estimaram-se, para cada ano do triênio 2023-2025, 4.640 novos casos de melanoma em homens e 4.340 em mulheres. Isso corresponde a um risco de 4,37 casos novos a cada 100 mil homens e 3,90 a cada 100 mil mulheres5. Assim, é evidente que o MC configura um problema de saúde pública no país. No entanto, os dados brasileiros acerca dessa doença ainda são escassos3.
O melanoma é uma neoplasia maligna dos melanócitos e a forma cutânea representa cerca de 90% dos casos; enquanto aproximadamente 5% estão ligados à forma ocular, menos de 2% à forma mucosa e o restante é de origem primária desconhecida6. O MC é geralmente caracterizado pela presença de mácula hipercrômica, com variação de cor e bordas irregulares, sendo também resistente à quimioterapia e radioterapia7. As terapias-alvo apresentam maior efetividade no tratamento dessa doença. O MC se apresenta nas seguintes formas: extensivo superficial, nodular, lentigo maligno e lentiginoso acral. Formas incomuns, como o melanoma amelanótico, spitzoide e desmoplásico, também podem ocorrer8.
Os principais fatores de risco para ocorrência de MC são: histórico pessoal e/ou familiar de melanoma, cor de pele branca, maior quantidade de nevos melanocíticos atípicos ou adquiridos, imunossupressão e exposição excessiva à radiação ultravioleta (UV), seja ela natural ou artificial, como nas câmaras de bronzeamento9. Há maior incidência de MC entre 40 e 60 anos. Isso ocorre, provavelmente, em função da deterioração do sistema imune e do efeito cumulativo da exposição aos raios solares10. Estudos também mostram maior incidência de melanoma maligno em comunidades com menores índices de pobreza, maiores níveis educacionais e menores taxas de desemprego11. Práticas laborais em ambientes abertos, que exigem longa duração de exposição aos raios solares, também se encontram entre os fatores de risco para o desenvolvimento de MC12.
A exposição à radiação UV, além de ser considerada o principal fator de risco para o desenvolvimento de MC, é o único passível de intervenção13. A prevenção do MC deve contemplar os cuidados com a exposição aos raios solares. Porém, no Brasil, a proteção solar ainda é bastante negligenciada14. Dentro da prevenção primária, é fundamental a orientação, principalmente de crianças, acerca das seguintes questões: horários de maior irradiação dos raios UVB (10h-16h); necessidade do uso de sombrinhas, chapéus, roupas de manga e calça compridas em locais de maior intensidade dos raios solares; e o uso de fotoprotetores14. Em relação à prevenção secundária, o diagnóstico precoce do MC é essencial tanto para melhorar o prognóstico do paciente quanto para reduzir os custos dos serviços de saúde. Esse diagnóstico pode ser feito, por exemplo, a partir de campanhas de detecção massiva15.
Para monitorar o comportamento do MC no Brasil, assim como de todas as demais neoplasias, um importante trabalho é exercido pelos Registros de Câncer de Base Populacional (RCBP)16. A partir dos dados coletados sistematicamente por eles, é possível extrair informações sobre incidência, mortalidade e sobrevida dos portadores de neoplasias, bem como analisar a qualidade das estratégias de prevenção adotadas. Dessa forma, são fornecidos subsídios de qualidade para o planejamento de ações em saúde e para a realização de estudos epidemiológicos16.
A literatura demonstra lacunas relativas a estudos que discutem o perfil e a sobrevida do paciente com MC primário (MCp) em períodos mais recentes na cidade de Goiânia. Tentar preencher esses dados é o principal objetivo deste estudo.
MÉTODO
Estudo descritivo de base populacional que buscou caracterizar a sobrevida do paciente com MCp a partir da análise retrospectiva de dados do RCBP de Goiânia (RCBP-GO). O projeto foi aprovado pelos Comitês de Ética em Pesquisa do Hospital das Clínicas da Universidade Federal de Goiás sob o número de parecer 5.251.103 (CAAE: 48272121.2.0000.5078), e da Associação de Combate ao Câncer de Goiás (ACCG) sob o número de parecer 5.296.048 (CAAE: 48272121.2.3001.0031), com base na Resolução n.º 466/201217 do Conselho Nacional de Saúde.
A coleta de dados foi realizada a partir das fichas preenchidas pelo RCBP-GO, com auxílio de questionário elaborado pelos autores. Foram incluídos no estudo pacientes diagnosticados com melanoma maligno da pele, de acordo com a décima edição da Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde (CID-10)18, C43, entre 2003 e 2016, residentes de Goiânia. As variáveis de coleta utilizadas para análise da sobrevida do paciente com MCp em Goiânia foram: sexo, cor da pele, profissão, CID-10, data do diagnóstico, status vital, localização da lesão primária, metástase e tipo histológico.
Os dados foram analisados com o auxílio do pacote estatístico SPSS (versão 26)19. A caracterização do perfil demográfico e clínico foi realizada por meio de frequência absoluta (n), frequência relativa (%); média, desvio-padrão, mediana, mínimo e máximo. A associação entre a faixa etária e o perfil clínico foi feita com base no teste do qui-quadrado de Pearson/post-hoc. A distribuição do perfil dos pacientes de acordo com o status vital foi testada por meio do teste do qui-quadrado de Pearson seguido da análise de resíduos padronizados, qui-quadrado post-hoc. As curvas de Kaplan-Meier para sobrevida foram realizadas e testadas por meio do teste de log rank (mantel-cox). Em todas as análises, o nível de significância adotado foi de 5% (p < 0,05).
RESULTADOS
Entre 2003 e 2016, foram registrados 653 novos casos de MC na cidade de Goiânia. Como mostra a Tabela 1, a maioria desses casos ocorreu em indivíduos do sexo feminino (356 registros, 54,5%), com idade entre 0 e 59 anos (337 registros, 51,6%), de cor branca (323 registros, 49,5%) e que trabalhavam em profissões do tipo interno, ou seja, em ambiente coberto (310 registros, 47,5%). Foram encontrados 316 (48,4%) novos casos de MC em indivíduos com 60 anos ou mais. Ressalta-se que o percentual de pacientes cujas informações sobre a cor da pele e a profissão não estavam disponíveis foi de, respectivamente, 36,9% e 40%. Ao considerar os pacientes com registro do status vital, 152 (23,3%) deles estavam vivos até o momento do último registro no sistema do RCBP-GO. Cento e trinta e quatro (20,5%) haviam morrido e seis (0,9%) haviam apresentado perda de seguimento (PS). Em 361 casos (55,3%), o status vital não estava informado, sendo, portanto, desconhecido.
Tabela 1. Características demográficas dos pacientes diagnosticados com MCp em Goiânia, no período 2003-2016 (n = 653)
|
|
n (%) |
|
Sexo |
|
|
Feminino |
356 (54,5) |
|
Masculino |
297 (45,5) |
|
Faixa etária |
|
|
60 ou mais |
316 (48,4) |
|
40 a 59 |
230 (35,2) |
|
20 a 39 |
102 (15,6) |
|
0 a 19 |
5 (0,8) |
|
Status vital |
|
|
Não informado |
361 (55,3) |
|
Vivo |
152 (23,3) |
|
Morto |
134 (20,5) |
|
PS |
6 (0,9) |
|
Cor de pele |
|
|
Branca |
323 (49,5) |
|
Não informada |
241 (36,9) |
|
Parda |
84 (12,9) |
|
Negra |
5 (0,8) |
|
Profissão |
|
|
Interna |
310 (47,5) |
|
Não informada |
261 (40,0) |
|
Externa |
82 (12,6) |
|
n = frequência absoluta; % = frequência relativa; PS = perda de seguimento. |
|
Tabela 2. Características clínicas dos pacientes diagnosticados com MCp em Goiânia, no período 2003-2016 (n = 653)
|
*CID-10 |
n (%) |
|
C43.5 |
179 (27,4) |
|
C43.7 |
152 (23,3) |
|
C43.6 |
106 (16,2) |
|
C43.9 |
82 (12,6) |
|
C43.3 |
65 (10,0) |
|
C43.4 |
37 (5,7) |
|
C43.1 |
17 (2,6) |
|
C43.2 |
11 (1,7) |
|
C43.0 |
4 (0,6) |
|
Localização da lesão primária |
|
|
Tronco |
179 (27,4) |
|
Membros inferiores |
151 (23,1) |
|
Não informada |
151 (23,1) |
|
Membros superiores |
108 (16,5) |
|
Cabeça e pescoço |
64 (9,8) |
|
Metástase |
|
|
Doença localizada |
414 (63,4) |
|
Não informada |
140 (21,4) |
|
Metástase |
63 (9,6) |
|
Loco regional |
35 (5,4) |
|
In situ |
1 (0,2) |
|
Tipo histológico |
|
|
Não classificado |
418 (64,0) |
|
Melanoma extensivo superficial |
114 (17,5) |
|
Melanoma nodular |
56 (8,6) |
|
Forma incomum |
41 (6,3) |
|
Melanoma lentiginoso acral |
14 (2,1) |
|
Lentigo maligno melanoma |
10 (1,5) |
|
Ano de diagnóstico |
|
|
2003 |
33 (5,1) |
|
2004 |
38 (5,8) |
|
2005 |
44 (6,7) |
|
2006 |
67 (10,3) |
|
2007 |
58 (8,9) |
|
2008 |
79 (12,1) |
|
2009 |
56 (8,6) |
|
2010 |
49 (7,5) |
|
2011 |
38 (5,8) |
|
2012 |
44 (6,7) |
|
2013 |
29 (4,4) |
|
2014 |
43 (6,6) |
|
2015 |
32 (4,9) |
|
2016 |
43 (6,6) |
|
* C43.0 Melanoma maligno do lábio; C43.1 Melanoma maligno da pálpebra, incluindo as comissuras palpebrais; C43.2 Melanoma maligno da orelha e do conduto auditivo externo; C43.3 Melanoma maligno de outras partes e partes não especificadas da face; C43.4 Melanoma maligno do couro cabeludo e do pescoço; C43.5 Melanoma maligno do tronco; C43.6 Melanoma maligno do membro superior, incluindo ombro; C43.7 Melanoma maligno do membro inferior, incluindo quadril; C43.8 Melanoma maligno invasivo da pele; C43.9 Melanoma maligno de pele, não especificado. n = frequência absoluta; % = frequência relativa.
|
|
A Tabela 2 mostra o perfil clínico dos pacientes incluídos no estudo. As CID-10 mais registradas no período foram a C43.5, com 179 casos (27,4%), e a C43.7, com 152 casos (23,3%). A doença localizada foi observada em 414 pacientes (63,4%) e a metástase em 63 casos (9,6%). Os melanomas diagnosticados que não foram classificados segundo o tipo histológico corresponderam a 64%. O melanoma extensivo superficial foi detectado em 114 (17,5%) casos. O melanoma nodular correspondeu a 56 (8,6%) do total dos casos.
Conforme a Tabela 3, houve associação (p < 0,01) entre o sexo masculino e o status vital morto, com 84 óbitos (62,7%) nessa população. Pacientes com idade igual ou superior a 60 anos apresentaram associação (p = 0,01) com o status vital morto (82 pacientes, 61,2%) e com a PS (5 pacientes, 83,3%). Já pacientes entre 20 e 39 anos apresentaram associação (p = 0,01) com o status vital vivo (29 pacientes, 19,1%). Em relação à cor da pele, foi possível observar associação (p = 0,02) entre a cor branca e o status vital vivo (108 pacientes, 71,1%), enquanto a cor parda associou-se ao status vital morto (35 pacientes, 26,1%). A profissão interna associou-se (p < 0,01) ao status vital vivo (96 pacientes, 63,2%), enquanto a profissão externa associou-se ao status vital morto (37 pacientes, 27,6%).
Tabela 3. Caracterização do perfil demográfico de acordo com o status vital dos pacientes diagnosticados com MCp em Goiânia, no período 2003-2016 (n = 292)
|
|
Status vital |
Total |
p* |
||
|
|
Morto 134 (45,9) |
Vivo 152 (52,1) |
PS 6 (2,1) |
||
|
Sexo |
|
|
|
|
|
|
Feminino |
50 (37,3) |
90 (59,2) |
4 (66,7) |
144 (49,3) |
<0,01 |
|
Masculino |
84 (62,7)‡ |
62 (40,8) |
2 (33,3) |
148 (50,7) |
|
|
Faixa etária |
|
|
|
|
|
|
0 a 19 |
0 (0,0) |
2 (1,3) |
0 (0,0) |
2 (0,7) |
0,01 |
|
20 a 39 |
12 (9,0) |
29 (19,1)‡ |
1 (16,7) |
42 (14,4) |
|
|
40 a 59 |
40 (29,9) |
57 (37,5) |
0 (0,0) |
97 (33,2) |
|
|
60 ou mais |
82 (61,2)‡ |
64 (42,1) |
5 (83,3)‡ |
151 (51,7) |
|
|
Cor de pele |
|
|
|
|
|
|
Branca |
68 (50,7) |
108 (71,1)‡ |
3 (50,0) |
179 (61,3) |
0,02 |
|
Negra |
2 (1,5) |
2 (1,3) |
0 (0,0) |
4 (1,4) |
|
|
Parda |
35 (26,1)‡ |
20 (13,2) |
2 (33,3) |
57 (19,5) |
|
|
Não informada |
29 (21,6) |
22 (14,5) |
1 (16,7) |
52 (17,8) |
|
|
Profissão |
|
|
|
|
|
|
Interna |
59 (44,0) |
96 (63,2)‡ |
4 (66,7) |
159 (54,5) |
<0,01 |
|
Externa |
37 (27,6)‡ |
20 (13,2) |
1 (16,7) |
58 (19,9) |
|
|
Não informada |
38 (28,4) |
36 (23,7) |
1 (16,7) |
75 (25,7) |
|
*qui-quadrado; ‡post-hoc; n = frequência absoluta; % frequência relativa PS = perda de seguimento.
A Tabela 4 traz a caracterização do perfil clínico de acordo com o status vital. Entre os pacientes que vieram a óbito, a CID-10 mais registrada foi a C43.9 (20,1%). No grupo dos óbitos, a localização da lesão primária predominante foi membros inferiores (40 casos, 29,9%). A maioria dos indivíduos apresentou doença localizada (52 casos, 38,8%) e 30,6% (41 casos) apresentaram metástase. O tipo histológico mais predominante nos pacientes que morreram foi o melanoma nodular (15 casos, 11,2%), contudo em 71,6% dos casos não houve classificação histológica.
Em relação aos pacientes vivos, a CID-10 predominante foi a C43.7 (54 casos, 35,5%). Em relação à localização da lesão da lesão primária, a predominância foi de membros inferiores (54 casos, 35,5%), enquanto 69,1% dos pacientes (105 casos) apresentaram doença localizada e 5,9% (9 casos), metástase. Além disso, o tipo histológico mais comum no grupo dos vivos foi o melanoma extensivo superficial (28 casos, 18,4%), e em 61,8% dos casos o melanoma não foi classificado de acordo com o tipo histológico. No grupo de pacientes em que houve PS, a CID-10 predominante foi a C43.7 (33,3%). Em relação à localização, houve predominância da cabeça e pescoço (3 casos, 50%), e 50% dos pacientes desse grupo apresentaram doença localizada (3 casos). Quanto ao tipo histológico, o melanoma lentiginoso acral e o melanoma nodular apresentaram a mesma prevalência (1 caso, 16,7%), e em 66,7% dos pacientes o tipo histológico não foi informado.
Tabela 4. Caracterização do perfil clínico de acordo com o status vital dos pacientes diagnosticados com MCp em Goiânia, no período 2003-2016 (n = 292)
|
|
Status vital |
Total |
p* |
||
|
|
Morto 134 (45,9) |
Vivo 152 (52,1) |
PS 6 (2,1) |
||
|
CID-10 |
|
|
|
|
|
|
C43.0 |
3 (2,2) |
0 (0,0) |
0 (0,0) |
3 (1,0) |
<0,01 |
|
C43.1 |
1 (0,7) |
2 (1,3) |
1 (16,7) |
4 (1,4) |
|
|
C43.2 |
2 (1,5) |
1 (0,7) |
1 (16,7)‡ |
4 (1,4) |
|
|
C43.3 |
17 (12,7)‡ |
5 (3,3) |
0 (0,0) |
22 (7,5) |
|
|
C43.4 |
9 (6,7) |
9 (5,9) |
1 (16,7) |
19 (6,5) |
|
|
C43.5 |
22 (16,4) |
40 (26,3) |
1 (16,7) |
63 (21,6) |
|
|
C43.6 |
12 (9,0) |
26 (17,1) |
0 (0,0) |
38 (13,0) |
|
|
C43.7 |
41 (30,6) |
54 (35,5) |
2 (33,3) |
97 (33,2) |
|
|
C43.9 |
27 (20,1)‡ |
15 (9,9) |
0 (0,0) |
42 (14,4) |
|
|
Localização da lesão primária |
|
|
|
|
|
|
Cabeça e pescoço |
13 (9,7) |
11 (7,2) |
3 (50,0) |
27 (9,2) |
0,06 |
|
Membros inferiores |
40 (29,9) |
54 (35,5) |
2 (33,3) |
96 (32,9) |
|
|
Membros superiores |
14 (10,4) |
26 (17,1) |
0 (0,0) |
40 (13,7) |
|
|
Tronco |
22 (16,4) |
39 (25,7) |
1 (16,7) |
62 (21,2) |
|
|
Não informada |
45 (33,6) |
22 (14,5) |
0 (0,0) |
67 (22,9) |
|
|
Metástase |
|
|
|
|
|
|
Doença localizada |
52 (38,8) |
105 (69,1)‡ |
3 (50,0) |
160 (54,8) |
<0,01 |
|
Loco regional |
17 (12,7) |
10 (6,6) |
0 (0,0) |
27 (9,2) |
|
|
Metástase |
41 (30,6)‡ |
9 (5,9) |
0 (0,0) |
50 (17,1) |
|
|
Não informada |
24 (17,9) |
28 (18,4) |
3 (50,0) |
55 (18,8) |
|
|
Tipo histológico |
|
|
|
|
|
|
Forma incomum |
7 (5,2) |
12 (7,9) |
0 (0,0) |
19 (6,5) |
0,05 |
|
Lentigo maligno melanoma |
0 (0,0) |
4 (2,6) |
0 (0,0) |
4 (1,4) |
|
|
Melanoma extensivo superficial |
13 (9,7) |
28 (18,4) |
0 (0,0) |
41 (14,0) |
|
|
Melanoma lentiginoso acral |
3 (2,2) |
2 (1,3) |
1 (16,7) |
6 (2,1) |
|
|
Melanoma nodular |
15 (11,2) |
12 (7,9) |
1 (16,7) |
28 (9,6) |
|
|
Não classificado |
96 (71,6) |
94 (61,8) |
4 (66,7) |
194 (66,4) |
|
|
* qui-quadrado; ‡post-hoc; n = frequência absoluta; % frequência relativa; PS = perda de seguimento. |
Na Figura 1, são mostradas as curvas relativas aos fatores que apresentaram associação estatisticamente significativa com a sobrevida do paciente com MCp, respectivamente: sexo (p < 0,001), faixa etária (p = 0,02), cor da pele (p = 0,04), profissão (p < 0,001) e metástase (p < 0,001).
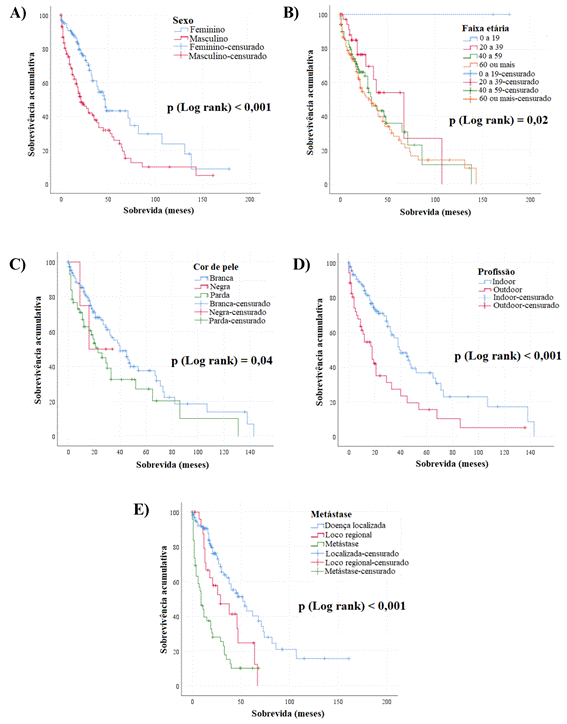
Figura 1. Sobrevida dos pacientes diagnosticados com MCp em Goiânia, no período 2003-2016. A) Curva de sobrevida de acordo com o sexo; B) Curva de sobrevida de acordo com a faixa etária; C) Curva de sobrevida de acordo com a cor da pele; D) Curva de sobrevida de acordo com a profissão; E) Curva de sobrevida de acordo com a metástase
DISCUSSÃO
O perfil demográfico dos pacientes diagnosticados com MCp em Goiânia apresentou padrões semelhantes a estudos nacionais20-24. Houve maior ocorrência dos casos em indivíduos do sexo feminino e de cor branca, assim como relatado em estudos conduzidos nas Regiões Sul e Sudeste do país em períodos semelhantes23,25,26. No entanto, outros estudos que buscaram caracterizar o MCp no país mostraram maior ocorrência dos casos em indivíduos do sexo masculino na maioria das cidades brasileiras12,27. Estudo realizado no Rio Grande do Norte encontrou maior predominância de casos de MCp em indivíduos de cor parda, o que pode ter relação com a maior concentração de indivíduos de cor parda e preta na Região Nordeste do país2. No presente estudo, a cor parda foi a segunda mais acometida. Essa diferença pode ter relação com as características da população de cada Região analisada, visto que, na literatura mundial, os indivíduos brancos são os mais atingidos. A Região Sul do Brasil apresenta população com características fenotípicas herdadas do grande contingente de imigrantes europeus de cor branca que ocuparam essa Região entre os séculos 19 e 20, o que se relaciona aos elevados índices locais de MCp28. Outros fatores que podem explicar a divergência encontrada são a grande miscigenação racial característica da população brasileira e o número de pacientes sem dados relativos à cor da pele (36,9% dos casos) no presente estudo.
A maior parte dos casos de MCp encontrava-se na faixa etária de 0 a 59 anos, o que converge com pesquisas nacionais que demonstraram maior incidência em indivíduos entre a quarta e a sexta décadas de vida12,14,21,27. Esse achado pode ter relação com a localização da cidade de Goiânia, onde a latitude é de 16°40’S, recebendo alta incidência solar durante todo o ano, com efeito cumulativo que predispõe ao surgimento mais precoce das lesões iniciais29. Entretanto, merece destaque a quantidade de casos de MCp encontrados em indivíduos com 60 anos ou mais (316 registros, 48,4%), o que está de acordo com a maioria da literatura internacional publicada sobre o assunto. É compreendido que os idosos não tenham ocupado a primeira posição de incidência neste estudo pela maior dificuldade de diagnóstico do MC em idades mais avançadas, o que se relaciona à apresentação de lesões com características distintas do padrão clássico e em locais de visibilidade comprometida, como o couro cabeludo30.
Foi observada maior ocorrência de MCp em indivíduos com profissões do tipo interna. Pessoas que trabalham em locais cobertos apresentam exposição aguda intermitente, o que aumenta o risco de MC30. Estudo realizado no Paraná observou que 24,2% dos pacientes com diagnóstico de MCp apresentavam risco de exposição solar intensa, mas a maioria (61,3%) trabalhava em atividades com menor risco de exposição solar12. Possíveis explicações para esse fenômeno são o fato de que grande parte das profissões internas gera maior renda quando comparadas às profissões externas, o que possibilita mais oportunidades de lazer com exposição solar aguda e ação cumulativa dos raios UV. É também possível que o perfil de paciente sob maior risco de desenvolvimento de MC (homens de pele branca com histórico familiar da doença) seja mais comumente direcionado às profissões internas do que às externas31.
Neste estudo, o tronco foi o local mais frequente de MCp, seguido dos membros inferiores, membros superiores e região de cabeça e pescoço. O mesmo perfil foi observado por um estudo realizado no Uruguai, que encontrou o dorso e os membros como as localizações mais comuns das lesões iniciais do MC32. Estudos conduzidos na cidade de Criciúma, Santa Catarina, e no Estado do Rio Grande do Norte, bem como um estudo multicêntrico nacional relataram maior incidência das lesões primárias em região de tronco e de membros inferiores2,22,27. Embora na região de cabeça e pescoço tenha sido o local menos acometido nos pacientes da pesquisa, outras pesquisas nacionais e pesquisa realizada na Colômbia encontraram maior incidência de lesões primárias nessa região24,33,34. A localização da lesão primária sofre influência de fatores sociodemográficos, que variam conforme a amostra encontrada em cada estudo e que poderiam explicar essas diferenças.
Dos tipos histológicos classificados, o mais encontrado neste estudo foi o extensivo superficial. Este configura o tipo histológico mais frequente na literatura, independentemente de sexo e idade21,27,33-36. O segundo tipo histológico mais frequente foi o melanoma nodular. Esses resultados coincidem com os achados de algumas pesquisas nacionais e internacionais32. Entretanto, divergem de uma pesquisa colombiana que o encontrou como o menos frequente34. A literatura mundial apresenta divergências em relação à prevalência do melanoma nodular, embora seja consenso que ele é mais encontrado em idosos30,37. Isso pode explicar o achado da presente pesquisa, em função da quantidade expressiva (48,4%) de casos na faixa etária de 60 anos ou mais.
A maior parte dos casos apresentou doença localizada ao diagnóstico. Os casos com metástase corresponderam a 9,6% da amostra. A doença locorregional foi observada em 35 pacientes (5,4%). Existe, na literatura mundial, uma tendência de estabilidade nas taxas de mortalidade por melanoma em razão do avanço nas técnicas diagnósticas. Estas permitem a detecção de tumores cada vez mais finos, com retirada cirúrgica precoce38,39. A detecção precoce contribui para a diminuição dos casos de metástase e pode explicar esses achados.
Ao comparar os resultados com pesquisa realizada em Goiânia, a partir de dados do RCBP-GO, entre os anos de 1988 e 200029, foi possível perceber tanto manutenções quanto mudanças nos perfis demográfico e clínico dos pacientes diagnosticados com MCp. O estudo de Sortino-Rachou et al.29 encontrou 260 casos de MCp no período, com maior ocorrência em pacientes do sexo masculino na faixa etária entre 0 e 59 anos, semelhante ao que foi observado neste estudo. O estudo anterior também obteve resultados semelhantes em relação à localização da lesão primária, com maior frequência das lesões iniciais na ordem seguinte: tronco, membros inferiores, cabeça e pescoço e membros superiores. Ademais, enquanto o estudo de Sortino-Rachou et al.29 relatou 56,9% de melanomas invasivos, 17,9% de melanomas metastáticos e 2,8% de melanomas in situ, a presente pesquisa constatou 63,4% doenças localizadas, 9,6% melanomas metastáticos, 5,4% melanomas loco regionais e 0,2% melanomas in situ. O aumento do número de casos encontrados entre os anos de 2003 e 2016, com maior frequência em mulheres, e a redução nas taxas de metástase podem estar relacionados a fatores como aumento da qualidade dos registros do RCBP-GO, maior eficiência das campanhas locais contra o câncer de pele e maior acurácia das técnicas diagnósticas utilizadas por clínicos e dermatologistas da cidade.
Em relação à sobrevida do paciente com MCp na cidade de Goiânia, os aspectos associados à menor sobrevida foram: sexo masculino, idade igual ou superior a 60 anos, cor de pele parda, profissão externa e metástase.
No Brasil, homens morrem mais de MC em comparação às mulheres40. Tal constatação pode ser explicada pela cultura masculina que enxerga o “homem másculo” como aquele que tolera a dor e não se preocupa com a saúde de seu corpo40, o que pode atrasar o diagnóstico e levar ao tratamento em estágios mais avançados do câncer, com menos chances de cura9.
O tratamento inicial do MC é a remoção cirúrgica da lesão. Contudo, não é incomum a utilização de tratamentos adjuvantes para auxiliar no processo de cura9. Em idosos, porém, esses tratamentos adicionais são pouco utilizados, em função da presença de comorbidades, da incapacidade de tolerar efeitos colaterais, da redução da autonomia, da dependência psicossocial e financeira, além dos tipos histológicos e localizações comumente mais atípicos dos tumores41. Pacientes com 20 a 39 anos são manejados de forma mais ampla, tendo em vista o perfil comumente menos agressivo dos tumores, além de apresentarem menos comorbidades e tolerarem melhor os efeitos colaterais das diversas terapias disponíveis, com melhores taxas de cura42.
Com relação ao tipo de MCp, o melanoma acral é o mais comum nas populações de pele escura e um dos tipos com pior prognóstico43. A deficiência do exame físico plantar por diversos clínicos e dermatologistas prejudica o diagnóstico precoce desse tipo histológico. Além disso, o acesso à saúde pública ainda apresenta vestígios de racismo e negligência contra a população de pele mais escura, representada pela maior rotatividade desses pacientes entre as unidades de atenção básica do Sistema Único de Saúde (SUS)44. Isso prejudica o diagnóstico e piora o prognóstico do paciente, o que pode explicar parcialmente os resultados encontrados em relação à pele parda.
No que diz respeito às atividades laborais, pacientes que trabalham em ambiente externos apresentam maiores chances de vir a óbito, pois apresentam menores condições sociais e econômicas, dificultando o acesso à saúde, o que aumenta as chances de desenvolver novas lesões melanocíticas31. Ademais, esses trabalhadores são, majoritariamente, de cor preta ou parda31, que tem maior relação com localizações primárias do tumor de pior prognóstico, como a acral43. O oposto ocorre com os pacientes que trabalham em profissões internas, que têm melhores taxas de sobrevida, o que condiz com os resultados da pesquisa.
A localização da lesão primária é um fator importante de prognóstico nos casos de MC. Enquanto prognósticos piores são associados a melanomas com lesão primária de localização axial (tronco, cabeça e pescoço), melanomas com lesão primária nos membros superiores e inferiores são associados a um melhor prognóstico45. Destaca-se que, dentro das localizações de membros inferiores e superiores, estão inclusas as extremidades (plantas dos pés, palmas das mãos e leito ungueal), o que pode ser um fator de confusão na análise do prognóstico das lesões em membros, visto que o melanoma acral é tido como de pior prognóstico na literatura43. No presente estudo, não foi possível determinar relação entre a localização da lesão primária e o tempo de sobrevida, apesar da relevância desse fator prognóstico na literatura46.
A presença de metástase é uma variável que influencia significativamente no prognóstico de pacientes com MC13. Pacientes com a doença localizada apresentam bom prognóstico na maioria dos casos. Pacientes com doença locorregional apresentam prognóstico variável de acordo com a presença ou não de ulceração e a quantidade de linfonodos envolvidos41. Pacientes com metástase apresentam prognóstico desfavorável e menor taxa de sobrevivência entre as localizações primárias citadas8. Os resultados encontrados a partir dos dados do estudo, portanto, coincidem com o que é descrito na literatura.
A classificação histológica do MCp possui importância para o diagnóstico e para a definição de conduta, porém não possui relevância significativa no prognóstico de pacientes de melanoma46. No presente estudo, não foi identificada associação entre o tipo histológico e o tempo de sobrevida dos pacientes com melanoma. Dessa forma, o achado do estudo é congruente com o que é descrito na literatura.
Como limitação deste estudo, destaca-se a utilização de dados cuja coleta primária foi realizada por funcionários do RCBP-GO, o que limita o controle dos pesquisadores sobre a qualidade desse processo. Além disso, o grande número de casos em que as variáveis de coleta não apresentavam a informação disponível também limita a extrapolação dos resultados obtidos para a população goiana.
Em relação aos pontos fortes deste estudo, merece destaque o grande número de casos de MCp encontrados (n = 653), o que permitiu a realização de uma análise robusta acerca do perfil epidemiológico do MCp na cidade de Goiânia, apesar da grande quantidade de informações não disponíveis. Além disso, o uso de dados de um RCBP, o qual recebe dados de pacientes provenientes de diversas fontes de informação da cidade, possibilitou a redução do viés de seleção do estudo.
CONCLUSÃO
O MCp é uma doença de grande relevância no município de Goiânia. Os fatores evidenciados que pioraram a sobrevida do paciente com MCp na cidade foram: sexo masculino, idade superior a 60 anos, cor de pele parda, profissão externa e presença de metástase. Os fatores evidenciados que melhoraram a sobrevida desses pacientes foram o sexo feminino, faixa etária de 20 a 39 anos, cor branca, profissão interna e doença localizada. Não houve diferença significativa entre o tempo de sobrevida e a localização da lesão primária e entre o tipo histológico no presente estudo.
Os resultados demonstram a necessidade da ampliação de campanhas de detecção em massa do MCp na cidade de Goiânia e da criação de estratégias que atraiam cada vez mais indivíduos do sexo masculino, idosos e de cor parda para serem avaliados, a fim de que o diagnóstico precoce seja estabelecido para essa população sob risco de menor sobrevida. Ademais, as localizações da lesão primária mais encontradas neste estudo reforçam a precária adoção de medidas de proteção solar pela população goiana, o que indica a importância de que essas medidas sejam incentivadas a partir de campanhas cujo público-alvo seja primordialmente crianças e jovens, a fim de que adultos conscientes sejam formados.
Por fim, em função da grande quantidade de dados não informados encontrados nas fichas do RCBP-GO, sugere-se uma melhor orientação em relação ao preenchimento das fichas de notificação aos médicos nas instituições que abastecem o RCBP-GO com dados sobre o MC na cidade de Goiânia. Outra sugestão pertinente é a inclusão das variáveis escolaridade e condição socioeconômica na ficha de notificação do RCBP-GO, pois estas sabidamente interferem no tempo de sobrevida dos pacientes com MCp e poderiam auxiliar em estudos futuros.
AGRADECIMENTOS
À ACCG e aos profissionais do RCBP-GO que forneceram os dados analisados neste estudo; e ao estatístico Macks Wendhell Gonçalves que realizou a análise estatística do presente trabalho.
CONTRIBUIÇÕES
Todos os autores contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Diepgen TL, Mahler V. The epidemiology of skin cancer. Br J Dermatol. 2002;146(s61):1-6. doi: https://doi.wiley.com/10.1046/j.1365-2133.146.s61.2.x
2. Lima RLF, Nóbrega MQR, Moraes MDLSA, et al. Estudo retrospectivo de melanomas cutâneos e mucosos na população do estado do Rio Grande do Norte, Brasil. J Bras Patol e Med Lab. 2009;45(6):493-9.
3. Steglich RB, Coelho KMPA, Cardoso S, et al. Epidemiological and histopathological aspects of primary cutaneous melanoma in residents of Joinville, 2003-2014. An Bras Dermatol. 2018;93(1):45-53. doi: https://doi.org/10.1590/abd1806-4841.20185497
4. Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. doi: http://doi.wiley.com/10.3322/caac.21492
5. Instituto Nacional de Câncer. Estimativa 2023: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2022. [acesso em 2023 nov 13]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/estimativa-2023.pdf
6. Chang AE, Karnell LH, Menck HR. The National Cancer Data Base report on cutaneous and noncutaneous melanoma. Cancer. 1998;83(8):1664-78. doi: https://doi.org/10.1002/(SICI)1097-0142(19981015)83:8%3C1664::AID-CNCR23%3E3.0.CO;2-G
7. Bakos L. Melanoma cutâneo: estudos de base populacional no Brasil. An Bras Dermatol. 2006;81(5):402.
8. Soong SJ, Ding S, Coit D, et al. Predicting Survival outcome of localized melanoma: an electronic prediction tool based on the AJCC melanoma database. Ann Surg Oncol. 2010;17(8):2006-14. doi: https://doi.org/10.1245/s10434-010-1050-z
9. Schadendorf D, Fisher DE, Garbe C, et al. Melanoma. Nat Rev Dis Prim. 2015;1(1):15003. doi: https://doi.org/10.1038/nrdp.2015.3
10. Minocha R, Damian DL, Halliday GM. Melanoma and nonmelanoma skin cancer chemoprevention: a role for nicotinamide? Photodermatol Photoimmunol Photomed. 2018;34(1):5-12. doi: http://doi.wiley.com/10.1111/phpp.12328
11. Eide MJ, Weinstock MA, Clark MA. Demographic and socioeconomic predictors of melanoma prognosis in the United States. J Health Care Poor Underserved. 2009;20(1):227-45.
12. Purim KSM, Sandri CO, Pinto NT, et al. Perfil de casos de melanoma em um hospital universitário, 2003 a 2007. Rev Bras Cancerol. 2013;59(2):193-9. doi: https://doi.org/10.32635/2176-9745.RBC.2013v59n2.523
13. Armstrong BK, Cust AE. Sun exposure and skin cancer, and the puzzle of cutaneous melanoma. Cancer Epidemiol. 2017;48:147-56. doi: https://doi.org/10.1016/j.canep.2017.04.004
14. Battisti R, Nunes DH, Weber AL, et al. Evaluation of the epidemiological profile and the mortality rate of the patients with primary cutaneous melanoma in Florianopolis - SC, Brazil. An Bras Dermatol. 2009;84(4):335-42.
15. Lages RB, Barbosa PB, Almeida IP, et al. Detecção precoce do câncer de pele: experiência de campanha de prevenção no Piauí-Brasil. Rev Bras em Promoção da Saúde [Internet]. 2012 [acesso 2023 nov 23];25(2):221-7. Disponível em: http://www.unifor.br/images/pdfs/rbps/2012.2_artigo13.pdf
16. Moura L, Curado MP, Simões EJ, et al. Avalição do Registro de Câncer de Base Populacional do Município de Goiânia, Estado de Goiás, Brasil. Epidemiol serv saúde. 2006;15(4):7-17. doi: http://dx.doi.org/10.5123/S1679-49742006000400002
17. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
18. Organização Mundial da Saúde. CID-10: Classificação Estatística Internacional de Doenças com disquete. Vol. 3, Índice Alfabético. São Paulo: Edusp; 2008.
19. SPSS®: Statistical Package for Social Science (SPSS) [Internet]. Versão 26.0. [Nova York]. International Business Machines Corporation. [acesso 2023 mar 9]. Disponível em: https://www.ibm.com/br-pt/spss?utm_content=SRCWW&p1=Search&p4=43700077515785492&p5=p&gclid=CjwKCAjwgZCoBhBnEiwAz35Rwiltb7s14pOSLocnooMOQh9qAL59IHVc9WP4ixhNTVMjenRp3-aEgxoCubsQAvD_BwE&gclsrc=aw.ds
20. Vilanova CMA, Lages RB, Ribeiro SM, et al. Perfil epidemiológico e histopatológico do melanoma cutâneo em um centro do nordeste brasileiro de 2000 a 2010. An Bras Dermatol. 2013;88(4):545-53.
21. Costa NF, Fernandes NC, Borges MRMM. Study of the histopathological types of cutaneous melanoma in palmas-TO from 2001 to 2011. An Bras Dermatol. 2015;90(5):638-45.
22. Melo AC, Wainstein AJA, Buzaid AC, et al. Melanoma signature in Brazil: Epidemiology, incidence, mortality, and trend lessons from a continental mixed population country in the past 15 years. Melanoma Res. 2018;28(6):629-36.
23. Lima AS, Stein CE, Casemiro KP, et al. Epidemiology of melanoma in the south of Brazil: study of a city in the Vale do Itajaí from 1999 to 2013. An Bras Dermatol. 2015;90(2):185-9. doi: https://doi.org/10.1590/abd1806-4841.20153076
24. Veneziano DB. Estudo do perfil epidemiológico do melanoma cutâneo na cidade de Jaú-SP através do registro de base populacional [Internet]. Botucatu: Universidade Estadual Paulista Júlio de Mesquita Filho, Faculdade de Medicina de Botucatu; 2014. [acesso 2023 nov 23]. Disponível em: http://repositorio.unesp.br/handle/11449/108855
25. Moreno M, Schmitt RL, Lang MG, et al. Epidemiological profile of patients with cutaneous melanoma in a region of southern Brazil. J Skin Cancer. 2012;2012:1-8.
26. Wainstein AJA, Duprat Neto JP, Enokihara MY, et al. Demographic, clinical, and pathologic features of patients with cutaneous melanoma: final analysis of the brazilian melanoma group database. JCO Glob Oncol. 2020;(6):575-82.
27. Konrad P, Fabris MR, Melao S, et al. Perfil epidemiológico e histopatológico dos casos de melanoma cutâneo primário diagnosticados em Criciúma no período entre 2005 e 2007. An Bras Dermatol. 2011;86(3):457-61.
28. Bakos L, Masiero N, Bakos R, et al. European ancestry and cutaneous melanoma in Southern Brazil. J Eur Acad Dermatology Venereol. 2009;23(3):304-7. doi: https://doi.org/10.1111/j.1468-3083.2008.03027.x
29. Sortino-Rachou AM, Curado MP, Latorre MRDO. Melanoma cutâneo: estudo de base populacional em Goiânia, Brasil, de 1988 a 2000. An Bras Dermatol. 2006;81(5):449-55.
30. Iglesias-Pena N, Paradela S, Tejera-Vaquerizo A, et al. Cutaneous melanoma in the elderly: review of a growing problem. Actas Dermosifiliogr. 2019;110(6):434-47. doi: http://dx.doi.org/10.1016/j.adengl.2019.05.012
31. Modenese A, Korpinen L, Gobba F. Solar radiation exposure and outdoor work: an underestimated occupational risk. Int J Environ Res Public Health. 2018;15(10):2063. doi: https://doi.org/10.3390/ijerph15102063
32. Amarillo D, Boni D, Nantes F, et al. Melanoma cutáneo en Uruguay: características clínico-epidemiológicas y sobrevida en cohorte de pacientes de dos centros de referencia en el período 2008-2017. Rev Medica Del Uruguay. 2020;36(2):146-54.
33. Bertoldi MB, Augusto C, Bastos S, et al. Melanoma cutaneo em um hospital universitario, 2001-2016. Rev Bras Cancerol. 2020;66(3):e-03911. doi: https://doi.org/10.32635/2176-9745.RBC.2020v66n3.911
34. Pozzobon FC, Acosta AE. Epidemiological profile of primary cutaneous melanoma over a 15-year period at a private skin cancer center in Colombia. Rev Salud Publica. 2018;20(2):226-31.
35. Ferreira T, Santos IDAO, Oliveira AF, et al. Estudo retrospectivo dos pacientes portadores de melanoma cutâneo atendidos na Universidade Federal de São Paulo. Rev Col Bras Cir. 2018;45(4):e1715. doi: https://doi.org/10.1590/0100-6991e-20181715
36. Mélo KC, Santos AGG, Amorim JR, et al. Análise temporal da mortalidade por cancer de pele melanona no Brasil: 2000 a 2016. Surg Cosmet Dermatology. 2019;11(4):287-94. doi: http://www.dx.doi.org/10.5935/scd1984-8773.20191141486
37. Tragos C, Hieken TJ. Optimizing the management of cutaneous melanoma in the elderly. Surgery. 2011;150(4):828-35. doi: http://dx.doi.org/10.1016/j.surg.2011.07.054
38. Garbe C, McLeod GRC, Buettner PG. Time trends of cutaneous melanoma in Queensland, Australia and Central Europe. Cancer. 2000;89(6):1269-78. doi: https://doi.org/10.1002/1097-0142(20000915)89:6%3C1269::AID-CNCR11%3E3.0.CO;2-C
39. MacKie RM, Bray CA, Hole DJ, et al. Incidence of and survival from malignant melanoma in Scotland: an epidemiological study. Lancet. 2002;360(9333):587-91. doi: https://doi.org/10.1016/s0140-6736(02)09779-9
40. Separavich MA, Canesqui AM. Saúde do homem e masculinidades na Política Nacional de Atenção Integral à Saúde do Homem: uma revisão bibliográfica. Saúde e Soc. 2013;22(2):415-28. doi: https://doi.org/10.1590/S0104-12902013000200013
41. Schadendorf D, van Akkooi ACJ, Berking C, et al. Melanoma. Lancet. 2018;392(10151):971-84.
42. Purim KSM, Bonetti JPC, Silva JYF, et al. Características do melanoma em idosos. Rev Col Bras Cir. 2020;47. Disponível em: https://doi.org/10.1590/0100-6991e-20202441
43. Maia M, Russo C, Ferrari N, et al. Melanoma acrolentiginoso: um desafio ao diagnóstico precoce. An Bras Dermatol. 2003;78(5):553-60. doi: https://doi.org/10.1590/S0365-05962003000500004
44. Massignam FM, Bastos JLD, Nedel FB. Discriminação e saúde: um problema de acesso. Epidemiol Serv Saúde. 2015;24(3):544-1. doi: http://dx.doi.org/10.5123/S1679-49742015000300020
45. Strudel M, Festino L, Vanella V, et al. Melanoma: prognostic factors and factors predictive of response to therapy. Curr Med Chem. 2020;27(17):2792-813. doi: http://dx.doi.org/10.2174/0929867326666191205160007
46. Bobos M. Histopathologic classification and prognostic factors of melanoma: a 2021 update. Ital J Dermatology Venereol. 2021;156(3):300-21. doi: https://doi.org/10.23736/S2784-8671.21.06958-3
Recebido em 22/2/2024
Aprovado em 19/4/2024
Editora-associada: Jeane Tomazelli. Orcid iD: https://orcid.org/0000-0002-2472-3444
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.