ARTIGO ORIGINAL
Desnutrição e Baixa Massa Muscular em Pacientes com Câncer Gastrointestinal Submetidos à Cirurgia: Existe Associação com a Localização do Tumor?
Malnutrition and Low Muscle Mass in Patients with Gastrointestinal Cancer Undergoing Surgery: is There an Association with Tumor Location?
Desnutrición y Baja Masa Muscular en Pacientes con Cáncer Gastrointestinal Sometidos a Cirugía: ¿Existe Asociación con la Ubicación del Tumor?
https://doi.org/10.32635/2176-9745.RBC.2024v70n2.4630
Juliane Alves da Silva1; Viviane Dias Rodrigues2; Renata Brum Martucci3; Andresa da Silva Couto4; Aline Barcellos Barreto5; Nilian Carla Souza6
1Instituto Nacional de Câncer (INCA), Programa de Residência Multiprofissional. Rio de Janeiro (RJ), Brasil. E-mail: julianea.silvanutri@gmail.com. Orcid iD: https://orcid.org/0000-0002-2149-9678
2,6INCA, Hospital do Câncer I, Setor de Nutrição e Dietética. Rio de Janeiro (RJ), Brasil. E-mails: viviane.rodrigues@inca.gov.br; niliansouza@yahoo.com.br. Orcid iD: https://orcid.org/0000-0003-2243-438X ; Orcid iD: https://orcid.org/0000-0003-1396-3386
3,4,5Universidade do Estado do Rio de Janeiro (Uerj), Instituto de Nutrição. Rio de Janeiro (RJ), Brasil. E-mails: renatabrum@yahoo.com; ndresascn@gmail.com; alinebarcellos1@hotmail.com. Orcid iD: https://orcid.org/0000-0002-3354-4229; Orcid iD: https://orcid.org/0009-0009-6722-3034 ; Orcid iD: https://orcid.org/0000- 0002-2787-4643
Endereço para correspondência: Juliane Alves da Silva. Rua Carlos de Carvalho, 47 – Centro. Rio de Janeiro (RJ), Brasil. CEP 20230-180. E-mail: julianemalta.jf@gmail.com
RESUMO
Introdução: A depleção do estado nutricional e a redução da massa muscular são características frequentes em pacientes com câncer. Objetivo: Comparar o estado nutricional, a massa e a força muscular em pacientes com câncer do trato gastrointestinal alto e câncer colorretal. Método: Subamostra de estudo de coorte prospectivo com pacientes com câncer do trato gastrointestinal submetidos à cirurgia. Para avaliação nutricional, foram utilizados a avaliação subjetiva global produzida pelo paciente (ASG-PPP) e o índice de massa corporal (IMC). A composição corporal foi avaliada por tomografia computadorizada e a aferição da força de preensão manual por dinamometria. A sarcopenia foi estabelecida pela redução da força e do índice de massa muscular esquelética ou redução da força e radiodensidade muscular esquelética. Resultados: O estudo foi conduzido com 52 pacientes, dos quais 54% eram do sexo masculino, 56% idosos, 67% com câncer colorretal e 68% em estádios 3 e 4 da doença. Na primeira consulta, embora a maioria dos indivíduos (42%) tenha sido classificada na faixa de peso adequado/eutrofia segundo o IMC, 56% apresentavam risco ou desnutrição de acordo com a ASG-PPP. Apenas três pacientes apresentavam sarcopenia. Foram observadas maior ocorrência de pacientes com baixo peso/desnutrição e redução da massa muscular esquelética no grupo de tumores do trato gastrointestinal alto em comparação com o grupo de pacientes com tumor colorretal (58% e 42%, p = 0,031; 60% e 40%, p = 0,018, respectivamente). Conclusão: A análise revelou uma ocorrência mais elevada de redução da massa muscular esquelética e baixo peso/desnutrição em pacientes com tumores do trato gastrointestinal alto.
Palavras-chave: Neoplasias Gastrointestinais/cirurgia; Neoplasias Colorretais/cirurgia; Sarcopenia/cirurgia; Estado Nutricional; Composição Corporal.
ABSTRACT
Introduction: Depletion of nutritional status and reduction of muscle mass are common features in cancer patients. Objective: To compare nutritional status, muscle mass, and strength in patients with upper gastrointestinal tract cancer and colorectal cancer. Method: Subset of a prospective cohort study involving patients with gastrointestinal tract cancer undergoing surgery. Nutritional assessment included patient-generated subjective global assessment (PG-SGA) and body mass index (BMI). Body composition was assessed by computed tomography, and handgrip strength, by dynamometry. Sarcopenia was defined by reduced muscle strength and skeletal muscle index or reduced muscle strength and skeletal muscle radiodensity. Results: The study included 52 patients, 54% males, 56% older adults, 67% had colorectal cancer, and 68% were in stages 3 and 4 of the disease. Although the majority of the individuals (42%) were classified as eutrophic/normal weight according to BMI, 56% were at nutritional risk or malnourished according to PG-SGA. Only three patients had sarcopenia. A higher incidence of patients with upper gastrointestinal tract cancer were underweight and exhibited low skeletal muscle mass compared to patients with colorectal cancer (58% and 42%, p = 0.031; 60% and 40%, p = 0.018, respectively). Conclusion: The analysis revealed a higher prevalence of underweight and low skeletal muscle mass in patients with upper gastrointestinal tract cancer.
Key word: Gastrointestinal Neoplasms/surgery; Colorectal Neoplasms/surgery; Sarcopenia/surgery; Nutritional Status; Body Composition.
RESUMEN
Introducción: La depleción del estado nutricional y la reducción de la masa muscular son características frecuentes en pacientes con cáncer. Objetivo: Comparar el estado nutricional, la masa y la fuerza muscular en pacientes con cáncer del tracto gastrointestinal superior y cáncer colorrectal. Método: Submuestra de un estudio de cohorte prospectivo con pacientes con cáncer del tracto gastrointestinal sometidos a cirugía. Para la evaluación nutricional se utilizaron la valoración global subjetiva generada por el paciente (VGS-GP) y el índice de masa corporal (IMC). La composición corporal se evaluó mediante tomografía computarizada y la medición de la fuerza de prensión manual se realizó mediante dinamometría. La sarcopenia se estableció por la reducción de la fuerza y del índice de masa muscular esquelética o la reducción de la fuerza y la radiodensidad muscular esquelética. Resultados: El estudio se llevó a cabo con 52 pacientes, de los cuales el 54% eran hombres, el 56% eran ancianos, el 67% tenía cáncer colorrectal y el 68% se encontraba en las etapas 3 y 4 de la enfermedad. Aunque la mayoría de los individuos (42%) fue clasificado como peso normal/eutrófico según el IMC en la primera consulta, el 56% estaba en riesgo nutricional o desnutrido según la VGS-GP. Solo tres pacientes presentaban sarcopenia. Se observó una mayor incidencia de pacientes con bajo peso/desnutrición y reducción de la masa muscular esquelética en el grupo de tumores del tracto gastrointestinal superior en comparación con el grupo de pacientes con tumor colorrectal (58% y 42%, p = 0,031; 60% y 40%, p = 0,018, respectivamente). Conclusión: El análisis reveló una mayor incidencia de reducción de la masa muscular esquelética y bajo peso/desnutrición en pacientes con cáncer de tracto gastrointestinal superior.
Palabras clave: Neoplasias Gastrointestinales/cirugía; Neoplasias Colorrectales/cirugía; Sarcopenia/cirugía; Estado Nutricional; Composición Corporal.
INTRODUÇÃO
O câncer atualmente se destaca por ser um problema de grande relevância na saúde global, sendo uma das principais causas de óbito prematura em diversos países1. No contexto brasileiro, as projeções, para cada ano do triênio 2023-2025, são de 704 mil casos novos, sendo notáveis os 66 mil (9,4%) casos de tumores de cólon e reto, assim como os 30 mil (4,4%) casos de tumor gástrico, 10.990 mil (1,56%) novos casos de tumores de esôfago e 10.980 mil de pâncreas2. O câncer colorretal ocupa a terceira posição entre os tipos mais frequentes, com taxas mais elevadas na Região Sudeste, seguido pelo câncer gástrico que se encontra na quinta posição, o câncer de esôfago, na décima terceira posição, e o câncer de pâncreas na décima quarta, sendo os dois últimos os com maior incidência na Região Sul do país2. A desnutrição relacionada ao câncer é caracterizada como uma condição que resulta da ativação da inflamação sistêmica que pode levar à anorexia e à degradação dos tecidos que, por sua vez, resultam em perda significativa de peso corporal, alterações na composição corporal e declínio da função física3. Além disso, fatores relacionados ao próprio tumor, como a localização, o estadiamento e o efeito do tratamento, contribuem para o comprometimento do estado nutricional4,5, impactando negativamente na sobrevida, na resposta ao tratamento, nos desfechos cirúrgicos e na qualidade de vida6.
Em paralelo, a sarcopenia é uma síndrome caracterizada pela baixa massa e função muscular associada ao envelhecimento, denominada sarcopenia primária7. Entretanto, tal condição pode estar presente em indivíduos com doenças crônicas, como o câncer, denominada como sarcopenia secundária8,9. De fato, a baixa massa muscular esquelética e, mais recentemente, a sarcopenia vêm sendo exploradas como condições associadas ao maior risco de complicações pós-operatórias e menor sobrevida em pacientes com câncer submetidos a cirurgias do trato gastrointestinal10-16.
Apesar de a literatura apontar os tumores do trato gastrointestinal, em especial os do trato gastrointestinal alto como um dos tipos de câncer que apresentam uma alta prevalência de desnutrição3,17, há uma escassez de estudos que associam a massa e a força muscular com a localização tumoral em pacientes submetidos a ressecções cirúrgicas. O objetivo deste estudo é comparar o estado nutricional, a massa e a força muscular entre pacientes com tumores localizados no trato gastrointestinal alto (como esôfago, estômago e pâncreas) e no colón e reto, submetidos a tratamento cirúrgico.
MÉTODO
Estudo de coorte prospectiva com pacientes diagnosticados com câncer do trato gastrointestinal atendidos em um hospital terciário no Rio de Janeiro. Trata-se de uma subamostra do projeto “Estado nutricional, composição corporal e funcionalidade em pacientes com câncer do trato gastrointestinal: um estudo prospectivo”, com a finalidade de acompanhar as mudanças de peso, de composição corporal e de funcionalidade ao longo do tratamento oncológico. O projeto foi aprovado pelo Comitê de Ética em Pesquisa (CEP) da instituição sob o número de parecer 6758988 (CAAE: 46304721.4.0000.5274) com base na Resolução n.º 466/201218 do Conselho Nacional de Saúde.
Os critérios de inclusão foram adultos (idade >20 anos), diagnosticados com tumor primário do trato gastrointestinal (esôfago, estômago, pâncreas, colorretal), que foram submetidos a tratamento cirúrgico e que tivessem realizado a consulta pré-cirúrgica no ambulatório de nutrição. Os critérios de exclusão foram indivíduos em cuidados paliativos, encaminhados para tratamento clínico (quimioterapia e radioterapia), performance status >313 e tumor sincrônico.
Os pacientes que seriam submetidos à cirurgia eletiva passaram por uma consulta inicial no ambulatório de nutrição antes da cirurgia, entre junho de 2021 a julho de 2023, conforme a rotina estabelecida pelo Setor de Nutrição e Dietética da instituição. No momento da consulta, para os pacientes que concordaram em participar do estudo, foi solicitado que assinassem o Termo de Consentimento Livre e Esclarecido. Em seguida, a avaliação do estado nutricional e da força muscular foi realizada. Os pacientes foram orientados quanto à alimentação de acordo com o tipo de patologia e suas necessidades individuais específicas. Aqueles classificados com risco nutricional ou desnutridos foram orientados quanto ao suporte nutricional oral ou enteral conforme a rotina de atendimento ambulatorial implementada segundo os procedimentos operacionais padrão elaborados pelo Setor de Nutrição e Dietética.
Os dados demográficos e a história clínica foram coletados por meio do prontuário eletrônico, como história familiar de câncer, comorbidades e uso de terapia nutricional, localização do tumor, data do diagnóstico, performance status, estadiamento clínico e dados relativos ao tratamento oncológico.
Foi utilizada a avaliação subjetiva global produzida pelo paciente (ASG-PPP) na versão traduzida e disponível em https://pt-global.org/. A ferramenta é composta por duas partes. A primeira é respondida pelo paciente ou cuidador e apresenta questões sobre peso, ingestão alimentar, sintomas e capacidade funcional. Na segunda parte, são avaliados fatores associados ao aumento da demanda metabólica e o exame físico. Os indivíduos foram classificados como bem nutrido (A), risco nutricional ou desnutrição moderada (B) e desnutrição grave (C); e foi obtida a soma dos escores. A pontuação da ASG-PPP, além de identificar mudanças no estado nutricional, pode ser utilizada para se planejar medidas de intervenção nutricional específicas14,19.
O peso corporal e a estatura foram aferidos e realizado o cálculo do índice de massa corporal (IMC, kg/m2). O IMC foi classificado segundo a Organização Mundial da Saúde (OMS) para adultos e a Organização Pan-Americana da Saúde (Opas) para Idosos20,21.
A massa muscular esquelética foi avaliada por tomografia computadorizada (TC), ao nível da terceira vértebra lombar (L3), utilizando o intervalo de atenuação -29 HU a +150 HU22, por meio do software Slice-O-Matic23, versão 5.0, (Tomovision®, Canadá). A área muscular esquelética obtida (cm2) foi utilizada no cálculo do índice de massa muscular esquelética (IMME), definido como a razão entre a área muscular (cm2) e a estatura (m2). Além disso, foi avaliada a média de radiodensidade do músculo esquelético (RME) pela média do valor da atenuação do músculo esquelético na faixa de -29 a +150 HU22.
A força muscular foi avaliada pela força de preensão manual (FPM) utilizando dinamômetro Jamar® (Sammons Preston®, EUA). Os pacientes realizaram o teste sentados, com o cotovelo flexionado a 90º. Foram realizadas três medidas de cada mão e utilizada a maior medida obtida22.
Pacientes com redução da FPM e do IMME ou redução da FPM e da RME foram considerados com sarcopenia, uma vez que o IMME e a RME são usados para confirmação diagnóstica, de acordo com o European Working Group on Sarcopenia in Older People8. Foram estabelecidos como pontos de corte valores abaixo do primeiro tercil: para homens, FPM< 29 kg, IMME < 44,8 cm²/m² e RME < 35,6 HU; e para mulheres, FPM< 18kg, IMME < 36,8 cm²/m² e RME < 31,8 HU.
Os dados foram analisados de forma anônima no software SPSS24 versão 21 e os resultados foram apresentados de maneira agregada para que não houvesse possibilidade de identificação dos pacientes. Foi aplicado o teste de Kolgomorov-Smirnov25, a fim de verificar a normalidade das distribuições, e os resultados foram apresentados pela média e desvio-padrão para as variáveis contínuas com distribuição normal; mediana e intervalo interquartil para variáveis com distribuição não normal; e pela frequência absoluta e percentual para as variáveis categóricas. Para comparar as variáveis categóricas (classificação da ASG-PPP A versus B e C, IMC baixo peso versus ausência de baixo peso, IMME, RME e FPM <1 tercil versus IMME, RME e FPM >1 tercil), foi empregado o teste qui-quadrado (X2). Foi considerado o nível de significância de 5% (p<0,05).
RESULTADOS
O estudo foi conduzido com 52 pacientes (24 mulheres e 28 homens) com mediana de idade de 61,5 anos (intervalo interquartil: 50,5; 66 anos), amostra composta por 56% de idosos e 44% adultos (Tabela 1). Dados sobre o recrutamento e o número de pacientes incluídos e excluídos no estudo encontram-se descritos no fluxograma (Figura 1).
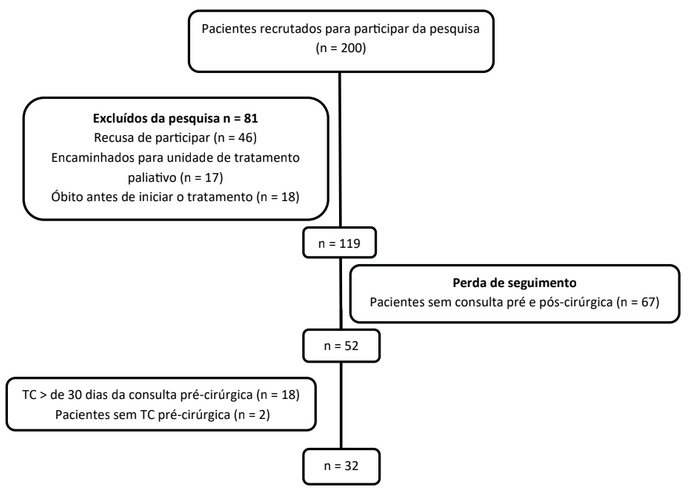
Figura 1. Fluxograma do número de pacientes incluídos e excluídos no estudo
As principais comorbidades foram hipertensão arterial (27%, n = 14) e associação entre diabetes mellitus e hipertensão (17%, n = 9), e nenhum paciente apresentava apenas diabetes mellitus. Sobre a avaliação da capacidade funcional, mais da metade da amostra eram de pacientes com restrição a atividades físicas extenuantes (performance status 1 e 2) (73%; n = 38). Quanto à localização do tumor, mais da metade dos pacientes foram diagnosticados tumor colorretal (67%; n = 35) e 33% (n = 17) com tumores do trato gastrointestinal alto (esôfago, estômago e pâncreas). Os estadiamentos mais prevalentes foram 3 e 4, o que representou 68% da amostra (n = 34) (Tabela 1). Além disso, 77% (n = 40) da amostra faziam uso de terapia nutricional oral e cerca de 19% (n = 10), de terapia nutricional enteral.
Tabela 1. Características clínicas e sociodemográficas
|
|
Total (n = 52) |
|
Idade, anos [mediana (IIQ 25; 75)] |
61,5 (50,5; 66) |
|
Faixa etária [n (%)] Adulto (≥ 20 anos) Idoso (≥ 60 anos) |
23 (44%) 29 (56%) |
|
Sexo [n (%)] Feminino Masculino |
24 (46%) 28 (54%) |
|
Comorbidades [n (%)] Sem comorbidades Hipertensão Diabetes mellitus e hipertensão Diabetes mellitus e outrasᵃ |
26 (50%) 14 (27%) 9 (17%) 3 (6%) |
|
Performance status [n (%)] 0 1-2 |
14 (27%) 38 (73%) |
|
Localização do tumor [n (%)] Esôfago Estômago Pâncreas Colorretal |
5 (10%) 10 (19%) 2 (4%) 35 (67%) |
|
Estágio do tumor [n (%)]b 0-II III-IV |
16 (32%) 34 (68%) |
A amostra não possui pacientes apenas com diabetes mellitus. aDiabetes mellitus e outras: angina (n = 1) e infarto agudo do miocárdio (n = 2); bn = 50.
IIQ = intervalo interquartil.
De acordo com a Tabela 2, os valores de IMC, FPM, IMME e RME eram semelhantes independentemente do sítio tumoral, exceto para homens com tumor colorretal que apresentavam valores maiores de IMME comparados àqueles com tumores do trato gastrointestinal alto (p = 0,021).
Tabela 2. Estado nutricional e composição corporal de pacientes com tumores do trato gastrointestinal atendidos no ambulatório de nutrição (n = 52)
|
TGI alto (n = 17)b |
Colorretal (n = 35) |
p |
|
|
IMC, kg/m2 [média ± DP] Homem Mulher |
22,7 ± 4,9 22,3 ± 4,7 23,4 ± 5,6 |
25,2 ± 4,2 25,1 ± 3,4 25,3 ± 4,9 |
0,084 0,109 0,449 |
|
FPM, kg [média ± DP] Homem Mulher |
29 (20,5; 38,5) 38 (28; 39) 20 (20; 21) |
24 (18; 39) 31,5 (22,7; 41) 20 (16,5; 24,5) |
0,538 0,866 0,924 |
|
IMME, cm2/m2 [média ± DP]a Homem Mulher RME, HU [média ± DP]a Homem Mulher |
42,9 ± 8,8 46,1 ± 4,7 38,1 ± 12 33,5 ± 6,9 34 ± 7,8 32,6 ± 6,3 |
48,6 ± 10,2 53,8 ± 8,5 41,1 ± 7,6 36,6 ± 6,9 37,9 ± 7,9 34,8 ± 5,2 |
0,122 0,021 0,675 0,247 0,341 0,574 |
an = 32; bTGI alto: tumores de esôfago, estômago e pâncreas.
TGI = trato gastrointestinal; DP = desvio-padrão; IMC = índice de massa corporal; ASG-PPP = avaliação subjetiva produzida pelo paciente; FPM = força de preensão manual; IMME = índice de massa muscular esquelético; RME = radiodensidade do músculo esquelético.
No entanto, 58% (n = 7) dos pacientes com tumores do trato gastrointestinal alto apresentavam baixo peso segundo IMC, o que difere dos pacientes com tumor colorretal, em que 75% (n = 30) possuem ausência de baixo peso (p = 0,031). Além disso, grande parte dos pacientes com tumor de trato gastrointestinal alto apresentava IMME <1 tercil (60%; n = 6), enquanto 82% (n = 18) dos indivíduos com tumor colorretal apresentaram IMME >1 tercil (p = 0,018) (Tabela 3). No entanto, entre os pacientes que apresentavam ausência de baixo peso (IMC classificado como peso adequado/eutrofia ou sobrepeso/obesidade), quatro apresentavam IMME < 1 tercil, enquanto dez apresentavam FPM < 1 tercil e oito RME < 1 tercil.
Tabela 3. Estado nutricional e composição corporal estratificado pela localização tumoral (n = 52)
|
Localização do tumor |
pa |
||
|
TGI alto (n = 17)b |
Colorretal (n = 35) |
||
|
Classificação IMC Baixo peso/desnutrição (n = 12) Ausência de baixo peso/desnutrição (n = 40)c |
7 (58%) 10 (25%) |
5 (42%) 30 (75%) |
0,031
|
|
ASG-PPP A (n = 23) B e C (n = 29) |
5 (22%) 12 (41%) |
18 (78%) 17 (59%) |
0,134 |
|
FPM < 1 tercil (n = 14) >1 tercil (n = 38) |
3 (21%) 14 (37%) |
11 (79%) 24 (63%) |
0,293 |
|
IMMEd <1 tercil (n = 10) >1 tercil (n = 22) |
6 (60%) 4 (18%) |
4 (40%) 18 (82%) |
0,018
|
|
RMEd <1 tercil (n = 10) >1 tercil (n = 22) |
5 (50%) 5 (23%) |
5 (50%) 17 (77%) |
0,123 |
|
Sarcopenia [n (%)]d Sim Não |
1 (10%) 9 (90%) |
2 (9%) 20 (91%) |
0,935 |
ateste qui-quadrado de Pearson; bTGI alto: tumores de esôfago, estômago e pâncreas. causência de baixo peso: indivíduos com peso adequado/eutrofia, sobrepeso e obesidade; d=32.
TGI = trato gastrointestinal; IMC = índice de massa corporal; ASG-PPP = avaliação subjetiva produzida pelo paciente; FPM = força de preensão manual; IMME = índice de massa muscular esquelético; RME = radiodensidade do músculo esquelético; HU = Hounsfield Units.
DISCUSSÃO
Encontrou-se maior ocorrência de baixo peso no grupo de tumores do trato gastrointestinal alto comparado ao grupo de pacientes com tumor colorretal. Em pacientes com câncer, o estado nutricional pode estar associado à localização do tumor, ao estadiamento e ao tipo de tratamento oncológico. Assim, a desnutrição é uma condição frequente em pacientes com câncer do trato gastrointestinal, sendo sua ocorrência maior comparada aos demais tipos de câncer22 e pode afetar até 80% dos pacientes com câncer trato gastrointestinal superior, em virtude da má absorção, obstrução intestinal, terapias de ressecção cirúrgica e tratamento sistêmico26-28.
Além disso, o grupo de pacientes com câncer do trato gastrointestinal alto apresentava maior ocorrência de IMME <1 tercil comparado ao grupo de câncer de colorretal (60% versus 40%; p<0,05), porém os dois grupos apresentavam a mesma ocorrência de RME <1 tercil (50%). McGovern et al.29 encontraram semelhante redução na RME para tumores de intestino, esôfago e pâncreas (52%, 54% e 55%, respectivamente). No entanto, pacientes com tumor de estômago apresentaram ocorrência maior (71%)29. Em paralelo, a redução do IMME para tumores do trato gastrointestinal alto foi inferior à encontrada neste estudo (esôfago: 49%, estômago: 35% e pâncreas: 32%)28. Murnane et al.30 encontraram 56% da redução do IMME em pacientes submetidos à ressecção radical de esôfago e estômago. Por outro lado, Carvalho et al.31 não encontraram diferenças estatísticas na ocorrência de redução de IMME para os tumores colorretal e gástrico em pacientes submetidos à cirurgia (20% e 13%, respectivamente)31.
No câncer, a baixa massa muscular é resultado do estado pró-inflamatório oriundo da própria doença, que propicia redução da síntese proteica e maior degradação de proteínas, além do aumento do gasto energético, podendo ou não estar associado à diminuição da ingestão alimentar32,33. Estudos demonstram que as citocinas inflamatórias derivadas do tumor estão envolvidas na patogênese da sarcopenia34-37. Apesar da infiltração de gordura no músculo, conhecida como mioesteatose, e da depleção da massa muscular representarem fenótipos clínicos distintos37,38, quando ocorrem concomitantemente, podem levar a um pior desfecho37,39,40.
Neste estudo, observou-se que mais da metade da amostra apresentava IMC classificado como peso adequado/eutrofia. Um estudo com idosos submetidos à cirurgia de ressecção de tumores gastrointestinais também encontrou maior ocorrência do estado de eutrofia, seguido de excesso de peso5. Por outro lado, observou-se que 56% apresentam risco de desnutrição ou desnutrição, segundo a ASG-PPP. A ASG-PPP inclui sintomas que podem afetar a ingestão alimentar, além de outros fatores que se relacionam ao risco de desnutrição, mesmo que não haja mudanças significativas no estado nutricional segundo o IMC41.
A aferição do peso corporal e o cálculo do IMC são comumente usados na prática clínica, porém essas medidas não fornecem informações sobre as contribuições relativas da massa gorda e massa muscular ou mudanças nesses compartimentos que podem refletir o real estado nutricional do indivíduo42. Além da avaliação da massa muscular, estudos apontam a relevância do diagnóstico da sarcopenia nesse grupo de pacientes. Nesse sentido, um estudo transversal realizado com 21 pacientes submetidos à gastrectomia verificou que a baixa massa muscular foi encontrada em 100% da amostra, no entanto, apenas uma paciente apresentava sarcopenia43. O que se assemelha ao presente estudo em que apenas três pacientes apresentaram sarcopenia, evidenciando que, em grande parte desta amostra, a redução da força e da massa muscular não foram concomitantes.
É amplamente descrita na literatura a estreita relação entre a massa muscular e os desfechos clínicos no contexto da oncologia44,45. Porém, são escassos os estudos que avaliam todas as variáveis necessárias para diagnóstico da sarcopenia como sugere o Consenso de Sarcopenia (força, massa e radiodensidade muscular). A avaliação da força muscular é considerada como primeiro critério para avaliação da sarcopenia, destacando sua importância8. Em um estudo brasileiro, foi observado que 22,6% dos pacientes com câncer colorretal apresentaram baixa força muscular46. Além disso, a baixa força muscular tem se mostrado como um fator de risco independente para complicações pós-operatórias47-49. Um estudo que avalia sarcopenia em pacientes com câncer gástrico submetidos à cirurgia encontrou prevalência de baixa FPM de 32% e de sarcopenia de 68%, assim como a associação entre sarcopenia e complicações pós-operatórias e sobrevida15.
O presente estudo tem algumas limitações. Primeiro, não foi possível obter a TC de todos os pacientes, uma vez que se trata de um método de conveniência utilizado para diagnóstico e estadiamento do câncer. Parte da amostra não possuía o exame no período estabelecido para análise de no máximo 30 dias pré-consulta ambulatorial, o que pode ter comprometido os resultados do diagnóstico de sarcopenia da amostra. Em segundo lugar, é importante considerar a heterogeneidade da amostra que, apesar de envolver apenas tumores do trato gastrointestinal, englobou tumores de pâncreas, estômago, esôfago e colorretal, que possuem características distintas que podem impactar o estado nutricional. No entanto, vale ressaltar que este trabalho apresentou um número amostral reduzido inviabilizando a estratificação por sítios tumorais específicos, como tumores de estômago, pâncreas e esôfago. Por conseguinte, foi necessário agrupá-los sob categoria de tumores gastrointestinal alto para permitir comparações adequadas do estado nutricional, IMME e RME entre os diferentes tipos de tumores. Dessa forma é importante destacar que esses achados não devem ser extrapolados para toda população.
CONCLUSÃO
Houve maior ocorrência da redução de massa muscular e do baixo peso no grupo de pacientes com tumores do trato gastrointestinal alto em comparação ao grupo de tumor colorretal. Assim, tais achados são úteis na identificação dos tipos de tumor que podem acarretar um maior comprometimento do estado nutricional no intuito de se iniciar uma intervenção nutricional precoce. É importante salientar que são necessários mais estudos para confirmação dos resultados. Além disso, faz-se mister estudos longitudinais capazes de avaliar o impacto cirúrgico na composição corporal, contribuindo para o desenvolvimento de estratégias nutricionais personalizadas que favoreçam melhores desfechos clínicos.
AGRADECIMENTOS
À Emanuelle Silva Russell e à Leticia Cardoso Lemos pela valiosa contribuição na aquisição de dados.
CONTRIBUIÇÕES
Juliane Alves da Silva, Viviane Dias Rodrigues e Nilian Carla Souza contribuíram na elaboração e/ou planejamento do estudo; na coleta, análise e/ou interpretação dos dados; na redação e/ou revisão crítica. Renata Brum Martucci contribuiu na elaboração e/ou planejamento do estudo; na redação e/ou revisão crítica. Andresa Couto e Aline Barcellos Barreto contribuiu na coleta, análise e/ou interpretação dos dados; na redação e/ou revisão crítica. Todas as autoras aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-63. doi: https://doi.org/10.3322/caac.21834
2. Santos MO, Lima FCS, Martins LFL, et al. Estimativa de incidência de câncer no Brasil, 2023-2025. Rev Bras Cancerol. 2023;69(1):e-213700. doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n1.3700
3. Arens J, Baracos V, Bertz H, et al. ESPEN expert group recommendations for action against cancer-related malnutrition. Clin nutr. 2017;36(5):1187-96.
4. Pinho NB, Martucci RB, Rodrigues VD, et al. High prevalence of malnutrition and nutrition impact symptoms in older patients with cancer: results of Brazilian multicenter study. Cancer. 2020;126(1):156-64.
5. Scislo L, Bodys-Cu´pak I, Walewska E, et al. Nutritional status indicators as predictors of postoperative complications in the elderly with gastrointestinal cancer. Int J Environ Res Public Health. 2022;19(20):1-14.
6. Sathianathen NJ, Kwaan M, Lawrentschuk N, et al. Adverse impact of malnutrition markers on major abdominopelvic cancer surgery. ANZ J Surg. 2019;89(5):509-14.
7. Cruz-Jentoft AJ, Gonzalez MC, Prado CM. Sarcopenia ≠ low muscle mass. Eur Geriatr Med. 2023;14(2):225-8. doi: https://doi.org/10.1007/s41999-023-00760-7
8. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised european consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. doi: https://doi.org/10.1093/ageing/afy169
9. Knoedler S, Schliermann R, Knoedler L, et al. Impact of sarcopenia on outcomes in surgical patients: a systematic review and meta-analysis. Int J Surg. 2023;109(12):4238-62. doi: https://doi.org/10.1097/JS9.0000000000000688
10. Zhang S, Tan S, Jiang Y, et al. Sarcopenia as a predictor of poor surgical and oncologic outcomes after abdominal surgery for digestive tract cancer: a prospective cohort study. Clin Nutr. 2019;38(6):2881-8. doi: https://doi.org/10.1016/j.clnu.2018.12.025
11. Alnimri F, Sivakumar J, Sutherland T, et al. Pre-operative low muscle mass is associated with major complications and lower recurrence-free survival after gastric cancer surgery. ANZ J Surg. 2021;91(3):316-22.
12. Sakurai K, Kubo N, Tamura T, et al. Adverse Effects of low preoperative skeletal muscle mass in patients undergoing gastrectomy for gastric cancer. Ann Surg Oncol. 2017;24(9):2712-9.
13. Oken MM, Creech RH, Tormey DC, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982;5(6):649-55.
14. Ottery FD. Definition of standardized nutritional assessment and interventional pathways in oncology. Nutrition. 1996;12(Suppl.1):15-9.
15. Huang DD, Cai Hy, Wang WB, et al. Measurement of muscle quantity/quality has additional predictive value for postoperative complications and long-term survival after gastrectomy for gastric cancer in patients with probable sarcopenia as defined by the nem EWGSOP2 consensus: analysis from a large scale prospective study. Nutrition. 2021;86:111156. doi: https://doi.org/10.1016/j.nut.2021.111156
16. Zhuang CL, Shen X, Zou HB, et al. EWGSOP2 versus EWGSOP1 for sarcopenia to predict prognosis in patients with gastric cancer after radical gastrectomy: analysis from a large-scale prospective study. Clin Nutr. 2020;39(7):2301-10.
17. Bossi P, Delrio P, Mascheroni A, et al. The spectrum of malnutrition/cachexia/sarcopenia in oncology according to different cancer types and settings: a narrative review. Nutrients. 2021;13(6):1-16.
18. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
19. Jager-Wittenaar H, Ottery FD. Assessing nutritional status in cancer: role of the Patient-Generated Subjective Global Assessment. Curr Opin Clin Nutr Metab Care. 2017;20(5):322-9.
20. World Health Organization. Physical status the use and interpretation of anthopometry. Geneva: WHO Library Cataloguing; 1995.
21. Organización Panamericana de la Salud. Encuesta Multicéntrica Salud Bienestar y Envejecimiento (SABE) en América Latina y el Caribe: informe preliminar. 36ª Reunión del Comité Asesor de Investigaciones en Salud; 9 -11 jul 2001; Kingston; Washington, D.C: OPAS: 2001.
22. Mourtzakis M, Prado CMM, Lieffers JR, et al. A practical and precise approach to quantification of body composition in cancer patients using computed tomography images acquired during routine care. Appl Physiol Nutr Metab. 2008;33(5):997-1006.
23. sliceOmatic [Internet]. Versão 5. Magog: TomoVision; 2021. [acesso 2024 jan 20]. Disponível em: https://www.tomovision.com/download/download_sliceo.html
24. SPSS®: Statistical Package for Social Science (SPSS) [Internet]. Versão 21. [Nova York]. International Business Machines Corporation. [acesso 2023 mar 9]. Disponível em: https://www.ibm.com/br-pt/spss?utm_content=SRCWW&p1=Search&p4=43700077515785492&p5=p&gclid=CjwKCAjwgZCoBhBnEiwAz35Rwiltb7s14pOSLocnooMOQh9qAL59IHVc9WP4ixhNTVMjenRp3-aEgxoCubsQAvD_BwE&gclsrc=aw.ds
25. Leotti VB, Birck AR, Riboldi J. Comparação dos Testes de Aderência à Normalidade Kolmogorov-smirnov, Anderson-Darling, Cramer–Von Mises e Shapiro-Wilk por Simulação. In: 11º Simpósio de Estatística Aplicada à Experimentação Agronômica; 2005 jul 4-8; Londrina (PR). Florianópolis (SC): UFSC; 2005. p. 192
26. Silva TGB. Prevalência de sarcopenia em idosos não-institucionalizados de uma cidade brasileira de médio porte [dissertação]. Pelotas: Universidade Federal de Pelotas; 2014. 163 p.
27. Mulazzani GEG, Corti F, Valle S Della, et al. Nutritional support indications in gastroesophageal cancer patients: from perioperative to palliative systemic therapy. a comprehensive review of the last decade. Nutrients. 2021;13(8):2766. doi: https://doi.org/10.3390/nu13082766
28. Klassen D, Strauch C, Alteheld B, et al. Assessing the effects of a perioperative nutritional support and counseling in gastrointestinal cancer patients: a retrospective comparative study with historical controls. Biomedicines. 2023;11(2):609. doi: https://doi.org/10.3390/biomedicines11020609
29. McGovern J, Dolan RD, Horgan PG, et al. Computed tomography-defined low skeletal muscle index and density in cancer patients: observations from a systematic review. J Cachexia Sarcopenia Muscle. 2021;12(6):1408-17.
30. Murnane LC, Forsyth AK, Koukounaras J, et al. Myosteatosis predicts higher complications and reduced overall survival following radical oesophageal and gastric cancer surgery. Eur J Surg Oncol. 2021;47(9):2295-303. doi: https://doi.org/10.1016/j.ejso.2021.02.008
31. Carvalho ALM, Gonzalez MC, Sousa IM, et al. Low skeletal muscle radiodensity is the best predictor for short-term major surgical complications in gastrointestinal surgical cancer: a cohort study. PLoS One. 2021;16(2):0247322.
Ryan AM, Prado CM, Sullivan ES, et al. Effects of weight loss and sarcopenia on response to chemotherapy, quality of life, and survival. Nutrition. 2019;67-68:110539. doi: https://doi.org/10.1016/j.nut.2019.06.020
32. Daly LE, Ní Bhuachalla ÉB, Power DG, et al. Loss of skeletal muscle during systemic chemotherapy is prognostic of poor survival in patients with foregut cancer. J Cachexia Sarcopenia Muscle. 2018;9(2):315-25. doi: https://doi.org/10.1002/jcsm.12267
33. Malietzis G, Johns N, Al-Hassi HO, et al. Low muscularity and myosteatosis is related to the host systemic inflammator y response in patients undergoing surger y for colorectal cancer. Ann Surg. 2016;263(2):320-5.
34. Okugawa Y, Kitajima T, Yamamoto A, et al. Clinical relevance of myopenia and myosteatosis in colorectal cancer. J Clin Med. 2022;11(9):2617.
35. Aro R, Meriläinen S, Sirniö P, et al. Sarcopenia and myosteatosis are associated with neutrophil to lymphocyte ratio but not glasgow prognostic score in colorectal cancer patients. J Clin Med. 2022;11(2656):1-16.
36. McGregor RA, Cameron-Smith D, Poppitt SD. It is not just muscle mass: a review of muscle quality, composition and metabolism during ageing as determinants of muscle function and mobility in later life. Longev Heal. 2014;3(1):1-8. doi: http://dx.doi.org/10.1186/2046-2395-3-9.
37. Stretch C, Aubin JM, Mickiewicz B, et al. Sarcopenia and myosteatosis are accompanied by distinct biological profiles in patients with pancreatic and periampullary adenocarcinomas. PLoS One. 2018;13(5):1-17.
38. Martin L, Birdsell L, MacDonald N, et al. Cancer cachexia in the age of obesity: Skeletal muscle depletion is a powerful prognostic factor, independent of body mass index. J Clin Oncol. 2013;31(12):1539-47.
39. Tian J, Yuan X, Xiao J, et al. Clinical characteristics and risk factors associated with COVID-19 disease severity in patients with cancer in Wuhan, China: a multicentre, retrospective, cohort study. Lancet Oncol. 2020;21(7):893-903. doi: http://dx.doi.org/10.1016/S1470-2045(20)30309-0
40. Ishida T, Makino T, Yamasaki M, et al. Quantity and quality of skeletal muscle as an important predictor of clinical outcomes in patients with esophageal cancer undergoing esophagectomy after neoadjuvant chemotherapy. Ann Surg Oncol. 2021;28(12):7185-95. doi: https://doi.org/10.1245/s10434-021-10025-x
41. Shibutani M, Kashiwagi S, Fukuoka T, et al. Impact of preoperative nutritional status on long-term survival in patients with stage i-iii colorectal cancer. In Vivo. 2023;37(4):1765-74.
42. Jager-Wittenaar H, Ottery FD. Assessing nutritional status in cancer: role of the patient-Generated Subjective Global Assessment. Curr Opin Clin Nutr Metab Care. 2017;20(5):322-9.
43. Holmes CJ, Racette SB. The utility of body composition assessment in nutrition and clinical practice: an overview of current methodology. Nutrients. 2021;13(8):1-16.
44. Gharagozlian S, Mala T, Brekke HK, et al. Nutritional status, sarcopenia, gastrointestinal symptoms and quality of life after gastrectomy for cancer – a cross-sectional pilot study. Clin Nutr ESPEN. 2020;37:195-201. doi: https://doi.org/10.1016/j.clnesp.2020.03.001
45. Xia L, Zhao R, Wan Q, et al. Sarcopenia and adverse health-related outcomes: An umbrella review of meta-analyses of observational studies. Cancer Med. 2020;9(21):7964-78.
46. Shirdel M, Andersson F, Myte R, et al. Body composition measured by computed tomography is associated with colorectal cancer survival, also in early-stage disease. Acta Oncol (Madr). 2020;59(7):799-808. disponível em: https://doi.org/10.1080/0284186X.2020.1744716
47. Nunes GD, Cardenas LZ, Miola TM, et al. Preoperative evaluation of sarcopenia in patients with colorectal cancer: a prospective study. Rev Assoc Med Bras. 2023;69(2):222-7.
48. Jiang X, Xu X, Ding L, et al. Preoperative low absolute and relative handgrip strength as predictors of postoperative short-term outcomes: a prospective study based on patients aged 60 years and older with gastric cancer. Eur Geriatr Med. 2023;14(2):251-62. doi: https://doi.org/10.1007/s41999-023-00768-z
Recebido em 13/3/2024
Aprovado em 20/5/2024
Editora-associada: Lívia Costa de Oliveira. Orcid iD: https://orcid.org/0000-0002-5052-1846
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.