ARTIGO ORIGINAL
Atividade Física e Capacidade Funcional de Pacientes com Câncer de Mama: Estudo de Coorte Prospectivo
Physical Activity and Functional Capacity of Breast Cancer Patients: Prospective Cohort Study
Actividad Física y Capacidad Funcional de Pacientes con Cáncer de Mama: Estudio de Cohorte Prospectivo
https://doi.org/10.32635/2176-9745.RBC.2024v70n3.4635
Natasha Catalano Silva1; Clarice Gomes Chagas Teodózio2; Suzana Sales de Aguiar3; Maurício San’Anna Junior4; Luiz Claudio Santos Thuler5; Anke Bergmann6
1Instituto Nacional de Câncer (INCA). Instituto Federal de Educação, Ciência e Tecnologia Rio de Janeiro (IFRJ). Rio de Janeiro (RJ), Brasil. E-mail: natasha_catalano0@hotmail.com. Orcid iD: https://orcid.org/0000-0003-1967-100X
2,3,5,6INCA, Coordenação de Pesquisa Clínica, Divisão de Pesquisa Clínica e Desenvolvimento Tecnológico. Rio de Janeiro (RJ), Brasil. E-mail: clarice_chagas@hotmail.com; saguiar@inca.gov.br; lthuler@inca.gov.br; abergmann@inca.gov.br. Orcid iD: https://orcid.org/0000-0002-7029-2198; Orcid iD: https://orcidorg/0000-0003-1963-1294; Orcid iD: https://orcid.org/0000-0003-2550-6537; Orcid iD: https://orcid.org/0000-0002-1972-8777
4IFRJ, Faculdade de Fisioterapia. Rio de Janeiro (RJ), Brasil. E-mail: mauricio.junior@ifrj.edu.br. Orcid iD: https://orcid.org/0000-0002-0705-8841
Endereço para correspondência: Anke Bergmann. Rua André Cavalcanti, 37 - sala 9 (anexo) – Centro. Rio de Janeiro (RJ), Brasil. CEP 20231-050. E-mail: abergmann@inca.gov.br
RESUMO
Introdução: Mulheres com câncer de mama podem apresentar diminuição da aptidão física, fadiga e fraqueza muscular após tratamento oncológico. Objetivo: Analisar alteração no nível de atividade física (AF) e na capacidade funcional de pacientes entre diagnóstico do câncer de mama e após tratamento cirúrgico. Método: Estudo de coorte prospectivo incluindo mulheres com indicação de cirurgia curativa para câncer de mama. As pacientes foram avaliadas no início do estudo e após cirurgia do câncer de mama. Para avaliar AF autorreferida, foi utilizado o IPAQ, e a capacidade funcional foi aferida mediante três testes físicos: teste de sentar e levantar de 30 segundos, marcha estacionária de dois minutos e força de preensão palmar (FPP). O teste de Wilcoxon comparou as variáveis pré e pós-cirurgia e o D de Cohen, o tamanho do efeito. Resultados: Foram incluídas 655 mulheres, a maioria na faixa etária ≤59 anos (62,9%), 49,6% em estadiamento clínico avançado (≥IIB), e 48,9% foram submetidas à cirurgia como primeiro tratamento oncológico. Após tratamento cirúrgico, houve redução dos níveis de AF total, caminhada, AF de intensidade moderada (p < 0,001 e D de Cohen = 0,31; 0,50; 0,15, respectivamente), e da FPP (p < 0,001; D de Cohen = 0,38). Foi observado aumento do desempenho da capacidade aeróbica e resistência de MMII (p < 0,001 em ambos os testes, D de Cohen = 0,23 e 0,39, respectivamente). Conclusão: As pacientes apresentaram aumento nos níveis de capacidade aeróbica e resistência de MMII. Entretanto, tiveram redução da FPP e diminuição nos níveis de AF de caminhada.
Palavras-chave: Neoplasias de Mama/cirurgia; Estado Funcional; Aptidão Física; Teste de Esforço.
Introduction: Women with breast cancer may experience a decrease in physical fitness, fatigue, and muscle weakness after oncological treatment. Objective: To analyze changes in the level of physical activity (PA) and functional capacity of patients since the diagnosis of breast cancer and after surgical treatment. Method: Prospective cohort study including women with indication of curative surgery for breast cancer. Patients were assessed at the beginning of the study and after breast cancer surgery. To assess self-reported PA, the IPAQ was used, and functional capacity was measured using three physical tests: a 30-second sit-to-stand test, a two-minute stationary walk, and handgrip strength. The comparison of variables before and after surgical treatment was performed using the Wilcoxon test, and the effect size was evaluated using Cohen's D. Results: A total of 655 women were included, with the majority in the age range ≤ 59 years old (62.9%), 49.6% with advanced clinical stage ≥ IIB, and 48.9% undergoing surgery as their first oncological treatment. After surgical treatment, there was a reduction in the level of total PA, walking, and moderate intensity PA (p < 0.001 and Cohen's D = 0.31; 0.50; 0.15, respectively), as well as handgrip strength (p < 0.001; Cohen's D = 0.38). An increase in aerobic capacity and lower limb resistance performance was observed (p < 0.001 in both tests, Cohen's D = 0.23 and 0.39, respectively). Conclusion: Breast cancer patients showed an increase in aerobic capacity and lower limb resistance. However, they experienced a reduction in handgrip strength and a significant decrease in PA levels, particularly in walking, with a substantial impact on their physical well-being.
Key words: Breast Neoplasms/surgery; Functional Status; Physical Fitness, Exercice Test.
RESUMEN
Introducción: Las mujeres con cáncer de mama pueden experimentar una disminución de la aptitud física, fatiga y debilidad muscular después del tratamiento oncológico. Objetivo: Analizar los cambios en el nivel de actividad física (AF) y la capacidad funcional de las pacientes entre el diagnóstico de cáncer de mama y después del tratamiento quirúrgico. Método: Estudio de cohorte prospectivo que incluyó a mujeres con indicación de cirugía curativa para el cáncer de mama. Las pacientes fueron evaluadas al inicio del estudio y después de la cirugía de cáncer de mama. Para evaluar la AF autorreportada, se utilizó el IPAQ y se midió la capacidad funcional mediante tres pruebas físicas: una prueba de sentarse y levantarse durante 30 segundos, una caminata estacionaria de dos minutos y la fuerza de agarre manual (FAM). La prueba de Wilcoxon comparó las variables pre e poscirurgía, y la prueba D de Cohen, el tamaño del efecto. Resultados: Se incluyeron 655 mujeres, la mayoría menores de 60 años (62,9%), el 49,6% con un estadio clínico avanzado ≥ IIB y el 48,9% sometidas a cirugía como primer tratamiento oncológico. Después del tratamiento quirúrgico, se observó una reducción en los niveles de AF total, de caminata y AF de intensidad moderada (p < 0,001 y D de Cohen = 0,31; 0,50; 0,15, respectivamente), así como en la FAM (p < 0,001; D de Cohen = 0,38). Se observó un aumento en el rendimiento de la capacidad aeróbica y la resistencia de las extremidades inferiores (p < 0,001 en ambas pruebas, D de Cohen = 0,23 y 0,39, respectivamente). Conclusión: Las pacientes con cáncer de mama mostraron un aumento en la capacidad aeróbica y la resistencia de las extremidades inferiores. Sin embargo, experimentaron una reducción en la FAM y una disminución significativa en los niveles de AF, especialmente en la caminata, con un impacto sustancial en su bienestar físico.
Palabras clave: Neoplasias de la Mama/cirugía; Estado Funcional; Aptitud Física; Prueba de Esfuerzo.
O câncer de mama é a neoplasia maligna com maior incidência entre as mulheres, com exceção dos tumores de pele não melanoma, em todas as Regiões do Brasil e do mundo1. De acordo com as estimativas do Global Cancer Observatory (Globocan), elaborada pela International Agency for Research on Cancer (Iarc), em 2022, foram registrados 2,3 milhões de novos casos de câncer de mama em todo o mundo2. No Brasil, estimam-se, para cada ano do triênio 2023-2025, 73.610 mil novos casos de câncer de mama3.
Em 2022, foram registrados 665.684 óbitos por câncer de mama em mulheres, sendo a principal causa de morte por câncer na população feminina1,4. A mortalidade está diretamente associada ao estádio em que o tumor é diagnosticado e ao tipo de tratamento oferecido2,4.
O tratamento do câncer de mama pode ser dividido em duas modalidades, tratamento local que consiste em cirurgia e radioterapia, e tratamento sistêmico como quimioterapia, hormonioterapia e terapia biológica5. Em decorrência da agressividade da doença e do tratamento, podem ocorrer alguns efeitos adversos como disfunção cardíaca, perda de peso, perda óssea, linfedema, artralgias, fadiga, disfunção cognitiva, além de recorrência do câncer de mama ou metástase5-8. Tais circunstâncias podem levar ao comprometimento da qualidade de vida dessas mulheres durante um longo período ou até para a vida inteira, o que acaba afetando diretamente a capacidade da mulher nas atividades de vida diária e profissional7,8.
De acordo com a Organização Mundial da Saúde (OMS), a atividade física (AF) pode ser definida como o “Movimento corporal produzido pela contração dos músculos esqueléticos que resultam em gasto energético maior do que em repouso”9. É recomendado que adultos com idade entre 18 e 64 anos realizem pelo menos de 150 a 300 minutos de AF aeróbica de intensidade moderada, ou de 75 a 150 minutos de AF aeróbica de intensidade vigorosa9. No Brasil, segundo dados do Instituto Brasileiro de Geografia e Estatística (IBGE), 40,3% da população adulta estão classificados na condição de insuficientemente ativos, e 47,5% da população feminina foi considerada insuficientemente ativa10.
Muitos estudos têm apoiado e evidenciado a associação da prática de AF regular com a diminuição do risco de câncer e sua mortalidade6,11,12. A AF e a capacidade funcional são variáveis modificáveis no ser humano, e mostram efeitos positivos na diminuição dos sintomas, na resposta ao tratamento oncológico, na qualidade de vida e na sobrevida em mulheres com câncer de mama9. Este estudo busca analisar os níveis de AF em diversas categorias, como trabalho, transporte, doméstico e lazer, e o nível de capacidade funcional de pacientes com câncer de mama ao diagnóstico e um a quatro anos após o tratamento cirúrgico.
MÉTODO
Foi realizado um estudo de coorte prospectivo de mulheres com diagnóstico de câncer de mama (10ª revisão da Classificação Estatística Internacional de Doenças e Problemas Relacionados com a Saúde – CID-1013 (C50)), com idade igual ou superior a 18 anos, com indicação de cirurgia curativa para o câncer de mama, no Hospital do Câncer III do Instituto Nacional de Câncer (HC III/INCA), no período de 4 de abril de 2016 a 31 de outubro 2018. Este estudo faz parte do projeto “Influência da atividade física na qualidade de vida, complicações do tratamento e prognóstico de mulheres com câncer de mama matriculadas no HC III/INCA”.
Quanto aos critérios de exclusão do projeto original, foram excluídas as mulheres com história de câncer prévio, que utilizassem auxiliar de marcha e sem condições clínicas, psicológicas ou emocionais de responderem aos questionários. As pacientes que aceitaram participar do estudo assinaram o Termo de Consentimento Livre e Esclarecido (TCLE). O projeto possui aprovação pelo Comitê de Ética em Pesquisa (CEP) do INCA sob o parecer 1.400.320 (CAAE: 51100615.7.0000.5274), de acordo com a resolução 466/1214 do Conselho Nacional de Saúde.
A partir dessas mulheres, foram excluídas do presente estudo aquelas que não foram submetidas às avaliações de AF no momento da inclusão no estudo e um a quatro anos após a cirurgia para o câncer de mama. Além disso, seguindo as orientações do manual do Questionário Internacional de Atividade Física (IPAQ), as participantes que apresentaram mais do que 960 min/sem de AF também foram excluídas da análise15.
Foram utilizadas as avaliações realizadas com as pacientes na primeira consulta no serviço de oncologia clínica ou pré-operatório no serviço de mastologia e a partir de um ano após a cirurgia, sendo considerada a avaliação de um a quatro anos. Nos dois momentos, foram aplicados o IPAQ versão longa e três testes de capacidade funcional.
O IPAQ foi desenvolvido para uso internacional, e validado e traduzido para população brasileira16. O questionário tem como finalidade estimar o tempo de AF realizado durante a última semana ou de uma semana atípica. Analisando a prática de atividades no trabalho, meio de transporte, nas atividades domésticas e de lazer e o tempo gasto sentado, seu resultado pode ser categorizado em AF leve, moderada e alta13.
É importante registrar que pessoas classificadas pelo IPAQ como nível leve de AF são insuficientemente ativos, as com alto nível são suficientemente ativos, porém pessoas com nível moderado podem ser suficiente ou insuficientemente ativos segundo as recomendações da OMS9,15.
Para análise da capacidade funcional, foram utilizados os testes força de preensão palmar, marcha estacionária de dois minutos e sentar e levantar de 30 segundos, nessa ordem. Todos os testes seguiram as recomendações de padronização do Senior Fitness Test16.
O teste de marcha estacionária de dois minutos é uma forma alternativa do teste de caminhada de seis minutos e mensura a capacidade aeróbica do indivíduo. A paciente realizou o máximo de passos de forma estacionária durante dois minutos, sendo registrado o número de passos realizados16,17.
Para segurança da paciente, antes e após o teste da marcha estacionária de dois minutos, foram avaliadas a dispneia e a fadiga por meio da Escala Modificada de Borg, e a pressão arterial foi aferida por meio de um esfigmomanômetro digital. A saturação de oxigênio e a frequência cardíaca foram verificadas por um oxímetro de pulso16,17. Esses parâmetros possibilitaram contraindicar a realização dos testes, evitando expor as pacientes a possíveis intercorrências.
A força de preensão palmar, também utilizada como parâmetro de saúde global, foi aferida por meio do dinamômetro digital da marca Smedley Takei III (Yagami Co Ltd., Tokyo, Japan). A paciente foi orientada a realizar o máximo de força de preensão palmar três vezes, registrada em quilograma força (kgf), e foi utilizada a média dos três valores para análise18.
O teste de sentar e levantar de 30 segundos é utilizado para avaliar a resistência de membros inferiores (MMII). As pacientes foram orientadas a sentar-se e levantar-se em uma cadeira padronizada, com os braços na posição cruzada na altura do ombro. Ao comando do avaliador, as participantes realizaram o máximo de repetições de sentar-se e levantar-se da cadeira durante 30 segundos. Foi registrado o número total de execuções16.
Além de dados referentes à AF e à capacidade funcional, foram coletados dados sociodemográficos (idade, raça/cor da pele, estado conjugal, escolaridade, situação de trabalho ao diagnóstico, renda familiar, consumo de álcool nos últimos 30 dias e consumo de tabaco atual) e clínicos (hipertensão arterial, diabetes, índice de massa corpórea, status menopausal, estádio clínico e primeiro tratamento realizado) por meio de prontuário físico, eletrônico e da entrevista de inclusão para caracterização da população do estudo.
Foi realizada análise descritiva das características sociodemográficas e clínicas da população geral do estudo por meio das medidas de tendência central, dispersão e frequência. Foi utilizado o teste Kolmogorov-Sminorv para avaliar a normalidade da distribuição das variáveis analisadas. As variáveis não paramétricas foram apresentadas em mediana e amplitude mínima e máxima. Para comparação dessas variáveis, foi utilizado o teste de Wilcoxon e, para avaliar o tamanho do efeito, foi utilizado o D de Cohen. Segundo Cohen19, um efeito D = 0,10 a 0,29 é considerado pequeno, D = 0,30 a 0,49, médio e D = 0,50 a 1,0, grande. Foram considerados estatisticamente significantes valores de p < 0,05. O programa estatístico Statistical Package for Social Sciences (SPSS)20 versão 21.0 foi utilizado para as análises do estudo.
RESULTADOS
No estudo original, foram avaliadas 1.075 mulheres. Destas, não foram elegíveis 119, totalizando 956 pacientes. Porém, 301 participantes não obtiveram os dados sobre a AF autorreferida nos dois momentos da avaliação ou apresentavam mais do que 960 min/sem de AF autorreferida, sendo excluídas. Dessa forma, para o presente estudo, foram analisadas 655 pacientes. O número de participantes foi diferente em cada teste em razão de alguma contraindicação para realizar o teste, por exemplo, hipertensão arterial, queda de saturação periférica de oxigênio, dor, ou alguma indisposição física ou emocional no momento do teste, inviabilizando aplicação dos questionários e da avaliação física (Figura 1).
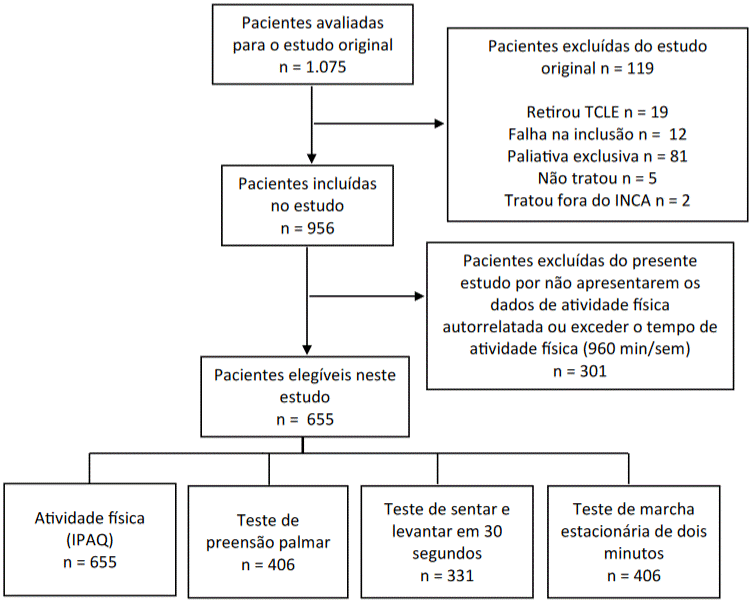
Figura 1. Fluxograma das participantes do estudo
A maioria da população do estudo tinha idade menor ou igual a 59 anos (62,9%), 64,0% das participantes declararam ter a cor de pele não branca e 50,5% não tinham companheiro no momento da entrevista. Em relação à escolaridade, 56,3% tinham mais de oito anos de estudo e 57,4% registraram não possuir vínculo empregatício formal. A maioria (74,0%) não consumira bebida alcoólica nos últimos 30 dias e 92,7% declararam que não fumavam ou haviam parado de fumar (Tabela 1).
No que se refere às características clínicas, 47,6% apresentavam hipertensão arterial, 17,9% eram diabéticas, 73,7% estavam com sobrepeso ou obesidade, 65,0% estavam na menopausa, 49,6% com estadiamento clínico avançado ≥ IIB, e o primeiro tratamento realizado de 48,9% foi a cirurgia (Tabela 2).
Tabela 1. Características sociodemográficas da população no início do estudo (n=655)
|
Variáveis |
n |
% |
|
Idade |
|
|
|
≤ 59 anos |
412 |
62,9 |
|
≥ 60 anos |
243 |
37,1 |
|
Raça/cor da pele |
|
|
|
Branca |
236 |
36,0 |
|
Não branca* |
419 |
64,0 |
|
Estado civil |
|
|
|
Com companheiro |
324 |
49,5 |
|
Sem companheiro |
331 |
50,5 |
|
Escolaridade |
|
|
|
< 8 anos de estudo |
286 |
43,7 |
|
≥ 8 anos de estudo |
369 |
56,3 |
|
Ocupação atual |
|
|
|
Sem atividade |
376 |
57,4 |
|
Em atividade |
275 |
42,0 |
|
Sem informação |
4 |
0,6 |
|
Consumo de álcool nos últimos 30 dias |
|
|
|
Sim |
168 |
25,7 |
|
Não |
485 |
74,0 |
|
Sem informação |
2 |
0,3 |
|
Consumo de tabaco atual |
|
|
|
Não fuma/parou de fumar |
607 |
93,0 |
|
Fuma todos os dias/alguns dias |
44 |
6,7 |
|
Sem informação |
4 |
0,3 |
(*) Não branca = parda, preta, indígena ou amarela.
Tabela 2. Características clínicas da população do estudo (n=655)
|
Variáveis |
n |
% |
|
Hipertensão arterial |
|
|
|
Sim |
312 |
47,6 |
|
Não |
341 |
52,1 |
|
Sem informação |
2 |
0,3 |
|
Diabetes |
|
|
|
Sim |
117 |
17,9 |
|
Não |
536 |
81,8 |
|
Sem informação |
2 |
0,3 |
|
Índice de massa corpórea |
|
|
|
Magreza |
9 |
1,4 |
|
Eutrófico |
145 |
22,1 |
|
Sobrepeso |
234 |
35,7 |
|
Obesidade |
249 |
38,0 |
|
Sem Informação |
18 |
2,7 |
|
Status menopausal |
|
|
|
Sim |
426 |
65,0 |
|
Não |
225 |
34,4 |
|
Não relatado |
4 |
0,6 |
|
Estadiamento clínico avançado |
|
|
|
< IIB |
317 |
48,4 |
|
≥ IIB |
325 |
49,6 |
|
Sem informação |
13 |
2,0 |
|
Primeiro tratamento realizado |
|
|
|
Quimioterapia neoadjuvante |
335 |
51,1 |
|
Cirurgia |
320 |
48,9 |
Em relação à avaliação do nível de AF antes e um a quatro anos após o tratamento cirúrgico, houve uma diminuição estatisticamente significante do nível de AF total, de caminhada e AF de intensidade moderada (p < 0,001; D de Cohen = 0,31; 0,50; 0,15, respectivamente). Apesar de ter apresentado um aumento nas atividades vigorosas (p < 0,001; D de Cohen = 0,15) e de lazer (p < 0,001; D de Cohen = 0,15) (Tabela 3).
Na avaliação do nível de capacidade funcional, identificou-se que as pacientes apresentaram aumento do desempenho da capacidade aeróbica e resistência de MMII após o tratamento cirúrgico (p < 0,001 em ambos os testes, D de Cohen = 0,23 e 0,39, respectivamente), embora tenham apresentado uma redução de força de preensão palmar após o tratamento cirúrgico (p < 0,001; D de Cohen = 0,38) (Tabela 3).
Tabela 3. Níveis de atividade física e capacidade funcional antes e após o tratamento cirúrgico
|
Variáveis |
Antes do tratamento cirúrgico |
Após o tratamento cirúrgico |
Tamanho do efeito |
p |
|
Mediana (mín.-máx.) |
Mediana (mín.-máx.) |
|||
|
Atividade física (IPAQ) MET-minutos/semana |
|
|
|
|
|
Total (n=655) |
2.790,0 (0,0 – 27.670,0) |
1.773,0 (33,0 – 25.819,4) |
0,31 |
< 0,001 |
|
Lazer (n=192) |
0,0 (0,0 – 7.695,0) |
792,0 (20,0 – 3.954,0) |
0,38 |
< 0,001 |
|
Trabalho (n=130) |
688,5 (0,0 – 26.190,0) |
776,0 (0,0 – 20.391,0) |
0,08 |
0,352 |
|
Doméstica (n=572) |
1.080,0 (0,0 – 18.430,0) |
960,0 (30,0 – 11.200,0) |
0,00 |
0,846 |
|
Transporte (n=513) |
396,0 (0,0 – 4.158,0) |
297,0 (33,0 – 6.237,0) |
0,07 |
0,107 |
|
Atividade moderada (n=585) |
1.695,0 (0,0 – 19.560,0) |
1.160,0 (30,0 – 16.037,0) |
0,15 |
< 0,001 |
|
Atividade vigorosa (n=48) |
0,0 (0,0 – 25.200,0) |
960,0 (120,0 – 20.160,0) |
0,15 |
< 0,001 |
|
Caminhada (n=551) |
660,0 (0,0 – 11.088,0) |
495,0 (33,0 – 13.662,0) |
0,50 |
< 0,001 |
|
Capacidade funcional |
Mediana (mín.-máx.) |
Mediana (mín.-máx.) |
|
|
|
Marcha estacionária (n=406) Passos |
87,3 (6,0 – 146,0) |
90,8 (6,5 – 175,0) |
0,23 |
< 0,001 |
|
Preensão palmar (n=582) Kgf |
21,2 (9,4 – 35,2) |
19,8 (3,8 – 32,3) |
0,38 |
< 0,001 |
|
Teste de sentar e levantar (n=331) Repetições |
12,0 (1,0 – 26,0) |
13,0 (5,0 – 30,0) |
0,39 |
< 0,001 |
Legendas: mín. = valor mínimo; máx. = valor máximo; tamanho do efeito – D de Cohen; IPAQ = Questionário Internacional de Atividade Física; MET = equivalente metabólico da tarefa.
DISCUSSÃO
Este estudo teve como objetivo avaliar os níveis de AF e a capacidade funcional de pacientes com câncer de mama ao diagnóstico e um a quatro anos após o tratamento cirúrgico. Foi identificado um aumento nos níveis de capacidade aeróbica e resistência de MMII, diminuição na força de preensão palmar e do nível de AF de caminhada.
Mazo et al.21 aplicaram a bateria de teste do Senior Fitness Test16 com o objetivo de desenvolver valores normativos para mulheres idosas saudáveis brasileiras na faixa etária de 60-69 anos que praticavam AF há pelo menos seis meses21. Esse teste classifica como muito boa a aptidão física de mulheres com idade de 60-69 anos que realizam pelo menos 12,5 repetições no teste de sentar e levantar. Em comparação ao presente estudo, pode-se observar que, apesar de a maioria das pacientes possuírem idade menor ou igual a 59 anos, elas mantiveram o número de repetições no teste de sentar e levantar similar ao encontrado (13,0 repetições) na população com faixa etária mais elevada.
De acordo com Rikli e Jones22, por questões fisiológicas, a aptidão física tende a declinar a partir dos 60 anos de idade. Nesse estudo, também foi possível identificar que a população feminina saudável com idade de 60-64 anos obteve uma média de 13,8 repetições no teste de sentar e levantar e uma média de 85,9 passos por minuto no teste de marcha estacionária de dois minutos. Esses dados foram similares aos encontrados no presente estudo cujas mulheres realizaram 13,0 repetições e 90,8 passos, respectivamente. O que sugere que a população do presente estudo, embora seja mais jovem, apresenta uma aptidão física similar à de uma população mais velha, o que pode ser preocupante.
Em um estudo observacional prospectivo com 79 mulheres com média de idade de 54,6 (±9,5) anos e que tiveram câncer de mama realizado por Grusdat et al.23 , avaliou-se a força de preensão palmar em três momentos: antes, uma semana após e três meses após o término do tratamento do câncer de mama. As pacientes desse estudo foram submetidas a quatro tipos de tratamento: cirurgia isolada, cirurgia e quimioterapia, cirurgia com quimioterapia e radioterapia, ou cirurgia e radioterapia. As médias da força de preensão palmar foram de 31,9 kgf, 28,0 kgf e 27,8 kgf respectivamente, sendo identificada uma redução da força de preensão palmar após o tratamento. Um estudo alemão com mulheres saudáveis e faixa etária entre 50 e 54 anos teve uma média de 32,5 kgf, e identificou que valores abaixo de 26,6 kgf eram considerados valores de risco para ter uma redução da função muscular24. Comparando os dois estudos citados anteriormente com o resultado do presente estudo, pode-se considerar que com uma mediana de força de preensão palmar de 19,8 (3,8-32,3) kgf as pacientes do presente estudo apresentam uma função muscular prejudicada desde o momento do diagnóstico até após o tratamento cirúrgico.
No estudo realizado por Ortiz et al.25, foram incluídas 89 sobreviventes de câncer de mama, do Texas e de Porto Rico, com média de idade de 55,5 anos (±10,0), que realizaram tratamento por pelo menos três meses e com comportamento sedentário (que não realizavam exercício físico de forma habitual). As pacientes incluídas obtiveram média de força de preensão palmar de 10,3 (±9,4) kgf, média de 11,60 (±3,1) repetições no teste de sentar e levantar, e apresentaram baixo nível de AF de intensidade moderada e vigorosa com uma média de 76,5 (±183,5) equivalente metabólico da tarefa (MET) min/sem no IPAQ. No presente estudo, foi identificada uma mediana de 19,8 (3,8-32,3) kgf de força de preensão palmar após o tratamento cirúrgico e, apesar de as pacientes terem apresentado diminuição da força, ainda alcançaram valor superior às pacientes do estudo de Ortiz et al.25. Ademais, o número de repetições no teste de sentar e levantar foi similar ao encontrado no presente estudo [13,0 (5,0-30,0) repetições]. Pode-se identificar também que as pacientes analisadas tiveram redução dos níveis de AF de intensidade moderada [ao diagnóstico: 1.695,0 (0,0-19.560,0) e após a cirurgia: 1.160,0 (30,0-16037,0)], entretanto, nesse período, houve melhora da AF de intensidade vigorosa [ao diagnóstico: 0,0 (0,0-25.200,0) e após a cirurgia: 960,0 (120,0-20.160,0)].
Zainordin et al.26, em um estudo transversal com 95 mulheres que completaram o tratamento oncológico há pelo menos seis meses, sendo 63 com câncer de mama e 32 com câncer ginecológico, identificaram que as mulheres com câncer de mama tinham média de idade de 51,2 (±6,9) anos, a maioria foi classificada como baixo nível de AF (74,6%) e nenhuma apresentou alto nível de AF, de acordo com o IPAQ. Além disso, quando avaliados os dois grupos juntos, foi identificado MET total médio de 403,5 (±332,7) min/sem. Apesar de os autores terem avaliado um grupo com mais de um tipo de câncer e esta pesquisa avaliado apenas mulheres com câncer de mama, o presente estudo mostrou um nível maior de AF ao diagnóstico e um a quatro anos após a cirurgia quando comparado ao encontrado por Zainordin et al.26.
No estudo realizado por Tami-Maury et al.27 nos Estados Unidos, foram incluídas 127 mulheres que concluíram o primeiro tratamento para o câncer de mama, podendo ser cirurgia, radioterapia, quimioterapia ou hormonioterapia. Essas mulheres foram submetidas a um protocolo de exercícios que durou três meses e consistiu em uma intervenção de 12 sessões de AF de intensidade moderada a alta. A média de idade da população foi de 59,6 (±10,7). Após a finalização do período do programa de exercício foi identificado que as mulheres apresentaram aumento da quantidade de tempo gasto em AF de intensidade moderada a vigorosa (172,8 vs. 344,6; p = 0,01), melhora do desempenho no teste de sentar e levantar [12,5 (±4,2) vs. 14,9 (±5,2); p = 0,01] e aumento da distância percorrida no teste de marcha estacionária de seis minutos (427,8 vs. 469,9; p = 0,01)27.
A implantação de um programa de exercício físico para mulheres submetidas ao tratamento para o câncer de mama apresenta impacto positivo na melhora da AF e da capacidade funcional dessas mulheres, podendo essa atividade ser incentivada nos centros de tratamento para o câncer de mama, a fim de que seja evitado o declínio desses domínios.
Os principais pontos fortes do presente estudo foram a inclusão de uma amostra robusta com 655 mulheres analisadas, o que estima um bom poder de estudo para análise dos resultados. Houve um período de duas semanas de treinamentos com a equipe do projeto a respeito da aplicação do IPAQ, testes físicos e a abordagem com as pacientes, e as fichas eram padronizadas, minimizando um possível viés de informação. As perguntas eram referentes aos dados atuais ou da semana anterior, minimizando um possível viés de memória das pacientes.
A principal limitação observada foi a contraindicação clínica, física ou emocional para realização dos testes funcionais que gerou um número de participantes diferente em cada teste, porém o tamanho amostral foi satisfatório. O questionário IPAQ avalia a AF em várias dimensões como lazer, trabalho, atividades domésticas e transporte. Apesar de ser uma avaliação subjetiva, esse é o instrumento mais utilizado para avaliação das dimensões da AF no dia a dia. Outra possível limitação do estudo foram as duas avaliações pontuais feitas com as pacientes em dois momentos específicos, não sendo possível saber se as pacientes iniciaram, mantiveram ou interromperam a realização de exercícios físicos entre as duas avaliações.
CONCLUSÃO
Foi observado que as pacientes tiveram um aumento nos níveis de capacidade aeróbica e resistência de MMII, redução da força de preensão palmar, e grande diminuição nos níveis de AF, especificamente na capacidade de caminhada, desde o momento do diagnóstico até um a quatro anos após a cirurgia de mulheres com câncer de mama tratadas no HC III/INCA. Esses achados destacam a importância de abordagens abrangentes para a reabilitação e o suporte físico dessas pacientes antes, durante e após o tratamento do câncer de mama, visando à manutenção de uma qualidade de vida adequada.
CONTRIBUIÇÕES
Natasha Catalano Silva contribuiu substancialmente na obtenção, análise e interpretação dos dados; e na redação. Clarice Gomes Chagas Teodózio e Maurício San’Anna Junior contribuíram substancialmente na análise e interpretação dos dados; e na revisão crítica. Suzana Sales de Aguiar, Luiz Claudio Santos Thuler e Anke Bergmann contribuíram na concepção e no planejamento do estudo; na análise dos dados; na redação e revisão crítica. Todos os autores aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
A autora Anke Bergmann declara potencial conflito de interesses pela condição de ser a editora-científica da Revista Brasileira de Cancerologia do INCA. Os demais autores não possuem conflito de interesses.
FONTES DE FINANCIAMENTO
Natasha Catalano Silva recebeu bolsa de iniciação científica pela Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (Faperj). Posteriormente, recebeu bolsa de iniciação científica pelo INCA para a realização deste estudo. Anke Bergmann e Luiz Claudio Santos Thuler recebem bolsa de produtividade em pesquisa (PQ) do Conselho Nacional de Produtividade e Pesquisa (CNPq).
REFERÊNCIAS
1. Instituto Nacional de Câncer [Internet]. Rio de Janeiro: INCA: [data desconhecida]. Conceito e Magnitude; 2022 set 16. [acesso 2024 jan 25]. Disponível em: https://www.gov.br/inca/pt-br/assuntos/gestor-e-profissional-de-saude/controle-do-cancer-de-mama/conceito-e-magnitude.
2. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-63. doi: https://doi.org/10.3322/caac.21834
3. Santos MO, Lima FCS, Martins LFL, et al. Estimativa de incidência de câncer no Brasil, 2023-2025. Rev Bras Cancerol. 2023;69(1):e-213700. doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n1.3700
4. Costa LDLN, Sardinha AHL, Verzaro PM, et al. Mortalidade por câncer de mama e condições de desenvolvimento humano no Brasil. Rev Bras Cancerol. 2023;65(1):e-12050. doi: https://doi.org/10.32635/2176-9745.RBC.2019v65n1.50
5. Instituto Nacional de Câncer [Internet]. Rio de Janeiro: INCA: [data desconhecida]. Tratamento; 2022 set 16. [atualizado em 2022 set 26; acesso 2024 jan 25] Disponível em: https://www.gov.br/inca/pt-br/assuntos/gestor-e-profissional-de-saude/controle-do-cancer-de-mama/acoes/tratamento
6. Seixas RJ, Kessler A, Frison VB. Atividade física e qualidade de vida em pacientes oncológicos durante o período de tratamento quimioterápico. Rev Bras Cancerol. 2010;56(3):321-30. doi: https://doi.org/10.32635/2176-9745.RBC.2010v56n3.1480
7. Diettrich S. Eficácia de um programa de atividade física nos níveis de fadiga em pacientes em tratamento de câncer de mama [dissertação]. Campo Grande: Universidade de Brasília, Programa Multi-instucional em Ciências da Saúde; 2007.
8. Ganz PA, Hahn EE. Implementing a survivorship care plan for patients with breast cancer. J Clin Oncol. 2008;26(5):759-67. doi: https://doi.org/10.1200/JCO.2007.14.2851
9. World Health Organization. Guidelines on physical activity and sedentary behaviour. Geneva: World Health Organization; 2020.
10. Instituto Brasileiro de Geografia e Estatística. Pesquisa nacional de saúde: 2019: percepção do estado de saúde, estilos de vida, doenças crônicas e saúde bucal: Brasil e grandes regiões. Rio de Janeiro: IBGE; 2020.
11. Dieli-Conwright CM, Courneya KS, Demark-Wahnefried W, et al. Aerobic and resistance exercise improves physical fitness, bone health, and quality of life in overweight and obese breast cancer survivors: a randomized controlled trial. Breast Cancer Res. 2018;20(1):124. doi: https://doi.org/10.1186/s13058-018-1051-6
12. Hiraoui M, Al-Haddabi B, Gmada N, et al. Effects of combined supervised intermittent aerobic, muscle strength and home-based walking training programs on cardiorespiratory responses in women with breast cancer. Bull Cancer. 2019;106(6):527-37. doi: https://doi.org/10.1016/j.bulcan.2019.03.014
13. Organização Mundial da Saúde. CID-10: Classificação Estatística Internacional de Doenças e problemas relacionados à saúde. São Paulo: Edusp; 2008.
14. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
15. Matsudo S, Araújo T, Matsudo V, et al. Questionário internacional de atividade física (IPAQ): estudo de validade e reprodutibilidade no Brasil. Rev Bras Ativ Fis Saúde. 2001;6(2):05-18. doi: https://doi.org/10.12820/rbafs.v.6n2p5-18
16. Rikli RE, Jones CJ. Functional fitness normative scores for community-residing adults, ages 60-94. JAPA. 1999;6:160-79.
17. Pedrosa R, Holanda G. Correlação entre os testes da caminhada, marcha estacionária e TUG em hipertensas idosas. Braz J Phys Ther 2009;13(3):252-6.
18. Oldervoll LM, Loge JH, Lydersen S, et al. Physical exercise for cancer patients with advanced disease: a randomized controlled trial. Oncologist. 2011;16(11):1649-57. doi: https://doi.org/10.1634/theoncologist.2011-0133
19. Cohen J. Statistical power analysis for the behavioral sciences 2. ed. Hillsdale: Lawrence Erlbaum Associates, Publishers; 1988.
20. SPSS®: Statistical Package for Social Science (SPSS) [Internet]. Versão 21.0. [Nova York]. International Business Machines Corporation. [acesso 2024 mar 9]. Disponível em: https://www.ibm.com/br-pt/spss?utm_content=SRCWW&p1=Search&p4=43700077515785492&p5=p&gclid=CjwKCAjwgZCoBhBnEiwAz35Rwiltb7s14pOSLocnooMOQh9qAL59IHVc9WP4ixhNTVMjenRp3-aEgxoCubsQAvD_BwE&gclsrc=aw.ds
21. Mazo GZ, Petreça DR; Sandreschi PF, et al. Normative values of physical fitness for Brazilian elderly woman aged 60-69 years. Rev Bras Med Esporte. 2015;21(4):318-22. doi: https://doi.org/10.1590/1517-869220152104134470
22. Rikli RE, Jones CJ. Development and validation of criterion-referenced clinically relevant fitness standards for maintaining physical independence in later years. Gerontologist. 2013;53(2):255-67. doi: https://doi.org/10.1093/geront/gns071
23. Grusdat NP, Stäuber A, Tolkmitt M, et al. Routine cancer treatments and their impact on physical function, symptoms of cancer-related fatigue, anxiety, and depression. Support Care Cancer. 2022;30(5):3733-44. doi: https://doi.org/10.1007/s00520-021-06787-5
24. Steiber N. Strong or weak handgrip? normative reference values for the german population across the life course stratified by sex, age, and body height. PLoS One. 2016;11(10):e0163917. doi: https://doi.org/10.1371/journal.pone.0163917
25. Ortiz A, Tirado M, Hughes DC, et al. Relationship between physical activity, disability, and physical fitness profile in sedentary latina breast cancer survivors. Physiother Theory Pract. 2018;34(10):783-94. doi: https://doi.org/10.1080/09593985.2018.1424978
26. Zainordin NH, Karim NA, Shahril MR, et al. Physical activity, sitting time, and quality of life among breast and gynaecology cancer survivors. Asian Pac J Cancer Prev. 2021;22(8):2399-408. doi: https://doi.org/10.31557/APJCP.2021.22.8.2399
27. Tami-Maury IM, Liao Y, Rangel ML, et al. Active living after cancer: adaptation and evaluation of a community-based physical activity program for minority and medically underserved breast cancer survivors. Cancer. 2022;128(2):353-63. doi: https://doi.org/10.1002/cncr.33904
Recebido em 18/3/2024
Aprovado em 11/6/2024
Editora-executiva: Letícia Casado. Orcid iD: https://orcid.org/0000-0001-5962-8765
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.