ARTIGO ORIGINAL
Avaliação da Hipossalivação e Xerostomia em Pacientes Oncológicos em Tratamento Quimioterápico
Assessment of Hyposalivation and Xerostomia in Cancer Patients Undergoing Chemotherapy Treatment
Evaluación de Hiposalivación y Xerostomía en Pacientes Oncológicos en Tratamiento de Quimioterapia
https://doi.org/10.32635/2176-9745.RBC.2024v70n2.4639
Cassius Kleberson Simões Diniz1; Marcos Diego Lima de Oliveira2; José Maria Chagas Viana Filho3
1-3Centro Universitário Uniesp. Cabedelo (PB), Brasil. E-mails: klebersom2010@hotmail.com; xmarcosdl@gmail.com; jose.viana@iesp.edu.br; Orcid iD: https://orcid.org/0009-0005-7021-0227; Orcid iD: https://orcid.org/0009-0009-4548-1120; Orcid iD: https://orcid.org/0000-0002-5922-1217
Endereço para correspondência: José Maria Chagas Viana Filho. Avenida Fernando Luiz Henrique dos Santos, 756, apto. 408 – Jardim Oceania. João Pessoa (PB), Brasil. CEP 58037-050. E-mail: jose.viana@iesp.edu.br
RESUMO
Introdução: Pacientes oncológicos tratados com quimioterapia apresentam efeitos adversos. Na boca, a hipossalivação e a xerostomia são relatadas como achados frequentes oriundos desse tratamento. Objetivo: Investigar a ocorrência de xerostomia e hipossalivação em pacientes oncológicos em tratamento quimioterápico. Método: Estudo transversal quantitativo, com coleta de dados realizada no Hospital São Vicente de Paulo, em João Pessoa, Paraíba, no setor de oncologia, entre agosto de 2022 e março de 2023. Os pacientes foram submetidos a um exame clínico, seguido da análise do fluxo salivar não estimulado e do preenchimento do instrumento Inventário de Xerostomia. Os dados foram analisados por meio de estatística descritiva e inferencial com auxílio do software Jamovi (versão 1.8.4). Resultados: Participaram do estudo 78 indivíduos com média de idade de 53 anos (±12,5), predominantemente do sexo feminino (n=63; 80,8%) e com diagnóstico de tumores sólidos (n=70; 89,7%). A hipossalivação foi diagnosticada em 59% dos pacientes (n=46), enquanto a xerostomia foi relatada por todos os indivíduos (n=78; 100%), sendo categorizada como amena (n=13; 16,7%) ou moderada (n=65; 83,3%). Houve diferença entre o fluxo salivar de pacientes com tumores sólidos e hematológicos, sendo os indivíduos com tumores sólidos os que apresentaram menor fluxo salivar (p = 0,0027, teste U de Mann-Whitney). Além disso, pessoas com hipossalivação possuem um risco aumentado de desenvolver xerostomia moderada (RR = 0,349; IC = 0,127 – 0,955; p = 0,006, teste Exato de Fisher). Conclusão: Indivíduos diagnosticados com hipossalivação neste estudo possuem risco aumentado de relatar a presença da xerostomia em graus moderados durante o tratamento quimioterápico.
Palavras-chave: Xerostomia/tratamento farmacológico; Saliva/efeitos dos fármacos; Antineoplásicos/efeitos adversos.
ABSTRACT
Introduction: Oncology patients undergoing chemotherapy experience adverse effects., Hyposalivation and xerostomia in the oral cavity are reported as frequent findings resulting from this treatment. Objective: To investigate the occurrence of xerostomia and hyposalivation in oncology patients undergoing chemotherapy. Method: Quantitative cross-sectional study, with data collection carried out at “Hospital São Vicente de Paula” in João Pessoa, Paraíba, in the oncology sector, between August 2022 and March 2023. Patients underwent a clinical examination, followed by analysis of unstimulated salivary flow and completion of the Xerostomia Inventory instrument. Data were analyzed using descriptive and inferential statistics with the assistance of Jamovi software (version 1.8.4). Results: A total of 78 individuals joined the study, with a mean age of 53 years (± 12.5), predominantly females (n=63; 80.8%), and diagnosed with solid tumors (n=70; 89.7%). Hyposalivation was diagnosed in 59% of the patients (n=46), while xerostomia was reported by all individuals (n=78; 100%), categorized as mild (n=13; 16.7%) or moderate (n=65; 83.3%). There was a difference in salivary flow between patients with solid and hematological tumors, with individuals with solid tumors showing lower salivary flow (p = 0.0027, Mann-Whitney U test). Additionally, individuals with hyposalivation have an increased risk of developing moderate xerostomia (RR = 0.349; CI = 0.127 – 0.955; p = 0.006, Fisher's Exact Test). Conclusion: Individuals diagnosed with hyposalivation in this study have an increased risk of reporting the presence of xerostomia in moderate degrees during chemotherapy treatment.
Key words: Xerostomia/drug therapy; Saliva/drug effects; Antineoplastic agents/adverse effects.
RESUMEN
Introducción: Los
pacientes oncológicos tratados con quimioterapia presentan efectos adversos. En
la boca, la hiposalivación y la xerostomía se informan como hallazgos frecuentes
derivados de este tratamiento. Objetivo: Investigar la ocurrencia
de xerostomía e hiposalivación en pacientes oncológicos bajo tratamiento
quimioterápico. Método: Estudio transversal cuantitativo, con la
recopilación de datos realizada en el Hospital São Vicente de Paulo, en João
Pessoa, Paraíba, en el sector de oncología, entre agosto de 2022 y marzo de
2023. Los pacientes fueron sometidos a un examen clínico, seguido del análisis
del flujo salival no estimulado y el llenado del instrumento Xerostomia
Inventory. Los datos fueron analizados mediante estadística descriptiva e
inferencial con la ayuda del software Jamovi (versión 1.8.4). Resultados:
Participaron en el estudio 78 individuos con un promedio de edad de 53 años
(±12,5), predominantemente de sexo femenino (n=63; 80,8%) y con diagnóstico de
tumores sólidos (n=70; 89,7%). La hiposalivación fue diagnosticada en el 59% de
los pacientes (n=46), mientras que la xerostomía fue informada por todos los individuos
(n=78; 100%), categorizándose como leve (n=13; 16,7%) o moderada (n=65; 83,3%).
Hubo diferencia entre el flujo salival de pacientes con tumores sólidos y
hematológicos, siendo los individuos con tumores sólidos los que presentaron
menor flujo salival (p = 0,0027, prueba U de Mann-Whitney). Además, las
personas con hiposalivación tienen un riesgo aumentado de desarrollar
xerostomía moderada (RR = 0,349; IC = 0,127 – 0,955; p = 0,006, prueba
Exacta de Fisher). Conclusión: Las personas diagnosticadas con
hiposalivación en este estudio tienen un mayor riesgo de informar la presencia
de xerostomía en grados moderados durante el tratamiento de quimioterapia.
Palabras clave: Xerostomía/tratamiento farmacológico; Saliva/efectos de los fármacos; Antineoplásicos/efectos adversos.
INTRODUÇÃO
O câncer é caracterizado por uma proliferação desordenada de células malignas, resultando em um descontrole no processo de divisão celular. Essa desregulação torna as células suscetíveis a múltiplas divisões, levando-as a se tornarem agressivas e incontroláveis, formando tumores1.
Além disso, o câncer é analisado em altas taxas de morbimortalidade global, representando um problema de saúde pública em todo o mundo. Segundo os dados de Bray et al.2, os números globais para 2022 revelaram a ocorrência de aproximadamente 20 milhões de novos casos de câncer e cerca de 10 milhões de mortes em virtude da doença, evidenciando uma progressão dos números. As projeções demográficas indicam que, em 2050, o número anual de novos casos de câncer deverá atingir 35 milhões, representando um aumento de 77% em relação aos níveis de 2022. De acordo com dados do Instituto Nacional de Câncer (INCA), foram estimados 704 mil novos casos de câncer para cada ano do triênio 2023-20253.
Os tratamentos convencionais para o câncer incluem cirurgia, radioterapia e quimioterapia, podendo ser utilizados isoladamente ou em combinação, sendo a quimioterapia o método mais comum. Os agentes antineoplásicos, destinados a combater as neoplasias, incluem drogas como: ciclofosfamida, cisplatina e oxicisplatina como alquilantes polifuncionais (impedindo a reprodução celular); citabarina, metorexato, flururacila, fludarabina, gencitabina, classificados como antimetabólitos, aqueles que interferem no metabolismo normal do paciente; e doxorrubicina, dactinomicina, daunorrubicina, como antibióticos antitumorais4.
Os agentes quimioterápicos causam efeitos adversos no corpo, uma vez que sua ação não se limita às células neoplásicas, afetando também tecidos saudáveis, especialmente aqueles com alta taxa de divisão celular5. Segundo Baig6, a quimioterapia apresenta como principais efeitos colaterais: anemia, alopecia, infecções, aumentos de sangramento, petéquias, mucosite oral, descontrole do pH do ambiente bucal, hipossalivação e xerostomia.
A xerostomia, conhecida como sensação de boca seca, pode ou não estar associada à hipossalivação, representando uma redução na produção de saliva. Esses efeitos da quimioterapia geralmente são transitórios, regredindo após os tratamentos, sendo denominados de efeitos agudos da terapia antineoplásica7.
A hipossalivação, por sua vez, é caracterizada pela redução do fluxo salivar, pode ser identificada clinicamente ou por meio da observação de sinais na mucosa oral, sendo o uso de medicamentos uma das principais causas4.
A saliva, produzida pelas glândulas salivares, é um fluido biológico crucial composto por água, eletrólitos, proteínas e cadeias de carboidratos, responsável pela manutenção do pH bucal, desempenhando um papel essencial na prevenção e no auxílio para o desenvolvimento de problemas bucais8,9. Além disso, possui propriedades como lubrificação, facilitação do paladar, digestão e mastigação, ação antimicrobiana, e funciona como um tampão eficaz para alimentos ácidos, inibindo a desmineralização dos dentes e os protegendo contra lesões cariosas10.
A princípio, o volume de produção salivar é aproximadamente 1ml/min, totalizando entre 1.000 e 1.500 ml por dia, sendo secretada de forma regular pelos sistemas endócrino e nervoso autônomo11.
A função salivar deficiente pode gerar diversos impactos negativos aos pacientes hospitalizados, sendo suscetíveis à presença de doença periodontal, cárie, cálculo dentário e dor9.
O teste de sialometria é um dos meios de diagnóstico da hipossalivação que permite identificar a diminuição do fluxo salivar. Enquanto, a xerostomia, uma condição subjetiva e crônica, é diagnosticada por meio de questionários aplicados diretamente ao paciente12.
As reações de hipossalivação e xerostomia, decorrentes do tratamento oncológico, requerem atenção, destacando a importância de identificação e observação como manifestações bucais em pacientes submetidos à quimioterapia4.
Diante do exposto, considerando a relevância da saliva e seu impacto nos pacientes em tratamento quimioterápico, é crucial reconhecer os problemas bucais que podem influenciar negativamente o quadro sistêmico, aumentando a necessidade de hospitalização. Portanto, objetiva-se analisar a ocorrência de hipossalivação e xerostomia em pacientes submetidos à quimioterapia e identificar fatores associados.
MÉTODO
Estudo observacional, transversal, quantitativo, realizado no Hospital São Vicente de Paulo (HSVP), localizado em João Pessoa, Paraíba, Brasil, conduzido pelo método hipotético-dedutivo e procedimentos comparativo-estatísticos. A técnica de observação direta foi empregada por meio da aplicação de um instrumento para a identificação da xerostomia e coleta de saliva para análise do fluxo salivar.
A amostra incluiu pacientes em tratamento quimioterápico entre os meses de agosto de 2022 e março de 2023. O tamanho da amostra foi calculado com base na prevalência de xerostomia (n = 30) e na taxa de fluxo salivar em pacientes submetidos à quimioterapia (0,33 ± 0,16), conforme relatado em um estudo anterior13. Com uma significância de 0,05, intervalo de confiança de 95% e escore Z de 1,96, o tamanho amostral estimado foi de 78 pacientes.
Os critérios de elegibilidade para a pesquisa foram estabelecidos, incluindo os seguintes critérios de inclusão: pacientes de ambos os sexos com idade igual ou superior a 18 anos; com diagnóstico de câncer; realizando tratamento oncológico apenas com quimioterapia. Por outro lado, os critérios de exclusão contemplaram pacientes tabagistas e/ou etilistas, gestantes e lactantes, com histórico de radioterapia, e aqueles com síndrome de Sjögren ou qualquer outra doença sistêmica conhecida por induzir xerostomia, como artrite reumatoide, poliarterite nodosa, esclerose sistêmica ou lúpus eritematoso.
Os procedimentos desta pesquisa seguiram as diretrizes éticas para pesquisas envolvendo seres humanos, conforme a Declaração de Helsinque e as Resoluções 466/201214 e 510/201615 do Conselho Nacional de Saúde. O projeto foi encaminhado para a Coordenação de Estudos e Pesquisas do HSVP para obtenção da anuência e, posteriormente, submetido ao Comitê de Ética em Pesquisa do Centro Universitário Uniesp. Somente após a aprovação sob o número de parecer 5.620.924 (CAAE 62879722.8.0000.5184), a coleta de dados foi iniciada.
A coleta de dados foi conduzida na sala de quimioterapia do HSVP, abordando os pacientes e convidando-os a participar do estudo. Antes da coleta, receberam instruções sobre o objetivo da pesquisa, esclarecendo todas as dúvidas. Aqueles que voluntariamente concordaram em compor a amostra assinaram o Termo de Consentimento Livre e Esclarecido (TCLE).
Após a assinatura do TCLE, a coleta salivar foi realizada usando a técnica de sialometria com fluxo salivar sem estímulo. A coleta foi realizada sempre no mesmo horário, respeitando o ciclo circadiano do fluxo salivar para manter uma consistência nos resultados. Os pacientes foram orientados a permanecer sentados em uma posição confortável, com a cabeça inclinada para frente a um ângulo de 90°, manter a boca aberta sem falar, mexer a língua ou deglutir durante um minuto, e depositar a saliva acumulada em um recipiente, repetindo essa ação a cada minuto por cinco minutos. Em seguida, a quantidade de saliva e espuma em milílitros (ml) foi avaliada e algumas gotas de simeticona (de três a cinco gotas, dependendo do volume da espuma) foram adicionadas ao copo coletor para precipitar a espuma e convertê-la em saliva. Com uma seringa hipodérmica milimetrada descartável, a saliva foi removida do copo coletor, e a quantidade obtida foi dividida pelo tempo da coleta, resultando no fluxo salivar em repouso em mililitro por minuto (mL/min). O diagnóstico de hipossalivação foi fechado quando as taxas do fluxo salivar não estimulado era ≤0,1 mL/min (valor considerado para o paciente em repouso)13.
Posteriormente, os voluntários foram submetidos a uma avaliação clínica simples da saúde bucal, utilizando um espelho bucal e uma sonda exploradora. Em seguida, responderam ao Inventário de Xerostomia, versão original de Thonson et al.16, validada em português por Mata et al.17, composto por 11 perguntas de respostas objetivas que determinaram a percepção da xerostomia. Dados como tipo de tumor primário, localização do tumor, medicação em uso e o número do ciclo quimioterápico em que se encontravam, além de informações sociodemográficas, foram extraídos dos prontuários médicos.
Os dados obtidos foram tabulados no programa Excel e analisados utilizando estatística descritiva e inferencial, com o auxílio do software Jamovi18 (versão 1.8.4). Antes da execução dos testes, foram aplicados os testes de normalidade e, com base nos resultados, as análises seguiram a estatística paramétrica ou não paramétrica. Adotou-se um nível de significância de 5%, com intervalo de confiança de 95%, e considerou-se um poder estatístico mínimo de 80%.
RESULTADOS
A amostra consistiu em 78 pacientes, com idade média de 53 anos (±12,5), sendo predominantemente do sexo feminino (n=63; 80,8%). Todos os participantes possuíam o diagnóstico de câncer e estavam em tratamento oncológico com quimioterapia.
Quanto à classificação dos tumores, a maioria dos indivíduos possuía tumores sólidos (n=70; 89,7%), enquanto apenas 10,3% (n=08) tratava-se de neoplasias hematológicas. O tumor maligno mais incidente foi o de mama (n=46; 59,0%).
Os protocolos quimioterápicos variaram de acordo com a utilização de 36 medicamentos. A combinação entre medicamentos mais frequentemente utilizada pelos pacientes foi a doxorrubicina associada à ciclofosfamida (n=10; 12,8%), que é amplamente utilizada no combate ao câncer de mama.
Em relação às desordens salivares propostas nesta análise de dados, foi possível identificar que a maioria dos pacientes (n=46; 59%) apresentou valores de fluxo salivar abaixo do normal (≤0,1mL/min), sendo diagnosticados com hipossalivação durante o tratamento quimioterápico. Somado a isso, todos os pacientes (n=78; 100,0%) relataram apresentar algum grau de xerostomia após o início da utilização da quimioterapia, sendo 83,3% (n=65) de forma moderada e 16,7% forma amena (n=13) (Tabela 1).
Tabela 1. Dados descritivos dos pacientes em internação oncológica (n=78). João Pessoa-PB, Brasil, 2023
|
Caracterização da amostra |
||
|
Idade (em anos) |
53 (±12,5) |
|
|
Sexo
|
Feminino – 63 (80,8%) Masculino – 15 (19,2%) |
|
|
Tipo de tumor |
Sólidos – 70 (89,7%) Hematológicos – 08 (10,3%) |
|
|
Localização primária do tumor |
Mama – 46 (59,0%) Linfoma de Hodgkin – 05 (6,4%) Ovário – 03 (3,8%) Gástrico – 02 (2,6%) Útero – 02 (2,6%) Estômago – 02 (2,6%) Reto – 02 (2,6%) Mieloma – 02 (2,6%) Intestino – 02 (2,6%) Seio maxilar – 01 (1,3%) Boca – 01 (1,3%) Sigmoide – 01 (1,3%) Leucemia – 01 (1,3%) Fígado – 01 (1,3%) Pulmão – 01 (1,3%) Carcinoma neuroendócrino – 01 (1,3%) Pâncreas – 01 (1,3%) Colón – 01 (1,3%) Endométrio – 01 (1,3%) Próstata – 01 (1,3%) |
|
|
Protocolos quimioterápicos |
||
|
Doxorrubicina+ciclofosfamida |
10(12,8%) |
|
|
Doxorrubicina+ciclofosfamida+placitaxel |
06 (7,7%) |
|
|
Trastuzumab |
06 (7,7%) |
|
|
Adriamicina+bleomicina+vimblastina+docarbagina |
04 (5,1%) |
|
|
Paclitaxel |
03 (3,8%) |
|
|
Taxol |
03 (3,8%) |
|
|
Carboplatina+paclitaxel |
02 (2,6%) |
|
|
Docitaxel+herceptim+perjeta |
02 (2,6%) |
|
|
Cisplatina |
02 (2,6%) |
|
|
Paclitaxel+herceptim |
02 (2,6%) |
|
|
Cisplatina+irinotecano |
02 (2,6%) |
|
|
Gencitabina |
02 (2,6%) |
|
|
Cisplatina+gencitabina |
02 (2,6%) |
|
|
Folinato de cálcio+fluoracila |
02 (2,6%) |
|
|
Bortezomibe+ciclofosfamida+dexametasona |
02 (2,6%) |
|
|
Carboplatina+taxol |
02 (2,6%) |
|
|
Docetaxel+ciclosfosfamida |
02 (2,6%) |
|
|
Capecitabina+oxaplatina |
01 (1,3%) |
|
|
Cisplatina+vinorelbina |
01 (1,3%) |
|
|
Gencitabina+cisplatia+docetaxel |
01 (1,3%) |
|
|
Pregabalina+ciclofosfamida |
01 (1,3%) |
|
|
Avastin+gencitabina+carboplastina+difenidrin+cortisona+alegra |
01 (1,3%) |
|
|
Brasarte+placitaxel |
01 (1,3%) |
|
|
Carboplatina+docitaxel+herceptim+perjeta |
01 (1,3%) |
|
|
Fluoracila+metotrexato+ciclofosfamida |
01 (1,3%) |
|
|
Rituximabe+fludarabina+ciclofosfamida |
01 (1,3%) |
|
|
Gencitabina+vinorelbina+fosfamida |
01 (1,3%) |
|
|
Avastin+irinotecano+fluoracila |
01 (1,3%) |
|
|
Paclitaxel+transtuzumabez |
01 (1,3%) |
|
|
Paclitaxel+transtuzumabe |
01 (1,3%) |
|
|
Alterações salivares |
||
|
Xerostomia
|
Amena – 13 (16,7%) Moderada – 65 (83,3%) |
|
|
Hipossalivação
|
Presente – 46 (59,0%) Ausente – 32 (41,0%) |
|
Nota: Variáveis numéricas: média (desvio-padrão); mediana (percentil 25; percentil 75); variáveis nominais: n (%).
O fluxo salivar variou de acordo com o tipo de tumor dos pacientes, sendo observada diferença entre os dois grupos (p = 0,027; teste U de Mann-Whitney). Em pacientes com tumores sólidos, a média do fluxo salivar foi de 0,542mL/min, já para os pacientes tumores hematológicos, a média do fluxo salivar foi de 1,16 mL/min, indicando que indivíduos com tumores sólidos foram mais atingidos pela hipossalivação durante o tratamento quimioterápico (Gráfico 1).
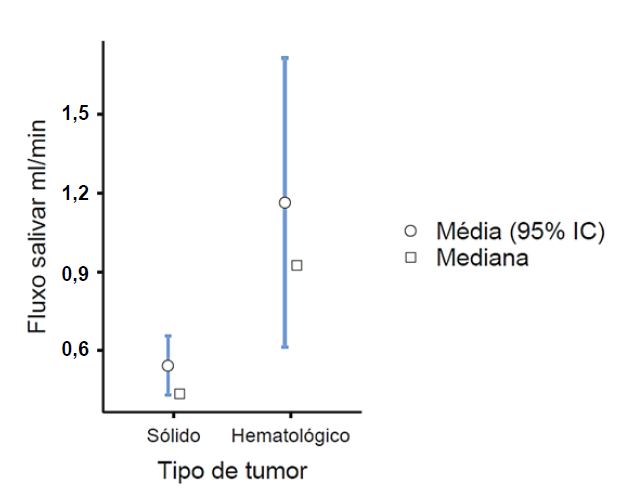
Gráfico 1. Diferença do fluxo salivar de pacientes com tumores sólidos e tumores hematológicos (n=78). João Pessoa-PB, Brasil, 2023
Também foi possível observar diferença entre o fluxo salivar de pacientes que relataram xerostomia moderada ou amena (p < 0,001; teste U de Mann-Whitney). Indivíduos com relato de xerostomia moderada exibiram um fluxo salivar inferior aos pacientes com relato de xerostomia amena (Gráfico 2).
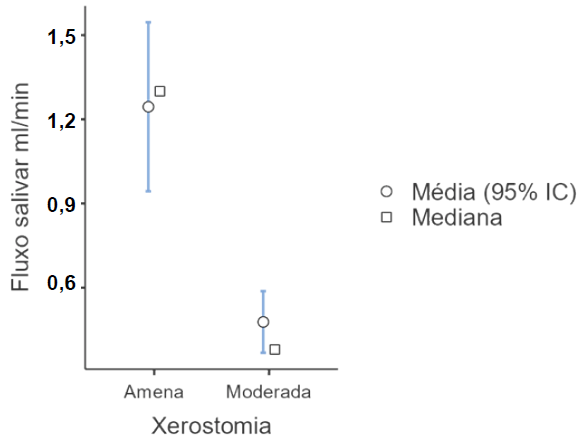
Gráfico 2. Diferença do fluxo salivar de acordo com o inventário de xerostomia (n=78). João Pessoa-PB, Brasil, 2023
Foi possível ainda inferir que os indivíduos diagnosticados com hipossalivação neste estudo têm um risco aumentado de relatar a presença da xerostomia em graus moderados durante o tratamento quimioterápico (RR = 0,349; IC = 0,127 – 0,955; p = 0,006) (Tabela 2).
Tabela 2. Dados descritivos do teste t para amostras fluxo salivar. João Pessoa-PB, Brasil, 2023
|
|
Hipossalivação |
|
|
|
|
|
Xerostomia |
Sim |
Não |
p |
RR |
IC 95% |
|
Amena |
03 |
10 |
0,006* |
0,349 |
0,127 – 0,955 |
|
Moderada |
43 |
22 |
|||
Legendas: *<0,05; RR = risco relativo; IC = intervalo de confiança (limite superior – limite inferior).
DISCUSSÃO
As caraterísticas epidemiológicas vistas nos resultados do presente estudo revelam uma tendência que acompanha as características do cenário brasileiro. De acordo com Santos et al.19, com relação aos casos novos de câncer no Brasil, percebe-se uma predileção pelo sexo feminino, sendo o câncer de mama o tipo de neoplasia mais incidente. Isto pode ser observado ao analisar as variáveis sexo e localização do câncer deste estudo.
Consequentemente, o protocolo quimioterápico mais observado nos pacientes era para o tratamento do câncer de mama, sendo a combinação “doxorrubicina + ciclofosfamida” a mais utilizada. Esse protocolo é amplamente utilizado no tratamento do câncer de mama, sobretudo seguido da aplicação de um taxano20, cuja combinação pode também ser observada nos resultados deste estudo ocupando o segundo lugar do protocolo mais empregado.
Medicações quimioterápicas podem levar a alterações salivares. Estudos primários sumarizados em uma revisão sistemática21 investigaram os efeitos bioquímicos e histológicos de fármacos antitumorais nas glândulas salivares. Os medicamentos anticâncer podem induzir a morte celular por meio do estresse oxidativo, desencadeando a formação de espécies reativas de oxigênio e resultando em apoptose das células produtoras de saliva. A ciclofosfamida, por exemplo, utilizada no tratamento do câncer e como imunossupressor, afeta as glândulas salivares, causando xerostomia por causa da redução na produção de saliva, com efeitos persistentes. Já o 5-fluorouracil, utilizado em tumores sólidos, também induz atrofia das glândulas salivares e xerostomia, associado ao estresse oxidativo21.
Dessa forma, pode-se sugerir que a hipossalivação, na maioria dos pacientes investigados, e a xerostomia, relatada por todos os indivíduos submetidos à quimioterapia neste estudo, são explicadas por eventos bioquímicos adversos das medicações que resultam na morte das células glandulares e mioepiteliais, bem como das que compõem os sistemas de ductos, implicando na baixa produção diária de saliva e na sintomatologia desagradável de boca seca.
Esse sintoma torna-se mais prevalente à medida que o tratamento vai avançando, conforme se pode observar nos dados de Acharya et al.22. Esse estudo acompanhou a evolução dos danos salivares em mulheres com câncer de mama sob tratamento quimioterápico durante 16 meses. Houve uma diminuição significativa na taxa média do fluxo salivar dessas pacientes, e um aumento na viscosidade da saliva durante o avanço do tratamento. Ou seja, as pacientes relatavam a xerostomia à medida que o seu fluxo salivar ia diminuindo, o que corrobora os dados estatísticos da presente pesquisa, em que os pacientes com hipossalivação apresentaram um risco aumentado em desenvolver graus moderados de xerostomia (RR = 0,349; IC = 0,127 – 0,955; p = 0,006).
Um dos fatores que podem explicar o espessamento da saliva ao longo do tratamento quimioterápico é a contribuição dos produtos das glândulas salivares maiores e menores na secreção de saliva. Fisiologicamente, 96% do conteúdo salivar é produzido pelas glândulas maiores e apenas 4% pelas glândulas menores, em estado de repouso. A produção aumenta para cerca de 99% nas glândulas maiores na presença de estímulos23. Nesse cenário, sua maior produção acontece nas glândulas submandibulares (70%) e glândulas parótidas (25%), que possuem muitas células serosas e secretam uma saliva mais fluida, rica em proteínas, íons e água24. Como maior parte do estímulo direciona-se a elas, possivelmente o dano celular acontece de forma mais severa e há, portanto, uma redução da fluidez salivar.
Com isso, fica evidente que a utilização de medicações contra a proliferação desordenada de células neoplásicas aumenta a produção de espécies reativas de oxigênio e, consequentemente, o dano tecidual nas glândulas salivares21, resultando em uma diminuição dos produtos salivares e ocasionando em relatos de xerostomia e diagnóstico clínico de hipossalivação.
Silva et al.25 avaliaram a relação entre a xerostomia e a qualidade de vida relacionada à saúde bucal em pacientes com câncer de cabeça. Os resultados apontaram alta prevalência no sexo feminino (85%), com idades entre 51 e 70 anos (40%), frequentemente diagnosticadas com câncer de cabeça e pescoço. Todos os pacientes (100%) desenvolveram xerostomia após o tratamento, evidenciando que terapias antineoplásicas trazem danos irreversíveis às glândulas salivares, aumentando a prevalência de xerostomia e impactando negativamente na qualidade de vida relacionada à saúde bucal.
Esse impacto negativo na qualidade de vida relacionada à saúde bucal de indivíduos submetidos a tratamentos antineoplásicos foi sumarizado por uma revisão sistemática que mostrou que, independentemente do tratamento (quimioterapia e/ou radioterapia), a saúde bucal de pacientes oncológicos se torna prejudicada em diversos aspectos, inclusive no que diz respeito às funções salivares, impedindo-os de realizarem as funções estomatognásticas de forma fisiológica26.
Entre os prejuízos e impactos negativos relatados na literatura, pode-se citar a predisposição à ocorrência de doenças microbianas, como cárie dentária, estomatites, candidose e queilite angular, ocasionadas pelo acúmulo de biofilme na superfície dos dentes e das mucosas; erosão dentária, pela mudança no pH salivar; relatos de ardência bucal, disgeusia e disfagia, que podem acarretar em prejuízos nutricionais; além de impactos negativos em outros âmbitos da vida, como distúrbios do sono e da fala, isolamento social e depressão24.
Observa-se nos resultados que houve diferença entre o fluxo salivar não estimulado de pacientes com tumores sólidos e hematológicos. Em relação a isso, há uma enorme dificuldade na literatura de explicações sobre as disfunções salivares diante de diferentes protocolos quimioterápicos27. No presente estudo, pode-se sugerir que a disparidade entre o número de pacientes com tumores sólidos e hematológicos pode ter influenciado nesse resultado.
Em suma, tumores hematológicos são mais incidentes na população infantojuvenil, ao passo que os tumores sólidos acometem mais indivíduos em idade adulta, pelo aumento da exposição aos fatores de risco2,3. O fato de essa investigação excluir da análise a população infantojuvenil talvez tenha favorecido a observação dessa diferença. Uma vez que, ao analisar a sumarização de estudos primários21, percebe-se que é frequente a ocorrência de alterações no fluxo salivar de indivíduos submetidos à quimioterapia, independentemente da medicação utilizada.
Outro fator que pode influenciar esse resultado seria a baixa estimativa de tumores hematológicos, em comparação aos tumores sólidos, na população adulta paraibana3, o que vai ao encontro destes achados, ao classificar a amostra em relação ao tipo de tumor. Portanto, acredita-se que essa diferença esteja relacionada ao desbalanço amostral entre os grupos analisados.
Durante a condução deste estudo, observaram-se algumas limitações, como a falta de dados sobre a ingestão diária de água e as limitações de desempenho das atividades estomatognáticas ocasionadas pelo baixo fluxo salivar e sensação de boca seca, além da ausência de um grupo controle, composto por pacientes saudáveis. Portanto, a partir dessas observações, sugere-se que novos estudos sejam realizados abordando essas variáveis. Ademais, em virtude da ampla diversidade de tumores e esquemas terapêuticos presentes na amostra estudada, não foi possível determinar quais fármacos exercem maior influência como fatores de risco para o desenvolvimento dessas condições salivares.
Os resultados desta pesquisa, além de contribuírem como fonte primária para outros estudos e destacarem a importância da vigilância odontológica na redução dos efeitos adversos ocasionados pela quimioterapia, exprimem a necessidade de investigar novas hipóteses acerca do tema, inclusive pelo mesmo grupo de pesquisa.
Diante disso, vale destacar a relevância do cirurgião-dentista na equipe multidisciplinar de hospitais oncológicos. Outrossim, recomenda-se a implementação de protocolos específicos para o tratamento da xerostomia e hipossalivação nesses pacientes, durante o tratamento quimioterápico, visando ao controle de alterações decorrentes da diminuição e espessamento do fluxo salivar.
CONCLUSÃO
Pacientes oncológicos sob tratamento quimioterápico apresentam hipossalivação e xerostomia, sendo os indivíduos com tumores sólidos mais afetados pelo baixo fluxo salivar quando comparados àqueles com tumores hematológicos. Além disso, indivíduos diagnosticados com hipossalivação neste estudo possuem risco aumentado de relatar a presença de xerostomia em níveis moderados durante o curso do tratamento quimioterápico.
CONTRIBUIÇÕES
Todos os autores contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Instituto Nacional de Câncer [Internet]. Rio de Janeiro: INCA; [data desconhecida]. O que é câncer? 2022 maio 31 [atualizado 2022 jul 14; acesso 2023 set 14]. Disponível em: https://www.gov.br/inca/pt-br/assuntos/cancer/o-que-e-cancer
2. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-63. doi: https://doi.org/10.3322/caac.21834
3. Instituto Nacional de Câncer. Estimativa 2023: incidência de câncer no Brasil [Internet]. Rio de Janeiro: INCA; 2022. [acesso 2023 set 9]. Disponível em: https://www.inca.gov.br/publicacoes/livros/estimativa-2023-incidencia-de-cancer-no-brasil
4. Sousa FL, Santana SB, Monteiro AX, et al. Hipossalivação em pacientes oncológicos sob tratamento quimio e radioterápica na Fundação Centro de Controle de Oncologia do Estado do Amazonas (FCECON). Braz J Develop. 2021;7(2):15971-81. doi: https://doi.org/10.34117/bjdv7n2-291
5. Silva FKV, Fursel KA, Oliveira Neto JL, et al. Alterações bucais em pacientes submetidos ao tratamento quimioterápico. RSD. 2021;10(6):e59510616562. doi: https://doi.org/10.33448/RSD-V10I6.16562
6. Baig MQ. Principles and practice of chemotherapy. Londres: JP Medical Ltd; 2021.
7. Caldas LHTA, Ricarte RG, Souza SRS, et al. Alterações orais da quimioterapia em pacientes infantojuvenis com leucemia linfoide aguda: uma revisão de literatura. Rev Bras Saúde Funcional. 2021:9(2):133-50. doi: https://doi.org/10.25194/rebrasf.v9i2.1447
8. Franca AAL, Roque DC, Bernardes VCC, et al. A importância da saliva para a manutenção da saúde bucal: uma revisão da literatura. SciGe [Internet]; 2021. 2(Supl. 1):34-4. Disponível em: https://www.scientiageneralis.com.br/index.php/SG/article/view/261
9. Silva AF, Horta HF, Oliveira CS, et al. Carbohydrates, saliva and oral health: a literatura review. Revista UNINGÁ. 2021;58:euj4026-6. doi: https://doi.org/10.46311/2318-0579.58.eUJ4026
10. Martina E, Campanati A, Diotallevi F, et al. Saliva and oral diseases. J Clin Med. 2020;9(2):466. doi: https://doi.org/10.3390/jcm9020466
11. Rech CA, Medeiros AW. Xerostomia associada ao uso de medicamentos em idosos. J Oral Invest. 2016;5(1):13-8.
12. Freitas LM. Alterações salivares em pacientes oncológicos: uma revisão sistemática [monografia na Internet]. Rio de Janeiro: Hospital Central do Exército; 2022. [acesso 2023 set 9]. Disponível em: http://bdex.eb.mil.br/jspui/handle/123456789/10182
13. Vistoso Monreal A, Polonsky G, Shiboski C, et al. Salivary gland dysfunction secondary to cancer treatment. Front Oral Health. 2022;3:907778. doi: https://doi.org/10.3389/froh.2022.907778
14. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
15. Conselho Nacional de Saúde (BR). Resolução n° 510, de 7 de abril de 2016. Dispõe sobre as normas aplicáveis a pesquisas em Ciências Humanas e Sociais cujos procedimentos metodológicos envolvam a utilização de dados diretamente obtidos com os participantes ou de informações identificáveis ou que possam acarretar riscos maiores do que os existentes na vida cotidiana, na forma definida nesta Resolução [Internet]. Diário Oficial da União, Brasília, DF. 2016 maio 24 [acesso ANO MÊS DIA]; Seção I:44. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/cns/2016/res0510_07_04_2016.html
16. Thomson WM, Chalmers JM, Spencer AJ, et al. The Xerostomia Inventory: a multi-item approach to measuring dry mouth. Community Dent Health [Internet]. 1999 [acesso 2023 nov 9];16(1):12-7. Disponível em: https://pubmed.ncbi.nlm.nih.gov/10697349/
17. Mata A, Silva MD, Freitas F, et al. Translation, validation, and constructo reliability of a portuguese version of the Xerostomia Inventory. Oral dis. 2011;18(3):293-8. doi: https://doi.org/10.1111/j.1601-0825.2011.01879.x
18. Jamovi [Internet]. Versão 1.8.4. Sydney: projeto Jamovi; 2024. [acesso 2024 jan 23]. Disponível em: https://www.jamovi.org/
19. Santos MO, Lima FCS, Martins LFL, et al. Estimativa de incidência de câncer no Brasil, 2023-2025. Rev Bras Cancerol. 2023;69(1):e-213700. doi:10.32635/2176-9745.RBC.2023v69n1.3700
20. Mamishin K, Naito Y, Nomura S, et al. Comparison of treatment completion rate between conventional and dose-dense doxorubicin and cyclophosphamide (ac) followed by a taxane in patients with breast cancer: a propensity score-matched analysis. Anticancer Research. 2021;41(12):6217-24. Disponível em: https://doi.org/10.21873/anticanres.15441
21. Ungureanu LB, Grãdinaru I, Ghiciuc CM, et al. Atrophy and inflammatory changes in salivary glands induced by oxidative stress after exposure to drugs and other chemical substances: a systematic review. Medicina. 2023;59(9):1692. Disponível em: https://doi.org/10.3390/medicina59091692
22. Acharya S, Pai KM, Bhat S, et al. Oral changes in patients undergoing chemotherapy for breast cancer. Indian J Dent Res. 2017;28(3):261. doi: https://doi.org/10.4103/ijdr.ijdr_379_16
23. Proctor GB. The Physiology of salivary secretion. Periodontology 2000. 2016;70(1):11-25. doi: https://doi.org/10.1111/prd.12116
24. Pedersen AML, Sørensen CE, Proctor GB, et al. Salivary secretion in health and disease. J Oral Rehabil. 2018;45(9):730-46. https://doi.org/10.1111/joor.12664
25. Silva RGB, Ramos AMPC, Pauxis Aben-Athar CY, et al. Avaliação da xerostomia em pacientes com câncer de cabeça e pescoço submetidos ao tratamento radioterápico. Rev Cont Saúde. 2017;17(32):5. doi: https://doi.org/10.21527/2176-7114.2017.32.5-14
26. Yuwanati M, Gondivkar S, Sarode S, et al. Oral health-related quality of life in oral cancer patients: systematic review and meta-analysis. Future Oncology. 2021;17(8):979-90. doi: https://doi.org/10.2217/fon-2020-0881
27. Costa RC, Bezerra PMM, Damascena LCL, et al. Impact of saliva and cariogenic microbiota on the chemotherapy-induced oral mucositis in oncopediatric patients: a preliminary longitudinal study. Int J Dent. 2020;2020:1243953. doi: https://doi.org/10.1155/2020/1243953
Recebido em 19/3/2024
Aprovado em 28/5/2024
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.