REVISÃO DE LITERATURA
Revisão Sistemática de Estudos Observacionais sobre o uso de Erlotinibe e Gefitinibe no Tratamento do Câncer de Pulmão de Células Não Pequenas
Systematic Review of Observational Studies on the use of Erlotinib and Gefitinib in the Treatment of Non-Small Cell Lung Cancer
Revisión Sistemática de Estudios Observacionales sobre el uso de Erlotinib y Gefitinib en el Tratamiento del Cáncer de Pulmón de Células No Pequeñas
https://doi.org/10.32635/2176-9745.RBC.2024v70n3.4656
Annemeri Livinalli1; Barbara Delano Cruz2; Isabel Cristina Martins Emmerick3; Isabela de Pinho Pestana4; Juliana Machado Rugolo5; Leticia Barbosa Teixeira6; Mariana Michel Barbosa7; Mario Jorge Sobreira da Silva8
1Ministério da Saúde. Jundiaí (SP), Brasil. E-mail: annemeri.livinalli@gmail.com. Orcid iD: https://orcid.org/0000-0003-2091-9113
2Merck Sharp & Dohme. Belo Horizonte (MG), Brasil. E-mail: bdelanocruz@yahoo.com.br. Orcid iD: https://orcid.org/0000-0002-4106-7768
3University of Massachusetts. Worcester, Massachusetts, USA. E-mail: isabel.emmerick@umassmemorial.org. Orcid iD: https://orcid.org/0000-0002-0383-2465
4,6,8Instituto Nacional de Câncer (INCA). Rio de Janeiro (RJ), Brasil. E-mails: isabelappestana@gmail.com; leticiabt@id.uff.br; mjsobreira@yahoo.com.br. Orcid iD: https://orcid.org/0000-0002-2410-5179; Orcid iD: https://orcid.org/0009-0006-5111-5758; Orcid iD: https://orcid.org/0000-0002-0477-8595
5Universidade Estadual Paulista (Unesp). Botucatu (SP), Brasil. E-mail: jr.machado@unesp.br. Orcid iD: https://orcid.org/0000-0003-3984-4959
7Universidade Federal de Minas Gerais (UFMG). Belo Horizonte (MG), Brasil. E-mail: marianamichelbarbosa@gmail.com. Orcid iD: https://orcid.org/0000-0002-8087-7237
Endereço para correspondência: Mario Jorge Sobreira da Silva. Rua Marquês de Pombal, 125 – 4º andar – Centro. Rio de Janeiro (RJ), Brasil. CEP 20230-240. E- mail: mjsobreira@yahoo.com.br
RESUMO
Introdução: A avaliação da utilização de medicamentos em larga escala compõe o ciclo de vida da tecnologia. Desde a incorporação de gefitinibe e erlotinibe para o tratamento do câncer de pulmão de células não pequenas no Sistema Único de Saúde, em 2013, nenhuma revisão com dados de mundo real foi publicada. Objetivo: Avaliar dados de efetividade, segurança, qualidade de vida e adesão ao uso de erlotinibe e gefitinibe no tratamento do câncer de pulmão de células não pequenas a partir de uma revisão sistemática de estudos observacionais. Método: O protocolo da revisão sistemática foi registrado. Foram realizadas buscas das evidências nas bases MEDLINE, EMBASE, Cochrane, LILACS e CINAHL. Dois pesquisadores selecionaram os estudos, extraíram os dados e avaliaram a qualidade metodológica de forma independente. O risco de viés foi avaliado utilizando a lista de itens para avaliação crítica do Instituto Joanna Briggs para estudos de coorte e estudos transversais. Resultados: Foram incluídos oito estudos de coorte e identificadas medianas superiores de sobrevida global e sobrevida livre de progressão para gefitinibe e erlotinibe em comparação à quimioterapia. Os estudos apontaram baixa frequência de eventos adversos, boa qualidade de vida e alta taxa de adesão entre os pacientes em uso dos medicamentos avaliados. Na avaliação do risco de viés, notou-se que, em todos os estudos, existia algum tipo de viés ou critérios de qualidade não atendidos. Conclusão: Identificou-se o benefício clínico em contexto de mundo real dos medicamentos gefitinibe e erlotinibe incorporados no Sistema Único de Saúde.
Palavras-chave: Cloridrato de Erlotinib; Gefitinibe; Neoplasias Pulmonares/tratamento farmacológico; Resultado do Tratamento; Revisão Sistemática.
ABSTRACT
Introduction: Evaluating the use of drugs on a large scale is part of the technology lifecycle. Since the introduction of gefitinib and erlotinib for the treatment of non-small cell lung cancer into the National Health System of Brazil in 2013, no reviews with real-world data have been published. Objective: To evaluate data on the efficacy, safety, quality of life, and adherence of erlotinib and gefitinib in the treatment of non-small cell lung cancer based on a systematic review of observational studies. Method: A systematic review protocol was registered. MEDLINE, EMBASE, Cochrane, LILACS and CINAHL were searched for evidence. Two investigators selected the studies, extracted the data and assessed the methodological quality independently. The risk of bias was assessed using the Joanna Briggs Institute list of critical appraisal items for cohort and cross-sectional studies. Results: Eight cohort studies were included. Higher median overall survival and progression-free survival were observed for gefitinib and erlotinib compared to chemotherapy. The studies showed a low incidence of adverse events, good quality of life and high adherence rates among patients taking the drugs evaluated. When assessing the risk of bias, it was noticed that all the studies had some type of bias or unmet quality criteria. Conclusion: Clinical benefit was identified in a real-world context for the drugs gefitinib and erlotinib incorporated into Brazil’s National Health System.
Key words: Erlotinib Hydrochloride; Gefitinib; Lung Neoplasms/drug therapy; Treatment Outcome; Systematic Review.
RESUMEN
Introducción: La evaluación del uso de medicamentos a gran escala forma parte del ciclo de vida de la tecnología. Desde la introducción de gefitinib y erlotinib para el tratamiento del cáncer de pulmón de células no pequeñas en el Sistema Único de Salud del Brasil en 2013, no se han publicado revisiones con datos del mundo real. Objetivo: Evaluar los datos sobre la eficacia, seguridad, calidad de vida y adherencia al uso de erlotinib y gefitinib en el tratamiento del cáncer de pulmón no microcítico a partir de una revisión sistemática de estudios observacionales. Método: Se registró un protocolo de revisión sistemática. Se realizaron búsquedas de evidencia en MEDLINE, EMBASE, Cochrane, LILACS y CINAHL. Dos investigadores seleccionaron de forma independiente los estudios, extrajeron los datos y evaluaron la calidad metodológica. El riesgo de sesgo se evaluó mediante la lista de ítems de evaluación crítica del Instituto Joanna Briggs para estudios de cohortes y transversales. Resultados: Se incluyeron ocho estudios de cohortes. Se observaron medianas de supervivencia global y supervivencia libre de progresión mayores con gefitinib y erlotinib en comparación con la quimioterapia. Los estudios mostraron una baja incidencia de acontecimientos adversos, buena calidad de vida y altas tasas de adherencia entre los pacientes que tomaban los fármacos evaluados. Al evaluar el riesgo de sesgo, se observó que todos los estudios presentaban algún tipo de sesgo o criterios de calidad que no se cumplían. Conclusión: Se identificó beneficio clínico en un contexto del mundo real para los fármacos gefitinib y erlotinib incorporados al Sistema Único de Salud del Brasil.
Palabras clave: Clorhidrato de Erlotinib; Gefitinib; Neoplasias Pulmonares/tratamiento farmacológico; Resultado del Tratamiento; Revisión Sistemática.
INTRODUÇÃO
O câncer de pulmão (CP) é considerado um importante problema de saúde
pública. Segundo as estimativas da International Agency for Research on Cancer (Iarc), o CP é a neoplasia de maior mortalidade (18,7%) e a mais incidente no mundo (12,4%)1. No Brasil, foram estimados, para cada ano do triênio 2023-2025, 18.020 casos novos de CP em homens e 14.540 em mulheres2.
Um dos subtipos histológicos de CP mais comuns é o carcinoma pulmonar, que é um tipo de câncer de pulmão de células não pequenas (CPCNP)3. Atualmente, os estádios iniciais da doença (I, II e IIIa) têm a cirurgia e a quimioterapia citotóxica neoadjuvante como principal
opção de tratamento. No entanto, em razão do diagnóstico tardio, é mais frequente que os pacientes sejam diagnosticados com doença localmente avançada ou com metástases (estádio IIIb ou IV), impossibilitando a cirurgia, e acarretando em baixa sobrevida4.
Durante décadas, a quimioterapia citotóxica foi a base do tratamento do CPCNP nos casos avançados ou metastáticos. Com o avanço da compreensão da fisiologia e de características de potenciais alvos moleculares no câncer, tornou-se possível identificar moléculas específicas e desenvolver novas estratégias para inibir o crescimento e a progressão tumoral de modo mais direcionado, com diminuição de danos às células saudáveis5.
O receptor do fator de crescimento epidérmico (do inglês - Epidermal growth fator receptor - EGFR) é um receptor de tirosina quinase (TK), cuja sinalização tem importante papel na manutenção e no crescimento dos tecidos epiteliais6. A superexpressão decorrente de mutação do gene EGFR está associada com a patogênese, proliferação, invasão e metástase de vários tumores sólidos, sendo observada em cerca de 30% dos casos de CPCNP metastáticos7.
Gefitinibe e erlotinibe estão entre os fármacos que compõem a classe terapêutica de inibidores de tirosina quinase (TKI) EGFR8. A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, em 2006, o registro de erlotinibe para o tratamento do CPCNP e do câncer de pâncreas9. Em 2010, gefitinibe foi a primeira terapia-alvo molecular aprovada no Brasil para o tratamento de pacientes com CPCNP em estádio avançado10. Em 2013, ambos os medicamentos foram incorporados pela Comissão Nacional de Incorporação de Tecnologias (Conitec), para compor o rol de tratamento ofertado no Sistema Único de Saúde (SUS)9,10, estando inclusive recomendados nas Diretrizes Diagnósticas e Terapêuticas do Câncer de Pulmão11.
A avaliação da utilização de uma tecnologia em larga escala, desde o estágio inicial de difusão, compõe o ciclo de vida da tecnologia12. Após a incorporação de gefitinibe e erlotinibe no SUS, nenhuma nova revisão dos dados publicados foi conduzida por parte da Conitec, de modo que não havia informação na literatura do benefício agregado aos pacientes brasileiros como resultado dessa incorporação. Frente a essas incertezas, por meio da identificação e análise referentes ao uso desses medicamentos, desde a incorporação, é possível traçar um panorama de benefícios reais em termos de efetividade e segurança, bem como avaliar questões de adesão e qualidade de vida (QV) relativas ao uso dos TKI para tratamento de CPCNP.
O objetivo do presente estudo é avaliar a efetividade, segurança, adesão e QV do uso de erlotinibe e gefitinibe no tratamento do CPCNP, a partir de uma revisão sistemática de estudos observacionais com dados de mundo real.
MÉTODO
O protocolo da revisão sistemática contendo o método descrito detalhadamente foi registrado na base International Prospective Register of Systematic Reviews (PROSPERO)13, sob o código CRD42022337969.
A pergunta de pesquisa empregada foi: “Pacientes adultos com CPCNP tratados com gefitinibe ou erlotinibe apresentam os mesmos resultados observados nos ensaios clínicos randomizados (ECR) quando tratados no ambiente clínico?”
Foram considerados os seguintes critérios de elegibilidade para inclusão dos estudos: População - pacientes adultos com CPCNP, avançado ou metastático, com mutações ativadoras do EGFR, em primeira linha de tratamento e monoterapia; Intervenção - erlotinibe ou gefitinibe; Comparador - quimioterapia, placebo ou cuidados de suporte; Desfechos - sobrevida global (SG), sobrevida livre de progressão (SLP), eventos adversos (EA), adesão e QV; Tipos de estudos - estudos observacionais (coorte retrospectivo, coorte prospectivo ou transversal), publicados no período de janeiro de 2014 a março 2023 nos idiomas português, inglês e espanhol. O período de corte inicial foi definido em razão da data de incorporação dos medicamentos no SUS.
Foram excluídos resumos de congresso, estudos que analisaram QV com instrumentos não validados, ou que analisaram os desfechos exclusivamente em pacientes com lesão cerebral.
As bases de dados bibliográficas eletrônicas utilizadas como estratégia de pesquisa foram: MEDLINE via PubMed, EMBASE, Biblioteca Cochrane, Literatura de Ciências da Saúde da América Latina e Caraíbas (LILACS), Índice Cumulativo da Literatura de Enfermagem e Saúde Aliada (CINAHL), Biblioteca Digital Brasileira de Teses e Dissertações (BDBTD), e Portal de Periódicos Capes.
Para cada base de dados, foi elaborada uma estratégia de busca da forma mais abrangente e sensível possível, com o uso de termos indexados, sinônimos e respectivas variações. Antes de realizar as buscas, estas foram revisadas, seguindo as recomendações da Peer Review of Electronic Search Strategies (PRESS). As estratégias de busca são apresentadas no Suplemento 1.
Os estudos recuperados em cada uma das bases de dados foram importados para a plataforma Covidence. Após remoção das publicações duplicadas, dois revisores independentes fizeram a triagem com leitura de títulos e resumos. Os estudos selecionados foram lidos na íntegra por dois revisores para verificar se estavam em conformidade com os critérios de elegibilidade. Aqueles que permaneceram seguiram para a etapa de extração de dados, que também foi realizada por dois revisores. Nos casos de discordância, em qualquer uma das etapas, um terceiro revisor avaliou o estudo. Todo o processo de seleção dos estudos foi documentado e apresentado utilizando o fluxograma recomendado nas diretrizes com Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)14.
Foram extraídas as seguintes informações dos estudos selecionados: nome do autor, data de publicação, países onde foram realizados estudos, delineamento do estudo, tamanho da amostra, sexo e idade dos participantes, tipo de intervenção (com dosagem, frequência, duração), dados de efetividade (SG e SLP), EA (frequência e tipos), taxas de adesão e QV relacionada com a saúde.
O risco de viés foi avaliado utilizando-se a lista de itens para avaliação crítica do Instituto Joanna Briggs para Estudos de Coorte e para Estudos Transversais (JBI’s critical appraisal tools)15. Dois revisores realizaram de forma independente a análise da qualidade metodológica dos estudos. Discordâncias foram resolvidas por um terceiro revisor.
A metanálise foi planejada no protocolo publicado, porém, em virtude da heterogeneidade dos estudos e dados coletados, não foi possível realizá-la. Procedeu-se, então, à síntese narrativa, com resultados sumarizados em análises descritivas.
RESULTADOS
Foram recuperadas 9.765 publicações nas bases de dados. Após a remoção das publicações duplicadas, 7.715 artigos passaram pela triagem com leitura de título e resumo, etapa realizada por dois revisores, permanecendo 48 publicações para leitura na íntegra, resultando na inclusão de dez estudos observacionais (Figura 1). O principal motivo para exclusão (60,5%) foi por conta da forma de apresentação dos resultados. Nos estudos excluídos, os autores reportaram os resultados por grupo farmacológico, combinando os resultados de diferentes TKI (gefitinibe, erlotinibe, afatinibe, osimertinibe, entre outros).
![]()
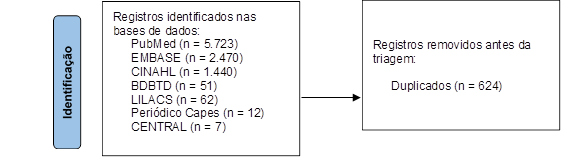
![]()
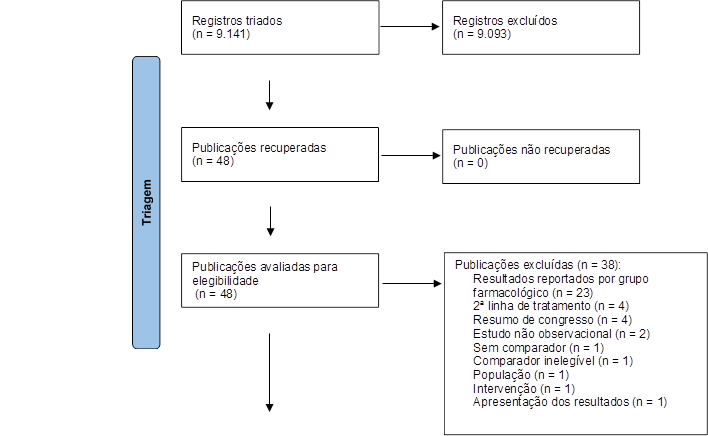

Figura 1. Diagrama de fluxo de seleção de estudos da revisão sistemática
Fonte: Adaptado de PRISMA14.
Dos dez estudos incluídos para extração de dados, o de Rusdi et al.16 foi excluído porque os dados de sobrevida do comparador divergiram entre duas tabelas apresentadas no artigo. Não foi possível o contato com os autores. Frente à incerteza de qual seria o dado correto, optou-se pela exclusão do estudo. O estudo de Jiang et al.17 também foi excluído, pois os resultados dos EA no grupo que recebeu quimioterapia foram obtidos da combinação de pacientes que receberam primeira ou segunda linha de tratamento, divergindo dos critérios de elegibilidade da revisão.
Foi analisado um total de oito estudos, sendo todos coortes prospectivas (n= 6) ou retrospectivas (n = 2) publicadas entre 2015 e 2020. Cinco estudos reportaram dados de SG18-22, quatro de SLP18,20-22, três de EA18,20,21, dois de adesão ao tratamento23,24, e um reportou dados de QV25 (Tabela 1).
Tabela 1. Características dos estudos incluídos e analisados na revisão sistemática
|
ID estudo |
País |
Delineamento do estudo |
Inibidor de EGFR |
Comparador |
Tamanho da amostraa |
Total (grupo intervenção) |
Desfechos avaliados |
|
Brat 202018 |
República Tcheca |
Coorte prospectiva |
Gefitinibe Erlotinibe |
Pemetrexede Bevacizumabe |
2.157 |
325 62 |
SG SLP EA |
|
Chung 201919 |
Taiwan |
Coorte retrospectiva |
Gefitinibe Erlotinibe |
Derivados de platina |
38.100 |
5.638 1.433 |
SG |
|
Schuette 201820 |
Alemanha |
Coorte prospectiva |
Gefitinibe |
Quimioterapiab |
4.243 |
176 |
SG SLP EA |
|
Wang 201521 |
China |
Coorte prospectiva |
Gefitinibe |
Docetaxel |
120 |
74 |
SG SLP EA |
|
Wu 201922 |
Taiwan |
Coorte prospectiva |
Gefitinibe |
Pemetrexede + cisplatina |
84 |
11 |
SG SLP |
|
Hess 201723 |
EUA |
Coorte retrospectiva |
Gefitinibe |
Sem comparador |
1.452 |
729 |
Adesão ao tratamento |
|
Timmers 201524 |
Holanda |
Coorte prospectiva |
Erlotinibe |
Sem comparador |
62 |
62 |
Adesão ao tratamento |
|
Wei 201925 |
Taiwan |
Coorte prospectiva |
Gefitinibe Erlotinibe |
Sem comparador |
346 |
54 202 |
QV |
Legendas: EA = eventos adversos; EGFR (sigla em inglês) = receptor do fator de crescimento epidérmico; NI = não informado; QV = qualidade de vida; SG = sobrevida global; SLP = sobrevida livre de progressão.
aEm alguns estudos, apenas uma parcela da população foi analisada; bQuimioterapia combinada ou monoterapia com os seguintes fármacos: bevacizumabe, carboplatina, cetuximabe, cisplatina, docetaxel, etoposideo, gemcitabina, paclitaxel, pemetrexede, vinorelbina.
O tamanho das amostras variou de 62 a 38.100. Nem todos os estudos informaram idade e sexo biológico. Entre os quatro que informaram, a idade variou de 46 a 80,8 anos, com predominância do sexo masculino. Os participantes tinham resultado histológico de adenocarcinoma, carcinoma de células escamosas e carcinoma de grandes células, estádio III ou IV.
O uso de gefitinibe predominou nos estudos incluídos que analisaram desfechos de efetividade ou segurança, ou ambos, totalizando pouco mais de 6.200 participantes. Apenas dois estudos18,19 incluíram resultados de participantes que receberam erlotinibe, totalizando cerca de 1.500 participantes. O comparador variou entre derivados de platina (carboplatina, cisplatina), pemetrexede, bevacizumabe, gencitabina, vinorelbina e docetaxel.
Na avaliação do risco de viés (Figura 2), notou-se que, em todos os estudos, existia algum tipo de viés ou critérios de qualidade não atendidos. Os itens com menor atendimento dos critérios na análise de risco de viés foram relacionados à caracterização da amostra para representar a população-alvo; o detalhamento dos participantes do estudo; e se a análise de dados foi realizada em uma proporção suficiente da amostra identificada.
|
Item avaliado |
Identificação do Estudo |
|||||||
|
Timmers 2015
|
Wang 2015 |
Hess 2017 |
Schuette 2018 |
Chung 2019 |
Wei 2019 |
Wu 2019 |
Brat 2020 |
|
|
Os dois grupos foram semelhantes e recrutados na mesma população? |
|
|
|
|
|
|
|
|
|
As exposições foram medidas de forma semelhante para atribuir os participantes aos grupos expostos ou não expostos? |
|
|
|
|
|
|
|
|
|
A exposição foi medida de forma válida e confiável? |
|
|
|
|
|
|
|
|
|
Foram identificados fatores de confusão? |
|
|
|
|
|
|
|
|
|
Foram estabelecidas estratégias para lidar com fatores de confusão? |
|
|
|
|
|
|
|
|
|
Os grupos/participantes estavam livres do desfecho no início do estudo (ou no momento da exposição)? |
|
|
|
|
|
|
|
|
|
Os desfechos foram medidos de forma válida e confiável? |
|
|
|
|
|
|
|
|
|
O tempo de acompanhamento relatado foi suficiente para que os resultados ocorressem? |
|
|
|
|
|
|
|
|
|
O acompanhamento foi completo e, se não, as razões para a perda de acompanhamento foram descritas e exploradas? |
|
|
|
|
|
|
|
|
|
Foram utilizadas estratégias para lidar com o acompanhamento incompleto? |
|
|
|
|
|
|
|
|
|
Foi utilizada análise estatística apropriada? |
|
|
|
|
|
|
|
|
Figura 2. Avaliação do risco de viés dos estudos incluídos na revisão sistemática
Legendas: ___ = Sim; ___ = Não; ___ = Incerto; ___= Não aplicável.
Para SG e SLP, todos os estudos apresentaram a mediana de sobrevida em meses. Apenas um estudo expressou o efeito do tratamento como uma hazard ratio (HR). Na comparação entre gefitinibe e platina, a HR foi de 1,56 (IC 95% 1,50 a 1,62; p<0,0001)19. Por conta da ausência do número de eventos, o qual permitiria calcular as demais HR, não foi possível conduzir a metanálise com os estudos que reportaram esse desfecho.
No estudo com o maior número de participantes19, a mediana de SG foi de 19,4 meses (IC 95% 18,8 a 19,9 meses), 17,5 meses (IC 95% 16,3 a 18,6 meses) e 11,4 (IC 95% 11,1 a 11,7 meses) nos grupos gefitinibe, erlotinibe e quimioterapia com derivados de platina, respectivamente.
A mediana de SLP no estudo com maior número de participantes18 foi de 10,4 meses (IC 95% 8,9 a 11,3 meses), 12,2 meses (IC 95% 9,1 a 17,3 meses), 5,6 meses (IC 95% 5,1 a 6,3 meses) e 4,9 meses (IC 95% 4,5 a 5,3 meses) nos grupos gefitinibe, erlotinibe, pemetrexede e bevacizumabe, respectivamente.
Observa-se na Tabela 2 que o uso de gefitinibe ou erlotinibe apresentou mediana de SG superior ao grupo comparador, em três dos cinco estudos analisados. Entretanto, Schuette et al.20 identificaram uma pequena diferença favorecendo o uso de quimioterapia (18,1 meses; IC 95% 15,1 a 23,5 meses), quando comparada ao gefitinibe (17,4 meses; IC 95% 14,7 a 20,4 meses). Nesse estudo, predominou o uso de carboplatina (45,5%), cisplatina (33,9%), pemetrexede (28,2%), gemcitabina (22,9%), e vinorelbina (22,7%). Wang et al.21 reportaram efeito favorável ao uso de docetaxel (10,0 meses; IC 95% não informado) quando comparado aos resultados do grupo que recebeu gefitinibe e havia EGFR do tipo selvagem (7,0 meses; IC 95% não informado). Porém, esse efeito não foi observado quando comparados os resultados do grupo que recebeu docetaxel com os do grupo que recebeu gefitinibe e havia mutação em EGFR (19,0 meses; IC 95% não informado). No estudo de Wu et al.22, a SG foi levemente superior no grupo que usou pemetrexede + cisplatina (17,3 meses; IC 95% não informado), quando comparado ao uso de gefitinibe (15,7 meses; IC 95% não informado). Porém, cabe a ressalva quanto ao tamanho da amostra (11 participantes no grupo gefitinibe e 23 no grupo quimioterapia).
Tabela 2. Sobrevida global e sobrevida livre de progressão de gefitinibe e erlotinibe em comparação à quimioterapia, segundo os estudos incluídos na revisão sistemática
|
ID estudo |
Fármaco |
n |
SG (mediana em meses) |
SLP (mediana em meses) |
Tempo de seguimento |
|
Brat 202018 |
Gefitinibe Erlotinibe Pemetrexede Bevacizumabe |
325 62 1.157 466 |
19,6 23,0 12,2 15,8 |
10,4 12,2 4,9 5,6 |
NI |
|
Chung 201919 |
Gefitinibe Erlotinibe Derivados de platina |
5.638 1.433 8.703 |
19,4 17,5 11,4 |
NA |
60 meses |
|
Schuette 201820 |
Gefitinibe Quimioterapia |
176 100 |
17,4 18,1 |
9,6 8,7 |
NI |
|
Wang 201521 |
Gefitinibe (Grupo A)a Gefitinibe (Grupo B)b Docetaxel |
31 43 43 |
19,0 7,0 10,0 |
11,0 4,0 6,0 |
26 mesesc |
|
Wu 201922 |
Gefitinib Pemetrexede + cisplatina |
11 23 |
15,7 17,3 |
3,1 6,2 |
60 meses |
Legendas: SG = sobrevida global; SLP = sobrevida livre de progressão; NA = não avaliado; NI = não informado.
aCom mutação no receptor do fator de crescimento epidérmico (EGFR, sigla em inglês); bEGFR tipo selvagem; cMediana de seguimento.
Entre os quatro estudos que analisaram a SLP, foi identificado, em três, melhores resultados para gefitinibe ou erlotinibe (Tabela 2). A única exceção foi observada no estudo de Wu et al.22, que tinha pequeno tamanho amostral.
Em relação aos EA, Brat et al.18 descreveram a predominância de eventos entre os participantes que receberam erlotinibe (43,6%) ou gefitinibe (27,7%). Não se informou a gravidade dos EA ou o tipo de evento. Entre os participantes do estudo de Wang et al.21 que receberam gefitinibe, 25,7% apresentaram diarreia grau I e 5,4% grau III, e 9,5% desenvolveram rash cutâneo grau III. No grupo que recebeu o docetaxel, foram relatados mielossupressão grau I (41,9%) e IV (16,3%), náusea, vômito ou diarreia com gravidade não informada (51,2%). Já no estudo de Schuette et al.20, foram relatados 239 EA no grupo que recebeu gefitinibe, sendo 20 deles classificados como grau III, incluindo isquemia cardíaca/infarto, diarreia e cistite. Os autores, porém, não relataram o número de EA no grupo controle.
A Tabela 3 apresenta a sumarização dos resultados dos estudos que analisaram a taxa de adesão e a QV associada ao tratamento com gefitinibe e erlotinibe.
Tabela 3. Taxa de adesão e dados de qualidade de vida associada ao tratamento com gefitinibe e erlotinibe, segundo estudos incluídos na revisão sistemática
|
ID estudo |
Fármaco |
Características analisadas |
Resultados |
|
Hess 201723 |
Erlotinibe |
Total de pacientes moniotorados Medication Possession Ratio – média Taxa de não aderentes ao tratamento Média de dias sem terapia Média de persistência de tratamento (dias) Percentual de pacientes que descontinuaram o tratamento |
407 0,96 + 0,17 14,3% 47,0 + 146,0 235,7 + 300,4 8,6% |
|
Timmers 201524 |
Erlotinibe |
Total de pacientes monitorados Medication Event Monitoring System – taxa de adesão Média de duração do tratamento (dias) Tempo máximo de seguimento (dias) |
55 92,7% 60,2 + 38,8 120 |
|
Wei 201925 |
Erlotinibe |
Total de pacientes monitorados Melhora dos sintomas relacionados à doença após 2 semanas de tratamento Melhora dos sintomas relacionados à doença após 4 semanas de tratamento Melhora dos sintomas relacionados à doença após 12 semanas de tratamento |
54 51,9% 37,0% 38,9% |
|
Gefitinibe |
Total de pacientes monitorados Melhora dos sintomas relacionados à doença após 2 semanas de tratamento Melhora dos sintomas relacionados à doença após 4 semanas de tratamento Melhora dos sintomas relacionados à doença após 12 semanas de tratamento |
202 44,6% 44,6% 46,5% |
aInstrumentos utilizados na avaliação da qualidade de vida: Functional Assessment of Cancer Therapy-Lung (FACT-L) e Questionnaire and Treatment Outcome Index (TOI).
Os dois estudos que analisaram a adesão ao tratamento envolveram apenas pacientes utilizando erlotinibe23,24. Em ambos os estudos, a taxa de adesão foi considerada alta, conforme as metodologias utilizadas.
O único estudo que avaliou QV25 incluiu pacientes que receberam gefitinibe e erlotinibe. Os resultados do estudo apontaram melhores resultados nos usuários em tratamento com gefitinibe após quatro e 12 semanas de tratamento.
DISCUSSÃO
Nesta revisão sistemática, foram incluídos somente estudos observacionais conduzidos a partir de 2014 com a finalidade de analisar a efetividade e a segurança de gefitinibe e erlotinibe em comparação com os dados dos ECR, utilizados para sustentar a decisão de incorporação desses medicamentos no SUS.
Em 2013, a recomendação de incorporação de gefitinibe foi baseada em dados de SLP obtidos de dois ECR de fase III26,27 e duas revisões sistemáticas com metanálise28,29. As medianas de SLP variaram de 9,2 meses26 a 10,8 meses27 no grupo que recebeu gefitinibe, e 5,4 meses27 a 6,3 meses26 no grupo que recebeu quimioterapia. Resultados semelhantes aos encontrados nesta revisão sistemática, cujas medianas de SLP variaram de 9,6 meses a 11,0 meses no grupo gefitinibe e 4,9 meses a 8,7 meses no grupo quimioterapia.
Para incorporação, as medianas de SG foram apresentadas somente em um estudo27 e foram de 30,5 meses no grupo gefitinibe e 23,6 meses no grupo quimioterapia, sem diferença estatisticamente significativa. Na época, os ECR de fase III dos medicamentos não haviam sido finalizados e, portanto, tais dados não foram utilizados para avaliação. Na presente revisão sistemática, as medianas de SG variaram de 19,0 a 19,6 meses no grupo gefitinibe, bem abaixo do valor obtido no ECR, mas ainda favorecendo o uso da tecnologia em comparação à quimioterapia padrão.
Do mesmo modo, a incorporação de erlotinibe foi baseada em dados de SLP obtidos de dois ECR fase III30,31 e duas revisões sistemáticas28,32. As medianas de SLP variaram de 9,5 meses33 a 13,7 meses (IC 95% 10,6 a 15,3)31 no grupo erlotinibe, em comparação com 4,6 meses (IC 95% 4,2 a 5,4)29 a 6,0 meses (IC 95% 5,4 a 6,7)32 no grupo quimioterapia, com redução de 63% e 84% no risco de ocorrer evento de progressão. Apenas um estudo incluído nesta revisão sistemática analisou a SLP do uso de erlotinibe e o resultado foi comparável aos dos ECR (12,2 meses no grupo intervenção versus 5,6 no grupo controle)18.
Na SG, o estudo EURTAC30 não demonstrou diferença significativa no uso de erlotinibe ou quimioterapia (HR 1,04; IC 95% 0,65 a 1,68, p=0,87). Como neste estudo as medianas de SG não foram apresentadas, não foi possível realizar a comparação com os dados da presente revisão sistemática.
Após a incorporação de erlotinibe e gefitinibe no SUS, outros ECR foram publicados33-40. Um estudo encontrou mediana de SG de 34,9 meses para uso de gefitinibe36. Os demais reportaram resultados de SG menores em comparação ao utilizado na decisão de incorporação do medicamento33,34,36,39. Em nenhum deles, foi identificada diferença estatisticamente significativa entre os grupos33,34,36,38,39. Em relação à SLP, os resultados dos estudos que avaliaram gefitinibe ficaram próximos aos utilizados na decisão de incorporação, exceto em um33, que obteve resultados inferiores aos do grupo que recebeu gefitinibe (mediana de 5,8 meses).
Dados de SG no uso de erlotinibe foram reportados em três ECR35,37,40. No estudo de Yue et al.40, os pacientes foram acompanhados por cinco anos, com medianas de SG superiores aos dos estudos observacionais incluídos nesta revisão sistemática, e com resultados melhores ao estimado no estudo de Rosell et al.30, utilizado no momento da incorporação.
No estudo de Wu et al.37, a SLP ficou próxima aos achados prévios. Porém, Lee et al.35 encontraram resultados de SLP inferiores aos relatados nos ECR utilizados na incorporação e nos estudos observacionais. Não foram identificados motivos para tal diferença.
A frequência de EA e de EA graves associados ao erlotinibe e gefitinibe, nos estudos incluídos na revisão sistemática, pode ser considerada baixa, especialmente quando comparada com a quimioterapia. Os principais EA relatados nos estudos não puderam ser comparados aos descritos nos relatórios da Conitec, em razão da ausência de controle dos fatores associados nos estudos observacionais.
Considerando que esses medicamentos funcionam pela mesma via molecular, eles podem apresentar EA similares quando administrados para o tratamento de CPCNP EGFR positivo, e os diferentes perfis de toxicidade desses fármacos se devem a diferenças em sua estrutura química e farmacocinética41. Rash cutâneo e diarreia estão entre os EA mais frequentes desses medicamentos34-35,39, por causa da sua ação na função de manutenção e do crescimento dos tecidos epiteliais. Adicionalmente, os EA hepáticos ocorrem por diferentes mecanismos42. Assim, os resultados encontrados se assemelham ao esperado.
No momento da incorporação, não foram disponibilizados dados sobre a taxa de adesão e QV relacionada ao tratamento com gefitinibe e erlotinibe9-10. Compreender como o uso dos medicamentos ocorre é essencial para criar condições de tratamento que irão fornecer benefício clínico ideal. Os resultados relatados pelo paciente devem ser considerados quando do processo de tomada de decisão do tratamento, pois melhor refletem o estado de saúde dos pacientes43.
A despeito das metodologias distintas, a taxa de adesão dos estudos, incluídos nesta revisão sistemática, foi superior a 85%, sendo considerada alta44. A adesão ao tratamento é uma importante proxy para o alcance de desfechos favoráveis em oncologia45. A ausência de adesão, além de favorecer resultados negativos, promove custos sociais e econômicos aos indivíduos e sistemas de saúde46. Joret et al.44 apontam que a carga econômica da não utilização de medicamentos orais do tipo TKI, para pacientes com CPCNP, é bastante alta, e sugerem que a implementação de estratégias de intervenção sistemáticas seja necessária para favorecer a adesão e a continuidade do tratamento.
No que tange à QV, os resultados obtidos nesta revisão apontaram melhora e manutenção prolongada de controle de sintomas, traduzindo-se em desfechos adequados relatados pelos pacientes. Em geral, dados de QV são subestimados ou sub-reportados em ECR envolvendo pacientes com CPCNP47. A comunicação adequada de dados de QV é um importante instrumento para apoiar a tomada de decisão clínica e para subsidiar processos de avaliação de ciclos de vida de tecnologias incorporadas aos sistemas de saúde48.
Esta revisão sistemática seguiu uma metodologia rigorosa, e o protocolo foi registrado prospectivamente na plataforma PROSPERO. A estratégia de busca foi ampla e sensível, resultando em um grande número de referências a serem triadas, minimizando o risco de não incluir estudos relevantes. Pesquisou-se a literatura cinza, e não foram encontrados estudos adicionais ou com a população brasileira, especificamente. A presente revisão sistemática apresenta algumas limitações. A primeira refere-se ao grau de heterogeneidade das populações incluídas nos estudos, impossibilitando análises comparadas e a realização de metanálise. A segunda está relacionada ao baixo número de eventos observados que contribuíram para a imprecisão das estimativas de efeito. Como terceira limitação, aponta-se que os estudos observacionais apresentam potenciais fatores confundidores, necessitando de maior rigor metodológico em seu delineamento. De forma geral, todos os estudos incluídos nesta revisão apresentaram algum tipo de viés ou critérios de qualidade não atendidos. Porém, o instrumento do Instituto Joanna Briggs não fornece um resultado global do risco de viés, impossibilitando a realização de uma análise comparativa dos estudos incluídos.
O monitoramento de tecnologias incorporadas em qualquer sistema de saúde é importante para a manutenção do processo de avaliação de tecnologias em saúde. Estudos observacionais assumem um papel considerável nesse monitoramento tanto para avaliação de efetividade e segurança quanto para avaliação de adesão ao tratamento e QV.
CONCLUSÃO
A comparação entre os dados dos estudos observacionais com ECR publicados antes e após a incorporação dos medicamentos demonstrou que ambos têm benefício clínico em relação à SLP, porém, o mesmo não foi observado com a SG. A frequência de EA foi considerada baixa e o perfil de segurança foi semelhante ao demonstrado nos ECR.
Os dados de adesão ao tratamento e de QV identificados na presente revisão sistemática são relevantes, uma vez que apontam alta taxa de adesão dos pacientes e melhora na QV dos pacientes em uso de gefitinibe, principalmente, de forma prolongada.
A presente revisão sistemática com estudos de mundo real mostrou importantes questões quando comparados aos dados apresentados para decisão de incorporação das tecnologias, erlotinibe e gefitinibe por parte da Conitec. Cabe destacar que, no momento da incorporação, foram apresentados apenas dados parciais da eficácia reportada nos estudos incluídos, sendo extremamente relevante a presente análise.
CONTRIBUIÇÕES
Annemeri Livinalli e Mario Jorge Sobreira da Silva contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica. Barbara Delano Cruz, Isabel Cristina Martins Emmerick, Isabela de Pinho Pestana, Juliana Machado-Rugolo, Leticia Barbosa Teixeira e Mariana Michel Barbosa contribuíram substancialmente na obtenção, análise e interpretação dos dados; e na redação. Todos os autores aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Ministério da Saúde e Conselho Nacional de Desenvolvimento Científico e Tecnológico.
REFERÊNCIAS
1. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-63. doi: https://doi.org/10.3322/caac.21834
2. Santos MO, Lima FCDS, Martins LFL, et al. Estimativa de incidência de câncer no Brasil, 2023-2025. Rev Bras Cancerol 2023;69(1):e-213700. doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n1.3700
3. Bender E. Epidemiology: the dominant malignancy. Nature. 2014;513:S2-3. doi: https://doi.org/10.1038/513S2a
4. Valerio TS, Emmerick ICM, Sobreira da Silva MJ. Factors associated with late-stage diagnosis and overall survival for lung cancer: an analysis of patients treated in a Brazilian hospital and a US-hospital from 2009 to 2019. Cancer Epidemiol. 2023;86:102443. doi: https://doi.org/10.1016/j.canep.2023.102443
5. Lima VCCD, Baldotto C, Terra RM, et al. Year in review 2018: lung cancer. Braz J Oncol. 2018;14(49):e-20180007. doi: https://doi.org/10.5935/2526-8732.20180007
6. Abdelgalil AA, Al-Kahtani HM, Al-Jenoobi FI. Erlotinib. In: Brittain H, editor. Profiles of drug substances, excipients and related methodology. London: Academic Press; 2020. p. 93-117. doi: https://doi.org/10.1016/bs.podrm.2019.10.004
7. Skoulidis F, Heymach JV. Co-occurring genomic alterations in non-small-cell lung cancer biology and therapy. Nat Rev Cancer. 2019;19(9):495-509. doi: https://doi.org/10.1038/s41568-019-0179-8
8. Mathias C, Prado GF, Mascarenhas E, et al. Lung cancer in Brazil. J Thorac Oncol. 2020;15(2):170-5. doi: https://doi.org/10.1016/j.jtho.2019.07.028
9. Agência Nacional de Vigilância Sanitária (BR). Relatório de recomendação da Comissão Nacional de Incorporação de Tecnologias no SUS – Erlotinibe para câncer de pulmão de células não pequenas. Brasília, DF: Ministério da Saúde; 2013.
10. Agência Nacional de Vigilância Sanitária (BR). Relatório de Recomendação da Comissão Nacional de Incorporação de Tecnologias no SUS – Gefitinibe para câncer de pulmão de células não pequenas em primeira linha. Brasília, DF: Ministério da Saúde; 2013.
11. Ministério da Saúde (BR), Secretaria de Atenção Especializada à Saúde. Portaria nº 957, de 26 de setembro de 2014. aprova as diretrizes diagnósticas e terapêuticas do câncer de pulmão [Internet]. Diário Oficial da União, Brasília, DF. 2014 set 29 [acesso 2022 set 20]; Seção 1:59. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/sas/2014/prt0957_26_09_2014.html
12. Kirwin E, Round J, Bond K, et al. A conceptual framework for life-cycle health technology assessment. Value Health. 2022; 25(7):1116-23. doi: https://doi.org/10.1016/j.jval.2021.11.1373
13. University of York. Centre for Reviews and Dissemination. New York: University of York; 2019. PROSPERO - International prospective register of systematic reviews. 2023. [acesso 2023 ago 31]. Disponível em: https://www.crd.york.ac.uk/prospero/display_record.php?ID=CRD42022337969
14. Moher D, Liberati A, Tetzlaff J, et al. Principais itens para relatar revisões sistemáticas e meta-análises: a recomendação PRISMA. Epidemiol Serv Saúde. 2015;24(2):335-42. doi: https://doi.org/10.5123/S1679-49742015000200017
15. Munn Z, Moola S, Lisy K, et al. Methodological guidance for systematic reviews of observational epidemiological studies reporting prevalence and cumulative incidence data. Int J Evid Based Healthc. 2015;13(3):147-53. doi: https://doi.org/10.1097/XEB.0000000000000054
16. Rusdi F, Iskandar H, Hardjianti T, et al. The one year survival rate of lung adenocarcinoma patients treated with chemotherapy or targeted therapy. Enferm Clin. 2020;30(Supl. 4):456-60. doi: https://doi.org/10.1016/j.enfcli.2019.10.120
17. Jiang SX, Walton RN, Hueniken K, et al. Real-world health utility scores and toxicities to tyrosine kinase inhibitors in epidermal growth fator receptor mutated advanced non-small cell lung cancer. Cancer Med 2019;8(18):7542-55. doi: https://doi.org/10.1002/cam4.2603
18. Brat K, Bratova M, Skrickova J, et al. Real-life effectiveness of first-line anticancer treatments in stage IIIB/IV NSCLC patients: data from the Czech TULUNG Registry. Thorac Cancer 2020;11(11):3346-56. doi: https://doi.org/10.1111/1759-7714.13679
19. Chung CH. EGFR tyrosine kinase inhibitor therapy for lung cancer treatments and their clinical outcomes: a cohort study in Taiwan. Oncol Lett. 2019;18(6):6090-100. doi: https://doi.org/10.3892/ol.2019.10942
20. Schuette W, Schirmacher P, Eberhardt WE, et al. Treatment decisions, clinical outcomes, and pharmacoeconomics in the treatment of patients with EGFR mutated stage III/IV NSCLC in Germany: na observational study. BMC Cancer. 2018;18(1):135. doi: https://doi.org/10.1186/s12885-018-4032-3
21. Wang XY, Zhou EX. Translational research on epidermal growth factor receptor gene mutations in targeted therapy for patients with advanced non-small cell lung cancer. J Int Trans Med. 2015;3(4):248-52. doi: https://doi.org/10.11910/2227-6394.2015.03.04.04
22. Wu JY, Yu CJ, Shih JY. Effectiveness of treatments for advanced non–small-cell lung cancer with exon 20 insertion epidermal growth factor receptor mutations. Clin Lung Cancer. 2019;20(6):e620-30. doi: https://doi.org/10.1016/j.cllc.2019.06.018
23. Hess LM, Louder A, Winfree K, et al. Factors associated with adherence to and treatment duration of erlotinib among patients with non-small cell lung cancer. J Manag Care Spec Pharm.2017;23(6):643-52. doi: https://doi.org/10.18553/jmcp.2017.16389
24. Timmers L, Boons CC, Moes-Ten Hove J, et al. Adherence, exposure and patients’ experiences with the use of erlotinib in non-small cell lung cancer. J Cancer Res Clin Oncol; 2015;141(8):1481-91. doi: https://doi.org/10.1007/s00432-015-1935-0
25. Wei YF, Huang WT, Liu TC, et al. Factors associated with improvement in symptoms and quality of life for first-line EGFR-tyrosine kinase inhibitor treatment in patients with EGFR-mutated non-small-cell lung cancer a multicenter prospective SMILE study. J Cancer. 2019;10(17):4151-8. doi: https://doi.org/10.7150/jca.30507
26. Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomized phase 3 trial. Lancet Oncol. 2010;11(2):121-8. doi: https://doi.org/10.1016/S1470-2045(09)70364-X
27. Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010;362(25):2380-8. doi: https://doi.org/10.1056/NEJMoa0909530
28. Gao G, Ren S, Li A, et al. Epidermal growth factor receptor-tyrosinekinase inhibitor therapy is effective as first-line treatment of advanced non-small-cell lung cancer with mutated EGFR: a meta-analysis from six phase III randomized controlled trials. Int J Cancer. 2012;131(5):e822-9. doi: https://doi.org/10.1002/ijc.27396
29. Wang F, Wang LD, Li B, et al. Gefitinib compared with systemic chemotherapy as first-line treatment for chemotherapy-naive patients with advanced non-small cell lung cancer: a meta-analysis of randomised controlled trials. Clin Oncol (R Coll Radiol). 2012;24(6):396-401. doi: https://doi.org/10.1016/j.clon.2011.09.013
30. Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open- label, randomised phase 3 trial. Lancet Oncol. 2012;13(3):239-46. doi: https://doi.org/10.1016/S1470-2045(11)70393-X
31. Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation- positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open- label, randomised, phase 3 study. Lancet Oncol. 2011;12(8):735-42. doi: https://doi.org/10.1016/S1470-2045(11)70184-X
32. Paz‐Ares L, Soulières D, Melezínek I, et al. Clinical outcomes in non-small-cell lung cancer patients with EGFR mutations: pooled analysis. J Cell Mol Med. 2010;14(1-2):51-69. doi: https://doi.org/10.1111/j.1582-4934.2009.00991.x
33. Han JY, Park K, Kim SW, et al. First-SIGNAL: first-line single-agent iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung. J Clin Oncol. 2012;30(10):1122-8. doi: https://doi.org/10.1200/JCO.2011.36.8456
34. Inoue A, Kobayashi K, Maemondo M, et al. Updated overall survival results from a randomized phase III trial comparing gefitinib with carboplatin-paclitaxel for chemo-naïve non-small cell lung cancer with sensitive EGFR gene mutations (NEJ002). Ann Oncol. 2013;24(1):54-9. doi: https://doi.org/10.1093/annonc/mds214
35. Lee SM, Khan I, Upadhyay S, et al. First-line erlotinib in patients with advanced non-small-cell lung cancer unsuitable for chemotherapy (TOPICAL): a double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2012;13(11):1161-70. doi: https://doi.org/10.1016/S1470-2045(12)70412-6
36. Patil VM, Noronha V, Joshi A, et al. Phase III study of gefitinib or pemetrexed with carboplatin in EGFR-mutated advanced lung adenocarcinoma. ESMO Open. 2017;2(1):e000168. doi: https://doi.org/10.1136/esmoopen-2017-000168
37. Wu YL, Zhou C, Liam CK, et al. First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive non-small-cell lung cancer: analyses from the phase III, randomized, open-label, ENSURE study. Ann Oncol. 2015;26(9):1883-9. doi: https://doi.org/10.1093/annonc/mdv270
38. Yoshioka H, Shimokawa M, Seto T, et al. Final overall survival results of WJTOG3405, a randomized phase III trial comparing gefitinib versus cisplatin with docetaxel as the first-line treatment for patients with stage IIIB/IV or postoperative recurrent EGFR mutation-positive non-small-cell lung cancer. Ann Oncol. 2019;30(12):1978-84. doi: https://doi.org/10.1093/annonc/mdz399
39. Tada H, Mitsudomi T, Misumi T, et al. Randomized phase III study of gefitinib versus cisplatin plus vinorelbine for patients with resected stage II-IIIA non–small-cell lung cancer with EGFR mutation (IMPACT). J Clin Oncol. 2022;40(3):231-41. doi: https://doi.org/10.1200/JCO.21.01729
40. Yue D, Xu S, Wang Q, et al. Updated overall survival and exploratory analysis from randomized, phase II EVAN study of erlotinib versus vinorelbine plus cisplatin adjuvant therapy in stage IIIa epidermal growth factor receptor+ non–small-cell lung cancer. J Clin Oncol. 2022;40(34):3912-7. doi: https://doi.org/10.1200/JCO.22.00428
41. Peters S, Zimmermann S, Adjei AA. Oral epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of non small cell lung cancer: comparative pharmacokinetics and drug drug interactions. Cancer Treat Rev. 2014;40:917-26. doi: https://doi.org/10.1016/j.ctrv.2014.06.010
42. Takeda M, Okamoto I, Fukuoka M, et al. Successful treatment with erlotinib after gefitinib related severe hepatotoxicity. J Clin Oncol. 2010;28:e273-4. doi: https://doi.org/10.1200/JCO.2009.26.5496
43. Anatchkova M, Donelson SM, Skalicky AM, et al. Exploring the implementation of patient-reported outcome measures in cancer care: need for more real-world evidence results in the peer reviewed literature. J Patient Rep Outcomes. 2018;2(1):64. doi: doi: https://doi.org/10.1186/s41687-018-0091-0
44. Joret R, Matti N, Beck M, et al. Medication adherence and persistence among patients with non-small cell lung cancer receiving tyrosine kinase inhibitors and estimation of the economic burden associated with the unused medicines. J Oncol Pharm Pract. 2022;28(5):1120-9. doi: https://doi.org/10.1177/10781552211012452
45. Verbrugghe M, Verhaeghe S, Lauwaert K, et al. Determinants and associated factors influencing medication adherence and persistence to oral anticancer drugs: a systematic review. Cancer Treat Rev. 2013;39(6):610-21. doi: https://doi.org/10.1016/j.ctrv.2012.12.014
46. Ghiggia A, Bianco A, Castelli L, et al. Adherence to oral chemotherapy: evidence from a randomised clinical trial. Eur J Cancer Care. 2021;30(1):e13336. doi: https://doi.org/10.1111/ecc.13336
47. Salomone F, Di Costanzo F, Pecoraro G, et al. Health-related quality of life is underestimated and underreported in phase III clinical trials in NSCLC. Lung Cancer. 2022;174:36-44. doi: https://doi.org/10.1016/j.lungcan.2022.10.003
48. Van Der Weijst L, Lievens Y, Schrauwen W, et al. Health-related quality of life in advanced non-small cell lung cancer: a methodological appraisal based on a systematic literature review. Front Oncol. 2019;9:715. doi: https://doi.org/10.3389/fonc.2019.00715
Recebido em 27/3/2024
Aprovado em 14/8/2024
Editor-associado: Fernando Lopes Tavares de Lima. Orcid iD: https://orcid.org/0000-0002-8618-7608
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.