Linfoma Plasmablástico de Cavidade Oral em Paciente sem Infecção pelo Vírus da Imunodeficiência Humana: Relato de Caso
Oral Cavity Plasmablastic Lymphoma in Patient without Human Immunodeficiency Virus Infection: Case Report
Linfoma Plasmablástico de Cavidad Oral en Paciente sin Infección por el Virus de la Inmunodeficiencia Humana: Informe de Caso
https://doi.org/10.32635/2176-9745.RBC.2024v70n2.4660
Martín Sebastian Rondón Salas1; Victória Bulcão Caraciolo2; Leandro Luongo de Matos3
1,2Pesquisador Autônomo. São Paulo (SP), Brasil. E-mails: martin.srs@hotmail.com; victoriacaraciolo40@gmail.com. Orcid iD: https://orcid.org/0009-0002-0426-4479; Orcid iD: https://orcid.org/0000-0003-0124-0076
3Faculdade Israelita de Ciências da Saúde Albert Einstein. Faculdade de Medicina da Universidade de São Paulo. São Paulo (SP), Brasil. E-mail: leandro.matos@einstein.br. Orcid iD: https://orcid.org/0000-0002-5068-8208
Endereço para correspondência: Martín Sebastian Rondon Salas. Rua Marc Chagall, 339 – Perdizes. São Paulo (SP), Brasil. CEP 05036-170. E-mail: martin.srs@hotmail.com
RESUMO
Introdução: O linfoma plasmablástico compreende um tumor raro que corresponde a cerca de 2% dos linfomas não Hodgkin, com maior prevalência em homens, com idade média de diagnóstico de 50 anos e de evolução agressiva, sendo comum seu diagnóstico em pacientes portadores do vírus da imunodeficiência humana (HIV), bem como com infecção por Epstein-Barr vírus (EBV). Relato do caso: Em vista da escassez de dados na literatura e da necessidade de maior entendimento sobre o seu diagnóstico, manejo e prognóstico desses pacientes, relata-se o caso de um paciente do sexo masculino, sem infecção pelo HIV, com sorologia positiva para EBV, diagnosticado com linfoma plasmablástico de mucosa da cavidade oral. O paciente em questão foi tratado de um abscesso periapical há cerca de 30 dias da primeira consulta com pouca melhora, evoluindo com ulceração da mucosa. Por suspeita de carcinoma de mucosa, foi realizada biópsia com diagnóstico de linfoma plasmablástico e iniciado tratamento com esquema quimioterápico CHOP (ciclofosfamida, doxorrubicina, vincristina e prednisona). Aproximadamente um mês após início do primeiro ciclo, o paciente foi admitido em sala de emergência com quadro de queda do estado geral, confusão mental, febre e choque séptico por neutropenia febril refratários às medidas de suporte, evoluindo a óbito. Conclusão: A descrição detalhada sobre o linfoma plasmablástico e seu curso clínico faz-se importante ao fornecer informações ao meio científico, considerando a escassez de dados sobre essa doença tão agressiva.
Palavras-chave: Linfoma Plasmablástico/diagnóstico; Linfoma não Hodgkin/diagnóstico; Infecções por Vírus Epstein-Barr; Boca/lesões.
ABSTRACT
Introduction: Plasmablastic lymphoma comprises a rare tumor, accounting for approximately 2% of non-Hodgkin lymphomas, with a higher prevalence in men, with a mean age of diagnosis of 50 years and aggressive evolution, its diagnosis is common in patients with human immunodeficiency virus (HIV) infection, as well as Epstein-Barr virus (EBV) infection. Case report: Given the scarcity of data in the literature and the need for a better understanding of its diagnosis, management, and prognosis, the case of a male patient without HIV infection but with positive serology for EBV, diagnosed with plasmablastic lymphoma of the oral cavity mucosa is reported. The patient was treated for a periapical abscess approximately 30 days before the initial consultation with little improvement, progressing to mucosal ulceration. Due to suspicion of mucosal carcinoma, a biopsy was performed, revealing plasmablastic lymphoma, and treatment was initiated with CHOP chemotherapy regimen (cyclophosphamide, doxorubicin, vincristine, and prednisone). Approximately one month after starting the first cycle, the patient was admitted to the emergency room with a decline in general condition, mental confusion, fever, and septic shock due to febrile neutropenia refractory to supportive measures, ultimately resulting in death. Conclusion: A detailed description of plasmablastic lymphoma and its clinical course is important for providing information to the scientific community, given the limited data available on this aggressive disease.
Key words: Plasmablastic Lymphoma/diagnosis; Lymphoma, Non Hodgkin/diagnosis; Epstein-Barr Virus Infections; Mouth/injuries.
RESUMEN
Introducción: El linfoma plasmablástico comprende un tumor raro que corresponde aproximadamente al 2% de los linfomas no Hodgkin, con una mayor prevalencia en hombres, con una edad media de diagnóstico de 50 años y una evolución agresiva. Es común su diagnóstico en pacientes con infección por el virus de inmunodeficiencia humana (VIH), así como con infección por el virus de Epstein-Barr (EBV). Informe del caso: Dada la escasez de datos en la literatura y la necesidad de comprender mejor su diagnóstico, manejo y pronóstico, se presenta el caso de un paciente masculino sin infección por el virus de inmunodeficiencia humana, pero con serología positiva para el virus de Epstein-Barr, diagnosticado con linfoma plasmablástico de la mucosa de la cavidad oral. El paciente había sido tratado por un absceso periapical aproximadamente 30 días antes de la primera consulta con poca mejoría, progresando a ulceración de la mucosa. Debido a la sospecha de carcinoma de mucosa, se realizó una biopsia que reveló linfoma plasmablástico, y se inició el tratamiento con el régimen de quimioterapia CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona). Aproximadamente un mes después de comenzar el primer ciclo, el paciente fue admitido en la sala de emergencias con un deterioro del estado general, confusión mental, fiebre y shock séptico debido a neutropenia febril refractaria a las medidas de apoyo, lo que finalmente resultó en su fallecimiento. Conclusión: Una descripción detallada del linfoma plasmablástico y su curso clínico es importante para agregar información a la comunidad científica, especialmente dada la limitada disponibilidad de datos sobre esta enfermedad agresiva.
Palabras clave: Linfoma Plasmablástico/diagnóstico; Linfoma no Hodgkin/diagnóstico; Infecciones por Virus de Epstein-Barr; Boca/lesiones.
INTRODUÇÃO
Os linfomas são neoplasias hematológicas amplamente conhecidas e podem ser divididos em linfoma de Hodgkin (LH) e linfoma não Hodgkin (LNH). Entre os não Hodgkin, existem diversos subtipos de classificações, sendo o linfoma difuso de grandes células B um dos mais comuns, correspondendo a cerca de 25% a 40% dos casos. Ocorre predominantemente em homens (55%) e possui diferentes categorias, entre eles o linfoma plasmablástico (LPB)1-4, um tumor raro que corresponde a aproximadamente 2% dos LNH. É então definido como uma neoplasia de grandes células B de alto grau de fenótipo plasmocítico. Apresenta uma prevalência maior em homens, sendo a média de idade ao diagnóstico de 50 anos. Caracteriza-se por um quadro clínico de evolução agressiva, sendo comum seu diagnóstico em pacientes portadores do vírus da imunodeficiência humana (HIV), podendo estar associado também à infecção por Epstein-Barr vírus (EBV). A apresentação fora do sistema linfático é comum4, sendo os locais de acometimento preferenciais a cavidade oral e o trato digestivo. O diagnóstico clínico é muitas vezes desafiador em vista de características sobrepostas de linfomas de alto grau e malignidade de células plasmocíticas4-6. O manejo é feito com esquemas quimioterápicos intensos, mas sem um padrão universalmente definido, com prognóstico reservado na maior parte dos casos.
Em vista da escassez de dados na literatura, relata-se o caso clínico de um paciente do sexo masculino (HIV negativo e EBV positivo) não imunocomprometido, diagnosticado com LPB da mucosa da cavidade oral, para melhor entendimento sobre o seu diagnóstico e curso clínico, além do manejo e prognóstico desses pacientes.
O paciente faz parte de protocolo de pesquisa registrado no Comitê de Ética em Pesquisa (CEP) da instituição sob o número de parecer 6724433 (CAAE: 32884214.5.0000.0065) e, em virtude do desfecho, existe dispensa aprovada de consentimento para investigações futuras, conforme a Resolução n.º 466/20127 do Conselho Nacional de Saúde.
RELATO DO CASO
Homem, 88 anos, em tratamento odontológico por abscesso periapical do canino inferior esquerdo há cerca de 30 dias, com pouca melhora do quadro, evolução com ulceração de mucosa com piora rápida e progressiva. Esteve presente em primeira consulta com o Serviço de Cirurgia de Cabeça e Pescoço no dia 8 de novembro de 2021. Tinha como antecedentes hipertensão tratada e tabagismo esporádico e passivo. Foi encaminhado para avaliação da Cirurgia de Cabeça e Pescoço após a realização de biópsia da lesão pelo odontologista em 26 de outubro de 2021, com resultado preliminar de neoplasia maligna pouco diferenciada, aguardando exame imuno-histoquímico complementar.
À oroscopia (Figura 1), foi evidenciada uma lesão vegetoinfiltrativa de aproximadamente 3,0 x 2,5cm, de epicentro em rebordo gengival inferior à esquerda acometendo desde os incisivos até o primeiro molar, com comprometimento de elementos dentários, presença de necrose tumoral central e acometimento do assoalho anterior da boca. Havia ainda presença de linfonodomegalias em níveis I e II bilateralmente, e o paciente apresentava-se com comprometimento significativo de performance status (KPS = 70; ECOG = 2).
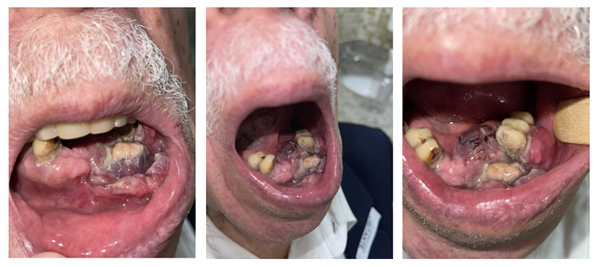
Figura 1. Oroscopia do paciente demonstrando lesão vegetoinfiltrativa em rebordo gengival inferior de aproximadamente 3,0 x 2,5 cm, com comprometimento de elementos dentários e presença de necrose tumoral central
Na tomografia por emissão de pósitrons/tomografia computadorizada (PET-CT) de estadiamento (Figura 2), realizada em 10 de dezembro de 2021, foi evidenciada uma lesão expansiva e infiltrativa no corpo da mandíbula à esquerda, medindo 5,2 x 3,5 cm (standardized uptake value – SUV máximo de 44,7), com erosão da mandíbula ultrapassando a linha média e extensão até o assoalho da boca à esquerda, sem outros achados significativos.
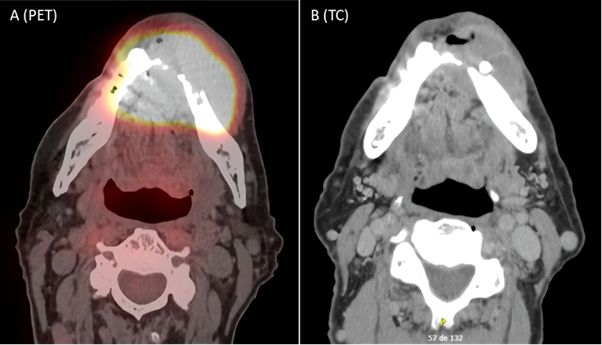
Figura 2. PET-CT demonstrando lesão expansiva e infiltrativa com realce heterogêneo em rebordo alveolar da mandíbula à esquerda, envolvendo a região da sínfise mentoniana e parassinfisiana bilateral com SUV máximo de 44,7
Uma nova biópsia foi realizada e o laudo anatomopatológico definitivo concluiu tratar-se de um LPB de mucosa, após exame imuno-histoquímico demonstrar CD3 negativo, CD20 negativo e CD138 positivo, além de EBV positivo. O paciente foi encaminhado para avaliação e tratamento pela hematologia.
Iniciou tratamento com esquema quimioterápico CHOP (ciclofosfamida, doxorrubicina, vincristina e prednisona) em "dose cheia" (D1 em 20 de dezembro de 2021), uma vez que tinha comorbidades compensadas e, apesar da idade avançada, tratava-se de doença agressiva. Após o primeiro ciclo do tratamento, o paciente evoluiu com sangramento oral, leucopenia grave com neutropenia assintomática, plaquetopenia e foi adequadamente tratado para essas toxicidades. Entretanto, foi admitido em sala de emergência no dia 2 de janeiro de 2022 por queda do estado geral, confusão mental, febre e choque séptico por neutropenia febril refratários às medidas de suporte, antibioticoterapia de amplo espectro e drogas vasoativas, evoluindo rapidamente a óbito.
DISCUSSÃO
Por ser uma afecção rara, há poucos casos de LPB na literatura. No entanto, existem alguns fatores que podem ajudar a identificar ou suspeitar dessa doença. O LPB é uma variante imunoblástica e geralmente se apresenta em pacientes HIV-positivo, imunocomprometidos e possui relação com o EBV1-3. A apresentação clínica é geralmente agressiva, com rápida evolução, como demonstrado neste caso, no qual o paciente apresentou-se com massa volumosa em cavidade oral, com queixa de rápida evolução, em apenas 30 dias. Além disso, a apresentação extranodal é bem comum4, como apresentado nesse paciente, com uma afecção da cavidade oral (um dos locais mais acometidos pelo fenótipo em discussão). A pesquisa de certos padrões imuno-histoquímicos por meio da biopsia é essencial para o diagnóstico, visto que a presença de certos marcadores (p. ex.: CD38, CD138, PRDM1, IRF4 E CD79a) e a ausência de outros (p.ex.: CD19, CD20 e o PAX5) podem indicar fortemente o diagnóstico4,5. Nesse caso, o paciente apresentava ausência de CD20, geralmente expresso em células B maduras ou outros tipos de linfomas como o de Burkitt, e a presença de CD138 (marcador relacionado com diferenciação plasmocitária), associado ao EBV, que tem como principal envolvimento a teoria da inibição da apoptose via diversos mecanismos intracelulares, favorecendo o surgimento dessa neoplasia. Esse padrão imuno-histoquímico associado à afecção da mucosa oral e à clínica agressiva levou ao diagnóstico desse linfoma. Não obstante, nem sempre as apresentações terão o mesmo padrão, como no caso desse paciente, com apresentação clinicamente compatível, mas sem infecção por HIV ou história de imunocomprometimento. Além disso, vale ressaltar a importância da realização do PET-CT para o estadiamento inicial da doença, uma vez que tal exame pode ser responsável pela mudança da terapêutica de alguns casos, por meio de aumento ou diminuição de estadiamento quando comparado à CT isoladamente6. No entanto, em razão da falta de evidência e de estudos que comparem a sensibilidade e especificidade dos resultados da CT isoladamente com o PET-CT no mesmo paciente, por meio do padrão-ouro (análise patológica), a maioria dos resultados de desfechos oncológicos é determinada pelo seguimento clínico de longo prazo para confirmar a presença ou ausência da doença6.
O tratamento do LPB não possui um esquema padrão bem estabelecido, porém a maioria das recomendações na literatura considera regimes mais intensos. Posto isso, no caso do paciente deste relato, o regime CHOP foi empregado em “dose cheia” justamente por se tratar de uma doença agressiva. Na literatura, são descritos estudos que também demonstram eficácia do esquema EPOCH (etoposídeo, prednisona, vincristina, ciclofosfamida e doxorrubicina) em pacientes com linfomas associados ao HIV, apesar de não ser especificada a sua aplicabilidade ao LPB. De acordo com um artigo de revisão sobre a biologia e o tratamento do LPB, publicado pela American Society of Hematology4, os esquemas de tratamento mais utilizados atualmente, por causa da sua intensidade e maior sobrevida em relação a outros esquemas, são o EPOCH, CODOX-M/IVAC (ciclofosfamida, vincristina, doxorrubicina, metotrexato alternando com ifosfamida, etoposideo e citarabina) e o hyper-CVAD (ciclofosfamida hiperfracionada, vincristina, doxorrubicina, e dexametasona) alternando com metotrexato e citarabina. Apesar de o esquema CHOP não ser o mais recomendado, há dois artigos citados nesta revisão que não demostraram diferença entre o esquema CHOP e EPOCH. O prognóstico do LPB, por ser uma doença agressiva, não tão facilmente diagnosticada e exigir um tratamento agressivo, é geralmente reservado4,5,8-10. Alguns artigos e revisões sistemáticas na literatura4,5,10 indicam uma sobrevida geral de 15 meses para pacientes com LPB HIV-positivo e entre sete e nove meses para pacientes com LPB HIV-negativos (11 meses para HIV-negativos imunocompetentes). No presente relato, o paciente apresentou uma sobrevida de pouco menos de dois meses, mesmo sem história de imunocomprometimento e HIV-negativo, porém em razão da grave intercorrência oncológica.
CONCLUSÃO
A descrição detalhada e relatada sobre o LPB e seu curso clínico faz-se importante ao adicionar informações ao meio científico, no qual a quantidade de dados disponíveis para essa doença é muito limitada. Dada a elevada quantidade de diagnósticos diferenciais, a inespecificidade de vários sintomas, os esquemas terapêuticos não bem definidos e o prognóstico reservado, a descrição detalhada dos casos, bem como os regimes de tratamentos utilizados, o padrão de identificação imuno-histoquímica bem descrito e o esclarecimento da associação com outras doenças virais são fundamentais para uma melhor acurácia diagnóstica, melhor tratamento e aumento da sobrevida, especialmente em uma doença tão agressiva.
CONTRIBUIÇÕES
Todos os autores contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Morton LM, Wang SS, Devesa SS, et al. Lymphoma incidence patterns by WHO subtype in the United States, 1992-2001. Blood. 2006;107(1):265.
2. Swerdlow SH, Campo E, Pileri SA, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016;127(20):2375.
3. Swerdlow SH, Campo E, Harris NL, et al, organizadores. Classification of Tumours of Haematopoietic and Lymphoid Tissues, revised. 4. ed. Lyon: International Agency for Research on Cancer; 2017.
4. Castillo JJ, Bibas M, Miranda RN. The biology and treatment of plasmablastic lymphoma. Blood. 2015;125(15):2323-30.
5. Delecluse HJ, Anagnostopoulos I, Dallenbach F, et al. Plasmablastic lymphomas of the oral cavity: a new entity associated with the human immunodeficiency virus infection. Blood. 1997;89(4):1413-20.
6. Kirby AM, Mikhaeel NG. The role of FDG PET in the management of lymphoma: what is the evidence base? Nucl Med Commun. 2007;28(5):335-54. doi: https://doi.org/10.1097/MNM.0b013e3280895e23
7. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
8. Silveira NPV, Michel FPS, Gomes PMS, et al. Linfoma Plasmablástico em paciente sem infecção pelo vírus da imunodeficiência humana: relato de caso. Hematol Transfus Cell Ther. 2022;44(Sup2):s94. doi: https://doi.org/10.1016/j.htct.2022.09.157
9. Stocco DC, Donadel CD, Monteiro CMLB, et al. Relato de caso: descrição clínica e histopatológica de Linfoma Plasmablástico em paciente portador do vírus da imunodeficiência humana. Hematol Transfus Cell Ther. 2020;42(Sup2):242-3 doi: https://doi.org/10.1016/j.htct.2020.10.407
10. Castillo J, Pantanowitz L, Dezube BJ. HIV-associated plasmablastic lymphoma: lessons learned from 112 published cases. Am J Hematol. 2008;83(10):804-9. doi: https://doi.org/10.1002/ajh.21250
Recebido em 8/4/2024
Aprovado em 23/5/2024
Editor-associado: Daniel Cohen Goldemberg. Orcid iD: https://orcid.org/0000-0002-0089-1910
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.