ARTIGO ORIGINAL
Tendência de Mortalidade por Cânceres Hematológicos em Sergipe e sua Distribuição Geoespacial de 1980 a 2021
Mortality Trend of Hematological Cancers in Sergipe and its Geospatial Distribution from 1980 to 2021
Tendencia de la Mortalidade por Cánceres Hematológicos en Sergipe y su Distribución Geoespacial de 1980 a 2021
https://doi.org/10.32635/2176-9745.RBC.2024v70n3.4699
Ríllary de Oliveira Silva Ferreira1; Alex Rodrigues Moura2; Carlos Anselmo Lima3; Angela Maria da Silva4
1-4Universidade Federal de Sergipe (UFS). Aracaju (SE), Brasil.
1E-mail: rdoliveira.sf@outlook.com. Orcid iD: https://orcid.org/0000-0003-3936-2271
2E-mail: alexrmoura@bol.com.br. Orcid iD: https://orcid.org/0000-0001-9655-9391
3E-mail: ca.lima01@gmail.com. Orcid iD: https://orcid.org/0000-0003-4269-7320
4E-mail: angela.silva910@gmail.com. Orcid iD: https://orcid.org/0000-0001-9330-537X
Endereço para correspondência: Ríllary de Oliveira Silva Ferreira. Rua Luiz Dias Mota, 59A – Luzia. Aracaju (SE), Brasil. CEP 49045-430. E-mail: rdoliveira.sf@outlook.com
RESUMO
Introdução: O câncer é a principal causa de morte de origem não metabólica no mundo. Os cânceres sanguíneos têm origem no sistema hematopoiético e são classificados em linfomas, leucemias, neoplasias de plasmócitos e síndromes mielodisplásicas. Objetivo: Descrever a tendência de mortalidade das principais neoplasias hematológicas no Estado de Sergipe entre 1980 e 2021 e sua distribuição espacial. Método: Foram estudadas, por meio de softwares de análise longitudinal e geoespacial, as taxas de mortalidade do Sistema de Informação sobre Mortalidade para o Estado e analisadas por grupo etário, sexo, tipo de neoplasia e município. Foram construídos gráficos de tendência temporal e analisadas suas variações percentuais anuais e médias, e confeccionados mapas de geodistribuição das taxas, com áreas de contiguidade, e análise de significância estatística pelos métodos Moran e LISA. Resultados: As taxas de mortalidade apresentaram-se constantemente crescentes no período em todas as neoplasias e grupos em que houve significância estatística. O maior número de óbitos ocorreu em homens com crescimento anual de 3% (IC 95%; 2,5-3,5). As leucemias corresponderam a 48,78% do total de óbitos. A ordem decrescente de mortalidade foi leucemias, linfoma não Hodgkin e mieloma múltiplo. O grupo etário de 65+ representou 35,76% do total de óbitos. As áreas de risco foram as Mesorregiões Leste e Agreste e a Região Grande Aracaju. Conclusão: A tendência de mortalidade por cânceres hematológicos em Sergipe é um tema pouco analisado. As taxas de mortalidade têm crescido no Estado, destacando-se leucemias, sexo masculino, idosos, e municípios com maior desigualdade e produção agrária.
Palavras-chave: Neoplasias Hematológicas; Mortalidade/tendências; Análise Espaço-Temporal.
ABSTRACT
Introduction: Cancer is the leading cause of non-metabolic death worldwide. Blood cancers originate in the hematopoietic system and are classified as lymphomas, leukemias, plasma cell neoplasms, and myelodysplastic syndromes. Objective: To describe the mortality trend of the main hematologic neoplasms in the State of Sergipe between 1980 and 2021 and their spatial distribution. Method: The mortality rates from the State’s Mortality Information System were investigated through longitudinal and geospatial analysis software and analyzed by age group, sex, type of neoplasm, and municipality. Time trend graphs were constructed and their annual and average percentage variations analyzed, and geodistribution maps of the rates were created, with areas of contiguity, and statistical significance analysis by the Moran and LISA methods. Results: The mortality rates were continuously increasing in the period for all statistically significant neoplasms and groups. The highest number of deaths occurred in males, with annual increase of 3% (95% CI 2.5-3.5). Leukemias accounted for 48.78% of total deaths. The descending order of mortality was leukemia, non-Hodgkin lymphoma and multiple myeloma. The age group of 65+ represented 35.76% of total deaths. The risk areas were the East and Agreste Mesoregions and the Great Aracaju Region. Conclusion: The trend of mortality due to hematologic cancers in Sergipe is a topic little analyzed. Mortality rates have increased in the State, with emphasis on leukemias, males, older adults, and municipalities with great inequality and agricultural production.
Key words: Hematologic Neoplasms; Mortality/trends; Spatio-Temporal Analysis.
RESUMEN
Introducción: El cáncer es la principal causa de muerte no metabólica en el mundo. Los cánceres de sangre se originan en el sistema hematopoyético y se clasifican en linfomas, leucemias, neoplasias de células plasmáticas y síndromes mielodisplásicos. Objetivo: Describir la tendencia de la mortalidad de las principales neoplasias hematológicas en el estado de Sergipe entre 1980 y 2021 y su distribución espacial. Método: Mediante softwares de análisis longitudinal y geoespacial se estudiaron las tasas de mortalidad del Sistema de Información sobre Mortalidad para el Estado y analizadas por edad, sexo, tipo de neoplasia y municipio. Se construyeron gráficos de tendencias temporales y se analizaron sus variaciones porcentuales anuales y promedio, y se crearon mapas de geodistribución de tarifas, con áreas de contigüidad y análisis de significación estadística mediante los métodos de Moran y LISA. Resultados: Las tasas de mortalidad aumentaron constantemente durante el período en todas las neoplasias y grupos en los que hubo significación estadística. En los hombres, que tuvieron el mayor número de muertes, hubo un aumento del 3% por año (IC 95% 2,5-3,5). La leucemia correspondió al 48,78% del total de muertes. Las causas en orden decreciente de mortalidad fueron leucemias, linfoma no Hodgkin y mieloma múltiple. El grupo de edad de 65+ representó el 35,76% del total de muertes. Las áreas de riesgo fueron las mesorregiones Este y Agreste y la región del Gran Aracaju. Conclusión: La tendencia de mortalidad por cánceres hematológicos en Sergipe es un tema poco analizado. Las tasas de mortalidad han crecido en el estado, con énfasis en leucemia, varones, adultos mayores y municipios con mayor desigualdad y producción agrícola.
Palabras clave: Neoplasias Hematológicas; Mortalidad/tendencias; Análisis Espacio-Temporal.
INTRODUÇÃO
O câncer é a principal causa de morte de origem não metabólica no mundo1. Segundo o Global Cancer Observatory (Globocan), em 2022, o risco cumulativo de desenvolver câncer antes dos 75 anos foi de 20% para ambos os sexos. Por sua vez, o risco cumulativo de morte por câncer antes dos 75 anos foi igual a 9,6% para ambos os sexos2. No Brasil, entre 1997 e 2016, ocorreram 213.750 óbitos por leucemias, linfomas, síndromes mielodisplásicas, mieloma múltiplo e outras neoplasias de plasmócitos, com 39.731 óbitos registrados apenas no Nordeste e 1.460 em Sergipe3.
As neoplasias malignas hematológicas (NMH), ou cânceres sanguíneos, têm origem em células precursoras das células sanguíneas e do sistema imunológico. Resultam de alterações na hematopoiese, levando à proliferação descontrolada de células em vários estágios de maturação, depositando-se na medula óssea, linfonodos, órgãos do sistema imune e sangue periférico. Podem ser classificadas em linfomas de Hodgkin e não Hodgkin, leucemias, neoplasias de plasmócitos (mieloma múltiplo e plasmocitoma) e síndromes mielodisplásicas4.
A quimioterapia é o tratamento mais comum para cânceres hematológicos, aumentando a sobrevida global dos pacientes. Outras opções incluem imunoterapia, radioterapia e transplante de medula óssea (TMO), dependendo do tipo da doença. Disparidades no acesso ao tratamento podem influenciar na sobrevida dos pacientes5.
Sergipe, o menor Estado da Federação, passou por mudanças importantes em sua estrutura populacional, economia e qualidade de vida nas últimas décadas. É necessário avaliar como essas mudanças influenciaram as taxas de mortalidade por cânceres hematológicos no Estado6.
O objetivo geral da pesquisa é analisar se houve aumento da mortalidade por NMH em Sergipe nos últimos anos, identificando a(s) principal(is) neoplasia(s) hematológica(s) relacionada(s) a esse aumento e estudando a distribuição dessa mortalidade por grupos etários, sexo e municípios ou Regiões de saúde no Estado. Poucas pesquisas abordam a análise espaço-temporal da mortalidade por cânceres hematológicos em Sergipe, sendo essa avaliação relevante em meio às transformações urbanas e sociais do Estado. Espera-se que o estudo contribua para fomentar novas pesquisas que elucidem a relação entre mortalidade por NMH e fatores como o Índice de Desenvolvimento Humano (IDH), disparidades no acesso à saúde e comorbidades.
MÉTODO
Estudo ecológico de séries temporais, com análise espacial, sobre os óbitos por NMH em Sergipe, no período de 1980 a 2021, utilizando dados do Sistema de Informação sobre Mortalidade (SIM)7 do Estado para calcular as taxas de mortalidade.
As taxas de mortalidade foram calculadas a partir de óbitos ocorridos em todas as faixas etárias e ambos os sexos, de acordo com os critérios de inclusão: óbito por cânceres hematológicos, conforme a 10ª revisão da Classificação Internacional de Doenças e Problemas Relacionados à Saúde (CID-10)8, em Sergipe, com registro no SIM, no período supracitado.
Os casos de óbito foram categorizados pelas CID-9 e CID-10, sendo a CID-9 utilizada até 1992. Os casos foram classificados da seguinte forma, de acordo com a CID-10: C81 – doença de Hodgkin; C82 – linfoma não Hodgkin, folicular; C83 – linfoma não Hodgkin, difuso; C84 – linfomas de células T cutâneas e periféricas; C85 – linfoma não Hodgkin de outros tipos, SOE; C90 – mieloma múltiplo e neoplasia maligna de plasmócitos; C91 – leucemia linfoide; C92 – leucemia mieloide; C93 – leucemia monocítica; C94 – outras leucemias de células de tipo específico; C95 – leucemia de tipo celular, SOE; e D46 – síndrome mielodisplásica.
As variáveis analisadas foram: tipo de neoplasia, idade ao óbito, sexo e ano do óbito. Os dados foram coletados de forma consolidada do SIM para Sergipe, mantendo o anonimato.
Para a análise da mortalidade por câncer, utilizou-se o banco de dados do SIM, gerenciado pela Secretaria de Estado da Saúde (SES), que possui registros consolidados a partir de 1980 para todo o Estado. Foram considerados casos de óbito por câncer aqueles em que a causa foi preenchida tanto como causa básica quanto como causas consequentes ou imediatas, conforme a Parte I do campo 49 da Declaração de Óbito. Os óbitos por câncer foram agrupados por sexo, grupos etários (0-19; 20-44; 45-64 e 65+), tipo de doença maligna do sangue e município de residência.
As taxas utilizadas para construção das curvas de tendência foram calculadas no programa Excel, versão 2010, com valores de p e desvios-padrão (DP) para os dados, considerando um intervalo de confiança (IC) de 95%.
Para os cálculos das taxas padronizadas e específicas por idade, utilizou-se como referências populacionais para Sergipe os censos de 1991, 2000 e 2010, além das estimativas intercensitárias fornecidas pelo Instituto Brasileiro de Geografia e Estatística (IBGE)9. A taxa específica por idade (TE) foi calculada dividindo o número total de óbitos por faixa etária e sexo no ano considerado pela população de referência por faixa etária e sexo no mesmo ano, por milhão. A taxa padronizada por idade foi calculada pelo somatório do produto entre as taxas específicas e o número de indivíduos para cada faixa etária, dividido pela população mundial padrão, conforme o modelo de Segi & Doll10.
Foram calculados os IC 95% para as taxas utilizando a fórmula: IC 95% = R ± (1,96 x SE), onde R é a taxa, 1,96 é a constante z e SE é o erro-padrão. O SE foi calculado por SE = R x √N, sendo R a taxa e N o número de óbitos para cada ano.
Foram elaboradas planilhas no Excel com o número total de óbitos por cânceres hematológicos e por neoplasia específica, escolhendo aquelas com maior mortalidade no banco de dados: leucemias, linfoma não Hodgkin e mieloma múltiplo. As planilhas também incluíram o número de óbitos por grupos etários (0-19; 20-44; 45-64 e 65+), as taxas brutas e padronizadas ano a ano, entre 1980 e 2021, para ambos os sexos, em Sergipe.
As tendências temporais de mortalidade foram calculadas com o programa Joinpoint Regression Program11, versão 5.0.2, do National Cancer Institute dos Estados Unidos. O programa identifica mudanças em curvas de tendência por meio de pontos de inflexão (Joinpoints), e determina a variação anual percentual e a sua média (APC e AAPC).
Em seguida, confecciona gráficos com as respectivas curvas de tendência temporal, permitindo a análise do crescimento ou diminuição nas taxas de mortalidade.
Para a análise temporal, utilizou-se o coeficiente milhão em razão dos valores de mortalidade muito pequenos para algumas neoplasias específicas, o que tornava impossível sua leitura pelo software. Anos com mortalidade nula foram excluídos da análise, com um limite máximo de exclusão de 20% dos anos. Dessa forma, a análise temporal foi realizada apenas para o Estado como um todo.
A análise espacial para Sergipe foi feita com o software TerraView 4.2.212, utilizando o modelo Bayes Empírico Local para suavização das taxas e o índice de Moran Global para avaliação da autocorrelação espacial. Os mapas foram exportados para o QGIS13, versão 3.10.7, para a disposição em série.
Foram confeccionadas tabelas no Excel com o código geográfico do município, seu nome, população nos censos do IBGE, taxas padronizadas por idade para cânceres hematológicos, número de óbitos por neoplasia específica, e área de saúde. Cada tabela foi dividida em períodos de dez anos (1990-1999, 2000-2009 e 2010-2019), excluindo-se os anos anteriores a 1990 por conta de mudanças geográficas.
As tabelas foram exportadas para o QGIS13, software pelo qual foram relacionadas com as malhas do Estado de Sergipe para criação de mapas contendo informações de mortalidade e geográficas. O TerraView12 calculou as taxas bayesianas e o índice de Moran, usados na confecção final dos mapas pelo QGIS13.
Em todos os mapas, a taxa de mortalidade das neoplasias estudadas foi analisada por 100 mil habitantes, diferente da análise temporal, por conveniência do programa TerraView.
A análise do índice de Moran14 considerou a autocorrelação de áreas contíguas para caracterizar a mortalidade por Regiões, classificando-as em:
– Região de alta mortalidade (Q1): municípios de alta mortalidade próximos a outros municípios de alta mortalidade.
– Região de baixa mortalidade (Q4): municípios de baixa mortalidade próximos a outros municípios de baixa mortalidade.
– Região de mortalidade variável (Q2 e Q3): municípios de alta mortalidade próximos a outros de baixa mortalidade, e vice-versa.
O método LISA14 de significância estatística confirmou as áreas de maior e menor risco populacional ao longo do período estudado, considerando a verossimilhança dos dados, representada pelos IC (95%, 99% e 99,9%).
Para os mapas, foram consideradas as taxas bayesianas, a análise do índice de Moran e a análise de significância pelo método LISA. Cada mapa foi disposto lado a lado, em série temporal, ao longo dos três períodos, na escala de 1:3.000.000, com a escala geográfica em km como referência. O programa Photoscape foi utilizado para reunir os mapas em uma única imagem, junto à legenda e às demais figuras indicativas (escala e seta indicativa de direção).
Este projeto foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de Sergipe, sob o número de parecer número 5.875.491 (CAAE: 66896523.2.0000.5546), de acordo com a Resolução n.º 466/1215 do Conselho Nacional de Saúde. O estudo utilizou dados secundários de mortalidade por câncer de indivíduos não identificados em Sergipe, coletados do SIM e disponibilizados pela SES de Sergipe.
Os autores possuem autorização para acesso aos bancos de dados consolidados do SIM de Sergipe pelos órgãos responsáveis. A obtenção desses dados foi realizada perante o Termo de Compromisso para Utilização de Dados (TCUD), dispensando assim o Termo de Consentimento Livre e Esclarecido (TCLE).
RESULTADOS
A mortalidade por leucemias, linfoma não Hodgkin e mieloma múltiplo correspondeu a 91,52% (2.966) do total de óbitos por NMH, enquanto 8,48% (275) dos óbitos foram em virtude de outras NMH. O grupo etário de 65 anos ou mais representou 35,76% (1.159) do total de óbitos registrados na série (Material Suplementar 1 e 2).
A mortalidade por leucemias, durante o período analisado, correspondeu a 48,78% (1.581) do total de óbitos por NMH, sendo as taxas padronizadas médias para o sexo masculino 42% maiores do que para o sexo feminino. A mortalidade por linfoma não Hodgkin correspondeu a 28% (908) do total, com taxas padronizadas médias 54% maiores no sexo masculino que no feminino. Para o mieloma múltiplo, que representou 14,71% (477) do total de óbitos, as taxas padronizadas médias para a mortalidade masculina foram apenas 4% maiores do que as femininas. Comparativamente, as taxas padronizadas de mortalidade para o sexo masculino foram em média 39% superiores às do sexo feminino. Em relação ao número absoluto de óbitos, o sexo masculino contou com 19,8% mais óbitos do que o sexo feminino.
Os gráficos de tendência elaborados pelo Joinpoint para o sexo masculino mostraram um aumento sem pontos de inflexão na mortalidade por milhão para todas as NMH em todas as faixas etárias, com o aumento anual mais expressivo ocorrendo no grupo etário de 65 anos ou mais (APC = 4,7, IC 95%; 3,7 – 5,8), seguido pelo grupo de adultos jovens (20-44 anos), com um APC = 2,1 (IC 95%; 1,0 – 3,2). Outro APC expressivo foi para todas as idades (APC = 3,0, IC 95%; 2,5 – 3,5) (Figura 1 e Tabela 1).
Para o sexo feminino, a tendência de mortalidade para todas as NMH apresentou crescimento entre 1992 e 2019 (APC = 2,1, IC 95%; 1,3 – 3,0). Para o grupo com mais de 65 anos, observou-se um crescimento sem pontos de inflexão, considerando a significância estatística (APC = 5,1, IC 95%; 4,2 – 6,0) até 2018.
Quanto às leucemias, no sexo masculino, para todos os grupos etários, excetuando-se o grupo de 20 a 44 e de 45 a 64 anos, em que não houve significância estatística, ocorreu um crescimento sem pontos de inflexão, destacando-se o grupo dos idosos (65+), com um APC = 3,5 (IC 95%; 2,2 – 4,7). Para o sexo feminino, a tendência de mortalidade por leucemias revelou-se crescente, sem inflexões, para a taxa padronizada por idade e no grupo de 65+ anos. O grupo etário que obteve o APC mais expressivo foi o de 65+ anos, com um APC = 3,2 (IC 95%; 1,9 – 4,6).
Quanto ao linfoma não Hodgkin, para o sexo masculino, a taxa padronizada por idade apresentou-se crescente, sem pontos de inflexão, no período (APC = 2,2, IC 95%; 1,4 – 3,0). O grupo de 65+ anos destacou-se com um APC = 2,8 (IC 95%; 1,5 – 4,1). Para o sexo feminino, a taxa padronizada por idade apresentou-se crescente, sem pontos de inflexão (APC = 1,8, IC 95%; 0,7 – 2,9).
Em relação ao mieloma múltiplo, a análise da tendência temporal para o sexo masculino mostrou aumento na taxa padronizada por idade, entre os anos de 1985 e 2021, com um APC = 5,9 (IC 95%; -4,4 – 7,4). Para o sexo feminino, para o grupo etário de 65+ anos, houve um crescimento sem pontos de inflexão, com um APC = 3,0 (IC 95%; 1,0 – 5,0).
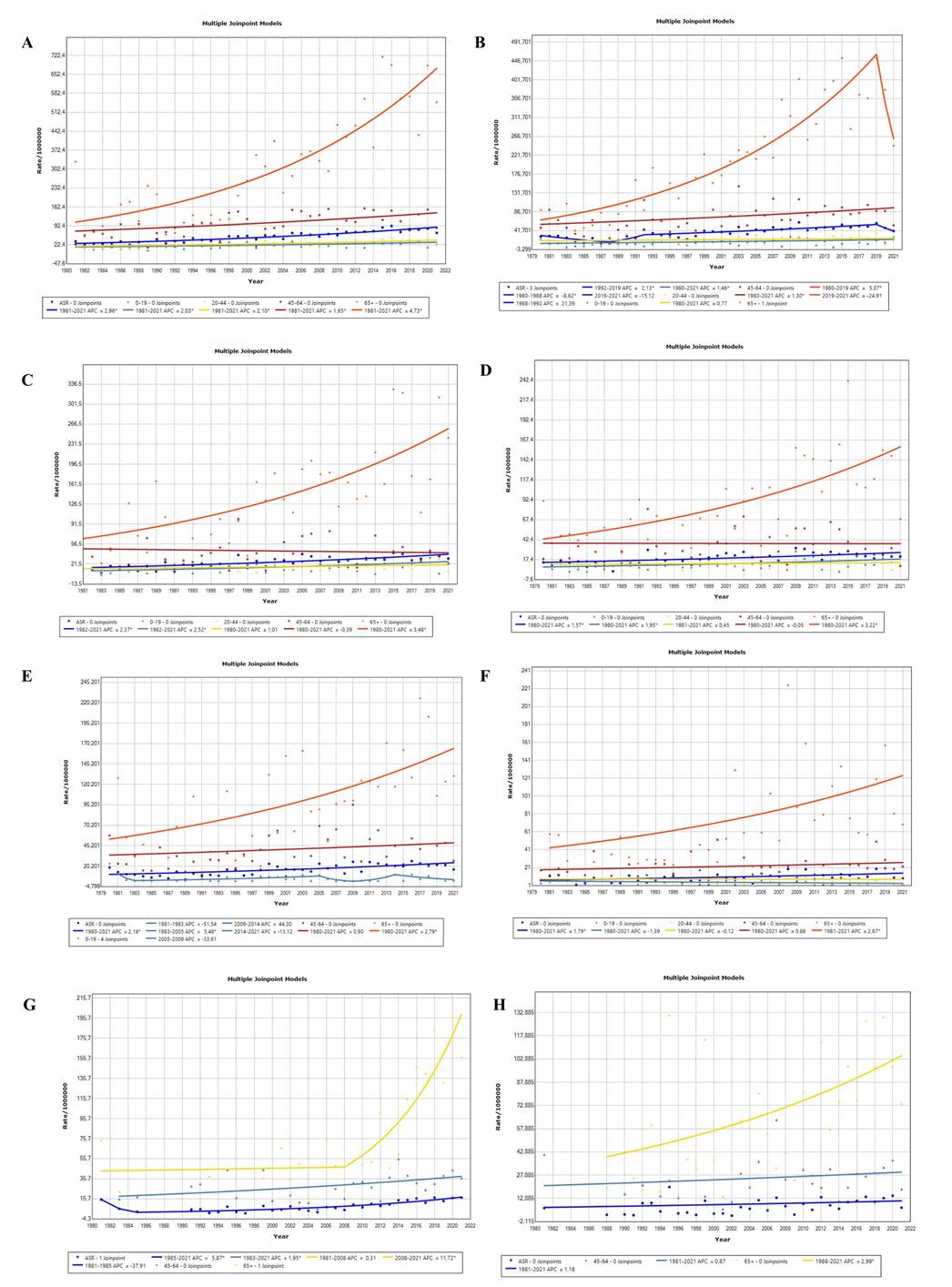
Figura 1. Tendências de mortalidade por milhão para todas as NMH e seus principais agrupamentos, para ambos os sexos, considerando as taxas padronizadas para os grupos etários de 0 a 19; 20 a 44; 45 a 64; mais de 65 anos e todas as idades (ASR)
Legendas: A e B: Total de NMH. A: sexo masculino. B: sexo feminino. C e D: Leucemias. C: sexo masculino. D: sexo feminino. E e F: linfoma não Hodgkin. E: sexo masculino. F: sexo feminino. G e F: mieloma múltiplo. G: sexo masculino. H: sexo feminino.
Tabela 1. Tendências de mortalidade para o total de NMH e seus principais agrupamentos, para ambos os sexos, considerando as taxas padronizadas para os grupos etários de 0 a 19; 20 a 44; 45 a 64; mais de 65 anos e todas as idades (TxA)
|
Todas as NMH |
|||||||
|
Feminino |
|||||||
|
TxA |
JP |
APC |
IC 95% |
p |
AAPC |
IC 95% |
p |
|
|
3 |
(1980-1988) -8,6 |
-16,3; -0,3 |
0,044 |
0,7 |
-3,4; 5,0 |
0,732 |
|
|
|
(1988-1992) 21,4 |
-15,4; 74,2 |
0,282 |
0,7 |
-3,4; 5,0 |
0,732 |
|
|
|
(1992-2019) 2,1 |
1,3; 3,0 |
<0,001 |
0,7 |
-3,4; 5,0 |
0,732 |
|
|
|
(2019-2021) -15,1 |
-39,9; 19,9 |
0,341 |
0,7 |
-3,4; 5,0 |
0,732 |
|
0-19 anos |
0 |
1,5 |
0,2; 2,7 |
0,022 |
1,5 |
0,2; 2,7 |
0,022 |
|
20-44 anos |
0 |
0,8 |
-0,4; 2,0 |
0,205 |
0,8 |
-0,4; 2,0 |
0,205 |
|
45-64 anos |
0 |
1,3 |
0,3; 2,3 |
0,009 |
1,3 |
0,3; 2,3 |
0,009 |
|
65 anos ou mais |
1 |
(1980-2019) 5,1 |
4,2; 6,0 |
< 0,001 |
3,4 |
1,2; 5,6 |
0,002 |
|
|
|
(2019-2021) -24,9 |
-50,6; 14,1 |
0,174 |
3,4 |
1,2; 5,6 |
0,002 |
|
Masculino |
|||||||
|
|
JP |
APC |
IC 95% |
p |
AAPC |
IC 95% |
p |
|
TxA |
0 |
3,0 |
2,5; 3,5 |
< 0,001 |
3,0 |
2,5; 3,5 |
< 0,001 |
|
0-19 anos |
0 |
2,0 |
0,9; 3,1 |
< 0,001 |
2,0 |
0,9; 3,1 |
< 0,001 |
|
20-44 anos |
0 |
2,1 |
1,0; 3,2 |
< 0,001 |
2,1 |
1,0; 3,2 |
< 0,001 |
|
45-64 anos |
0 |
1,7 |
0,6; 2,7 |
0,002 |
1,7 |
0,6; 2,7 |
0,002 |
|
65 anos ou mais |
0 |
4,7 |
3,7; 5,8 |
< 0,001 |
4,7 |
3,7; 5,8 |
< 0,001 |
|
Leucemias |
|||||||
|
Feminino |
|||||||
|
|
JP |
APC |
IC 95% |
p |
AAPC |
IC 95% |
p |
|
TxA |
0 |
1,6 |
0,8; 2,4 |
< 0,001 |
1,6 |
0,8; 2,4 |
< 0,001 |
|
0-19 anos |
0 |
2,0 |
0,7; 3,2 |
0,003 |
2,0 |
0,7; 3,2 |
0,003 |
|
20-44 anos |
0 |
0,4 |
-0,8; 1,7 |
0,478 |
0,4 |
-0,8; 1,7 |
0,478 |
|
45-64 anos |
0 |
0 |
-1,6; 1,5 |
0,953 |
0 |
-1,6; 1,5 |
0,953 |
|
65 anos ou mais |
0 |
3,2 |
1,9; 4,6 |
< 0,001 |
3,2 |
1,9; 4,6 |
< 0,001 |
|
Masculino |
|||||||
|
|
JP |
APC |
IC 95% |
p |
AAPC |
IC 95% |
p |
|
TxA |
0 |
2,4 |
1,6; 3,1 |
< 0,001 |
2,4 |
1,6; 3,1 |
< 0,001 |
|
0-19 anos |
0 |
2,5 |
1,3; 3,8 |
< 0,001 |
2,5 |
1,3; 3,8 |
< 0,001 |
|
20-44 anos |
0 |
1,0 |
-0,3; 2,3 |
0,133 |
1,0 |
-0,3; 2,3 |
0,133 |
|
45-64 anos |
0 |
-0,4 |
-1,9; 1,2 |
0,614 |
-0,4 |
-1,9; 1,2 |
0,614 |
|
65 anos ou mais |
0 |
3,5 |
2,2; 4,7 |
< 0,001 |
3,5 |
2,2; 4,7 |
< 0,001 |
|
Linfoma não Hodgkin |
|||||||
|
Feminino |
|||||||
|
|
JP |
APC |
IC 95% |
p |
AAPC |
IC 95% |
p |
|
TxA |
0 |
1,8 |
0,7; 2,9 |
0,002 |
1,8 |
0,7; 2,9 |
0,002 |
|
0-19 anos |
0 |
-1,4 |
-3,5; 0,8 |
0,195 |
-1,4 |
-3,5; 0,8 |
0,195 |
|
20-44 anos |
0 |
-0,1 |
-2,3; 2,1 |
0,912 |
-0,1 |
-2,3; 2,1 |
0,912 |
|
45-64 anos |
0 |
0,9 |
-0,6; 2,3 |
0,225 |
0,9 |
-0,6; 2,3 |
0,225 |
|
65 anos ou mais |
0 |
2,7 |
0,8; 4,6 |
0,006 |
2,7 |
0,8; 4,6 |
0,006 |
|
Masculino |
|||||||
|
|
JP |
APC |
IC 95% |
p |
AAPC |
IC 95% |
p |
|
TxA |
0 |
2,2 |
1,4; 3,0 |
< 0,001 |
2,2 |
1,4; 3,0 |
< 0,001 |
|
|
4 |
(1981-1983) -51,5 |
-88,7; 107,9 |
0,314 |
-2,6 |
-13,6; 9,8 |
0,664 |
|
|
|
(1983-2005) 5,5 |
1,2; 10,0 |
0,014 |
-2,6 |
-13,6; 9,8 |
0,664 |
|
|
|
(2005-2009) -33,6 |
-69,2; 43,1 |
0,282 |
-2,6 |
-13,6; 9,8 |
0,664 |
|
|
|
(2009-2014) 44,3 |
-7,5; 125,1 |
0,101 |
-2,6 |
-13,6; 9,8 |
0,664 |
|
0-19 anos |
|
(2014-2021) -13,1 |
-28,9; 6,1 |
0,160 |
-2,6 |
-13,6; 9,8 |
0,664 |
|
20-44 anos |
0 |
0,8 |
-1,0; 2,6 |
0,398 |
0,8 |
-1,0; 2,6 |
0,398 |
|
45-64 anos |
0 |
0,9 |
-0,5; 2,3 |
0,192 |
0,9 |
-0,5; 2,3 |
0,192 |
|
65 anos ou mais |
0 |
2,8 |
1,5; 4,1 |
< 0,001 |
2,8 |
1,5; 4,1 |
< 0,001 |
|
Mieloma múltiplo |
|||||||
|
Feminino |
|||||||
|
|
JP |
APC |
IC 95% |
p |
AAPC |
IC 95% |
p |
|
TxA |
0 |
1,2 |
-0,7; 3,1 |
0,199 |
1,2 |
-0,7; 3,1 |
0,199 |
|
45-64 anos |
0 |
0,9 |
-1,2; 3,0 |
0,401 |
0,9 |
-1,2; 3,0 |
0,401 |
|
65 anos ou mais |
0 |
3,0 |
1,0; 5,0 |
0,004 |
3,0 |
1,0; 5,0 |
0,004 |
|
Masculino |
|||||||
|
|
JP |
APC |
IC 95% |
p |
AAPC |
IC 95% |
p |
|
TxA |
1 |
(1981-1985) -37,9 |
-65,8; 12,6 |
0,112 |
0,4 |
-5,3; 6,4 |
0,901 |
|
|
|
(1985-2021) 5,9 |
-4,4; 7,4 |
< 0,001 |
0,4 |
-5,3; 6,4 |
0,901 |
|
45-64 anos |
0 |
2,0 |
0,1; 3,8 |
0,036 |
2,0 |
0,1; 3,8 |
0,036 |
|
65 anos ou mais |
1 |
(1981-2008) 0,3 |
-3,5; 4,2 |
0,867 |
3,9 |
1,0; 6,8 |
0,007 |
|
|
|
(2008-2021) 11,7 |
6,8; 16,8 |
< 0,001 |
3,9 |
1,0; 6,8 |
0,007 |
Legendas: Txa = Taxa padronizada por idade; JP = número de Joinpoints; APC = variação anual percentual; AAPC = variação anual percentual média; IC 95% = intervalo de confiança de 95%.
Na análise espacial, o geoprocessamento dos dados de mortalidade mostrou significância estatística para os mapas construídos com base nas taxas bayesianas, considerando a heterogeneidade do território e a distribuição da população, o que torna os resultados fidedignos e aplicáveis à realidade. É relevante destacar que o período de 2010-2019 é o mais próximo da atualidade, tornando a análise mais valiosa para fins de pesquisa e avaliação das áreas de risco para as neoplasias estudadas (Material Suplementar 3).
Para o sexo masculino, os mapas de taxa bayesiana revelaram variações importantes na distribuição espacial da mortalidade ao longo dos períodos analisados. Houve concentração de óbitos na Região de Grande Aracaju, Leste, Agreste Central e Sul entre 1990 e 1999. Entre 2000 e 2009, houve um aumento nas taxas em todas as Regiões, com novas concentrações nas Regiões Baixo São Francisco e Médio Sertão. Entre 2010 e 2019, a concentração foi nas Mesorregiões Agreste e Leste do Estado (Figura 2C), com o aumento das taxas no interior do Estado.
Os mapas de Moran mostraram clusters de autocorrelação significativa (Figuras 2D, 2E e 2F). No período de 1990-1999 (Figura 2D), parte da Região de Grande Aracaju foi considerada de alto risco de mortalidade por NMH para o sexo masculino. Entre 2000 e 2009, o cluster de alto risco foi na Região de Grande Aracaju e no município de Aquidabã (Figura 2E). No período de 2010-2019, o cluster de alto risco foi novamente Grande Aracaju e o município de Aquidabã (Figura 2F). As Regiões de baixo risco para mortalidade por NMH foram, entre 1990 e 1999, a Região de Centro-Sul e alguns municípios das Regiões de Alto e Médio Sertão. Entre 2000 e 2009, as Regiões de baixo risco foram as Regiões Centro-Sul, Sul, e os municípios de Poço Redondo. Entre 2010 e 2019, os municípios de baixo risco foram alguns das Regiões de Alto Sertão e de Agreste Central.
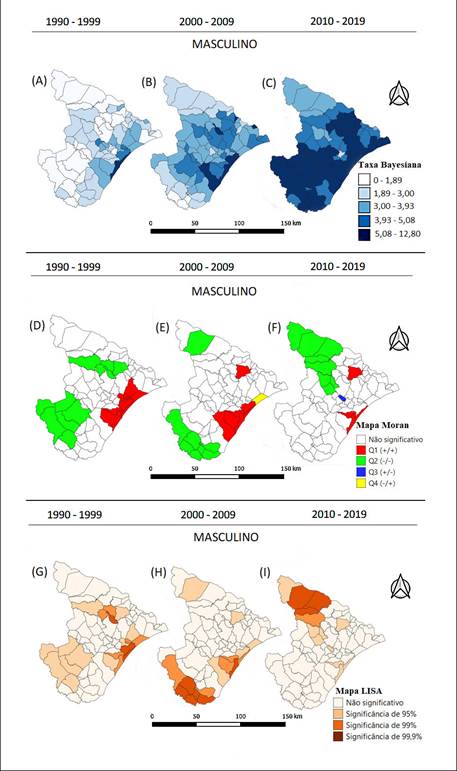
Figura 2. Mapas da distribuição espacial de NMH em Sergipe, considerando as taxas bayesianas, para o sexo masculino, entre os anos de 1990 e 2019
Para o sexo feminino, os mapas de taxa bayesiana mostraram algumas variações na distribuição espacial da mortalidade. Houve concentração de óbitos na Região de Grande Aracaju entre 1990 e 1999 (Figura 3A). Entre 2000 e 2009, houve um aumento nas taxas em todas as Regiões, exceto nas Regiões de Alto Sertão e parte da Região Sul (Figura 3B). Entre 2010 e 2019, houve uma grande concentração nas Regiões de Alto Sertão, Grande Aracaju e Centro Sul do Estado (Figura 3C).
Os mapas de Moran para o sexo feminino também mostraram clusters de autocorrelação significativa (Figuras 3D, 3E e 3F). No período de 1990-1999 (Figura 3D), a Região de alto risco foi parte da Região de Grande Aracaju. Entre 2000 e 2009 (Figura 3E), as Regiões de alto risco foram Grande Aracaju e no município de Aquidabã. Já entre 2010 e 2019, o cluster de alto risco foi na Região de Grande Aracaju e o município de Lagarto, com um cluster de baixo risco no Alto Sertão (Figura 3F). As Regiões de baixo risco foram, entre 1990 e 1999, alguns municípios das Regiões Sul, Médio Sertão, Agreste Central e Médio São Francisco. Entre 2000 e 2009, as Regiões de baixo risco foram o município de Poço Redondo e alguns municípios das Regiões Centro-Sul e Sul. Entre 2010 e 2019, a Região de baixo risco foi Alto Sertão, além de alguns municípios das Regiões de Baixo São Francisco e o município de Ribeirópolis.
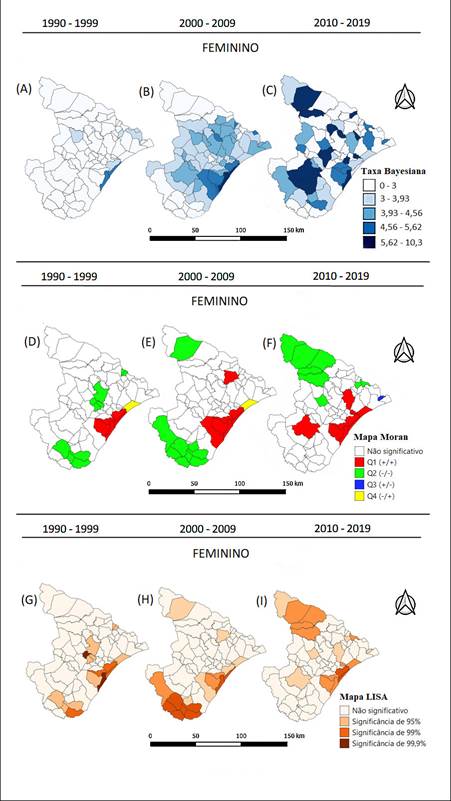
Figura 3. Mapas da distribuição espacial de NMH em Sergipe, considerando as taxas bayesianas, para o sexo feminino, entre os anos de 1990 e 2019
DISCUSSÃO
No presente estudo, as taxas padronizadas por idade e as taxas bayesianas de mortalidade pelas neoplasias hematológicas estudadas em Sergipe mostraram-se crescentes de 1980 a 2021, indicando um aumento na mortalidade por essas neoplasias no Estado ao longo do período. As leucemias foram as neoplasias com as maiores taxas de mortalidade, seguidas por linfoma não Hodgkin e mieloma múltiplo. O grupo etário com maior mortalidade observada foi o dos idosos com 65 anos ou mais. Em termos de distribuição espacial, as Regiões com as maiores taxas de mortalidade foram as Mesorregiões Leste e Agreste do Estado, com destaque para a Região de Grande Aracaju.
Uma tendência semelhante de crescimento da mortalidade por NMH foi observada na Bahia, entre os anos de 2008 e 2018, com um aumento nas taxas de mortalidade em todas as Macrorregiões de saúde para as faixas etárias consideradas (0-60 anos e 60+)16. Isso está de acordo com a estimativa do estudo de Barbosa et al.17, que prevê um aumento na mortalidade por câncer até 2030 na Região Nordeste, ao contrário das Regiões Sul, Sudeste e Centro-Oeste do país que possuem uma perspectiva de redução da mortalidade até 2030.
Comparativamente, em países desenvolvidos, como os Estados Unidos, as taxas de mortalidade por NMH têm decrescido desde o início dos anos 1990, refletindo melhorias nos protocolos terapêuticos e esforços para prevenção, diagnóstico precoce e tratamento dessas doenças. No entanto, em países em desenvolvimento, como o Brasil, a mortalidade por essas neoplasias ainda é alta em razão da carência de políticas específicas e da pequena variedade de recursos terapêuticos disponíveis18-21.
No Estado de Sergipe, a mortalidade por NMH segue a ordem decrescente de leucemias, linfoma não Hodgkin, mieloma múltiplo e outras NMH. Essa ordem é semelhante ao panorama mundial apresentado pelo Globocan2, no qual as leucemias são as neoplasias hematológicas com maior mortalidade. Estudos têm relacionado a mortalidade por leucemias à exposição ocupacional a benzeno e formaldeído em países em desenvolvimento, enquanto, em países mais desenvolvidos, a mortalidade por leucemias está relacionada ao alto índice de massa corporal (IMC)18.
A mortalidade por NMH em Sergipe foi maior no sexo masculino, apresentando um crescimento sem pontos de inflexão na taxa padronizada de mortalidade no período, considerando todas as idades. Essa predominância das taxas de mortalidade masculina também é observada em outras topografias de câncer no Estado e em estudos em outras Regiões do Brasil, dos Estados Unidos e da Europa18-24. Isso pode estar relacionado a uma maior exposição a fatores de risco como tabagismo, infecções, fatores ocupacionais e ambientais25-27.
Para o sexo feminino, a mortalidade por NMH também foi crescente entre os anos de 1992 e 2019, destacando-se o grupo de 65+ anos, entre os anos de 1980 e 2019. Os últimos anos da série, mesmo para esse grupo etário, não apresentaram alterações significativas na mortalidade durante a pandemia por covid-19, assim como no sexo masculino, apesar das alterações no acesso à saúde e da relação positiva entre a doença e as NMH que, juntas, contribuem para um desfecho mais desfavorável28-30.
O linfoma não Hodgkin foi a neoplasia com a maior disparidade nas taxas de mortalidade entre os sexos, possivelmente por causa de fatores hormonais e ambientais que demandam mais estudos18,30,31.
O mieloma múltiplo foi a neoplasia mais associada à idade avançada no estudo, e a faixa etária com maior mortalidade foi a de 65 anos ou mais, o que é consistente com estudos que apontam o envelhecimento como um dos principais fatores de risco para o surgimento de neoplasias hematológicas32-36.
A distribuição espacial da mortalidade por NMH em Sergipe mostrou concentração de óbitos nas Regiões Grande Aracaju, Leste e Agreste do Estado, que coincidem com as áreas de maior densidade populacional, urbanização, desigualdade social e incidência de pobreza, sugerindo uma relação com um estilo de vida carcinogênico nessas Regiões. Esses fatores impactam na incidência desses cânceres e, consequentemente, na sua mortalidade37,38.
Os municípios de Aracaju e Barra dos Coqueiros, que possuem os mais altos índices de Gini em Sergipe, também são áreas com alta incidência de pobreza. Esses municípios e outros com alta mortalidade por NMH estão localizados em Regiões de grande desigualdade social, alta incidência de pobreza e hábitos urbanos, o que pode estar relacionado à falta de políticas públicas eficazes de prevenção, diagnóstico precoce e tratamento eficaz desses tipos de câncer19,39,40. Nesse sentido, o Estado carece de capacitação profissional e de elucidação populacional acerca dos fatores de risco para essas neoplasias, ou de políticas de redução de danos, no caso de trabalhadores que lidam com agrotóxicos, substâncias químicas cancerígenas, ou radiação ionizante2,4,22,26,28. Em se tratando de diagnóstico precoce, este depende do acesso à saúde, que é dificultado por fatores como a distância do interior do Estado aos centros de tratamento oncológico, as dificuldades socioeconômicas da maior parte da população e à falta de elucidação do paciente e de sua família quanto ao seu diagnóstico. Em termos de tratamento, o TMO que é o tratamento de escolha para algumas NMH, como, por exemplo, para todas as leucemias agudas, e, em casos de baixa fragilidade terapêutica, para o mieloma múltiplo, assim como alguns quimioterápicos, não está disponível para a maior parte dos pacientes, por conta de dificuldades financeiras para sua obtenção5.
No Brasil, a queda nas taxas de mortalidade por NMH pode ocorrer de forma mais tardia em razão de falhas estruturais no sistema de saúde, como a dificuldade de acesso a terapias adequadas no momento oportuno. Isso é especialmente relevante em países de IDH médio ou baixo, onde as desigualdades de acesso aos serviços de saúde são mais pronunciadas11,41-45.
As áreas de maior risco de mortalidade por NMH em Sergipe, de acordo com os mapas de distribuição das taxas bayesianas, incluem a Região Grande Aracaju e os municípios de Aquidabã, Lagarto e Capela. Essas áreas de risco podem estar relacionadas a práticas agrícolas, sedentarismo e maus hábitos alimentares locais, que podem aumentar a incidência e a mortalidade por essas causas. A Associação Brasileira de Saúde Coletiva (Abrasco) destaca que o Brasil é o maior consumidor de agrotóxicos do mundo, e as Regiões com maiores produções agrícolas em Sergipe, como o Leste Sergipano, Centro-Sul e Sul, podem ter impacto significativo na mortalidade por NMH por causa do consumo desses produtos38,46,47.
O estudo apresenta como ponto forte um panorama da mortalidade por cânceres hematológicos em Sergipe ao longo de uma série temporal longa, baseada em dados oficiais de qualidade e representativos da população48. No entanto, é importante considerar que alguns pacientes podem fornecer endereços falsos ou mudarem-se para locais próximos aos serviços de saúde antes do óbito, o que pode levar à subnotificação da mortalidade por NMH no interior do Estado49.
CONCLUSÃO
A tendência de mortalidade por NMH mostrou-se crescente no Estado de Sergipe, destacando-se a mortalidade por leucemias. A ordem decrescente de mortalidade no Estado foi leucemias, linfoma não Hodgkin, mieloma múltiplo e outras NMH. Para o sexo masculino, a tendência de crescimento não mostrou pontos de inflexão em todo o período analisado. Para o sexo feminino, a tendência de crescimento apresentou variações anuais, para o total de neoplasias estudadas. As taxas de mortalidade mais altas foram observadas em indivíduos com 65 anos ou mais e, no sexo masculino, para todas as neoplasias analisadas. A distribuição espacial da mortalidade se deu sobretudo nas Mesorregiões Leste e Agreste sergipanos, destacando-se a Região Grande Aracaju e os municípios de mais alto IDH, de maior densidade populacional, de maior índice de Gini e de significativa produção agrária, para todas as neoplasias estudadas. Diante das taxas de mortalidade crescentes no Estado por essas doenças, o traçado de áreas de risco é de fundamental importância para o controle da mortalidade. Para tanto, algumas possíveis estratégias são o investimento na Política Nacional de Atenção Oncológica (PNAO), permitindo o maior acesso a serviços de saúde para esse perfil de pacientes. Paralelamente, é preciso investir em métodos diagnósticos e em estratégias terapêuticas, também criando, quando necessário, programas de rastreamento desses cânceres no âmbito da Saúde Pública.
CONTRIBUIÇÕES
Ríllary de Oliveira Silva Ferreira, Alex Rodrigues Moura, Carlos Anselmo Lima e Angela Maria da Silva contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Organização Panamericana da Saúde [Internet]. Brasília, DF: OPAS; 2020. Câncer, 2020 out. [acesso 2022 dez 7]. Disponível em: https://www.paho.org/pt/topicos/cancer
2. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-63. doi: https://doi.org/10.3322/caac.21834
3. Observatório de Oncologia [Internet]. São Paulo: Observatório de Oncologia; 2019. Trajetória de incidência e mortalidade das neoplasias hematológicas no Brasil, 2019 set 19. [acesso 2022 nov 21]. Disponível em: http://https://observatoriodeoncologia.com.br/trajetoria-da-incidencia-e-mortalidade-das-neoplasias-hematologicas-no-brasil
4. Longo DL. Harrison’s Hematology and Oncology. In: Kasper DL, Hauser SL, organizadores. Polycythemia vera and other myeloproliferative neoplasms. myeloproliferative disorders. New York: McGraw Hill; 2016. p. 158-66
5. Rosko A, Giralt S, Mateos MV, et al. Myeloma in elderly patients: when less is more and more is more. Am Soc Clin Oncol Educ Book. 2017;37:575-85. doi: https://doi.org/10.1200/edbk_175171
6. Cidades e Estados [Internet]. Rio de Janeiro: Instituto Brasileiro de Geografia e Estatística; c2017. Sergipe; [acessado 2023 jan 23]. Disponível em: http://www.ibge.gov.br/cidades-e-estados/se.html
7. SIM: Sistema de Informação sobre Mortalidade [Internet]. Versão 3.2.1.2. Brasília (DF): DATASUS. [data desconhecida] - [acesso 2024 fev 12]. Disponível em: http://sim.saude.gov.br/default.asp
8. Organização Mundial da Saúde. CID-10: Classificação Estatística Internacional de Doenças e problemas relacionados à saúde. São Paulo: Edusp; 2008.
9. TABNET [Internet]. Brasília (DF): DATASUS. c2008. População residente. [acesso 2024 maio 28]. Disponível em: https://datasus.saude.gov.br/informacoes-de-saude-tabnet/
10. Doll R, Cook P. Summarizing indices for comparison of cancer incidence data. Int J Cancer. 1967;2(3):269-79. doi: https://doi.org/10.1002/ijc.2910020310
11. Joinpoint Regression Program [Internet]. Version 5.0.2. 2024. Hoboken: John Wiley & Sons, Ltd; c2000. [acessado 2024 abr 22]. Disponível em: https://surveillance.cancer.gov/joinpoint/
12. TerraView [Internet]. Versão 4.2.2. São José dos Campos: INPE; 2013. [acesso 2024 abr 22]. Disponível em: https://www.dpi.inpe.br/terralib5/wiki/doku.php?id=wiki:downloads
13. QGIS [Internet]. Versão 3.10.7. Grüt: QGIS.org; 2016. [acesso 2022 out 20]. Disponível em: https://qgis.org/download/
14. Marques AJ. Aplicações de técnicas de autocorrelação espacial para espacial para avaliação da organização das habitações nas mesorregiões do estado do Paraná. Observatorium: Rev Eletr Geo. 2009;1(3):89-105.
15. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
16. Santos HLP, Machado JS, Brito AS, et al. Série histórica de mortalidade por neoplasias no Estado da Bahia entre os anos de 2008 e 2018. Rev Bras Cancerol. 2022;68(1):e-081376. doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n1.1376
17. Barbosa IR, Souza DLB, Bernal MM, et al. Cancer mortality in Brazil: temporal trends and predictions for the year 2030. Medicine (Baltimore). 2015;94(16):e746. doi: https://doi.org/10.1097/md.0000000000000746
18. Zhang N, Wu J, Wang Q, et al. Global burden of hematologic malignancies and evolution patterns over the past 30 years. Blood Cancer J. 2023;13(1):82. doi: https://doi.org/10.1038/s41408-023-00853-3
19. Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023. CA Cancer J Clin. 2023;73(1):17-48. Doi: https://doi.org/10.3322/caac.21763
20. Sasaki K, Strom SS, O'Brien S, et al. Relative survival in patients with chronic‐phase chronic myeloid leukaemia in the tyrosine‐kinase inhibitor era: analysis of patient data from six prospective clinical trials. Lancet Haematol. 2015;2(5):e186-93. Doi: https://doi.org/10.1016/s2352-3026(15)00048-4
21. Akinyemiju TF, Soliman AS, Copeland G, et al. Trends in breast cancer stage and mortality in Michigan (1992–2009) by race, socioeconomic status, and area healthcare resources. Plos One. 2013;8(4):e61879. doi: https://doi.org/10.1371/journal.pone.0061879
22. Luz LL, Mattos IE. Tendência das taxas de mortalidade por linfoma não-Hodgkin na Região Sudeste do Brasil, 1980-2007. Cad Saude Publica. 2011;27(7):1340-8. doi: https://doi.org/10.1590/S0102-311X2011000700009
23. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017. CA Cancer J Clin. 2017;67(1):7-30. doi: https://doi.org/10.3322/caac.21387
24. Bertuccio P, Bosetti C, Malvezzi M, et al. Trends in mortality from leukemia in Europe: an update to 2009 and a projection to 2012. Int J Cancer. 2013;132(2):427-36. doi: https://doi.org/10.1002/ijc.27624
25. Islami F, Chen W, Yu XQ, et al. Cancer deaths and cases attributable to lifestyle factors and infections in China, 2013. Ann. Oncol. 2017;28(10):2567-74. doi: https://doi.org/10.1093/annonc/mdx342
26. Eastmond DA, Keshava N, Sonawane B. Lymphohematopoietic cancers induced by chemicals and other agents and their implications for risk evaluation: an overview. Mutat Res Rev Mutat Res. 2014;761:40-64. doi: https://doi.org/10.1016/j.mrrev.2014.04.001
27. Chiu BC, Dave BJ, Blair A, et al. Agricultural pesticide use and risk of t(14; 18)-defined subtypes of non-Hodgkin lymphoma. Blood. 2018;108(4):1363-9. doi: https://doi.org/10.1182/blood-2005-12-008755
28. Wang Q, Berger NA, Xu R. When hematologic malignancies meet COVID-19 in the United States: infections, death and disparities. Blood Rev. 2020;47:100775. doi: https://doi.org/10.1016/j.blre.2020.100775
29. Fundação Oswaldo Cruz [Internet]. Rio de Janeiro; Fiocruz; 2021. Estudo revela como a pandemia afetou os atendimentos no SUS, 2021 nov 12. [acesso 2023 jun 28]. Disponível em: https://portal.fiocruz.br/noticia/estudo-revela-como-pandemia-afetou-os-atendimentos-no-sus
30. Boccolini PMM, Boccolini CS, Meyer A. Tendência de mortalidade por linfomas não Hodgkin no Brasil, 1980 a 2012. Cad Saúde Colet. 2015;23(2):188-97. doi: https://doi.org/10.1590/1414-462X201500020014
31. Bacchi CE, Bacchi MM, Rabenhorst SH, et al. AIDS-related lymphoma in Brazil: histopathology, immunophenotype, and association with Epstein-Barr virus. Am J Clin Pathol. 1996;105(2):230-7. doi: https://doi.org/10.1093/ajcp/105.2.230
32. Howlader N, Noone AM, Krapcho M, et al. SEER cancer statistics review, 1975-2013 [Internet]. 2016 [acesso 2022 dez 22]: [cerca de 1 p.]. Disponível: https://seer.cancer.gov/archive/csr/1975_2013/index.html
33. Gouveia MS, Batista JKM, Passos TS, et al. Comparison of factors associated with leukemia and lymphoma mortality in Brazil. Cad Saude Publica. 2020;36(8):e00077119. doi: https://doi.org/10.1590/0102-311X00077119
34. Benderra MA, Serrano AG, Paillaud E, et al. Prognostic value of comorbidities in older patients with cancer: the ELCAPA cohort study. ESMO Open. 2023;8(5):101831. doi: https://doi.org/10.1016/j.esmoop.2023.101831
35. Schmidt MI, Duncan BB, Azevedo e Silva G, et al. Chronic non-communicable diseases in Brazil: burden and current challenges. Lancet. 2011;377(9781):1949-61. doi: https://doi.org/10.1016/s0140-6736(11)60135-9
36. Lamb BW, Sevdalis N, Benn J, et al. Multidisciplinary cancer team meeting structure and treatment decisions: a prospective correlational study. Ann Surg oncol. 2013;20(3):715-22. doi: https://doi.org/10.1245/s10434-012-2691-x
37. Cidades@ [Internet]. Rio de Janeiro: Instituto Brasileiro de Geografia e Estatística; c2017. IDH Sergipe. [acesso 2022 nov 23]. Disponível em: https://cidades.ibge.gov.br/brasil/se/pesquisa/37/30255
38. Garofolo A, Avesani CM, Camargo KG, et al. Dieta e câncer: um enfoque epidemiológico. Rev Nutr. 2004;17(4):491-505. doi: http://dx.doi.org/10.1590/S1415-52732004000400009
39. TABNET [Internet]. Brasília (DF): DATASUS. c2008. Índice de Gini da renda familiar per capita – Sergipe, 2010. [acesso 2023 ago 18]. Disponível em: http://tabnet.datasus.gov.br/cgi/ibge/censo/cnv/ginise.def
40. TABNET [Internet]. Brasília (DF): DATASUS. c2008. Proporção de pessoas com baixa renda - Sergipe. 2010 [acesso 2023 set 22]. Disponível em: http://tabnet.datasus.gov.br/cgi/tabcgi.exe?ibge/censo/cnv/pobrezase
41. Thun MJ, Delancey JO, Center MM, et al. The global burden of cancer: priorities for prevention. Carcinogenesis. 2009;31(1):100-10. doi: https://doi.org/10.1093/carcin/bgp263
42. Veras R. Envelhecimento populacional contemporâneo: demandas, desafios e inovações. Rev Saude Publica. 2009;43(3):548-54. doi: https://doi.org/10.1590/S0034-89102009005000025
43. Curado MP, Souza DL. The burden of cancer in Latin America and the Carribean. Ann Glob Health. 2014;80(5):370-7. doi: https://doi.org/10.1590/S0034-89102009005000025
44. Wünsch FV, Antunes JLF, Boing AF, et al. Perspectivas da investigação sobre determinantes sociais em câncer. Physis. 2008;18(3):427-50. doi: https://doi.org/10.1590/S0103-73312008000300004
45. Ribeiro AA, Nardocci AC. Desigualdades socioeconômicas na incidência e mortalidade por câncer: revisão de estudos ecológicos, 1998-2008. Saude Soc. 2013;22(3):878-91. doi: https://doi.org/10.1590/S0104-12902013000300020
46. Carneiro FF, Augusto LGS, Rigotto RM, et al, organizadores. Dossiê ABRASCO: um alerta sobre os impactos dos agrotóxicos na saúde. Rio de Janeiro; São Paulo: EPSJV; Expressão Popular; 2015.
47. Empresa de Desenvolvimento Agropecuário de Sergipe. Áreas de concentrações das principais culturas agrícolas do Estado de Sergipe. Nossa Sra. do Socorro: EMDAGRO; 2009
48. Frias PG, Szwarcwald CL, Lira PI. Avaliação dos sistemas de informações sobre nascidos vivos e óbitos no Brasil na década de 2000. Cad Saúde Pública. 2014;30(10):2068-80. doi: https://doi.org/10.1590/0102-311x00196113
49. Barbosa SFC, Costa CA, Ferreira LSC, et al. Aspectos epidemiológicos dos casos de leucemia e linfomas em jovens e adultos atendidos em hospital de referência para câncer em Belém, Estado do Pará, Amazônia, Brasil. Rev Panamazonica Saude. 2015;6(3):43-50. doi: http://dx.doi.org/10.5123/s2176-62232015000300006
Recebido em 2/5/2024
Aprovado em 18/7/2024
Editora-associada: Jeane Tomazelli. Orcid iD: https://orcid.org/0000-0002-2472-3444
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.