ARTIGO ORIGINAL
Sobrevida Livre de Doença em Mulheres com Câncer de Mama: Coorte de 36 e 60 Meses
Disease-Free Survival in Women with Breast Cancer: 36- and 60-Month Cohorts
Sobrevida Libre de Enfermedad en Mujeres con Cáncer de Mama: Cohortes de 36 y 60 Meses
Bruna Mascarenhas Santos1; Ione Jayce Ceola Schneider2
1,2Universidade Federal de Santa Catarina (UFSC), Departamento de Ciências, Tecnologias e Saúde (DCS). Araranguá (SC), Brasil.
E-mail: brunamascarenhassantos@gmail.com. Orcid iD: https://orcid.org/0000-0001-8326-6450
E-mail: ione.schneider@ufsc.br. Orcid iD: https://orcid.org/0000-0001-6339-7832
Endereço para correspondência: Bruna Mascarenhas Santos. Rua Gov. Jorge Lacerda, 3201 – Urussanguinha. Araranguá (SC), Brasil. CEP 88906-072. E-mail: brunamascarenhassantos@gmail.com
RESUMO
Introdução: O estudo de sobrevida livre de doença tem contribuído para a compreensão do comportamento e dos fatores prognósticos após o diagnóstico do câncer de mama em mulheres. Objetivo: Analisar a sobrevida livre de doença em 36 e 60 meses e fatores prognósticos em mulheres com câncer de mama atendidas em um serviço privado de saúde. Método: Estudo de coorte histórica com população de mulheres com diagnóstico de câncer de mama não metastático atendidas no período de 2010 a 2021. Foram coletados dados demográficos e clínicos. A análise estatística foi descritiva, bivariada e de sobrevida pelo método de Kaplan-Meier com utilização do teste log-rank. Resultados: A sobrevida livre de doença em 36 meses foi de 89,8% (IC 95%: 84,8-93,3) e o estádio clínico III foi o de pior prognóstico com redução de 11% no tempo médio em comparação ao estádio I. Em relação a de 60 meses, a sobrevida livre de doença foi 80,6% (IC 95%: 73,1-86,2), com estádio II e III com pior prognóstico. A redução do tempo médio do estádio III foi de 21% em comparação com o estádio I. Conclusão: Características tumorais e clínicas são importantes para a compreensão da sobrevida livre de doença e identificação de perfis de risco para recidiva, dada a escassez de pesquisas relacionadas ao tema na população brasileira. Assim, reforça-se a necessidade de diagnóstico precoce para reduzir a recorrência.
Palavras-chave: Neoplasias da Mama/diagnóstico; Sobrevida; Prognóstico; Estudos de Coortes.
ABSTRACT
Introduction: The study of disease-free survival has contributed to understanding the behavior and prognostic factors following the diagnosis of breast cancer in women. Objective: To analyze disease-free survival in 36 e 60 months and prognostic factors in women with breast cancer treated at a private health service. Method: Historical cohort study of women diagnosed with non-metastatic breast cancer seen between 2010 and 2021. Demographic and clinical data were collected. The statistical, descriptive, bivariate, survival analysis used the Kaplan-Meier method and the log-rank test. Results: Disease-free survival at 36 months was 89.8% (95%CI: 84.8-93.3) and clinical stage III was the worst prognosis with an 11% reduction in the meantime compared to stage I. Compared to 60 months, disease-free survival was 80.6% (95%CI: 73.1-86.2), with stage II and III having the worst prognosis. The reduction in mean time for stage III was 21 per cent compared to stage I. Conclusion: Tumor and clinical characteristics are important for understanding disease-free survival and identifying risk profiles for recurrence, given the scarcity of research on the subject in the Brazilian population. It therefore emphasises the need for early diagnosis to reduce recurrence.
Key words: Breast Neoplasms/diagnosis; Survival; Prognosis; Cohort Studies.
RESUMEN
Introducción: El estudio de la sobrevida libre de enfermedad ha contribuido a conocer el comportamiento y los factores pronósticos tras el diagnóstico de cáncer de mama en mujeres. Objetivo: Analizar la sobrevida libre de enfermedad a los 36 y 60 meses y los factores pronósticos en mujeres con cáncer de mama atendidas en un servicio sanitario privado. Método: Estudio de cohortes histórico con una población dinámica de mujeres diagnosticadas con cáncer de mama no metastásico atendidas entre 2010 y 2021. Se recogieron datos demográficos y clínicos. Los análisis estadísticos fueron descriptivos, bivariados y de sobrevida mediante el método de Kaplan-Meier y la prueba log-rank. Resultados: La sobrevida libre de enfermedad a los 36 meses fue del 89,8% (IC 95%: 84,8-93,3) y el estadio clínico III fue el de peor pronóstico, con una reducción del 11% del tiempo medio en comparación con el estadio I. En comparación con los 60 meses, la supervivencia libre de enfermedad fue del 80,6% (IC 95%: 73,1-86,2), siendo los estadios II y III los de peor pronóstico. La reducción del tiempo medio para el estadio III fue del 21% en comparación con el estadio I. Conclusión: Las características tumorales y clínicas son importantes para comprender la sobrevida libre de enfermedad e identificar perfiles de riesgo de recurrencia, dada la escasez de investigaciones sobre el tema en la población brasileña. Por tanto, se destaca la necesidad de un diagnóstico temprano para reducir la recurrencia.
Palabras
clave:
Neoplasias de la Mama/diagnóstico; Supervivencia; Pronóstico; Estudios de
Cohortes.
O câncer de mama configura-se como um problema de saúde pública no Brasil e no mundo1. É o tipo de neoplasia maligna mais incidente em mulheres e com maior mortalidade. A cada ano são previstos cerca de 2 milhões de novos casos da doença no mundo e 94 mil no Brasil2,3. O número total de óbitos associados à doença na população feminina mundial ultrapassa os 666 mil e concentra-se, sobretudo, em países menos desenvolvidos2. Entre as mulheres brasileiras, corresponde à maior causa mortis por neoplasias e contabilizou mais de 22 mil óbitos2,3.
Em razão da persistência dos índices de mortalidade, com tendência a aumento no Brasil e América Latina4,5, o estudo de sobrevida do câncer de mama contribui para a descrição do comportamento da doença e dos fatores prognósticos a ela relacionados6. Enquanto a sobrevida global (SG) é a análise da mortalidade geral dos pacientes com determinada condição de saúde, a sobrevida livre de doença (SLD) reflete o período após o tratamento para alguma doença específica, durante o qual a paciente sobrevive sem sinal de recorrência7.
De modo geral, as estimativas de SG do câncer de mama em cinco anos vêm mostrando tendência de aumento em países desenvolvidos, ainda assim, observa-se grande disparidade global nesse quesito1. No Brasil, a estimativa de sobrevida por câncer de mama em cinco anos foi de 75,2% para o período de 2010 a 20148. Ainda assim, deve-se considerar que o uso da SG como desfecho primário tem sido questionado pela literatura, dando espaço e evidência para o estudo de SLD, principalmente pela primeira apresentar desvantagens, como a necessidade de longo tempo de seguimento para avaliação9.
A análise da SLD do câncer de mama e dos fatores prognósticos a ela associados têm permitido melhor compreensão do perfil dos pacientes e das características relacionadas à recorrência, promovendo também um apoio teórico para guiar decisões terapêuticas. Todavia, nota-se que os estudos de investigação da recidiva de câncer mamário dentro do contexto brasileiro são, ainda, escassos10.
Os fatores considerados para a análise de sobrevida do câncer de mama são aqueles que interferem no prognóstico da doença, podendo ser inerentes à biologia do tumor, como também às características demográficas e socioeconômicas da paciente6. Nesse contexto, torna-se possível a identificação do risco de grupos específicos, avaliando suas especificidades tumorais, tempo para o diagnóstico do tumor, abordagem terapêutica que receberam, entre outros pontos com repercussão direta no quadro prognóstico11.
A descrição desses dados é fundamental para avaliar o perfil das mulheres acometidas pelo câncer de mama, mas, principalmente, para estabelecer a relação entre as estratégias que vêm sendo aplicadas e os resultados sobre o prognóstico da doença. Todos os fatores relacionados à sobrevida desta neoplasia têm sido estudados com a finalidade de aprimorar a avaliação prognóstica das pacientes, além de permitirem maior conhecimento sobre o comportamento da doença, possibilitando um cuidado mais realista e eficaz que venha a repercutir na melhoria da qualidade de vida das pessoas acometidas, podendo também guiar ações futuras12,13.
Visto a relevância da temática do câncer de mama no âmbito da saúde coletiva, bem como o número reduzido de estudos que analisam a SLD de mulheres que tiveram esse diagnóstico no Brasil, elaborou-se a seguinte pergunta de pesquisa: quais são os fatores prognósticos que afetam a SLD do câncer de mama em mulheres? Diante disso, o objetivo deste estudo é analisar a SLD em 36 meses e 60 meses, assim como os fatores prognósticos em mulheres com câncer de mama atendidas em serviço privado de saúde.
MÉTODO
Estudo de coorte não concorrente (retrospectivo)14, com população dinâmica, realizado por meio de dados de mulheres com diagnóstico de câncer de mama atendidas em um serviço de saúde privado localizado no município de Florianópolis (SC). Foram incluídos os casos de mulheres com diagnóstico de câncer de mama atendidas no período de 2010 a 2021. Foram excluídos os casos de diagnóstico de câncer de mama exclusivamente in situ e estádio clínico IV.
As variáveis analisadas foram faixa etária ao diagnóstico (39 anos ou menos, 40 a 49 anos, 50 a 69 anos, 70 anos ou mais), estado conjugal (com companheiro [casada], sem companheiro [solteira, divorciada, viúva]), tipo histológico (carcinoma ductal invasivo, carcinoma lobular invasivo, carcinoma ductal invasivo e lobular associados, e outros), estadiamento clínico (EC – EC I, EC II, EC III), status para receptor de estrogênio (positivo e negativo), receptor de progesterona (positivo e negativo), HER-2 (positivo e negativo). Foram coletadas as informações de referentes ao tratamento, como tratamento cirúrgico na mama (sim e não), tratamento quimioterápico (sim e não), tipo de tratamento quimioterápico (adjuvante, neoadjuvante), tratamento radioterápico (sim e não), hormonioterapia (sim e não). A partir das informações sobre tratamento, foi criada uma variável que contemplava a combinação das modalidades que a paciente havia realizado (cirurgia e hormonioterapia; cirurgia, radioterapia e hormonioterapia; cirurgia e quimioterapia; cirurgia, quimioterapia e hormonioterapia; cirurgia, quimioterapia e radioterapia; cirurgia, quimioterapia, radioterapia e hormonioterapia).
O desfecho do estudo foi a presença de recidiva do diagnóstico inicial do câncer de mama (sim e não). Foram definidos como recidiva local e/ou metástase à distância (óssea, pulmonar, hepática, cerebral, linfonodos e outras). Além disso, foram coletadas as informações de data do diagnóstico, data da última consulta, data da recidiva.
O tempo de sobrevida livre de doença foi calculado entre a data do diagnóstico e a data da primeira recidiva registrada. A data da última consulta foi considerada como o final do acompanhamento para as pacientes que não tiveram recidiva e esses casos foram censurados. Foram calculadas duas coortes, a primeira com todos os casos incluídos e acompanhamento de 36 meses e a segunda com acompanhamento de 60 meses, com os casos com diagnóstico no período de 2010 a 2019.
Foi realizada análise descritiva e bivariada entre as variáveis de exposição e o desfecho, a SLD para as duas coortes. Utilizou-se o teste qui-quadrado para comparação das variáveis. As curvas de sobrevida foram estimadas pelo método de Kaplan-Meier, no qual a probabilidade de sobrevida até a data especificada é estimada considerando que a sobrevivência até cada tempo é independente de até outros tempos. Para comparar as curvas de sobrevida estratificadas, utilizou-se o teste log-rank, que compara os valores observados e esperados de cada estrato sob a hipótese nula de que o risco é o mesmo em todos os estratos. Também foi calculada a taxa de incidência de recidiva em 36 e 60 meses por mil pessoas-mês15.
Foi realizada análise de risco utilizando o modelo semiparamétrico de Cox e o teste de proporcionalidade dos riscos ao longo do tempo. Além disso, foi testada a interação entre as variáveis e efeito moderador. As variáveis independentes faixa-etária, situação conjugal, receptor de estrogênio, receptor de progesterona, HER-2 e estádio clínico foram incluídas no ajuste, pois são importantes. A variável combinação de tratamento não foi incluída na análise, porque apresentou interação e efeito moderador com a variável estádio clínico. Assim, foram estimadas as áreas sobre as curvas de 36 e 60 meses, para a variável estadiamento, ajustada pelas demais variáveis, utilizando o tempo médio de sobrevida livre de recidiva (RMST, do inglês Restricted Mean Survival Time) até os pontos especificados16. A análise de dados foi realizada no software Stata17 16.1.
A pesquisa foi fundamentada nos princípios éticos, com base na Resolução n.º 46618 de 12 de dezembro de 2012 do Conselho Nacional de Saúde, e teve aprovação pelo Comitê de Ética em Pesquisa (CEP) com Seres Humanos da Universidade Federal de Santa Catarina (UFSC), no dia 10 de novembro de 2021, sob o parecer de número 5.097.894 (CAAE: 51838821.0.0000.0121).
RESULTADOS
Foram coletadas informações de 266 mulheres com diagnóstico de câncer de mama em EC I, II ou III, atendidas no período de 2010 a 2021. Essas mulheres foram acompanhadas por 36 meses (Tabela 1).
Sobre as características tumorais, foram avaliados os tipos histológicos, estadiamento clínico e imuno-histoquímica. O carcinoma ductal invasivo (CDI) se sobressaiu aos demais tipos histológicos e esteve presente em 74,4% dos casos de modo isolado. O carcinoma lobular invasivo (CLI), isoladamente, acometeu 8,6% das mulheres. Outros tipos tumorais se fizeram presentes de modo isolado em 12,8% do total avaliado. Nessa categoria, estão inclusos os tipos micropapilar, mucinoso, apócrino, cribiforme, medular, tubular e neuroendócrino (dados não apresentados). O EC II foi o mais frequente, identificado em 40,6% dos casos, seguido pelo EC I (39,5%) e pelo EC III (19,9%). Os receptores hormonais de estrogênio foram positivos em 81,5% dos casos e de progesterona em 72,3%. Já a positividade para o oncogene HER-2 se fez presente em 20,5% da população analisada (Tabela 1).
Das mulheres incluídas no estudo, 87,2% foram submetidas a tratamento cirúrgico das mamas, e a quadrantectomia – cirurgia conservadora – foi o procedimento mais realizado entre elas, correspondendo a 47,6% dos casos. Em segundo lugar, observou-se a mastectomia simples (41,4%) e, por último, a mastectomia bilateral (10,6%), ora preventiva, ora terapêutica. Para os casos de acometimento linfonodal, o tratamento cirúrgico das axilas variou entre excisão de linfonodo sentinela (68,6%) e esvaziamento axilar (31,4%). Foram submetidas ao tratamento quimioterápico adjuvante 47,7% das mulheres e à modalidade neoadjuvante 26,7%. Quanto à modalidade de tratamento radioterápica, 51,9% foram submetidos a ela. Em relação à hormonioterapia, 72,3% tinham informações sobre o tratamento (dados não apresentados). Em relação à combinação dos tratamentos, a maioria das pacientes realizou cirurgia, quimioterapia, radioterapia e hormonioterapia (27,4%).
Ao final de 36 meses de acompanhamento, 21 (7,9%) das mulheres tiveram recidiva e a média de tempo de acompanhamento foi de 26,2 meses (intervalo de confiança – IC 95%: 24,6-27,7). A taxa de SLD foi de 89,8% (IC 95%: 84,8-93,29) (Gráfico 1) e a taxa média de incidência por mil pessoas-mês foi de 3,10 (IC 95%: 1,96-4,62). O sítio de metástase mais comum foi em ossos (47,6%), seguido por linfonodos (38,1%), fígado (23,8%), mamas (19,1%), pulmão (18,8%) e cérebro (9,5%) (dados não apresentados).
As variáveis associadas à incidência de recidiva aos 36 meses estão apresentadas na Tabela 1. Na análise bivariada, apenas o estadiamento foi associado à recidiva, e o EC III teve incidência de 20,9% das recidivas. Em relação à análise de sobrevida em 36 meses, o estadiamento clínico, o receptor de estrogênio e de progesterona foram associados. A pior SLD foi encontrada no EC III, com 73,8% de probabilidade de recidiva em 36 meses (Gráfico 1). Em relação ao receptor de estrogênio, aquelas com status negativo tiveram 79,0% e as com progesterona negativa, 80,3% de probabilidade de sobrevida (Tabela 1).
Foi realizada análise ajustada para identificar as variáveis de maior risco para recidiva ao longo do tempo. Foi detectada interação entre a variável tratamento e estadiamento, assim como efeito moderador do estadiamento sobre a variável tratamento.
Ao realizar a análise para estimar o risco de recidiva ajustava por faixa etária, estado conjugal, estádio, tipo histológico, receptor hormonal de estrogênio, receptor hormonal de progesterona e HER-2, apenas estádio mostrou-se como fator independente de risco de recidiva. O EC III aumentou em 10,48 (IC 95%: 2,10-52,21) o risco de recidiva ao longo do tempo comparado ao estádio I, independente das demais características do diagnóstico. O EC II não foi significativamente diferente do EC I (HR: 3,26; IC 95%: 0,65-16,31) (dados não apresentados). O modelo respeitou a proporcionalidade ao longo do tempo (p=0,339).
Ao analisar a diferença no tempo médio até a recidiva entre os estadiamentos, o EC I teve média de 30,5 meses (IC 95%: 18,5-41,5), o ECII apresentou redução não significativa de tempo de 1,02 meses (IC 95%: -2,5; 0,47), e o ECIII, redução significativa de 4,0 (IC 95%: -6,95; -1,04) comparado ao ECI. As variáveis de ajuste, faixa etária, tipo histológico, estado conjugal, receptores de estrogênio e de progesterona e status HER-2, não mostraram significância na redução de tempo até a recidiva. Ao analisar a razão do RMST, as diferenças permanecem, e o EC III tem redução de 11% do tempo até a recidiva (Coef: 0,89; IC 95%: 0,81; 0,97).
Para o acompanhamento de 60 meses, 215 mulheres foram acompanhadas, e as características estão apresentadas na Tabela 2. A média de tempo de acompanhamento foi de 39,5 (IC 95%: 36,5-42,5). No período, 29 (13,5%) tiveram recidivas. A taxa de incidência foi 3,42 (IC 95%: 2,38-4,92) por mil pessoas-mês acompanhadas. A SLD ao final de 60 meses foi de 80,6 (IC 95%: 73,1-86,2) (Gráfico 2).
Em relação à recidiva em 60 meses, apenas a variável estadiamento clínico foi associada, no qual a maior incidência esteve nos diagnósticos em EC III (37,2%). Essa associação também esteve presente na análise de sobrevida, sendo o estádio com pior SLD, com taxa de 50,3% (Tabela 2 e Gráfico 2).
A estimativa de risco de recidiva em 60 meses ajustada por faixa etária, estado conjugal, estádio, tipo histológico, receptor hormonal estrógeno, receptor hormonal de progesterona e HER-2, também apresentou apenas o estádio como fator independente de risco de recidiva. O EC II aumentou em 4,55 (IC 95%: 1,20-17,32) e o EC III em 21,09 (IC 95%: 5,58-79,76) o risco de recidiva ao longo do tempo comparado ao estádio I, independente das demais características do diagnóstico (dados não apresentados). O modelo respeitou a proporcionalidade ao longo do tempo (p=0,605).
Quanto à diferença no tempo médio até a recidiva entre os estadiamentos, o EC I teve média de 54,7 meses (IC 95%: 30,3-70,0), o EC II apresentou redução não significativa de tempo de 3,3 meses (IC 95%: -7,02; 0,42); já o EC III, redução significativa de 12,43 meses (IC 95%: -18,91; -5,94) comparado ao EC I. As variáveis de ajuste, faixa etária, tipo histológico, estado conjugal, receptores de estrogênio e de progesterona e status HER-2, não mostraram significância na redução de tempo até a recidiva. O EC III teve redução de 21% do tempo até a recidiva (Coef: 0,79; IC 95%: 0,69; 0,90).
DISCUSSÃO
O presente estudo analisou a sobrevida livre de doença de 266 mulheres com diagnóstico de câncer de mama não metastático no período de 2010 a 2021. A SLD foi de 89,9% (IC 95%: 84,8-93,3) se considerado 60 meses e em 36 meses foi de 80,6% (IC 95%: 73,1-86,2).
Ainda que o número de estudos com foco em SLD realizados no Brasil seja restrito, encontraram-se taxas similares em pesquisas nacionais recentes. Um estudo realizado a partir de coorte retrospectiva de um hospital de Juiz de Fora (MG) constatou uma SLD em cinco anos de 79,5% (IC 95%: 74,6–83,6) em um grupo de mulheres com diagnóstico de câncer de mama não metastático19. Outra análise de sobrevida com coorte retrospectiva de 253 pacientes diagnosticadas com câncer de mama do subtipo luminal A, no município de Itajaí (SC), identificou uma SLD em 3 anos de 86,0%7. Esses estudos foram realizados em serviços públicos de referência de seus municípios e os dados aproximam-se dos resultados de serviços privados. No primeiro19, o estadiamento também foi fator independente para a SLD, assim como o encontrado neste estudo. Isso demonstra a importância do diagnóstico precoce para esse desfecho.
Em estudos internacionais, os achados também foram próximos, ou discretamente superiores em alguns deles. Uma análise retrospectiva realizada na Holanda constatou SLD em cinco anos de 88,1% em um grupo de mulheres com câncer de mama submetidas à quimioterapia neoadjuvante20. Outra pesquisa, ambientada em um centro oncológico da Polônia, apresentou SLD em cinco anos de 80,5%21 e um estudo alemão que analisou a SLD de mulheres com câncer de mama não metastático em três e cinco anos obteve uma taxa de 82,5%22. Uma hipótese para as variações existentes entre os resultados são as diferenças metodológicas, como os critérios de seleção populacional e o tempo de análise.
Entre as variáveis analisadas, o estadiamento clínico ganhou destaque e faz-se relevante para a análise da SLD à medida que trata, sobretudo, da gravidade pela classificação TNM, proposta pela União Internacional Contra o Câncer (UICC)23, a qual leva em consideração o tamanho tumoral, o acometimento linfonodal e a presença de metástase. No caso do EC III, os tumores são sempre maiores que 2 cm, pode haver ou não o acometimento de linfonodos e não há presença de metástase24.
No presente estudo, a SLD para os diagnósticos em EC III foi significativamente menor e teve consonância com os achados de outras análises, que apresentaram taxas decrescentes quanto maior o estádio clínico da doença. O estudo de Dong et al.25 obteve taxa de 63,3% em cinco anos dentro do EC III, chegando a 33,8% em 10 anos. No estudo de Nowikiewicz et al.21, foi constatada taxa ainda menor para o EC III, com SLD em cinco anos de 52%. Outro estudo de coorte retrospectivo em Taiwan, que acompanhou 559 mulheres que passaram por tratamento entre 2004 e 2022, com média de seguimento de 45 meses, encontrou o EC III como fator independente, com aumento de 4,84 (IC 95%: 2,88-8,22) para a recorrência26.
Em estudo na Índia, com 3.256 mulheres com câncer de mama, no período de 2004 até 2020, seguidas até junho de 2023, a SLD em cinco anos foi de 94,3% (IC 95%: 93,3-95,4). As piores taxas de SLD foram observadas em mulheres com tamanho tumoral classificados como pT3/4 (maior de 5 cm de diâmetro ou qualquer tamanho e invadiu o tórax ou a pele) e ≥4 linfonodos positivos. As classificadas como EC III tiveram SDL de 74,0 (IC 95%: 70,0-77,0), e esse estádio teve razão de risco para recidiva 2,61 (IC 95%: 2,08, 3,27) maior que o EC I, mas sem ajustes para outras características27.
Em Istambul, uma coorte com 1.247 pacientes com câncer de mama diagnosticadas e tratadas entre janeiro de 2011 e junho de 2019, com média de seguimento de 31 meses, mostrou taxa de SLD de 73,8% em cinco anos. E os fatores preditores independentes de SLD foram invasão linfovascular [hazard ratio – HR: 4,35 (IC 95%: 1,18–15,94)], carcinoma in situ residual [HR: 7,37 (IC 95%: 1,52–35,71)], tamanho tumoral ypT III [HR: 5,42 (IC 95%: 1,69–17,35)], e subtipos moleculares não-luminal [HR: 4,41 (IC 95%: 1,33–14,58)]28.
Sugere-se, então, que estadiamentos maiores detêm pior prognóstico, uma vez que os melhores índices de sobrevida se relacionam com doença em fase inicial, assim como a recorrência relaciona-se com doença em estádio avançado. Nesse sentido, a detecção precoce é importante por possibilitar o diagnóstico de formas menos agressivas e o estabelecimento de tratamentos adequados em tempo oportuno, impactando na qualidade de vida e na sobrevida das pacientes19,25.
No Marrocos, por exemplo, uma coorte de 1901 mulheres diagnosticadas entre janeiro de 2008 a agosto de 2017, em EC I a EC III, analisou a SLD comparando tratamento apropriado ou não seguindo recomendações nacionais e internacionais de acordo com tipo de cirurgia, tamanho tumoral e características imuno-histoquímicas. Os resultados mostram que o manejo adequado dos casos aumentou significativamente a SLD (88% vs. 62%) em três e cinco anos (80% vs. 50%). Entretanto, o estudo não considerou como manejo adequado os casos de câncer luminal intermediário, nos quais se pode ou não utilizar quimioterapia seguida de hormonioterapia baseada em assinaturas genômicas ou pelo Ki6729. Além disso, referem que pode ter ocorrido classificação com manejo inadequado de alguns pacientes em hormonioterapia por falta de registro.
Apesar de não significativo na análise bivariada, outro achado importante relacionou-se à receptividade para estrogênio, determinando piores prognósticos entre as pacientes com status negativo. Um fato importante é que esse status hormonal prevalece entre mulheres mais jovens, as quais tendem a desenvolver cânceres mais agressivos. Tal correlação e semelhanças referentes ao status negativo como fator preditor de recidiva foram encontradas em diversos estudos revisados25,30-32. Pruessmann et al.22, em sua análise, concluíram que as pacientes com negatividade para receptores hormonais têm risco aumentado de morte, progressão da doença e taxas de sobrevida menores. A coorte de 1.858 mulheres incluídas em seu estudo encontrou SLD em cinco anos de 81,3% para aquelas com receptor de estrogênio negativo, em comparação a 86,8% para aquelas com receptor de estrogênio positivo. Outro estudo também mostrou associação apenas na análise bivariada26.
A receptividade para o oncogene HER-2, apesar de não significativa no presente estudo, vale ser mencionada também, pois apresentou conformidade com outros achados em pesquisas. Sua expressão também se concentra em mulheres com diagnóstico de câncer em idades mais jovens, e, ao contrário dos receptores hormonais, a positividade do gene HER-2 é que costuma determinar piores prognósticos. Isso foi constatado na análise presente pelo menor índice de SLD entre as mulheres HER-2 positivas e em outros estudos avaliados20,25,31,33.
Em relação às características sociodemográficas, as taxas de SLD menos favoráveis foram identificadas em mulheres da faixa etária de 39 anos ou menos e, quanto ao estado civil, entre as solteiras. Ambas as variáveis sem diferença significante quanto à SLD. Entretanto, ser jovem ao diagnóstico é um fator preditor de características tumorais desfavoráveis e, por consequência, de mau prognóstico, com piores taxas de SG e SLD quando comparadas às mais velhas30,34-36.
O estudo de SLD conduzido por Pruessmann et al.22 demonstrou essa relação e concluiu que existe influência de fatores tumorais biológicos, patológicos e clínicos, como, por exemplo, a maior negatividade para receptores de estrogênio e de progesterona, a positividade para HER-2 e o maior acometimento linfonodal entre mulheres mais jovens. Um estudo que comparou características imuno-histoquímicas de mulheres jovens (≤45 anos; n = 104) e idosas (≥65 anos; n = 96) encontrou que as primeiras tiveram SLD em cinco anos de 70,1%, já as segundas, de 84,6% (p=0,001). Além disso, o estudo mostra, em análise bivariada, que mulheres mais jovens têm tumores maiores, mais frequência de receptor de estrogênio negativo, de HER-2 positivo e com maior envolvimento axilar37.
Uma coorte na Alemanha com 2.518 mulheres, com diagnóstico de câncer de mama entre 2007 e 2010, comparou mulheres com idade menor e maior que 70 anos. Mulheres mais velhas apresentaram maior frequência de diagnóstico em estádio avançado (26% EC III vs. 14% nas mais jovens) e maior envolvimento linfonodal (58% vs. 48%). A média de SLD, em meses, nas mais jovens foi de 12,2 (IC 95%: 10,8-13,3) e das mais velhas, 7,6 (IC 95%:6,6-8,9). Os autores sugerem que essas diferenças podem ter ocorrido pelas mulheres mais velhas não serem incluídas nas recomendações de rastreamento. Entretanto, a SLD em 3 anos apresentou taxas semelhantes38.
Outro estudo, com o objetivo de analisar a relação entre idade e prognóstico de 5.438 mulheres com diagnóstico de câncer de mama, entre setembro de 1997 e janeiro de 2018, com tamanho tumoral ≤5 cm e 1 a 3 linfonodos positivos com dados, utilizou dados de 11 hospitais chineses. Outros critérios incluíram tratamento com mastectomia e dissecção axilar com margens negativas, ausência de evidência de metástase a distância e não ter realizado quimioterapia neoadjuvante. A média de seguimento foi de 67 meses. A SLD foi de 83,9%. A idade apresentou uma curva em U na associação do desfecho SLD ao ser utilizada como contínua, com 50 anos como referência. Essa idade apresentou menor risco de recidiva. A análise foi ajustada por período de tratamento (1997–2007 vs. 2008–2018), localização tumoral, tamanho tumoral patológico (pT2 vs. pT1), grau tumoral (G3 vs. G1-2), presença de invasão linfovascular, receptores hormonais, linfonodos positivos, radioterapia, quimioterapia e HER-239.
Dados de 192 mulheres com câncer de mama que realizaram tratamento neoadjuvante do Kaohsiung Medical University Hospital em Taiwan foram analisados sobre o impacto da idade na SLD. Não houve diferença entre os grupos de idade em relação à taxa de resposta completa. Entretanto, mulheres com menos de 50 anos tiveram melhora SLD comparada às mais velhas, entre as que não tiveram resposta completa40. O grupo com resposta patológica completa teve apenas 17 pacientes, e o grupo com 50 anos ou mais teve melhor resposta. Os autores sugerem que a resposta patológica completa pode ser um desfecho substituto para a SLD em mulheres com mais de 50 anos.
A variável estado civil, apesar de não significativa estatisticamente, também teve resultados coincidentes com outros estudos de SG e SLD, os quais demonstraram piores índices entre mulheres solteiras13,41, além de ser comum o fato de mulheres não casadas terem doença mais avançada ao momento do diagnóstico42.
Algumas limitações devem ser consideradas nesta pesquisa, sobretudo o fato de se tratar de um estudo retrospectivo, suscetível à ausência e à omissão de informações. Destaca-se a ausência das informações sobre raça/cor e escolaridade entre os dados apresentados. Ambas não puderam ser incluídas no estudo por ausência de dados. Entretanto, sabe-se da importância dessas tanto para o diagnóstico quanto para a sobrevida após o tratamento do câncer de mama. Outra limitação é que se trata de um estudo de coorte dinâmica, e nem todos os indivíduos incluídos tiveram o mesmo tempo de acompanhamento, o que pode gerar viés nas estimativas de risco, mas todos os testes respeitaram a proporcionalidade dos riscos ao longo do tempo. Também deve-se levar em conta que os estudos consultados na revisão de literatura para a validação dos resultados encontrados, mesmo quando consonantes, foram delineados por diferentes metodologias, as quais podem interferir direta e indiretamente na qualidade dos dados apresentados.
CONCLUSÃO
A SLD foi de 80,6% em 36 meses e de 89,9% em 60 meses nessa coorte aberta de um serviço privado de saúde e foi associada de maneira independente ao estadiamento no momento do diagnóstico. Ainda que tenha sido realizado em um serviço com características que possam ser consideradas diferenciadas por ter acesso facilitado e parte da população estar abaixo da faixa etária de rastreamento, o estudo é importante para a compreensão da doença e dos fatores relacionados à sua recidiva em todos os âmbitos da saúde. Os dados encontrados mostraram-se semelhantes a outros estudos realizados em serviços públicos de saúde brasileiros. O estadiamento ao diagnóstico é um fator que determina de maneira independente os resultados clínicos nessa população. Demonstrando a importância da conscientização do diagnóstico precoce do câncer de mama.
Sabe-se que os resultados podem contribuir significativamente para a identificação de perfis de risco e, também, para a validação de intervenções terapêuticas adotadas nos últimos anos, um avanço relevante para o cuidado em saúde direcionado ao câncer de mama. Além disso, o estudo é relevante para o cenário nacional, dada a escassez de pesquisas relacionadas à SLD na população brasileira.
AGRADECIMENTOS
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (Processo 307848/2021-3).
CONTRIBUIÇÕES
Ambas as autoras contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e na revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITOS DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
1. Instituto Nacional de Câncer José Alencar Gomes da Silva. A situação do câncer de mama no Brasil: síntese de dados dos sistemas de informação. Rio de Janeiro: INCA; 2019.
2. Ferlay J, Ervik M, Lam F, et al. Global Cancer Observatory: cancer today [Internet]. Lyon: International Agency for Research on Cancer; 2024 [acesso 2024 out 20]. Disponível em: https://gco.iarc.fr/today
3. Atlas On-line de Mortalidade [Internet]. Rio de Janeiro: Instituto Nacional de Câncer José Alencar Gomes da Silva. c1996-2014 - [acesso 2024 out 12]. Disponível em https://mortalidade.inca.gov.br/
4. Azamjah N, Soltan-Zadeh Y, Zayeri F. Global trend of breast cancer mortality rate: a 25-year study. Asian Pac J Cancer Prev. 2019;20(7):2015-20. doi: https://doi.org/10.31557/apjcp.2019.20.7.2015
5. Couto MSA, Guerra MR, Firme VAC, et al. Comportamento da mortalidade por câncer de mama nos municípios brasileiros e fatores associados. Rev Panam Salud Pública. 2017;41:1. doi: https://doi.org/10.26633/rpsp.2017.168
6. Ayala ALM, Anjos JC, Cassol GA, et al. Sobrevida em 10 anos em mulheres com câncer de mama: coorte história de 2000-2014. Ciênc saúde coletiva. 2019;24(4):1537-50. doi: https://doi.org/10.1590/1413-81232018244.16722017
7. Borges GS, Colchon PH, Júnior MCS, et al. Análise da sobrevida livre de doença e sobrevida global em pacientes com câncer de mama luminal A. Rev Bras Oncol Clin. 2011;7(26):18-26.
8. Allemani C, Matsuda T, Di Carlo V, et al. Global surveillance of trends in cancer survival 2000–14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018;391(10125):1023-75. doi: https://doi.org/10.1016/s0140-6736(17)33326-3
9. Machado KK, Katz A, Buyse M, et al. Sobrevida global e outros desfechos clínicos em câncer de mama: situação atual e controvérsias. Rev Assoc Med Bras. 2010;56(5):514-6. doi: https://doi.org/10.1590/S0104-42302010000500008
10. Diniz RW, Guerra MR, Cintra JRD, et al. Disease-free survival in patients with non-metastatic breast cancer. Rev Assoc Med Bras. 2016;62(5):407-13. doi: https://doi.org/10.1590/1806-9282.62.05.407
11. Peres VC, Veloso DLC, Xavier RM, et al. Breast cancer in women: recurrence and survival at five years. Texto contexto - enferm. 2015;24(3):740-7. doi: https://doi.org/10.1590/0104-07072015000600014
12. Guerra MR, Mendonça GAS, Bustamante-Teixeira MT, et al. Sobrevida de cinco anos e fatores prognósticos em coorte de pacientes com câncer de mama assistidas em Juiz de Fora, Minas Gerais, Brasil. Cad Saúde Pública. 2009;25(11):2455-66. doi: https://doi.org/10.1590/S0102-311X2009001100015
13. Schneider IJC, d’Orsi E. Sobrevida em cinco anos e fatores prognósticos em mulheres com câncer de mama em Santa Catarina, Brasil. Cad Saúde Pública. 2009;25(6):1285-96. doi: https://doi.org/10.1590/S0102-311X2009000600011
14. Rothman KJ, Greenland S, Lash TL, et al. Modern epidemiology. 2 ed. Philadelphia: Lippincott-Raven; 1998. 737 p.
15. Vandenbroucke JP, Pearce N. Incidence rates in dynamic populations. Int J Epidemiol. 2012;41(5):1472-9. doi: https://doi.org/10.1093/ije/dys142
16. Le-Rademacher J, Wang X. Time-to-event data: an overview and analysis considerations. J Thorac Oncol. 2021;16(7):1067-74. doi: https://doi.org/10.1016/j.jtho.2021.04.004
17. StataR [Internet]. Versão 16.1. Lakeway: StataCorp LLC; 1996–2024c. [acesso 2023 nov 20]. Disponível em: https://www.stata.com/
18. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
19. Carmo PO, Leite ICG, Guerra MR. Sobrevida de mulheres com câncer de mama subtipo luminal assistidas em Juiz de Fora, MG. Rev Bras Mastol (Impr). 2016;26(3):118-25. doi: https://doi.org/10.5327/Z201600030007RBM
20. Simons JM, Jacobs JG, Roijers JP, et al. Disease-free and overall survival after neoadjuvant chemotherapy in breast cancer: breast-conserving surgery compared to mastectomy in a large single-centre cohort study. Breast Cancer Res Treat. 2021;185(2):441-51. doi: https://doi.org/10.1007/s10549-020-05966-y
21. Nowikiewicz T, Wiśniewska M, Wiśniewski M, et al. Overall survival and disease-free survival in breast cancer patients treated at the Oncology Centre in Bydgoszcz – analysis of more than six years of follow-up. Contemp Oncol (Pozn). 2015;19(4):284-9. doi: https://doi.org/10.5114/wo.2015.54387
22. Pruessmann J, Pursche T, Hammersen F, et al. Conditional disease-free and overall survival of 1,858 young women with non-metastatic breast cancer and with participation in a post-therapeutic rehab programme according to clinical subtypes. Breast Care (Basel). 2021;16(2):163-72. doi: https://doi.org/10.1159/000507315
23. Brierley JD, Gospodarowicz M, Wittekind CH, editors. TNM Classification of Malignant Tumours. 8 ed. Chichester, West Sussex: Wiley Blackwell; 2017.
24. Amin MB, editor. AJCC cancer staging manual. 8 ed. Chicago: American Joint Committee on Cancer; Springer; 2017. 1024 p.
25. Dong G, Wang D, Liang X, et al. Factors related to survival rates for breast cancer patients. Int J Clin Exp Med. 2014;7(10):3719-24.
26. Chen CC, Tang WH, Wu CC, et al. Pretreatment circulating albumin, platelet, and RDW-SD associated with worse disease-free survival in patients with breast cancer. Breast Cancer (Dove Med Press). 2024;2024(16):23-39. doi: https://doi.org/10.2147/BCTT.S443292
27. Louis D, Mathew M, Gutjahr G, et al. Survival outcomes of breast cancer patients in South India over 20 years. Asian Pacific J Cancer Prevention. 2024;25(8):2633-44. doi: https://doi.org/10.31557/APJCP.2024.25.8.2633
28. Trabulus FDC, Nazli MA, Arslan E, et al. Predictors of recurrence in breast cancer patients with pathological partial response. Rev Assoc Med Bras (1992). 2024;70(3):e20231215. doi: https://doi.org/10.1590/1806-9282.20231215
29. Mrabti H, Sauvaget C, Bendahhou K, et al. Breast cancer treatment and its impact on survival in Morocco: a study over a decade. BMC Cancer. 2024;24(1):786. doi: https://doi.org/10.1186/s12885-024-12570-6
30. Morrison DH, Rahardja D, King E, et al. Tumour biomarker expression relative to age and molecular subtypes of invasive breast cancer. Br J Cancer. 2012;107(2):382-7. doi: https://doi.org/10.1038/bjc.2012.219
31. Kheirelseid EA, Boggs JM, Curran C, et al. Younger age as a prognostic indicator in breast cancer: a cohort study. BMC Cancer. 2011;11(1):383. doi: https://doi.org/10.1186/1471-2407-11-383
32. Azim HA, Partridge AH. Biology of breast cancer in young women. Breast Cancer Res. 2014;16(4):427. doi: https://doi.org/10.1186/s13058-014-0427-5
33. Buzdar AU, Suman VJ, Meric-Bernstam F, et al. Disease-free and overall survival among patients with operable HER2-positive breast cancer treated with sequential vs concurrent chemotherapy: the ACOSOG Z1041 (Alliance) randomized clinical trial. JAMA Oncol. 2019;5(1):45-50. doi: https://doi.org/10.1001/jamaoncol.2018.3691
34. Han W, Kim SW, Ae Park I, et al. Young age: an independent risk factor for disease-free survival in women with operable breast cancer. BMC Cancer. 2004;4(82):1-8. doi: https://doi.org/10.1186/1471-2407-4-82
35. Gnerlich JL, Deshpande AD, Jeffe DB, et al. Elevated breast cancer mortality in young women (<40 years) compared with older women is attributed to poorer survival in early stage disease. J Am Coll Surg. 2009;208(3):341-7. doi: https://doi.org/10.1016/j.jamcollsurg.2008.12.001
36. Lian W, Fu F, Lin Y, et al. The impact of young age for prognosis by subtype in women with early breast cancer. Sci Rep. 2017;7(1):11625. doi: https://doi.org/10.1038/s41598-017-10414-x
37. Caparlar MA, Dokcu S, Erogu A. Significance of immunohistochemical markers in women with breast cancer. Niger J Clin Pract. 2023;26(3):314-8. doi: https://doi.org/10.4103/njcp.njcp_252_22
38. Tasci HI. Clinical and pathological differences of breast cancer in younger and elderly patients. Ann Ital Chir. 2023;94:131-1
39. Zhao XR, Tang Y, Wu HF, et al. Influence of age as a continuous variable on the prognosis of patients with pT1-2N1 breast cancer. Breast. 2022;66:136-44. doi: https://doi.org/10.1016/j.breast.2022.08.005
40. Li CL, Wu CC, Kan JY, et al. The impact of age group in breast cancer survival outcome according to neoadjuvant treatment response: a matched case-control study. Kaohsiung J Med Sci. 2022;38(3):277-82. doi: https://doi.org/10.1002/kjm2.12475
41. Ding W, Ruan G, Lin Y, et al. Dynamic changes in marital status and survival in women with breast cancer: a population-based study. Sci Rep. 2021;11(1):5421. doi: https://doi.org/10.1038/s41598-021-84996-y
42. Osborne C, Ostir GV, Du X, et al. The influence of marital status on the stage at diagnosis, treatment, and survival of older women with breast cancer. Breast Cancer Res Treat. 2005;93(1)41-7. doi: https://doi.org/10.1007/s10549-005-3702-4
Recebido em 11/6/2024
Aprovado em 21/11/2024
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
Tabela 1. Descrição das características demográficas e clínicas das pacientes, 36 meses, 2010-2024
|
Variável |
n |
% |
|
Recidiva |
Valor de p* |
|
S(t) (IC 95%) |
Valor de p† |
||
|
n |
% |
|||||||||
|
Faixa etária |
|
|
|
|
|
0,215 |
|
|
0,1567 |
|
|
|
39 anos ou menos |
37 |
13,9 |
|
6 |
16,2 |
|
|
77,7 (56,2-89,6) |
|
|
|
40 a 49 anos |
47 |
17,7 |
|
3 |
6,4 |
|
|
91,1 (74,8-97,1) |
|
|
|
50 a 69 anos |
136 |
51,1 |
|
8 |
5,9 |
|
|
92,8 (86,0-96,3) |
|
|
|
70 anos ou mais |
46 |
17,3 |
|
4 |
8,7 |
|
|
88,9 (72,6-95,7) |
|
|
Estado civil |
|
|
|
|
|
0,576 |
|
|
0,5346 |
|
|
|
Com parceiro |
150 |
61,7 |
|
10 |
6,7 |
|
|
91,5 (84,7-95,3) |
|
|
|
Sem parceiro |
93 |
38,3 |
|
8 |
8,6 |
|
|
88,6 (78,3-94,1) |
|
|
Tipo histológico |
|
|
|
|
|
0,581 |
|
|
0,5684 |
|
|
|
CDI |
198 |
74,4 |
|
18 |
9,1 |
|
|
88,2 (81,8-92,4) |
|
|
|
CDI e CLI |
11 |
4,1 |
|
1 |
9,1 |
|
|
90,9 (50,8-98,7) |
|
|
|
CLI |
23 |
8,6 |
|
1 |
4,3 |
|
|
93,3 (61,3-99,0) |
|
|
|
Outros |
34 |
12,8 |
|
1 |
2,9 |
|
|
97,0 (80,4-99,6) |
|
|
Estadiamento clínico |
|
|
|
|
|
<0,001 |
|
|
<0,001 |
|
|
|
I |
105 |
39,5 |
|
3 |
2,9 |
|
|
96,7 (90,1-99,0) |
|
|
|
II |
108 |
40,6 |
|
7 |
6,5 |
|
|
91,4 (82,8-95,8) |
|
|
|
III |
53 |
19,9 |
|
11 |
20,7 |
|
|
73,8 (57,5-84,7) |
|
|
Receptor de estrogênio |
|
|
|
|
|
0,068 |
|
|
0,0279 |
|
|
|
Negativo |
49 |
18,5 |
|
7 |
14,3 |
|
|
79,0 (60,5-89,5) |
|
|
|
Positivo |
216 |
81,5 |
|
14 |
6,5 |
|
|
92,0 (86,7-95,2) |
|
|
Receptor de progesterona |
|
|
|
|
|
0,033 |
|
|
0,0139 |
|
|
|
Negativo |
73 |
27,7 |
|
10 |
13,7 |
|
|
80,3 (66,2-89,0) |
|
|
|
Positivo |
191 |
72,3 |
|
11 |
5,8 |
|
|
93,0 (87,6-96,1) |
|
|
HER-2 |
|
|
|
|
|
0,336 |
|
|
0,3647 |
|
|
|
Negativo |
210 |
79,5 |
|
15 |
7,1 |
|
|
91,0 (85,4-94,5) |
|
|
|
Positivo |
54 |
20,5 |
|
6 |
11,1 |
|
|
85,1 (69,5-93,1) |
|
|
Protocolo de tratamento |
|
|
|
|
|
0,230 |
|
|
0,0323 |
|
|
|
Outras combinações |
37 |
13,9 |
|
5 |
13,5 |
|
|
77,4 (52,0-90,4) |
|
|
|
Cirurgia, HTx |
16 |
6 |
|
2 |
12,5 |
|
|
85,9 (54,0-96,3) |
|
|
|
Cirurgia, RTx, HTx |
35 |
13,2 |
|
- |
- |
|
|
1 |
|
|
|
Cirurgia, QTx |
34 |
12,8 |
|
4 |
11,8 |
|
|
78,3 (50,8-91,6) |
|
|
|
Cirurgia, QTx, HTx |
50 |
18,8 |
|
2 |
4 |
|
|
95,3 (82,3-98,8) |
|
|
|
Cirurgia, QTx, RTx |
21 |
7,9 |
|
3 |
14,3 |
|
|
81,6 (53,0-93,7) |
|
|
|
Cirurgia, QTx, RTx, HTx |
73 |
27,4 |
|
5 |
6,8 |
|
|
91,5 (80,8-96,4) |
|
|
Recidiva em 36 meses |
|
|
|
|
|
|
|
|
|
|
|
|
Não |
245 |
92,1 |
|
|
|
|
|
|
|
|
|
Sim |
21 |
7,9 |
|
|
|
|
|
|
|
|
Probabilidade de sobrevida |
n |
Pessoa-mês |
Recidiva |
Taxa média de incidência por mil pessoas-mês |
|
S(t) (IC 95%) |
|
|||
|
|
12 meses |
205 |
2.791,5 |
|
8 |
2,9 (1,4-5,7) |
|
96,7 (93,4-98,3) |
|
|
|
|
24 meses |
176 |
2.238 |
|
7 |
3,1 (1,5-6,5) |
|
93,2 (88,7-95,8) |
|
|
|
|
36 meses |
150 |
1.939 |
|
6 |
3,1 (1,4-6,9) |
|
89,5 (84,8-93,3) |
|
|
Legendas: S (t) (IC 95%) = função de sobrevivência (intervalo de confiança 95%); CDI = carcinoma ductal infiltrante, CLI = carcinoma lobular infiltrante, HTx = hormonioterapia, RTx = radioterapia; QTx = quimioterapia.
*valor de p do teste qui-quadrado; †valor de p do teste log-rank.
Tabela 2. Descrição das características demográficas e clínicas das pacientes, 60 meses, 2010-2024
|
Variável |
n |
% |
|
Recidiva |
p* |
|
S(t) (IC 95%) |
p† |
||
|
n |
% |
|||||||||
|
Faixa etária |
|
|
|
|
|
0,62 |
|
|
0,575 |
|
|
|
39 anos ou menos |
25 |
11,6 |
|
5 |
220 |
|
|
74,1 (48,2-88,4) |
|
|
|
40 a 49 anos |
35 |
16,3 |
|
4 |
11,4 |
|
|
81,4 (57,6-92,6) |
|
|
|
50 a 69 anos |
120 |
55,8 |
|
14 |
11,7 |
|
|
83,3 (73,1-89,9) |
|
|
|
70 anos ou mais |
35 |
16,3 |
|
6 |
17,1 |
|
|
74,6 (51,2-88,0) |
|
|
Estado civil |
|
|
|
|
|
0,658 |
|
|
0,627 |
|
|
|
Com parceiro |
123 |
63,1 |
|
16 |
13 |
|
|
81,3 (71,0-88,2) |
|
|
|
Sem parceiro |
72 |
36,9 |
|
11 |
15,3 |
|
|
79,0 (65,0-87,8) |
|
|
Tipo histológico |
|
|
|
|
|
0,131 |
|
|
0,211 |
|
|
|
CDI |
163 |
75,8 |
|
27 |
16,6 |
|
|
77,2 (68,4-83,9) |
|
|
|
CDI e CLI |
9 |
4,2 |
|
- |
- |
|
|
100 |
|
|
|
CLI |
17 |
7,9 |
|
1 |
5,9 |
|
|
90,9 (50,8-98,7) |
|
|
|
Outros |
26 |
12,1 |
|
1 |
3,8 |
|
|
90,0 (47,3-98,5) |
|
|
Estadiamento clínico |
|
|
|
|
|
<0,001 |
|
|
<0,001 |
|
|
|
I |
91 |
42,3 |
|
4 |
4,4 |
|
|
94,3 (85,2-97,9) |
|
|
|
II |
81 |
37,7 |
|
9 |
11,1 |
|
|
83,7 (70,7-91,2) |
|
|
|
III |
43 |
20 |
|
16 |
37,2 |
|
|
50,3 (31,8-66,3) |
|
|
Receptor de estrogênio |
|
|
|
|
|
0,333 |
|
|
0,201 |
|
|
|
Negativo |
38 |
17,8 |
|
7 |
18,4 |
|
|
69,4 (45,8-84,2) |
|
|
|
Positivo |
176 |
82,3 |
|
22 |
12,5 |
|
|
82,7 (74,8-88,4) |
|
|
Receptor de progesterona |
|
|
|
|
|
0,380 |
|
|
0,243 |
|
|
|
Negativo |
59 |
27,7 |
|
10 |
16,9 |
|
|
74,0 (56,5-85,3) |
|
|
|
Positivo |
154 |
72,3 |
|
19 |
12,3 |
|
|
82,8 (74,2-88,8) |
|
|
HER-2 |
|
|
|
|
|
0,286 |
|
|
0,216 |
|
|
|
Negativo |
170 |
79,8 |
|
21 |
12,3 |
|
|
82,2 (73,9-88,2) |
|
|
|
Positivo |
43 |
20,2 |
|
8 |
18,6 |
|
|
73,4 (53,1-86,0) |
|
|
Protocolo de tratamento |
|
|
|
|
|
0,379 |
|
|
0,3 |
|
|
|
Outras combinações |
22 |
10,2 |
|
3 |
13,6 |
|
|
75,0 (38,2-91,7) |
|
|
|
Cirurgia, HTx |
15 |
7 |
|
3 |
20 |
|
|
72,7 (34,9-90,8) |
|
|
|
Cirurgia, RTx, HTx |
33 |
15,3 |
|
1 |
3 |
|
|
96,1 (75,7-99,5) |
|
|
|
Cirurgia, QTx |
30 |
13,9 |
|
3 |
10 |
|
|
78,4 (46,4-92,6) |
|
|
|
Cirurgia, QTx, HTx |
40 |
18,6 |
|
5 |
12,5 |
|
|
82,7 (62,6-92-6) |
|
|
|
Cirurgia, QTx, RTx |
16 |
7,5 |
|
4 |
25 |
|
|
70,5 (38,9-87,8) |
|
|
|
Cirurgia, QTx, RTx, HTx |
59 |
27,5 |
|
10 |
17 |
|
|
77,5 (62,1-87,3) |
|
|
Recidiva em 60 meses |
|
|
|
|
|
|
|
|
|
|
|
|
Não |
186 |
86,5 |
|
|
|
|
|
|
|
|
|
Sim |
29 |
13,5 |
|
|
|
|
|
|
|
|
Probabilidade de sobrevida |
n |
Pessoa-mês |
|
Recidiva |
Taxa média de incidência por mil pessoas-mês |
|
S(t) (IC 95%) |
|
||
|
|
12 meses |
171 |
2.320,5 |
|
6 |
2,6 (1,2-5,8) |
|
96,7 (93,4-98,3) |
|
|
|
|
24 meses |
148 |
1.887 |
|
5 |
2,6 (1,1-6,4) |
|
93,9 (82,2-96,6) |
|
|
|
|
36 meses |
128 |
1.642 |
|
6 |
3,6 (16-8,2) |
|
90,0 (84,3-93,7) |
|
|
|
|
48 meses |
114 |
1.438 |
|
5 |
2,5 (1,5-8,4) |
|
86,3 (79,8-90,8) |
|
|
|
|
60 meses |
83 |
1.196 |
|
7 |
5,8 (2,8-12,3) |
|
80,6 (73,1-86,2) |
|
|
Legendas: S (t) (IC 95%) = função de sobrevivência (intervalo de confiança 95%); CDI = carcinoma ductal infiltrante; CLI = carcinoma lobular infiltrante; HTx = hormonioterapia; RTx = radioterapia; QTx = quimioterapia.
*valor de p do teste qui-quadrado; †valor de p do teste log-rank.
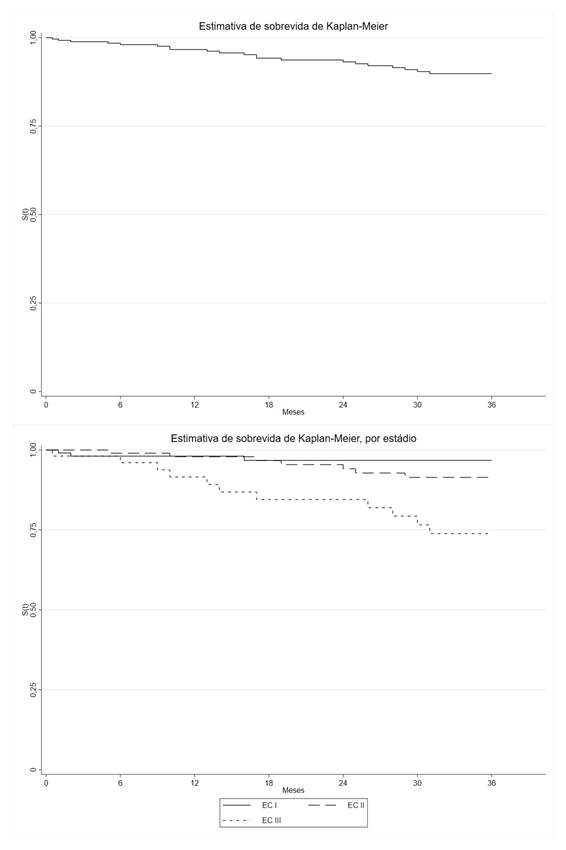
Gráfico 1. Sobrevida livre de doença após diagnóstico do câncer de mama, 36 meses de acompanhamento, 2010-2024
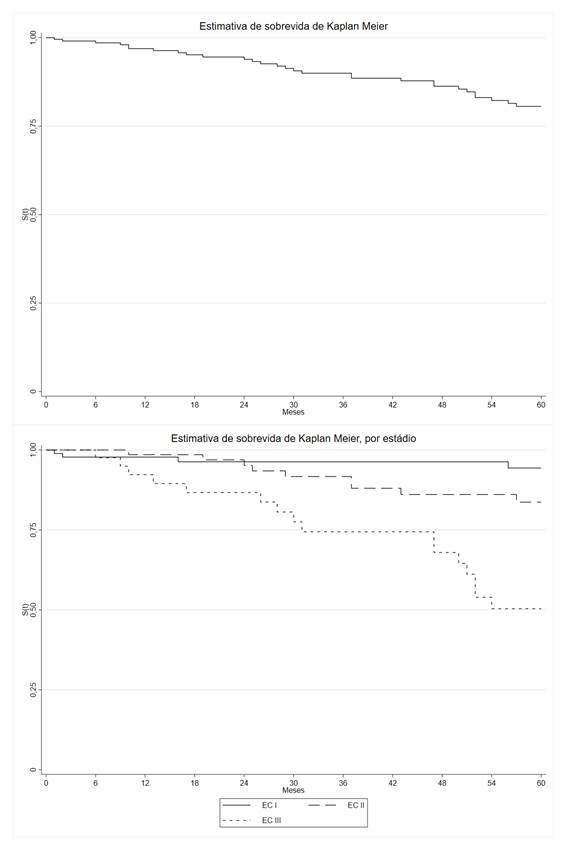
Gráfico 2. Sobrevida livre de doença após diagnóstico do câncer de mama, 60 meses de acompanhamento, 2010-2024
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.