DISCUSSÃO
Neste estudo, avaliou-se a prevalência de DRD em pacientes com câncer avançado locorregional e metastático sem possibilidades terapêuticas de cura, usando ASG-PPP VR, critérios do consenso internacional de CC e do GLIM. Não foi verificada acurácia satisfatória do diagnóstico de DRD para as diferentes combinações fenotípicas do critério GLIM e do consenso de CC quando comparados à ASG-PPP VR, bem como medidas de acurácia não atingiram níveis aceitáveis utilizando a ASG-PPP VR como método de referência.
A prevalência de alterações do estado nutricional foi alta neste estudo, de 71,3% pelo GLIM, 79,1% pelo consenso de CC e 58,3% por meio da ASG-PPP VR. Tais resultados estão de acordo com o estudo multicêntrico de Santos et al.17, com 261 pacientes com câncer colorretal avaliados em três hospitais brasileiros, o qual mostrou prevalência de desnutrição de 45,1% a 80,2% de acordo com as combinações dos critérios do GLIM e de 57,2% pela ASG-PPP. Outro estudo com 885 pacientes com câncer hospitalizados no Brasil, que excluiu pacientes em cuidados paliativos, verificou menores prevalências de desnutrição, variando de 3,9% a 30% conforme as combinações dos critérios do GLIM e 26,1% de acordo com a ASG (categorias B ou C)18. No estudo multicêntrico Chinês de Zhang et al.16, dos 637 pacientes incluídos, 28,3% e 43,3% apresentavam desnutrição usando o GLIM e a ASG-PPP, respectivamente.
As diferenças na prevalência da desnutrição nos estudos podem ser atribuídas, entre outros fatores, ao estágio da doença, uma vez que 85,8% da presente amostra foi constituída de pacientes com doença metastática, assim como 73% dos pacientes no estudo de Santos et al.17 apresentavam tumores nos estádios III e IV. Enquanto nos estudos de Ozorio et al.18 e de Zhang et al.16, 55,1% e 66,8% dos pacientes apresentavam estadiamentos III e IV. A presença do câncer em estágio avançado pode resultar em pior estado nutricional, como expressão da relação entre carga tumoral, estado inflamatório, redução da ingestão alimentar, presença de sintomas e PP, repercutindo em maiores prevalências de desnutrição1.
No presente estudo, os critérios GLIM, o consenso de CC e a ASG-PPP VR foram aplicados em todos os pacientes sem triagem prévia de risco nutricional, considerando o fato de que são pacientes minimamente em risco nutricional dado o diagnóstico de câncer incurável e de acordo com resultados de estudos prévios realizados com pacientes da mesma UCP2,12,33. Apesar de, ao longo da última década, ter havido progresso na compreensão sobre os mecanismos etiológicos, permitindo melhorar a definição e as terminologias associadas ao diagnóstico nutricional, como DRD, CC e sarcopenia1,8,14, na prática clínica, observa-se que essas três condições podem coexistir e seus diagnósticos clínicos abordam critérios etiológicos e fenotípicos comuns como PP, baixo IMC, baixa massa muscular e inflamação, impondo o desafio de diferenciá-las em contextos clínicos.
Nessa conjuntura, em 2021, as diretrizes da European Society for Medical Oncology (ESMO) recomendaram avaliar a CC de acordo com a definição GLIM5. Em termos práticos, tanto do ponto de vista terminológico quanto dos critérios diagnósticos, a CC e a DRD definidas por consenso de especialistas propõem parâmetros comuns como PP de 5%, baixo IMC (mesmos pontos de corte em ambas as definições) e baixa massa muscular, além da presença de inflamação sistêmica. Tal fato corrobora os resultados deste estudo, que demonstraram melhor concordância e uma excelente acurácia (92,1%) entre essas duas definições, com sensibilidade de 100%. Esses resultados sugerem que o GLIM poderia ser utilizado como uma proposta de abordagem em substituição ao consenso de CC, conforme proposto pela ESMO em 2021. Por outro lado, é importante salientar que a proposta do GLIM tampouco melhorou a então existente proposta diagnóstica do consenso internacional de CC, método que é utilizado na prática clínica e em pesquisas para o contexto de pacientes com câncer desde 2011.
Outro ponto importante é que a maioria dos estudos publicados, avaliando a validade concorrente e preditiva do GLIM em pacientes com câncer, utiliza a presença da carga da doença como critério etiológico, o que foi ratificado pela publicação recente do comitê GLIM27. Um aspecto relevante a ser considerado é que nem todo paciente com câncer, inclusive incurável, possui marcadores inflamatórios elevados, por exemplo, PCR >10 mg/L ou escore prognóstico de Glasgow (EPG) = 2 (que indica PCR elevada e albumina reduzida). Publicações prévias de estudos nessa população demonstraram que a prevalência do EPG modificado igual a 0, ou seja, PCR <10 mg/L, foi maior do que 60%34,35, o que está de acordo com os resultados do presente estudo, cujos valores médios de albumina e medianos de PCR nos desnutridos e caquéticos foram de 3,4 g/dL e entre 6,7-7,5 mg/L, respectivamente. Ou seja, embora significativamente mais elevados quando comparados aos bem nutridos e não caquéticos, não atendem aos pontos de corte recomendados para classificação de presença de inflamação sistêmica. Tais resultados podem sugerir que a incorporação dos parâmetros inflamatórios nos pontos de corte mais comumente utilizados ou os propostos pelo comitê GLIM25 podem não contribuir para melhorar a acurácia diagnóstica no contexto de pacientes com câncer.
Os resultados deste estudo demonstram que, quando comparada aos consensos do GLIM e de CC, a ASG-PPP identificou menos pacientes desnutridos. Isso poderia ser explicado pela simplificação dos critérios diagnósticos do GLIM e de CC, uma vez que uma PP de 5% ou IMC <20 (<22 se mais de 70 anos) é suficiente para diagnosticar a DRD. Também poderia estar relacionado ao fato de a ASG-PPP não comtemplar nenhum critério de avaliação da inflamação sistêmica para diagnóstico da desnutrição. No entanto, em contrapartida, esse instrumento contempla outros domínios importantes para avaliação nutricional de pacientes com câncer, como a ingestão alimentar e os SIN. O estudo de Martin et al.36 avaliou 12.253 pacientes com câncer avançado e demonstrou que a baixa ingestão alimentar e a inflamação sistêmica são fatores associados à perda de peso corporal; no entanto, a razão de chance foi maior para a baixa ingestão alimentar, mesmo quando comparada a valores de PCR >10 mg/L. Dessa forma, independentemente do apetite e da presença de inflamação, a baixa ingestão é um fator modificável que contribui significativamente para a perda de peso corporal.
É importante mencionar que o estado nutricional e os aspectos clínicos relacionados à evolução da doença sofrem alterações transitáveis e não necessariamente conjugadas. Assim, os diversos parâmetros de avaliação nutricional podem sofrer diferentes graus de alterações desde os primeiros sinais e sintomas de anorexia até as alterações de pré-caquexia, caquexia e caquexia refratária, ou seja, os sinais de comprometimento nutricional são mutáveis, mas nem sempre concomitantes1. No caso da CC, por exemplo, existe uma dificuldade para o diagnóstico, por se tratar de um espectro metabólico complexo, com graus e características variados, e que não pode ser limitado a um único parâmetro. Por isso, esforços têm sido gerados para a definição dos critérios diagnósticos, com combinação de fatores e pontos de corte2,33. Apesar da complexidade envolvida, identificar a fase do estado nutricional é essencial para que se adote um plano de cuidados individualizado com medidas de intervenção ou controle de sintomas adequadas às necessidades nutricionais2.
No presente estudo, a ASG-PPP apresentou muito baixa concordância e acurácia com os critérios do GLIM. Outros estudos prévios com pacientes com câncer em diferentes contextos clínicos não relataram acurácia aceitável do GLIM considerando a ASG-PPP como parâmetro de referência16-18,37-39. O estudo de Henriksen et al.40, com 426 pacientes com câncer colorretal, mostrou que a concordância entre a ASG-PPP e o GLIM foi baixa e a sensibilidade do GLIM não atingiu níveis aceitáveis, com ou sem triagem nutricional prévia (k = 0,24), independentemente da ferramenta utilizada. Os valores de acurácia diferiram de acordo com a ferramenta de triagem utilizada antes do GLIM com melhores resultados quando ASG-PPP VR foi utilizada como ferramenta de triagem (k = 0,60, sensibilidade 47% e especificidade 97%).
Os critérios GLIM foram desenvolvidos para facilitar o diagnóstico, comparações globais da prevalência, intervenções e resultados da desnutrição. Sendo assim, a validação para avaliar sua utilidade na prática clínica é essencial. No entanto, no contexto de pacientes com câncer, ainda faltam dados que apoiem sua validade. Em razão das diferenças conceituais entre os critérios do GLIM, da CC e a ASG-PPP, não se pode esperar uma concordância de 100%, até porque esses métodos avaliam diferentes domínios conceituais da desnutrição. No entanto, a acurácia precisa ser minimamente aceitável para que o GLIM cumpra o seu propósito de universalidade e, para atingir esse objetivo, é essencial padronizar ainda mais os seus critérios diagnósticos.
A revisão sistemática de Sealy et al.41 avaliou a validade de conteúdo de métodos de avaliação da desnutrição em pacientes com câncer com base em definições conceituais internacionalmente aceitas para desnutrição. Dos 37 métodos de avaliação analisados pelos autores, a miniavaliação nutricional e a ASG-PPP apresentaram os melhores índices de validade de conteúdo. Dessa forma, como a ASG-PPP é frequentemente considerada uma ferramenta de avaliação nutricional bem aceita no ambiente oncológico, com várias publicações demostrando sua validade preditiva11, buscou-se avaliar a conformidade entre a ASG-PPP e os consensos do GLIM e de CC nessa população. Esses resultados não apoiam a incorporação desses métodos em substituição à ASG-PPP para o diagnóstico de DRD, podendo ser usados em paralelo com ferramentas estabelecidas e validadas, como a ASG-PPP VR. Não foram encontrados estudos prévios avaliando a validade concorrente e preditiva do GLIM no cenário de paciente com câncer incurável.
O presente estudo apresenta limitações. Primeiro, diz respeito a uma amostra de conveniência coletada em um único centro. Segundo, nem todas as combinações possíveis do GLIM forma testadas. Particularmente no que se refere à avaliação da massa muscular, nenhum método de maior acurácia foi utilizado, apenas medidas antropométricas. No entanto, embora as medidas antropométricas sejam métodos duplamente indiretos de avaliação da massa muscular e, portanto, de baixa precisão, constituem medidas simples e amplamente disponíveis na prática clínica. Por fim, não foi avaliada a capacidade preditiva dos três diferentes métodos de avaliação, uma vez que o objetivo foi verificar a validade concorrente ou a capacidade diagnóstica dos métodos mais tradicionais para a avaliação de pacientes com câncer avançado. Ademais, as capacidades preditivas da ASG-PPP VR e de diferentes critérios diagnósticos da CC já foram avaliadas previamente em outros estudos do mesmo grupo de pesquisa, os quais demostraram associação significativa do pior estado nutricional avaliado por esses métodos com desfechos desfavoráveis e mortalidade2,12.
Por fim, é essencial avaliar periodicamente os pacientes com câncer, pois o estado nutricional é uma condição modificável. Como componentes importantes dos cuidados de suporte, os cuidados nutricionais e metabólicos enfrentam limites próprios e ainda não existe tratamento padrão-ouro disponível para abordar a DRD e o catabolismo no câncer. Novos estudos podem contribuir para verificar a validade e a aplicabilidade do GLIM para avaliação de pacientes com câncer com foco na melhor uniformização dos critérios de avaliação nutricional e para direcionar as diferentes opções de cuidados nutricionais.
CONCLUSÃO
Os critérios do GLIM e do consenso de CC apresentaram concordância muito fraca quando comparados com a ASG-PPP VR. Além disso, apresentaram medidas de acurácia consideradas não aceitáveis para o diagnóstico nutricional. Esses resultados sugerem menor aplicabilidade prática do GLIM e do consenso de CC para a avaliação nutricional na população estudada.
CONTRIBUIÇÕES
Emanuelly Varea Maria Wiegert e Larissa Calixto-Lima contribuíram na elaboração e planejamento do estudo; na análise e interpretação dos dados; na redação e revisão crítica. Gabriella da Costa Cunha contribuiu na coleta, análise e interpretação dos dados; na redação e revisão crítica. Todas as autoras aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITOS DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
REFERÊNCIAS
1. Bossi P, Delrio P, Mascheroni A, et al. The spectrum of malnutrition/cachexia/sarcopenia in oncology according to different cancer types and settings: a narrative review. Nutrients. 2021;13(6):1980. doi: https://doi.org/10.3390/nu13061980
2. Wiegert EVM, Oliveira LC, Calixto-Lima L, et al. Cancer cachexia: comparing diagnostic criteria in patients with incurable cancer. Nutrition. 2020;79-80:110945. doi: https://doi.org/10.1016/j.nut.2020.110945
3. Pinho NB, Martucci RB, Rodrigues VD, et al. Malnutrition associated with nutrition impact symptoms and localization of the disease: results of a multicentric research on oncological nutrition. Clin Nutr. 2019;38(3):1274-9. doi: https://doi.org/10.1016/j.clnu.2018.05.010
4. Muscaritoli M, Arends J, Bachmann P, et al. ESPEN practical guideline: clinical nutrition in cancer. Clin Nutr. 2021;40(5):2898-913. doi: https://doi.org/10.1016/j.clnu.2021.02.005
5. Arends J, Strasser F, Gonella S, et al. Cancer cachexia in adult patients: ESMO Clinical Practice Guidelines. ESMO Open. 2021;6(3):100092. doi: https://doi.org/10.1016/j.esmoop.2021.100092
6. Erickson N, Sullivan ES, Kalliostra M, et al. Nutrition care is an integral part of patient-centred medical care: a European consensus. Med Oncol. 2023;40(4):112. doi: https://doi.org/10.1007/s12032-023-01955-5
7. Arends J. Struggling with nutrition in patients with advanced cancer: nutrition and nourishment-focusing on metabolism and supportive care. Ann Oncol. 2018;29(supl 2):ii27-34. doi: https://doi.org/10.1093/annonc/mdy093
8. Horie LM, Barrére APN, Castro MG, et al. Diretriz BRASPEN de terapia nutricional no paciente com câncer. BRASPEN J. 2019;34(1):2‐32.
9. Instituto Nacional de Câncer José Alencar Gomes da Silva. Consenso nacional de nutrição oncológica [Internet]. Rio de Janeiro: Instituto Nacional de Câncer; 2015. [acesso 2024 abr 5]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document/consenso_nacional_de_nutricao_oncologica_-_2a_edicao_2015_completo_0.pdf
10. Sociedade Brasileira de Nutrição Oncológica. Consenso Brasileiro de Nutrição Oncológica da SBNO [Internet]. Rio de Janeiro: SBNO; 2021. [acesso 2024 abr 5]. Disponível em: https://sbno.com.br/wp-content/uploads/2021/07/consenso_2021.pdf
11. Jager-Wittenaar H, Ottery FD. Assessing nutritional status in cancer: role of the patient-generated subjective global assessment. Curr Opin Clin Nutr Metab Care. 2017;20(5):322-9. doi: https://doi.org/10.1097/MCO.0000000000000389
12. Cunha MS, Wiegert EVM, Calixto-Lima L, et al. Validation of the scored Patient-generated subjective global assessment short form as a prognostic tool for incurable cancer patients. JPEN J Parenter Enteral Nutr. 2022;46(4):915-22. doi: https://doi.org/10.1002/jpen.2251
13. Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol. 2011;12(5):489-95. doi: https://doi.org/10.1016/S1470-2045(10)70218-7
14. Cederholm T, Barazzoni R, Austin P, et al. ESPEN guidelines on definitions and terminology of clinical nutrition. Clin Nutr. 2017;36(1):49-64. doi: https://doi.org/10.1016/j.clnu.2016.09.004
15. Cederholm T, Jensen GL, Correia MITD, et al. GLIM criteria for the diagnosis of malnutrition - a consensus report from the global clinical nutrition community. Clin Nutr. 2019;38(1):1-9. doi: https://doi.org/10.1016/j.clnu.2018.08.002
16. Zhang Z, Wan Z, Zhu Y, et al. Prevalence of malnutrition comparing NRS2002, MUST, and PG-SGA with the GLIM criteria in adults with cancer: a multi-center study. Nutrition. 2021;83:111072. doi: https://doi.org/10.1016/j.nut.2020.111072
17. Santos ALS, Santos BC, Frazão LN, et al. Validity of the GLIM criteria for the diagnosis of malnutrition in patients with colorectal cancer: a multicenter study on the diagnostic performance of different indicators of reduced muscle mass and disease severity. Nutrition. 2024;119:112324. doi: https://doi.org/10.1016/j.nut.2023.112324
18. Ozorio GA, Ribeiro LMK, Santos BC, et al. Exploring the use of the GLIM criteria to diagnose malnutrition in cancer inpatients. Nutrition. 2023;116:112195. doi: https://doi.org/10.1016/j.nut.2023.112195
19. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
20. Schag CC, Heinrich RL, Ganz PA. Karnofsky performance status revisited: reliability, validity, and guidelines. J Clin Oncol. 1984;2(3):187-93. doi: https://doi.org/10.1200/JCO.1984.2.3.187
21. Heymsfield SB, McManus C, Smith J, et al. Anthropometric measurement of muscle mass: revised equations for calculating bone-free arm muscle area. Am J Clin Nutr. 1982;36(4):680-90. doi: https://doi.org/10.1093/ajcn/36.4.680
22. Tietz NW, editor. Clinical guide to laboratory tests. 4 ed. Missoouri: Elsevier ; 2006.
23. ASG-PPP [Internet]. versão 18-008 v.05.21.18. Ottery: Pt-Global Platform; ©2014. [acesso 2024 abr 5]. Disponível em: https://pt-global.org/downloads-da-pg-sga/?lang=pt
24. Abbott J, Teleni L, McKavanagh D, et al. Patient-Generated Subjective Global Assessment Short Form (PG-SGA SF) is a valid screening tool in chemotherapy outpatients. Support Care Cancer. 2016;24(9):3883-7. doi: https://doi.org/10.1007/s00520-016-3196-0
25. Carriço M, Guerreiro CS, Parreira A. The validity of the Patient-Generated Subjective Global Assessment Short-form© in cancer patients undergoing chemotherapy. Clin Nutr ESPEN. 2021;43:296-301. doi: https://doi.org/10.1016/j.clnesp.2021.03.037
26. Azevedo MD, Pinho NB, Carvalho Padilha P, et al. Clinical usefulness of the patient-generated subjective global assessment short form for nutritional screening in patients with head and neck cancer: a multicentric study. Ecancermedicalscience. 2024;18:1662. doi: https://doi.org/10.3332/ecancer.2024.1662
27. Cederholm T, Jensen GL, Ballesteros-Pomar MD, et al. Guidance for assessment of the inflammation etiologic criterion for the GLIM diagnosis of malnutrition: a modified Delphi approach. Clin Nutr. 2023;43(5):1025-32. doi: https://doi.org/10.1016/j.clnu.2023.11.026
28. Barazzoni R, Jensen GL, Correia MITD, et al. Guidance for assessment of the muscle mass phenotypic criterion for the Global Leadership Initiative on Malnutrition (GLIM) diagnosis of malnutrition. Clin Nutr. 2022;41(6):1425-33. doi: https://doi.org/10.1016/j.clnu.2022.02.001
29. Gonzalez MC, Mehrnezhad A, Razaviarab N. Calf circumference: cutoff values from the NHANES 1999-2006. Am J Clin Nutr. 2021;113(6):1679-87. doi: https://doi.org/10.1093/ajcn/nqab029
30. SPSS®: Statistical Package for Social Science (SPSS) [Internet]. Versão 23.0. [Chicago]. International Business Machines Corporation. [acesso 2023 mar 9]. Disponível em: https://www.ibm.com/br-pt/spss?utm_content=SRCWW&p1=Search&p4=43700077515785492&p5=p&gclid=CjwKCAjwgZCoBhBnEiwAz35Rwiltb7s14pOSLocnooMOQh9qAL59IHVc9WP4ixhNTVMjenRp3-aEgxoCubsQAvD_BwE&gclsrc=aw.ds
31. McHugh ML. Interrater reliability: the kappa statistic. Biochem Med (Zagreb). 2012;22(3):276-82.
32. de van der Schueren MAE, Keller H, GLIM Consortium, et al. Global Leadership Initiative on Malnutrition (GLIM): guidance on validation of the operational criteria for the diagnosis of protein-energy malnutrition in adults. Clin Nutr. 2020;39(9):2872-80. doi: https://doi.org/10.1016/j.clnu.2019.12.022
33. Wiegert EVM, Oliveira LC, Calixto-Lima L, et al. New cancer cachexia staging system for use in clinical practice. Nutrition. 2021;90:111271. doi: https://10.1016/j.nut.2021.111271
34. Souza Cunha M, Wiegert EVM, Calixto-Lima L, et al. Relationship of nutritional status and inflammation with survival in patients with advanced cancer in palliative care. Nutrition. 2018;51-52:98-103. doi: https://doi.org/10.1016/j.nut.2017.12.004
35. Cunha GDC, Rosa KSDC, Wiegert EVM, et al. Clinical relevance and prognostic value of inflammatory biomarkers: a prospective study in terminal cancer patients receiving palliative care. J Pain Symptom Manage. 2021;62(5):978-86. doi: https://doi.org/10.1016/j.jpainsymman.2021.04.009
36. Martin L, Muscaritoli M, Bourdel-Marchasson I, et al. Diagnostic criteria for cancer cachexia: reduced food intake and inflammation predict weight loss and survival in an international, multi-cohort analysis. J Cachexia Sarcopenia Muscle. 2021;12(5):1189-202. doi: https://doi.org/10.1002/jcsm.12756
37. De Groot LM, Lee G, Ackerie A, et al. Malnutrition screening and assessment in the cancer care ambulatory setting: mortality predictability and validity of the Patient-Generated Subjective Global Assessment Short form (PG-SGA SF) and the GLIM criteria. Nutrients. 2020;12(8):2287. doi: https://doi.org/10.3390/nu12082287
38. Yin L, Cheng N, Chen P, et al. Association of malnutrition, as defined by the PG-SGA, ESPEN 2015, and GLIM criteria, with complications in esophageal cancer patients after esophagectomy. Front Nutr. 2021;8:632546. doi: https://doi.org/10.3389/fnut.2021.632546
39. Qin L, Tian Q, Zhu W, et al. The Validity of the GLIM criteria for malnutrition in hospitalized patients with gastric cancer. Nutr Cancer. 2021;73(11-12):2732-9. doi: https://doi.org/10.1080/01635581.2020.1856894
40. Henriksen C, Paur I, Pedersen A, et al. Agreement between GLIM and PG-SGA for diagnosis of malnutrition depends on the screening tool used in GLIM. Clin Nutr. 2022;41(2):329-36. doi: https://doi.org/10.1016/j.clnu.2021.12.024
41. Sealy MJ, Nijholt W, Stuiver MM, et al. Content validity across methods of malnutrition assessment in patients with cancer is limited. J Clin Epidemiol. 2016;76:125-36. doi: https://doi.org/10.1016/j.jclinepi.2016.02.020
Recebido em 2/7/2024
Aprovado em 25/11/2024
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
Tabela 1. Características demográficas e clínicas de pacientes com câncer avançado em cuidados paliativos (n = 254)
|
Variáveis |
n (%) |
|
Idade >60 anos |
173 (68,1) |
|
Idade (mediana) |
65 (58;71) |
|
Sexo masculino |
140 (55,1) |
|
Cor da pele |
|
|
Branca |
92 (36,2) |
|
Preta |
43 (16,9) |
|
Parda |
119 (46,9) |
|
Local de atendimento |
|
|
Ambulatório |
236 (92,9) |
|
Internação hospitalar |
18 (7,1) |
|
KPS 30-40% |
63 (24,8) |
|
Sítio tumoral |
|
|
Cabeça e pescoço |
78 (30,7) |
|
TGI altoa |
32 (12,6) |
|
Colorretal |
32 (12,6) |
|
Ginecológicob |
28 (11,0) |
|
Pulmão |
19 (7,5) |
|
Urológico |
17 (6,7) |
|
Mama |
15 (5,9) |
|
Fígado, pâncreas e via biliar |
13 (5,1) |
|
Outrosc |
20 (7,9) |
|
Metástase a distância |
218 (85,8) |
|
Tratamento prévio (últimos 2 meses)* |
|
|
Quimioterapia |
177 (69,7) |
|
Radioterapia |
66 (26,0) |
|
Cirurgia |
81 (31,9) |
|
Comorbidades |
|
|
HAS |
107 (42,1) |
|
DM |
45 (17,7) |
Legendas: DM = diabetes mellitus; HAS = hipertensão arterial sistêmica; KPS = Karnofsky performance status; TGI = trato gastrointestinal; aesôfago, estômago; bcolo do útero, endométrio, ovário, vagina e vulva; cpele, olho, rim, testículo, sítio indeterminado. *A soma totaliza mais de 100%, pois um mesmo paciente pode estar em mais de uma categoria.
Tabela 2. Características nutricionais de acordo com a classificação do estado nutricional em pacientes com câncer avançado em cuidados paliativos (n = 254)
|
Variáveis |
Total (n) |
GLIM |
Consenso de CC |
ASG-PPP VR ≥ 9 pontos |
||||||
|
Bem nutrido (n=73;28,7%) |
Desnutrido (n=181;71,3%) |
p |
Não caquético (n=53;20,9%) |
Caquético (n=201;79,1%) |
p |
Bem nutrido (n=106;41,7%) |
Desnutrido (n=148;58,3%) |
p |
||
|
PP 6 meses >2%* |
254 |
26 (35,6%) |
181 (100%) |
<0,001 |
6 (11,3%) |
201 (100%) |
<0,001 |
81 (76,4%) |
126 (85,1%) |
0,055 |
|
PP 6 meses >5%* |
254 |
0 (0,0%) |
181 (100%) |
<0,001 |
0 (0,0%) |
181 (90,0%) |
<0,001 |
72 (67,9%) |
109 (73,6%) |
0,196 |
|
IMC (kg/m2)** |
245 |
20,8 ± 3,8 |
20,1 ± 4,0 |
0,257 |
21,7 ± 3,9 |
19,9 ± 3,9 |
0,005 |
19,7 ± 3,4 |
20,8 ± 4,3 |
0,029 |
|
Baixo IMC* |
245 |
39 (54,2%) |
105 (60,7%) |
0,211 |
21 (40,4%) |
123 (63,7%) |
0,002 |
68 (66,0%) |
76 (53,5%) |
0,033 |
|
PPA (cm)** |
236 |
|
|
|
|
|
|
|
|
|
|
Homens |
|
31,8 ± 3,2 |
30,3 ± 3,5 |
0,035 |
31,9 ± 3,3 |
30,4 ± 3,5 |
0,032 |
30,6 ± 3,8 |
30,8 ± 3,1 |
0,800 |
|
Mulheres |
|
29,9 ± 3,3 |
30,4 ± 3,2 |
0,509 |
30,6 ± 3,5 |
30,1 ± 3,1 |
0,574 |
29,5 ± 2,8 |
30,6 ± 3,4 |
0,097 |
|
Baixo PPA* |
236 |
43 (62,3%) |
115 (68,9%) |
0,206 |
27 (54,0%) |
131 (70,4%) |
0,023 |
74 (71,8%) |
84 (63,2%) |
0,102 |
|
AMB (cm2)** |
252 |
|
|
|
|
|
|
|
|
|
|
Homens |
|
27,2 ± 8,0 |
24,0 ± 9,7 |
0,077 |
28,0 ± 8,2 |
23,9 ± 10,0 |
0,031 |
24,5 ± 9,7 |
25,1 ±9,2 |
0,687 |
|
Mulheres |
|
24,9 ± 9,9 |
23,2 ± 8,7 |
0,338 |
28,6 ± 10,3 |
22,6 ± 8,4 |
0,005 |
22,7 ± 7,8 |
24,3 ± 9,7 |
0,351 |
|
Baixa AMB (<1º tercil)* |
252 |
20 (27,4%) |
60 (33,5%) |
0,213 |
9 (17,0%) |
71 (35,7%) |
0,006 |
38 (36,2%) |
42 (28,6%) |
0,126 |
|
FPM (kg)** |
246 |
|
|
|
|
|
|
|
|
|
|
Homens |
|
30,5 ± 9,2 |
26,6 ± 8,4 |
0,022 |
30,9 ± 9,0 |
26,7 ± 8,4 |
0,018 |
28,4 ± 9,2 |
26,9 ± 8,2 |
0,307 |
|
Mulheres |
|
16,7 ± 5,1 |
16,2 ± 4,9 |
0,627 |
17,0 ± 4,5 |
16,2 ± 5,1 |
0,540 |
17,0 ± 5,1 |
16,0 ± 4,9 |
0,325 |
|
Baixa FPM (<1º tercil)* |
246 |
17 (24,6%) |
57 (32,2%) |
0,157 |
10 (20,0%) |
64 (32,7%) |
0,056 |
26 (25,2%) |
48 (33,6%) |
0,103 |
|
PCR (mg/L)*** |
227 |
2,8 (1,0; 9,2) |
7,1 (2,0; 12,7) |
0,003 |
3,6 (1,6; 9,5) |
6,7 (1,7; 12,3) |
0,149 |
3,1 (1,1; 9,4) |
7,5 (2,6; 12,9) |
<0,001 |
|
Albumina (g/dL)** |
240 |
3,6 ± 0,6 |
3,4 ± 0,6 |
0,004 |
3,6 ± 0,7 |
3,4 ± 0,6 |
0,018 |
3,6 ± 0,6 |
3,4 ± 0,6 |
0,022 |
|
SIN (caixa 3 ASG-PPP VR)*** |
254 |
2 (0; 3) |
2 (0; 3) |
0,890 |
2 (0; 3) |
2 (0; 3) |
0,544 |
0 (0; 1) |
3 (2; 4) |
<0,001 |
Legendas: ASG-PPP VR = avaliação subjetiva global produzida pelo paciente versão reduzida; AMB = área muscular do braço; CC = caquexia do câncer; FPM = força de preensão manual; GLIM = Global Leadership Initiative on Malnutrition; IMC = índice de massa corporal; PCR = proteína C-reativa; PP = perda de peso; PPA = perímetro da panturrilha; SIN = sintomas de impacto nutricional; *frequência, teste qui-quadrado; **média ±desvio-padrão, teste t de Student; ***mediana (intervalo interquartil); teste U de Mann-Whitney.
Tabela 3. Medidas de acurácia dos métodos de avaliação nutricional em pacientes com câncer avançado em cuidados paliativos (n = 254)
|
Métodos |
Kappa |
p |
Acurácia (%) |
Se (%) |
Es (%) |
VPP (%) |
VPN (%) |
|
0,79 |
<0,001 |
92,1 |
100 |
72,6 |
90,0 |
100 |
|
|
GLIM versus ASG-PPP VR |
0,06 |
0,320 |
56,2 |
60,2 |
46,5 |
73,6 |
32,0 |
|
0,06 |
0,224 |
57,8 |
60,2 |
49,0 |
81,7 |
24,5 |
Legendas: ASG-PPP VR = avaliação subjetiva global produzida pelo paciente versão reduzida; CC = caquexia do câncer; Es = especificidade; GLIM = Global Leadership Initiative on Malnutrition; Se = sensibilidade; VPN = valor preditivo negativo; VPP = valor preditivo positivo.
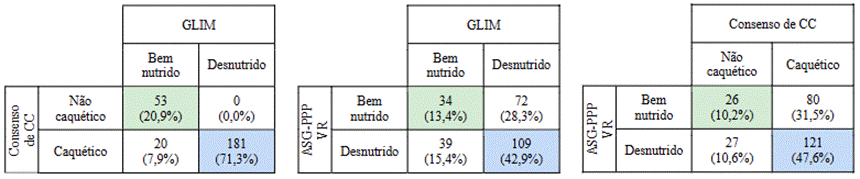
Figura 1. Concordância diagnóstica entre o GLIM, o consenso de CC e a ASG-PPP VR em pacientes com câncer avançado em cuidados paliativos (n = 254)
Legendas: GLIM = Global Leadership Initiative on Malnutrition; ASG-PPP VR = avaliação subjetiva global produzida pelo paciente versão reduzida; CC = caquexia do câncer.
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.