ARTIGO ORIGINAL
Gliomas Difusos do Adulto: Prevalência da Mutação IDH1 em um Hospital Universitário
Adult Diffuse Gliomas: Prevalence of the IDH1 Mutation in a University Hospital
Gliomas Difusos en Adultos: Prevalencia de la Mutación IDH1 en un Hospital Universitario
https://doi.org/10.32635/2176-9745.RBC.2024v70n4.4936
Vitor Bonk Rizzo1; Michelle Arrata Ramos2; Eduardo Morais de Castro3; Pedro Helo dos Santos Neto4; Samya Hamad Mehanna5
1,2,5Faculdade Evangélica Mackenzie do Paraná. Curitiba (PR), Brasil. E-mails: vitorrizzo03@hotmail.com; michellearrata@gmail.com; samyahm88@gmail.com. Orcid iD: https://orcid.org/0009-0003-5825-4935; Orcid iD: https://orcid.org/0009-0000-8731-0527; Orcid iD: https://orcid.org/0000-0002-6636-1314
3Faculdades Pequeno Príncipe. Curitiba (PR), Brasil. E-mail: medmoca@gmail.com. Orcid iD: https://orcid.org/0000-0001-6136-2660
4Hospital Universitário Evangélico Mackenzie. Curitiba (PR), Brasil. E-mail: pedrohsneto@outlook.com. Orcid iD: https://orcid.org/0000-0002-4720-8605
Endereço para correspondência: Vitor Bonk Rizzo. Rua João Batista Carcereri, 228 – Pilarzinho. Curitiba (PR), Brasil. CEP 80120-180, E-mail: vitorrizzo03@hotmail.com
RESUMO
Introdução: Os gliomas pertencem aos tumores primários do sistema nervoso central e são neoplasias originárias nas células da glia. São classificados pelo padrão de infiltração, grau histopatológico e alterações moleculares. Mutações na enzima isocitrato desidrogenase (IDH), identificada em alguns tumores gliais, marcam o início da carcinogênese, aumentando a funcionalidade das enzimas metabólicas IDH1 e IDH2. Assim, dividem-se os gliomas difusos do adulto pela detecção dessa mutação, determinando características que podem facilitar o tratamento, havendo terapias-alvo específicas, como vorasidenib e ivosidenib, que melhoram o prognóstico dos pacientes. Objetivo: Analisar e correlacionar a prevalência da mutação IDH1-R132H, detectada por meio de exame imuno-histoquímico tumoral e avaliar a epidemiologia dos pacientes com gliomas submetidos a tratamento cirúrgico entre 2019 e 2023 no Hospital Universitário Evangélico Mackenzie (HUEM). Método: Estudo transversal e analítico, com coleta de dados históricos de prontuários médicos do HUEM, analisando o laudo anatomopatológico. A amostra final é composta por 67 pacientes. Resultados: Houve maior prevalência dos casos no sexo masculino, raça branca, com a faixa etária entre 61-70 anos. Quanto aos subtipos, a origem em astrócitos foi a principal. Os glioblastomas IDH-selvagem grau histológico 4 prevaleceram. No período estudado, a maioria veio a óbito. Conclusão: A presença de mutações IDH1, somada a demais alterações genômicas, pode definir o prognóstico e a estratégia de escolha para o tratamento dos pacientes. Dessa forma, evidencia-se a importância de ampliar o conhecimento imuno-histoquímico dos gliomas, visto que isso pode levar a estratégias terapêuticas mais efetivas.
Palavras-chave: Glioma/cirurgia; Mutação; Imuno-Histoquímica.
ABSTRACT
Introduction: Gliomas are part of the primary tumors of the central nervous system and are neoplasms originating from glial cells. They are classified by the pattern of infiltration, histopathological grade, and molecular alterations. Mutations in the isocitrate dehydrogenase (IDH) enzyme identified in some glial tumors mark the beginning of carcinogenesis, increasing the functionality of the metabolic enzymes IDH1 and IDH2. Thus, adult diffuse gliomas are divided by the detection of this mutation, determining characteristics that can facilitate treatment, with specific targeted therapies such as vorasidenib and ivosidenib that improve patient prognosis. Objective: To analyze and correlate the prevalence of the IDH1-R132H mutation detected through tumor immunohistochemical examination and to evaluate the epidemiology of patients with gliomas who underwent surgical treatment between 2019 and 2023 at the Evangelical Mackenzie University Hospital (HUEM). Method: Cross-sectional and analytical study, with the collection of historical data from medical records at HUEM, analyzing the pathological anatomy report. The final sample consisted of 67 patients. Results: There was a higher prevalence of cases in white males, aged between 61-70 years. Regarding subtypes, the origin in astrocytes was the main one. IDH-wildtype glioblastomas of histological grade 4 prevailed. During the study period, the majority passed away. Conclusion: The presence of IDH1 mutations, combined with other genomic alterations, can define the prognosis and the strategy of choice for treating patients. Thus, it shows the importance of expanding immunohistochemical knowledge of gliomas, as this can lead to more effective therapeutic strategies.
Key words: Glioma/surgery; Mutation; Immuno-Histochemistry.
RESUMEN
Introducción: Los gliomas pertenecen a los tumores primarios del sistema nervioso central y son neoplasias originadas en las células de la glía. Se clasifican por el patrón de infiltración, grado histopatológico y alteraciones moleculares. Las mutaciones en la enzima isocitrato deshidrogenasa (IDH) identificadas en algunos tumores gliales marcan el inicio de la carcinogénesis, aumentando la funcionalidad de las enzimas metabólicas IDH1 e IDH2. Así, se dividen los gliomas difusos del adulto por la detección de esta mutación, determinando características que pueden facilitar el tratamiento, existiendo terapias dirigidas específicas como vorasidenib e ivosidenib que mejoran el pronóstico de los pacientes. Objetivo: Analizar y correlacionar la prevalencia de la mutación IDH1-R132H, detectada a través de un examen inmunohistoquímico tumoral, y evaluar la epidemiología de los pacientes con gliomas sometidos a tratamiento quirúrgico entre 2019 y 2023 en el Hospital Universitario Evangélico Mackenzie (HUEM). Método: Estudio transversal y analítico, con recolección de datos históricos de historias clínicas del HUEM, analizando el informe anatomopatológico. La muestra final está compuesta por 67 pacientes. Resultados: Hubo mayor prevalencia de casos en el sexo masculino, raza blanca, con el grupo de edad entre 61-70 años. En cuanto a los subtipos, el origen en astrocitos fue el principal. Los glioblastomas IDH-salvaje de grado histológico 4 prevalecieron. En el periodo estudiado, la mayoría falleció. Conclusión: La presencia de mutaciones IDH1, junto con otras alteraciones genómicas, puede definir el pronóstico y la estrategia de elección para el tratamiento de los pacientes. De esta forma, se evidencia la importancia de ampliar el conocimiento inmunohistoquímico de los gliomas, ya que esto puede llevar a estrategias terapéuticas más efectivas.
Palabras clave: Glioma/cirugía; Mutación; Inmuno-Histoquímica.
INTRODUÇÃO
Os gliomas são neoplasias derivadas de células da glia e fazem parte do grupo heterogêneo de tumores primários do sistema nervoso central (SNC). Constituem 30% de todas as neoplasias cerebrais e 80% dos cânceres nessa região. Os gliomas são subdivididos e classificados de acordo com: tipo histológico, grau de agressividade e características moleculares1. A incidência dos gliomas é variável ao redor do mundo, tendo uma taxa global média de 3,4 casos por 100 mil habitantes por ano. A ocorrência no Sul do Brasil é consideravelmente maior, sendo de 10,17 casos em homens por 100 mil habitantes e de 8,52 casos em mulheres para cada 100 mil habitantes a cada ano2.
As enzimas isocitrato desidrogenase 1 (IDH1) e 2 (IDH2) realizam parte do ciclo de Krebs, responsável por processos celulares da glicose, metabolismo da glutamina e lipogênese3. A identificação da mutação do gene IDH revolucionou a classificação dos gliomas difusos dos adultos, nos protocolos da Organização Mundial da Saúde (OMS) de 2016 e recentemente nos de 20213,4. Sabe-se, inclusive, que todos os oligodendrogliomas, por definição, possuem essa alteração genética. Ainda, a partir dessa análise, é possível dividir astrocitomas em IDH-mutante e IDH-selvagem4.
O uso de testes genéticos para essa constatação ainda é pouco acessível, por isso a técnica mais utilizada é o estudo imuno-histoquímico dos tumores5. A mutação identificada por esse método é a R132H do IDH1, sendo amplamente usada como meio diagnóstico para correta subclassificação. Cerca de 25% dos pacientes com gliomas apresentam mutação do IDH1/IDH2, proporcionando resultados prognósticos e terapêuticos melhores aos pacientes5,6, já que as terapias direcionadas para gliomas com a mutação IDH1-R132H estão sendo desenvolvidas e têm se concentrado principalmente no uso de inibidores de IDH mutante, que visam reduzir a produção do oncometabólito 2-hidroxiglutarato (2-HG), associado à progressão tumoral6. Nesse contexto, o objetivo geral da pesquisa é avaliar a prevalência da mutação IDH1-R132H em gliomas em um hospital do Paraná, catalogando características epidemiológicas populacionais e relacionando-as a fatores prognósticos.
MÉTODO
Estudo transversal e retrospectivo com abordagem quantitativa, realizado no Estado do Paraná, Curitiba, no qual prontuários médicos do Hospital Universitário Evangélico Mackenzie (HUEM) foram revisados. A coleta de dados ocorreu entre novembro de 2019 e junho de 2023 por meio do levantamento dos laudos anatomopatológicos das peças cirúrgicas e imuno-histoquímicos para avaliação da mutação IDH1-R132H dos pacientes submetidos à neurocirurgia com idade superior a 18 anos. Foram excluídos pacientes pediátricos, sem dados no prontuário e/ou com análise imuno-histoquímica incompleta. Além disso, diversas variáveis foram elencadas, como sexo, idade, raça, tipo/grau histológico e desfecho clínico.
A análise imuno-histoquímica de gliomas é uma ferramenta essencial para a caracterização molecular desses tumores7. Os marcadores imuno-histoquímicos comumente utilizados incluem a IDH1, a síndrome de alfa talassemia/retardo mental ligado ao X (ATRX), a proteína tumoral p53 e o Ki-67, todas realizadas na amostra determinada7. Para a interpretação diagnóstica microscópica, tem-se os seguintes parâmetros definidos pela literatura:
● ATRX: a perda da expressão (ausência de imunomarcação) das células tumorais é frequentemente associada a gliomas mutantes de IDH, particularmente aqueles de linhagem astrocítica7. A perda de ATRX, juntamente com a mutação de TP53, pode ajudar a diferenciar astrocitomas mutantes de IDH de outros subtipos7.
● p53: utilizada como um substituto para mutações no gene TP537. A superexpressão (imunomarcação forte e difusa) de p53 é frequentemente observada em gliomas mutantes de IDH, especialmente naqueles sem codeleção 1p/19q7.
● Ki-67: o índice de marcação de Ki-67 é um preditor da proliferação celular, sendo utilizado para avaliar a agressividade do tumor7. A positividade nuclear da imunorreação é quantificada em valores por porcentagem7.
● IDH1-R132H: utilização de anticorpos monoclonais que são eficazes na detecção da proteína mutante7. Na análise microscópica, quando mostra coloração citoplasmática forte e, em menor grau, nuclear em células tumorais, favorece o padrão mutante dos gliomas estudados7. Se a coloração for negativa, mas houver suspeita clínica, há a recomendação de análise genética complementar para buscar outras mutações em IDH1 ou IDH2, porém indisponível no serviço em questão7.
Para a análise dos dados, as informações foram exportadas para uma planilha do software Microsoft Office Excel, na qual eles foram tratados por estatística descritiva em números absolutos e percentuais. Nos dados aplicáveis, foi realizado o teste de Fisher com significância de 0,05.
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa do HUEM sob o número de parecer 6.082.856 (CAAE: 69638223.9.0000.0103), conforme exigido pela Resolução nº 466/128 do Conselho Nacional de Pesquisa, que regulamenta a pesquisa científica em seres humanos. Na sequência, os dados obtidos foram comparados com a literatura levantada sobre a temática.
RESULTADOS
No período de novembro de 2019 a junho de 2023, foram registrados 67 casos de gliomas cerebrais atendidos no Centro de Assistência em Alta Complexidade do hospital e que atenderam aos critérios de inclusão da pesquisa. A Tabela 1 apresenta a caracterização da amostra distribuída por sexo. A distribuição demonstra prevalência do sexo masculino, que totalizou 59,7% dos casos. A tabela também registra a distribuição dos pacientes com gliomas de acordo com a faixa etária (intervalo de dez anos). A faixa entre 61 e 70 anos foi a mais acometida, com 29,85% dos casos. Em relação à raça, teve expressivo predomínio na população branca em 88,06% da amostra (Tabela 1).
No que diz respeito à distribuição dos aspectos histopatológicos, os astrocitomas foram o destaque em 91,9% dos casos, incluindo nesse grupo os identificados como glioblastoma. Para a categorização quanto ao grupo dos tumores, foram divididos em baixo grau (corresponde ao grau 2 da OMS) e alto grau (incluindo-se graus 3 e 4), conforme a literatura descrita8. As neoplasias de alto grau foram as mais incidentes, representando 88,7% da amostra, enquanto as de baixo grau representaram 11,3%.
A Tabela 2 apresenta os resultados da análise imuno-histoquímica para pesquisa da expressão de IDH1-R132H, além de serem analisados também os anticorpos para P53 e ATRX, somados à avaliação do índice proliferativo (Ki-67). Casos em que houve positividade do anticorpo IDH1-R132H são definidos como mutados e costumam ser acompanhados de padrão anormal de P53 e perda da expressão de ATRX. Em 21% da amostra, foi detectada a mutação IDH pesquisada. Sobre o Ki-67, expresso em média geral, quanto maior a porcentagem avaliada microscopicamente, indica-se a neoplasia mais agressiva, com velocidade de crescimento acelerada; valores acima de 20% já são considerados elevados9.
A partir da análise conjunta da histopatologia e dos resultados imuno-histoquímicos, considerando a classificação mais atualizada da OMS9, na Tabela 3 estão todas as entidades patológicas diagnosticadas na população estudada. A neoplasia mais predominante foi o glioblastoma IDH-selvagem, grau 4, representando 75,8% dos casos.
Em relação ao desfecho clínico dos pacientes com gliomas (Tabela 4), foram categorizados em dois grupos: vivos e óbitos. A taxa de mortalidade foi significativa, representando 67,16% da amostra. Quanto aos pacientes em cuidados paliativos que receberam alta, representam quatro pacientes dos 22 no grupo “vivos”.
Ao relacionar a presença ou a ausência de mutação IDH1-R132H nos gliomas de alto grau e óbito, verifica-se que 90% dos pacientes eram IDH-selvagem e apenas 10% eram IDH-mutante, com resultado estatístico sem significância (p=0,1934), conforme demonstrado no Gráfico 1. Em relação ao desfecho clínico, associando com os gliomas classificados como alto grau (Gráfico 1), os pacientes foram categorizados em dois grupos: vivos e óbitos. A taxa de mortalidade foi mais prevalente no grupo dos glioblastomas, representando 65,45% (36 pacientes) da amostra. No grupo dos gliomas de graus 3 e 4 IDH mutado, a porcentagem de pacientes vivos (4 pacientes) e de óbitos (4 pacientes) foi equivalente, correspondendo, cada um, a 7,27%. No grupo dos glioblastomas, os pacientes em cuidados paliativos que receberam alta representaram três dos 11 pacientes no grupo dos “vivos” correspondendo a 5,45%.
DISCUSSÃO
Em 2008, estudos da sequência dos exomas de gliomas grau 4, classicamente chamados glioblastomas, identificaram mutações em um gene do ciclo de Krebs na enzima IDH6. Posteriormente, novas pesquisas demonstraram que essa alteração genética foi encontrada em cerca de 80% dos gliomas de graus 2 e 3, em 73% dos glioblastomas ditos à época como secundários e em 3,7% dos primários5,6. As enzimas IDH1 e IDH2 catalisam a conversão do isocitrato para alfacetoglutarato, uma reação de descarboxilação6. Em casos de mutações nesses genes, ocorrendo frequentemente no éxon 4, nos hotspots R132H de IDH1 e R140 e R172 de IDH2, alterações enzimáticas são induzidas nas células gliais6. Ocorre, assim, a conversão do isocitrato para 2-HG, considerada um metabólico oncogênico que inibe, então, as funções das enzimas dependentes de alfacetoglutarato6.
Dessa forma, as mutações de IDH marcam o início da patogênese de determinadas neoplasias gliais, conferindo aumento na funcionalidade das enzimas metabólicas IDH1 e IDH23. Essas enzimas passam a produzir em maior quantidade o oncometabólito 2-HG, cujos efeitos nos estados epigenômicos celulares e na regulação gênica alteram drasticamente a homeostase celular, facilitando, por exemplo, perdas funcionais em genes como ATRX e TP53, os quais respectivamente estão associados à instabilidade genômica e à supressão tumoral5.
Em relação ao perfil epidemiológico dos pacientes diagnosticados com gliomas cerebrais no período de novembro de 2019 a junho de 2023 no HUEM, os homens foram mais afetados do que as mulheres, representando aproximadamente 60% dos casos. O acometimento 1,4 vezes maior em homens pode ser explicado por diversos fatores. Por exemplo, a testosterona pode estimular o crescimento dos glioblastomas por meio do receptor androgênico, promovendo maior proliferação celular e progressão tumoral. Em contraste, o estrogênio pode oferecer proteção contra o desenvolvimento desses tumores, o que pode explicar a menor incidência em mulheres10,11.
Ainda, as variações genéticas e moleculares entre os sexos desempenham um papel crucial, e as mutações em genes como TP53 e EGFR podem ser mais prevalentes na população masculina, o que pode gerar impacto no tratamento e o prognóstico12, além de contribuir para a maior prevalência dos gliomas em homens13,14. Referente à distribuição etária dos casos de gliomas, apresentada na Tabela 1, observa-se que a principal faixa etária afetada foi de 51 a 70 anos; no total, foram registrados 66 casos e 73,96% deles ocorreram em pacientes com 50 anos ou mais. De acordo com os dados americanos mais recentes, o pico de incidência de glioblastoma ocorre na faixa etária entre 65 e 74 anos12, estando em consonância com a amostra regional brasileira estudada15.
A incidência de gliomas também apresenta variações significativas entre diferentes grupos raciais ao redor do mundo. Estudos recentes indicam que, nos Estados Unidos, a taxa de incidência de glioblastoma é maior entre brancos em comparação com negros e asiáticos. De acordo com dados da American Brain Tumor Association (2022)15 e do estudo de Ostrom et al.16, os brancos têm uma taxa de incidência aproximadamente 1,5 a 2 vezes maior do que os negros15,16.
A análise dos gliomas realizada revelou informações significativas sobre a distribuição dos tipos moleculares e sua relação com o grau histológico dos tumores, representados na Tabela 3. A mutação do gene IDH1, um importante marcador diagnóstico e prognóstico em gliomas, mostrou-se altamente prevalente em tumores de graus histológicos inferiores a quatro. Esses achados corroboram a literatura que indica uma predominância da mutação IDH1 em tumores de baixo grau, incluindo astrocitomas e oligodendrogliomas, e sua ausência em glioblastomas anteriormente designados como primários, que possuem um perfil molecular distinto e mais agressivo17,18.
A análise do marcador P53 revelou que a forma selvagem foi predominante em graus histológicos mais baixos. Ainda, os casos de superexpressão para proteína P53 foram observados associados a casos IDH1 mutados (3 casos) e não mutados (5 casos de glioblastoma). A predominância de TP53 mutado em gliomas de alto grau é decorrente da evasão dos mecanismos de controle celular e a promoção de um fenótipo tumoral mais agressivo, caracterizado por maior proliferação celular, resistência à apoptose e invasividade. Essas alterações moleculares estão intimamente relacionadas à progressão tumoral e à piora do desfecho clínico nesses pacientes19. Quanto ao marcador ATRX, os resultados indicaram ausência de expressão de ATRX em casos IDH1 mutantes de alto grau, afinal a perda de ATRX, uma proteína envolvida na manutenção da estabilidade genômica e na regulação da estrutura da cromatina, tem sido amplamente correlacionada com a agressividade em gliomas cerebrais. A inativação de ATRX, frequentemente observada em subtipos específicos de gliomas, resulta em alterações epigenéticas que favorecem a instabilidade telomérica e a replicação aberrante do DNA19.
A análise imuno-histoquímica dos 62 casos, referente à Tabela 3, revelou variação significativa nos tipos e graus histológicos, com uma predominância notável de glioblastomas IDH-selvagem (75,8%) nesta amostra. Esse padrão é consistente com a literatura atual, que descreve os glioblastomas como os gliomas mais frequentes e agressivos, associados à ausência da mutação IDH119. Em termos de números absolutos, enquanto o glioblastoma IDH selvagem é responsável por aproximadamente 60% dos gliomas difusos (incluindo todos os graus), os astrocitomas IDH mutados representam cerca de 20% a 30% desses tumores19,20.
A imuno-histoquímica para detecção de mutações IDH1-R132H em gliomas apresenta várias limitações20. Ela pode resultar em resultados falso-negativos, especialmente em secções examinadas a partir de material peroperatório, em virtude da qualidade do tecido e/ou do anticorpo utilizado20. Além disso, a imuno-histoquímica não detecta mutações raras de IDH1 além da R132H, o que pode gerar discrepâncias em relação a métodos de sequenciamento de DNA20,21. A heterogeneidade de coloração nas células tumorais também pode dificultar a interpretação dos resultados20. Apesar de ser uma técnica rápida e acessível, a necessidade de confirmação por análise genética é evidente, especialmente em casos com suspeita de mutações não R132H, mas o obstáculo de acesso e a disponibilidade desses exames nas instituições públicas brasileiras podem limitar a confirmação20.
Os resultados também destacam a importância da mutação IDH1 na classificação dos gliomas conforme a OMS. A classificação OMS agora considera a mutação IDH1 como um dos principais critérios para a definição de gliomas, diferenciando os astrocitomas e oligodendrogliomas IDH-mutantes dos casos IDH-selvagens21. Pacientes com gliomas portadores de mutações IDH1 apresentam sobrevida global e sobrevida livre de progressão significativamente melhores em comparação com aqueles com tumores IDH1 selvagens21. Uma metanálise revelou que a mutação IDH1 está associada a uma redução significativa no risco de mortalidade em pacientes com glioblastoma, com um risco relativo de 0,43, indicando uma diminuição de 57% no risco de morte em relação aos pacientes sem a mutação22. Outro estudo mostrou que a presença de mutações IDH1/2 em gliomas está associada a um melhor prognóstico, com uma razão de risco combinada para sobrevida global de 0,33, sugerindo uma redução de 67% no risco de morte23.
A sobrevida média para pacientes com gliomas IDH-mutantes de graus 2 e 3 varia entre sete e dez anos, dependendo do subtipo tumoral e dos tratamentos aplicados4. Já para casos IDH selvagem (glioblastomas) é geralmente entre 12 e 15 meses, mesmo com tratamento intensivo incluindo cirurgia, radioterapia e quimioterapia4. Esses dados ressaltam a importância do status de IDH não apenas no diagnóstico, mas como um fator crítico na estratificação prognóstica e na tomada de decisões terapêuticas para pacientes com gliomas cerebrais.
Conhecer a presença da mutação IDH tem significância para a abordagem terapêutica do paciente, visto que estão sendo desenvolvidos medicamentos que atuam na bioquímica da enzima IDH. Vorasidenib, um inibidor de IDH1/2, aprovado recentemente em agosto de 2024 pelo Food and Drug Administration (FDA), demonstrou aumentar a sobrevida livre de progressão para pacientes maiores de 12 anos, com astrocitomas grau 2 ou oligodendrogliomas suscetíveis à mutação IDH1 ou IDH2, após realizada ressecção parcial ou completa neurocirúrgica do tumor24.
Além dos inibidores de IDH, outras abordagens terapêuticas estão sendo exploradas com diferentes mecanismos farmacológicos, incluindo vacinas peptídicas específicas para a mutação IDH1-R132H, que têm mostrado induzir respostas imunológicas específicas e promissoras em ensaios clínicos iniciais6,25. A combinação de inibidores de IDH com outras terapias, como bloqueio de checkpoint imunológico, também está sendo investigada, com dados pré-clínicos sugerindo potencial para melhorar a resposta imunológica e a sobrevida25,26. Pelo conhecimento de que a mutação IDH induz a hipermetilação fenotípica, causando diferentes alterações nas células tumorais, surge o potencial terapêutico para a correção dessa desregulação6,27. Outro exemplo de droga-alvo é o decitabine, um inibidor da DNA metiltransferase capaz de suprimir a proliferação de células de gliomas com IDH mutados in vitro e in vivo28. Essas estratégias refletem um avanço significativo no tratamento de gliomas com mutação IDH, oferecendo novas opções terapêuticas que podem melhorar o prognóstico desses pacientes6.
CONCLUSÃO
Os achados encontrados reforçam a importância da avaliação histológica e molecular na classificação e manejo dos gliomas. A presença de mutações IDH1, a relação entre TP53 mutado e agressividade tumoral, juntamente com a perda de ATRX, são aspectos críticos que influenciam o prognóstico e a estratégia de tratamento dos pacientes. A compreensão dessas correlações é fundamental para a abordagem clínica personalizada e para a previsão do comportamento tumoral.
CONTRIBUIÇÕES
Vitor Bonk Rizzo, Michelle Arrata Ramos e Samya Hamad Mehanna contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica. Eduardo Morais de Castro e Pedro Helo dos Santos Neto contribuíram na obtenção, análise e interpretação dos dados; na redação e revisão crítica. Todos os autores aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITOS DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Gondim CC, Delgado AB, Marques D, et al. Análise epidemiológica de gliomas operados em hospital de referência em combate ao câncer na Paraíba entre 2015 e 2018. Rev Saúde Ciênc. 2018;7(2):133-44. doi: https://doi.org/10.35572/rsc.v7i2.102
2. Valadares AD, Kaneshima AM, Kaneshima EN, et al. Perfil anatomopatológico e imuno-histoquímico de gliomas de pacientes da região de Maringá-PR. Rev Bras Cancerol. 2021:67(3):e-101287. doi: https://doi.org/10.32635/2176-9745.RBC.2021v67n3.1287
3. Reitman ZJ, Yan H. Isocitrate dehydrogenase 1 and 2 mutations in cancer: alterations at a crossroads of cellular metabolism. J Natl Cancer Inst. 2010;102(13):932-41. doi: https://doi.org/10.1093/jnci/djq187
4. Yan H, Parsons DW, Jin G, et al. IDH1 and IDH2 mutations in gliomas. N Engl J Med. 2009;360(8):765-73. doi: https://doi.org/10.1056/NEJMoa0808710
5. Sporikova Z, Slavkovsky R, Tuckova L, et al. IDH1/2 Mutations in patients with diffuse gliomas: a single centre retrospective massively parallel sequencing analysis. Appl Immunohistochem Mol Morphol. 2022;30(3):178-83. doi: https://doi.org/10.1097/PAI.0000000000000997
6. Han S, Liu Y, Cai SJ, et al. IDH mutation in glioma: molecular mechanisms and potential therapeutic targets. Br J Cancer. 2020;122(11):1580-9. doi: https://doi.org/10.1038/s41416-020-0814-x
7. Meel M, Jindal A, Kumar M, et al. IDH1, ATRX, p53, and Ki67 expression in glioblastoma patients: their clinical and prognostic significance-a prospective study. Asian J Neurosurg. 2024;19(1):14-20. doi: https://doi.org/10.1055/s-0042-1750783
8. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
9. World Health Organization. World Health Organization Classification of Tumours of the Central Nervous System. 5. ed. Lyon: International Agency for Research on Cancer; 2021.
10. Jovanovich N, Habib A, Chilukuri A, et al. Sex-specific molecular differences in glioblastoma: assessing the clinical significance of genetic variants. Front Oncol. 2024;13:1340386. doi: https://doi.org/10.3389/fonc.2023.1340386
11. Daswani B, Khan Y. Insights into the role of estrogens and androgens in glial tumorigenesis. J Carcinog. 2021;20:10. doi: https://doi.org/10.4103/jcar.jcar_2_21
12. Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol. 2016;16(10):626-38. doi: https://doi.org/10.1038/nri.2016.90
13. Vienne-Jumeau A, Tafani C, Ricard D. Environmental risk factors of primary brain tumors: a review. Rev Neurol (Paris). 2019;175(10):664-78. doi: https://doi.org/10.1016/j.neurol.2019.08.004
14. Yang W, Warrington NM, Taylor SJ, et al. Sex differences in GBM revealed by analysis of patient imaging, transcriptome, and survival data. Sci Transl Med. 2019;11(473):eaao5253. doi: https://doi.org/10.1126/scitranslmed.aao5253
15. American Brain Tumor Association. Glioblastoma & high-grade astrocytoma [Internet]. Chicago: American Brain Tumor Association; 2022. [Acesso 2024 ago 25]. Disponível em: https://www.abta.org/download/22533/
16. Ostrom QT, Price M, Neff C, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2015-2019. Neuro Oncol. 2022;24(Supl 5):v1-95. doi: https://doi.org/10.1093/neuonc/noac202
17. Weller M, van den Bent M, Preusser M, et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol. 2022;19(5):357-8. doi: https://doi.org/10.1038/s41571-022-00623-3
18. Ohgaki H, Kleihues P. Genetic alterations and signaling pathways in the evolution of gliomas. Cancer Sci. 2009;100(12):2235-41. doi: https://doi.org/10.1111/j.1349-7006.2009.01308.x
19. Cancer Genome Atlas Research Network. Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas. N Engl J Med 2015;372:2481-98. doi: https://doi.org/10.1056/NEJMoa1402121
20. Yoshida A, Satomi K, Ohno M, et al. Frequent false-negative immunohistochemical staining with IDH1 (R132H)-specific H09 antibody on frozen section control slides: a potential pitfall in glioma diagnosis. Histopathology. 2019;74(2):350-4. doi: https://doi.org/10.1111/his.13756
21. Louis DN, Perry A, Wesseling P, et al. The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro Oncol. 2021;23(8):1231-51. doi: https://doi.org/10.1093/neuonc/noab106
22. Dai Y, Ning X, Han G, et al. Assessment of the association between isocitrate dehydrogenase 1 mutation and mortality risk of glioblastoma patients. Mol Neurobiol. 2016;53(3):1501-8. doi: https://doi.org/10.1007/s12035-015-9104-7
23. Zou P, Xu H, Chen P, et al. IDH1/IDH2 mutations define the prognosis and molecular profiles of patients with gliomas: a meta-analysis. PLoS One. 2013;8(7):e68782. doi: https://doi.org/10.1371/journal.pone.0068782
24. Sahm F, Brandner S, Bertero L, et al. Molecular diagnostic tools for the World Health Organization (WHO) 2021 classification of gliomas, glioneuronal and neuronal tumors; an EANO guideline. Neuro Oncol. 2023;25(10):1731-49. doi: https://doi.org/10.1093/neuonc/noad100
25. Food and Drug Administration [Internet]. Washington,D.C.: FDA; 2024. FDA approves vorasidenib for Grade 2 astrocytoma or oligodendroglioma with a susceptible IDH1 or IDH2 mutation, 2024. [acesso 2024 ago 29]. Disponível em: https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-vorasidenib-grade-2-astrocytoma-or-oligodendroglioma-susceptible-idh1-or-idh2-mutation
26. Xiong Z, Raphael I, Olin M, et al. Glioblastoma vaccines: past, present, and opportunities. EBioMedicine. 2024;100:104963. doi: https://doi.org/10.1016/j.ebiom.2023.104963
27. Takei J, Kamata Y, Tanaka T, et al. Prognostic survival biomarkers of tumor-fused dendritic cell vaccine therapy in patients with newly diagnosed glioblastoma. Cancer Immunol Immunother. 2023;72(10):3175-89. doi: https://doi.org/10.1007/s00262-023-03482-8
28. Turcan S, Fabius AW, Borodovsky A, et al. Efficient induction of differentiation and growth inhibition in IDH1 mutant glioma cells by the DNMT inhibitor decitabine. Oncotarget. 2013;4(10):1729-36. doi: https://doi.org/10.18632/oncotarget.1412
Aprovado em 18/12/2024
Editor-associado: Claudio Gustavo Stefanoff. Orcid iD: https://orcid.org/0000-0001-7050-3269
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
Tabela 1. Distribuição conforme os dados clínicos dos pacientes com gliomas: sexo, idade e raça (n=67)
|
Dados clínicos |
||||
|
n=67 |
|
Perfil |
n |
% |
|
Sexo
|
|
Masculino |
40 |
59,70% |
|
Feminino |
27 |
40,30% |
||
|
Idade
|
|
11-20 anos |
2 |
2,99% |
|
21-30 anos |
1 |
1,49% |
||
|
31-40 anos |
10 |
14,93% |
||
|
41-50 anos |
9 |
13,43% |
||
|
51-60 anos |
15 |
22,85% |
||
|
61-70 anos |
20 |
29,85% |
||
|
71-80 anos |
8 |
11,94% |
||
|
81-90 anos |
2 |
2,99% |
||
|
Raça
|
|
Branca |
59 |
88,06% |
|
Parda |
5 |
7,46% |
||
|
Sem informação |
3 |
4,48% |
||
Tabela 2. Resultado da análise imuno-histoquímica dos anticorpos IDH1, P53, ATRX, Ki-67 com relação ao grau histológico tumoral (n=62)
|
Anticorpos |
Resultado |
AST/OLIG grau 2 |
AST/OLIG grau 3 |
AST grau 4 |
GBM |
|
IDH |
Positivo |
6 |
3 |
4 |
0 |
|
Negativo |
1 |
1 |
0 |
47 |
|
|
P53 |
Selvagem |
6 |
3 |
1 |
42 |
|
Mutado |
1 |
1 |
3 |
5 |
|
|
ATRX
|
Expresso |
5 |
4 |
1 |
46 |
|
Não expresso |
2 |
0 |
3 |
1 |
|
|
KI-67 |
Média de % |
3,75% |
18,75% |
35% |
37,7% |
Legendas: AST = Astrocitoma; OLIG = Oligodendroglioma; GBM = Glioblastoma.
Tabela 3. Classificação dos gliomas conforme nomenclatura atualizada da OMS de 2021 (n=62)
|
Classificação da OMS 2021 |
n=62 |
% |
|
Astrocitoma IDH-mutante, grau 2 |
4 |
6,44% |
|
Astrocitoma IDH-mutante, grau 3 |
2 |
3,22% |
|
Astrocitoma IDH-mutante, grau 4 |
4 |
6,44% |
|
Glioblastoma IDH-selvagem, grau 4 |
47 |
75,8% |
|
Oligodendroglioma IDH-mutante, grau 2 |
3 |
4,83% |
|
Oligodendroglioma IDH-mutante, grau 3 |
1 |
1,61% |
|
Oligodendroglioma IDH-selvagem, grau 3 |
1 |
1,61%
|
|
Total |
62 |
100% |
Legenda: OMS = Organização Mundial da Saúde.
Tabela 4. Desfecho dos pacientes com gliomas (n=67)
|
Desfecho |
n=67 |
% |
|
Vivos |
22 |
32,84% |
|
Óbitos |
45 |
67,16% |
|
Total |
67 |
100% |
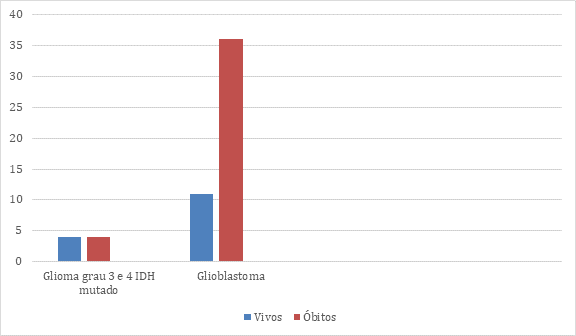
Gráfico 1. Relação entre o desfecho clínico versus classificação dos gliomas de alto grau (n=55)
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.