Prevalencia de Dos Variantes en BRCA2 en Mujeres con Cáncer de Mama del Hospital Día Oncológico, Encarnación, Paraguay, 2023: Estudio Piloto
Prevalência de Duas Variantes do BRCA2 em Mulheres com Câncer de Mama do Hospital Día Oncológico, Encarnación, Paraguai, 2023: Estudo-Piloto
Prevalence of Two Variants of BRCA2 in Women with Breast Cancer of the Hospital Día Oncológico, Encarnación, Paraguay, 2023: a Pilot Study
https://doi.org/10.32635/2176-9745.RBC.2025v71n2.4962
Mónica María González1; Diana Paola Dressler Sanabria2; Liliana Noelia Talavera Stefani3
1,2Universidad Nacional de Itapúa, Facultad de Medicina. Encarnación, Paraguay. E-mails: mmgonzalez@medicina.uni.edu.py; dpdressler@uni.edu.py. Orcid iD: https://orcid.org/0000-0002-7692-9751; Orcid iD: https://orcid.org/0000-0002-9298-358X
3Universidad Nacional de Itapúa, Facultad de Ciencias y Tecnología. Encarnación, Paraguay. E-mail: lilitalavera20@gmail.com. Orcid iD: https://orcid.org/0000-0002-3249-2930
Dirección para correspondencia: Diana Paola Dressler Sanabria. Avenida Ucrania, Ka'aguy Rory, Encarnación, Paraguay. E-mail: dpdressler@uni.edu.py
RESUMEN
Introducción: El cáncer de mama hereditario hace referencia a casos en donde la predisposición genética cumple un rol importante en su desarrollo. Las variantes genéticas heredadas, especialmente en los genes BRCA1 y BRCA2 aumentan de forma significativa el riesgo de contraer cáncer de mama, y en ciertos casos, cáncer de ovario. Objetivo: Determinar la prevalencia de dos variantes en el gen BRCA2 en mujeres con cáncer de mama que asisten al Hospital Día Oncológico de la ciudad de Encarnación. Método: Se realizó un estudio piloto observacional y descriptivo. La muestra estuvo conformada por mujeres de entre 18 y 50 años con diagnóstico de cáncer de mama, seleccionadas mediante un muestreo no probabilístico por conveniencia. Tras la obtención del consentimiento informado, se aplicaron cuestionarios y se obtuvieron muestras de sangre. Posteriormente, se llevaron a cabo técnicas de secuenciación genómica y análisis genético para la identificación de variantes en BRCA2. Resultados: Participaron 11 pacientes, con una media de edad de 39,45 años; 6 de ellas con antecedente familiar de primer grado de algún tipo de cáncer y la totalidad de las mismas diagnosticadas con cáncer de mama invasivo. Las dos variantes analizadas en el gen BRCA2 fueron, NM_000059.4: c.5351_5352insA y NM_000059.4: c.5681_5682insA. Conclusión: Las variantes de estudio no fueron detectadas en las 11 mujeres con cáncer de mama. Se requiere abarcar todo el gen BRCA2 para iniciar una base de datos de las variantes genéticas que circulan en la población itapuense.
Palabras clave: Neoplasias de la Mama/genética; Enfermedades Genéticas Congénitas; Gen BRCA2.
RESUMO
Introdução: O câncer de mama hereditário refere-se a casos em que a predisposição genética desempenha um papel importante em seu desenvolvimento. As variantes genéticas herdadas, especialmente nos genes BRCA1 e BRCA2, aumentam significativamente o risco de desenvolver câncer de mama e, em certos casos, câncer de ovário. Objetivo: Determinar a prevalência de duas variantes no gene BRCA2 em mulheres com câncer de mama atendidas no Hospital Dia Oncológico da cidade de Encarnación. Método: Foi realizado um estudo-piloto observacional e descritivo. A amostra foi composta por mulheres entre 18 e 50 anos, diagnosticadas com câncer de mama, selecionadas por amostragem não probabilística por conveniência. Após a obtenção do consentimento informado, foram aplicados questionários e coletadas amostras de sangue. Posteriormente, foram realizadas técnicas de sequenciamento genômico e análises genéticas para identificação de variantes no BRCA2. Resultados: Participaram do estudo 11 pacientes, com idade média de 39,45 anos; seis delas apresentavam histórico familiar de primeiro grau de algum tipo de câncer, e todas foram diagnosticadas com câncer de mama invasivo. As duas variantes analisadas no gene BRCA2 foram NM_000059.4: c.5351_5352insA e NM_000059.4: c.5681_5682insA. Conclusão: As variantes estudadas não foram detectadas nas 11 mulheres com câncer de mama. É necessário analisar todo o gene BRCA2 para iniciar um banco de dados das variantes genéticas presentes na população de Itapúa.
Palavras-chave: Neoplasias da Mama/genética; Doenças Genéticas Inatas; Gene BRCA2.
ABSTRACT
Introduction: Hereditary breast cancer refers to cases in which genetic predisposition plays a significant role in its development. Inherited genetic variants, particularly in the BRCA1 and BRCA2 genes, significantly increase the risk of developing breast cancer and, in some cases, ovarian cancer. Objective: To determine the prevalence of two variants of the BRCA2 gene in women with breast cancer attending the Oncological Day Hospital in the city of Encarnación, Paraguay. Method: A pilot observational and descriptive study was conducted. The sample consisted of women aged 18 to 50 years diagnosed with breast cancer, selected through non-probabilistic convenience sampling. After obtaining informed consent, questionnaires were administered, and blood samples were collected. Subsequently, genomic sequencing techniques and genetic analysis were performed to identify BRCA2 variants. Results: A total of 11 patients participated, with a mean age of 39.45 years; six of them had a first-degree family history of cancer, and all were diagnosed with invasive breast cancer. The two BRCA2 gene variants analyzed were NM_000059.4: c.5351_5352insA and NM_000059.4: c.5681_5682insA. Conclusion: The variants investigated were not detected in the 11 women with breast cancer. A comprehensive analysis of the entire BRCA2 gene is necessary to establish a database of genetic variants circulating in the Itapúa population.
Key words: Breast Neoplasms/genetics; Genetic Diseases, Inborn; BRCA2 Gene.
INTRODUCCIÓN
El aumento de la carga por cáncer es una preocupación importante a nivel mundial, se estima que aparecerán aproximadamente 30 millones de casos nuevos para 2040, siendo los países de escasos y medianos recursos los más vulnerables1. En la región de las Américas se estimó alrededor de 4,2 millones de personas afectadas en el año 2022, encabezando la lista el cáncer de próstata en hombres y cáncer de mama en las mujeres2.
En Paraguay son detectados aproximadamente 800 casos nuevos de cáncer de mama por año convirtiéndose en un desafío importante para el país3. Estas estimaciones muestran una tendencia al alza, representando implicaciones importantes para la salud pública, los sistemas de atención médica y la calidad de vida de las personas.
El desarrollo y progresión de cáncer de mama es influenciado por diversos factores, tanto genéticos como ambientales, 5-10% de cánceres de mama son hereditarios, mientras que un 90% es esporádico, posee un componente genético, pero no es heredable4. La interacción entre factores genéticos y ambientales, así como la complejidad de las vías biológicas involucradas, hacen que la comprensión completa del cáncer de mama sea un desafío continuo5.
La mayoría de las mujeres diagnosticadas con cáncer de mama no tienen antecedentes familiares conocidos. Sin embargo, la Organización Mundial de la Salud (OMS) enfatiza que la ausencia de antecedentes familiares conocidos no significa necesariamente que una mujer tenga un menor riesgo de desarrollar cáncer de mama6.
Las mutaciones genéticas que guardan relación con el cáncer de mama son un tema importante en la investigación médica y consejería genética. Una de las mutaciones mejor caracterizadas en este contexto son las mutaciones en los genes BRCA1 y BRCA2, los mismos están involucrados en la reparación del ADN y supresión de tumores7. Además de BRCA1 y BRCA2 existen otros genes descriptos recientemente considerados como genes de predisposición, algunos ejemplos incluyen el PALB2, TP53, CHEK2, ATM, PTEN, NBN, RAD51C y RAD51D, STK11, CDH1, BRIP18. Estos genes están involucrados en la reparación del ADN y la supresión de tumores, por tanto, las mutaciones en los mismos aumentan la susceptibilidad al cáncer de mama y otros tipos de cáncer. Algunos de ellos están asociados con el fenotipo triple negativo, un subtipo de cáncer de mama que tiende a ser más agresivo y a tener menos opciones de tratamiento dirigidas, lo que lo hace particularmente desafiante9.
La prevalencia y el espectro de mutaciones de la línea germinal en los genes BRCA1 y BRCA2 están ciertamente mejor delimitados en la población europea y norteamericana9. Este grupo demográfico sugiere que Paraguay puede tener poblaciones fundadoras únicas debido a sus patrones históricos de inmigración.
Para muchas de estas poblaciones, se han identificado mutaciones recurrentes y fundadoras. Al respecto, Cerretini et al.10 identificó una frecuencia del 6,3% de variantes patogénicas en los genes BRCA en una población argentina de mujeres con cáncer de mama, por ejemplo las variantes c.5351_5352insA y c.5681_5682insA, localizadas en el exón 11 del gen BRCA2, que alteran la secuencia de aminoácidos de la proteína p.Asn1784Lysfs; la mutación c.1653T>A en el exón 4 del gen PALB2, que provoca un cambio del marco de lectura alterando la secuencia de aminoácidos de la proteína p.Tyr551Ter8.
La identificación de las mutaciones puede tener implicaciones importantes para el manejo y la prevención. Las personas con antecedentes familiares de cáncer de mama u otros tipos de cáncer pueden considerar pruebas genéticas para determinar si presentan mutaciones. Sin embargo, la falta de recursos para la detección preventiva y el acceso a una atención de calidad provoca retrasos significativos en la detección del cáncer de mama. Aún existen aspectos desconocidos que requieren más investigación para obtener un panorama más completo acerca de su etiología y factores de riesgo11.
La genética del cáncer de mama en Paraguay es generalmente desconocida y aunque la temprana edad de aparición y la agresividad sugieren que puede haber un fuerte componente hereditario en el desarrollo de la enfermedad, pocos estudios nacionales han intentado compensar esta falta de conocimiento.
La investigación en este campo sigue siendo activa y se espera que futuros estudios arrojen más luz sobre los aspectos aún no comprendidos. En este trabajo se seleccionaron dos variantes reportadas por Cerretini et al.10 principalmente aquellas encontradas en mujeres con ascendencia (indígena/española, alemana/paraguaya), previamente reportadas en diferentes poblaciones latinoamericanas, las cuales al ser patogénicas pueden predecir desarrollo de cáncer de mama. Por tanto, el objetivo de este estudio fue determinar la prevalencia de dichas variantes en los genes BRCA2, con la finalidad de iniciar una base de datos acerca de las variantes genéticas que circulan en la muestra bajo estudio, puesto que, identificar a las mismas ofrece a las personas la capacidad de tomar decisiones sobre su salud, adoptar medidas preventivas y beneficiarse de un monitoreo más cercano y personalizado. Esto puede tener un impacto significativo en la detección temprana, el tratamiento y la prevención del cáncer de mama en el departamento de Itapúa, Paraguay.
MÉTODO
Este estudio piloto tuvo un diseño observacional y descriptivo. Se llevó a cabo en el Hospital Día Oncológico de la ciudad de Encarnación, Paraguay, durante el año 2023.
La muestra estuvo conformada por mujeres seleccionadas según criterios preestablecidos por dos médicos tratantes del nosocomio. Se incluyeron mujeres de entre 18 y 50 años con antecedente familiar de cáncer, pacientes con diagnóstico de cáncer de mama invasivo o carcinoma ductal in situ, y aquellas con fichas clínicas completas.
El muestreo fue no probabilístico por conveniencia. Para la recolección de muestras y datos, el equipo de investigación realizó visitas periódicas al hospital, socializando el objetivo del estudio con los médicos tratantes. A las pacientes que aceptaron participar se les programó una jornada de estudio, durante la cual se les explicaron los beneficios de su participación, se les proporcionó el formulario de consentimiento informado, se les administró un cuestionario estructurado elaborado por las investigadoras y se realizó la extracción de una muestra de sangre entera.
Se seleccionaron variantes previamente reportadas por Cerretini et al.10 en el gen BRCA2, encontradas en mujeres con ascendencia paraguaya, indígena o española. Las variantes analizadas fueron NM_000059.4: c.5351_5352insA y NM_000059.4: c.5611_5682insA. Luego de descargar la secuencia en formato FASTA, se procedió al diseño in silico de cebadores específicos para la amplificación de las mutaciones de interés, para lo cual se utilizó la herramienta Primer 312. Los cebadores fueron sintetizados por la empresa Macrogen-Korea.
Para la validación de los primers mediante PCR convencional, se empleó una muestra de ADN de un paciente voluntario al azar. Para la extracción del ADN se empleó el kit Wizard® Genomic DNA Purification (PROMEGA)13 siguiendo las condiciones sugeridas por el fabricante para muestras de sangre.
La amplificación de la región seleccionada fue realizada en un termociclador de la marca BOECO, en un volumen final de 50uL de reacción, con los siguientes reactivos: 1X de Buffer (PCR Buffer, -Mg), 1,5 mM MgCl2, 1 unidad de taq (DNA Polimerasa, Invitrogen), 0,2 mM de cada dNTPs (Promega), 0,5 µM de cada uno de los cebadores y aproximadamente 100ng de ADN templado. En cuanto a las condiciones de ciclado, se utilizaron condiciones estándares, desnaturalización inicial a 94°C por 5 min, 35 ciclos que incluyeron desnaturalización a 94°C por 45 s, hibridación a TM (Temperatura de hibridación) específica de cada cebador por 45 s, elongación a 72°C por 1 min, elongación final a 72°C por 10 min.
Los amplicones fueron visualizados por electroforesis horizontal en gel de agarosa (Figura 1). Como marcador de peso molecular se utilizó el 100 pb DNA Ladder (Invitrogen). Posteriormente, los fragmentos fueron enviados para su secuenciación a la empresa Macrogen-Korea. La calidad de las secuencias recibidas fue evaluada, y se generó una secuencia consenso utilizando el software BioEdit14.
Se realizó la extracción de ADN de las participantes a partir de sangre periférica con EDTA utilizando el kit PureDireX GR Reagent (Genomic DNA Isolation Reagent)15, siguiendo las condiciones sugeridas por el fabricante para muestras de sangre entera.
Se utilizaron los cebadores previamente diseñados y puestos a punto por el equipo de trabajo (Tabla 1). Las amplificaciones fueron realizadas en un termociclador de la marca BOECO, en un volumen final de 25 uL de reacción, conteniendo los siguientes reactivos: 1X de Buffer (Green GoTaq Reaction Buffer), 0,5 U de taq (GoTaq G2 DNA Polymerasa, Promega), 0,2 mM de dNTPs (Promega), 0,2 µM de cada uno de los cebadores y aproximadamente 50 ng de ADN templado.
Las condiciones de ciclado abarcaron la desnaturalización inicial a 94°C por 5 min, 35 ciclos que incluyeron desnaturalización a 94°C por 45 s, hibridación a TM (Temperatura de hibridación) específica del par de cebadores por 45 s, elongación a 72°C por 1 min, elongación final a 72°C por 10 min. En todos aquellos casos en donde no se observó amplificación en las PCR, se procedió a la realización de diluciones 1:10 y 1:20 con el fin de disminuir la cantidad de inhibidores. Los productos de PCR fueron enviados a secuenciar a la empresa Macrogen Korea.
Previo al análisis se comprobó la identidad de cada una de las secuencias recibidas utilizando la herramienta BLASTn16. Posteriormente, se realizó la edición y alineamiento múltiple con las regiones analizadas utilizando el software Bioedit14. Para la búsqueda de polimorfismos se utilizó el software DNAsp vs. 617, comparando las secuencias con referencias públicamente disponibles para identificar variantes de interés o alguna otra no reportada previamente.
El estudo fue aprobado por el Comité de Ética de la Investigación de la Facultad de Medicina de la Universidad Nacional de Itapúa, con el número de dictamen CEI 01/2025.
RESULTADOS
Mediante el empleo del programa Primer 3 se obtuvieron un total de 6 pares de cebadores; sin embargo, se seleccionaron 2 pares que cumplieron con los criterios ya anteriormente mencionados (Figura 1 y Tabla 1).
Un total de 11 mujeres en un rango de edad de 31 a 51 años participaron del estudio. La edad media fue de 39,45 años (Tabla 2). La totalidad de las mismas refirieron cáncer de mama invasivo, 7 (64%) de ellas se encontraban en la fase premenopáusica. De aquellas con ER/Estado de HER2, 4 de 11 pacientes (80%) presentaron cáncer de mama ER+ y 4 pacientes (36%) eran HER2 positivos. Se registró que 6 pacientes (54%) tenían cánceres de mama triple negativos. La mayoría (54%) manifestó tener algún familiar de primer grado con cáncer de mama u ovario.
Luego de la secuenciación, se obtuvo un alineamiento de 552 pb, que alinean desde la posición 5335 a la 5886 de la región codificante (cds) del gen BRCA2 (NM_000059.3), en las cuales se encuentran incluidas las dos variantes analizadas en esta investigación. En el alineamiento no se encontraron variantes entre las mujeres incluidas en el estudio ni frente a la secuencia de referencia. Por lo tanto, en el 100% de la muestra estudiada no se detectaron las variantes analizadas en este trabajo. DISCUSIÓN
El cáncer de mama representa una de las principales causas de mortalidad oncológica en mujeres en Paraguay. A pesar de los esfuerzos realizados para mejorar el acceso a servicios de detección temprana, persisten barreras significativas que limitan el diagnóstico oportuno y preciso de la enfermedad. En este contexto, la identificación de variantes genéticas patogénicas asociadas al desarrollo y evolución del cáncer de mama constituye un reto fundamental para la implementación de estrategias de medicina de precisión. Este estudio piloto tuvo como objetivo la búsqueda de dos variantes específicas en el gen BRCA2 en una cohorte de mujeres con cáncer de mama. Los resultados obtenidos indicaron que las variantes NM_000059.4: c.5351_5352insA y NM_000059.4: c.5681_5682insA no fueron detectadas en la muestra analizada.
Los estudios genéticos más recientes sobre cáncer de mama hereditario en Latinoamérica han sido publicados en Chile18, Brasil19, México20 y Argentina10. En este estudio piloto, las variantes fueron seleccionadas considerando los criterios de ascendencia de la población de Itapúa (indígena/española, alemana/paraguaya, rusa/ucraniana) y reportes en diferentes poblaciones latinoamericanas tomando como referencia lo publicado por Cerretini et al.10, quienes identificaron una frecuencia del 6,3% de variantes patogénicas en los genes BRCA1 y BRCA2 en una población argentina de mujeres con cáncer de mama. Los resultados obtenidos en la presente investigación dan la pauta que debe ser incluida una mayor cantidad de variantes dentro del cribado. La inclusión de otras mutaciones permitirá ampliar la búsqueda para conocer la circulación de las mismas dentro de la población.
El gen BRCA2 posee 91193 pb de longitud, de las cuales 10257 pb corresponden a la región codificante21. Además del estudio de las dos posiciones de interés, también se analizó el 5,38% (552pb) de la región codificante de este gen, no encontrando las variantes previamente mencionadas, lo cual refuerza la necesidad de expandir la investigación a otros segmentos del gen y considerar la inclusión de genes adicionales implicados en la predisposición al cáncer de mama.
La genómica del cáncer de mama también es utilizada para estudiar las características moleculares y genéticas de los tumores, lo que puede ayudar a personalizar el tratamiento y predecir la respuesta al mismo. En el grupo de pacientes analizadas, los datos genéticos se consideran relevantes debido al tipo de cáncer de mama que padecían las once mujeres (invasivo). Asimismo, la alta prevalencia de cánceres triple negativos es un hallazgo significativo y puede influir en las opciones de tratamiento. Este tipo de cáncer es más agresivo y difícil de tratar22.
Otra de las características presentadas en la muestra fue que seis mujeres contaban con antecedentes familiares de primer grado. Esto resalta la fuerte influencia hereditaria en el desarrollo de cáncer en mujeres de temprana edad23, considerando que la media de edad en este grupo de mujeres fue de 39 años y la mayoría se encontraba en la fase de la premenopausia.
Los resultados señalan que más de la mitad de las pacientes tiene antecedentes familiares de cáncer de mama u ovario, lo que podría indicar un componente genético o hereditario significativo en esta muestra, posiblemente relacionado con mutaciones de otros genes implicados en el cáncer de mama.
Las investigadoras reconocen que las limitaciones principales de este estudio piloto incluyen el tamaño reducido de la muestra y la selección limitada de variantes genéticas. La muestra solo representa a las mujeres con cáncer de mama que acuden al Hospital Día Oncológico cuyas fichas clínicas contenían los datos histológicos completos, lo cual ha disminuido el criterio de elegibilidad.
Además, la selección de solo dos variantes se debió en parte a los costos elevados de secuenciación, que, a pesar de haber disminuido en los últimos años, continúan siendo una barrera importante. Si bien la secuenciación de nueva generación (NGS) permite una cobertura más amplia, su costo supera los 1000 USD en la mayoría de los paneles comerciales24, lo que limita su aplicabilidad en la muestra de esta investigación. Por esta razón, la estrategia basada en PCR y secuenciación Sanger resulta una opción viable, aunque con menor capacidad de detección de variantes. De esta manera, realizar el screening de variantes a través de PCR y secuenciación por la tecnología de SANGER es una opción interesante, aunque de menor cobertura en cuanto a la cantidad de variantes a analizar. Al no detectar ninguna de las variantes propuestas, no se ha podido relacionar con los criterios histológicos (seis mujeres presentaban cáncer triple negativo).
A pesar de estas limitaciones, los resultados obtenidos en este estudio piloto constituyen un punto de partida para futuras investigaciones en genética del cáncer de mama en Paraguay. La ausencia de las variantes estudiadas sugiere que otras mutaciones pueden estar implicadas en la predisposición a esta enfermedad. Es fundamental expandir el análisis a un panel más amplio de genes y aumentar el tamaño de la muestra para mejorar la capacidad de detección de variantes relevantes. Estudios futuros con metodologías de secuenciación de nueva generación podrán proporcionar información más detallada sobre la genética del cáncer de mama en Paraguay, contribuyendo al desarrollo de estrategias de detección y tratamiento más efectivos.
CONCLUSIÓN
Las dos variantes genéticas analizadas en el gen BRCA2 a través de técnicas de secuenciación genómica y análisis genético no fueron detectadas en las pacientes con cáncer de mama que formaron parte de la muestra. Se denota la necesidad de incluir una mayor cantidad de variantes genéticas en el screening, inclusive abarcar otros genes como BRCA 1 y PALB2, generando de esta manera mayor posibilidad de encontrar e identificar mutaciones asociadas al cáncer de mama hereditario. El estudio de las variantes genéticas que guardan relación con el cáncer de mama son un tema importante en la investigación médica, científica y consejería genética.
AGRADECIMIENTOS
A la Dra. Karem Sosa, mastóloga, Hospital Día Oncológico en Encarnación Paraguay y al Dr. José Bozzano, oncólogo, Hospital Día Oncológico en Encarnación Paraguay.
Mónica María González contribuyó en la conceptualización, investigación, administración del proyecto y supervisión. Diana Paola Dressler Sanabria contribuyó en la conceptualización, análisis formal, investigación, visualización, revisión y edición. Liliana Noelia Talavera Stefani contribuyó en la curación de datos, análisis formal, metodología, validación, revisión y edición. Todas las autoras contribuyeron en la adquisición de financiamiento y la redacción, y aprobaron la versión final a publicarse.
DECLARACIÓN DE CONFLICTO DE INTERESES
Nada a declarar.
FUENTES DE FINANCIAMIENTO
Rectorado, Universidad Nacional de Itapúa.
REFERENCES
1. Organización Mundial de la Salud, Panamericana de la Salud [Internet]. Washigton, DC: OPAS; OMS; [sem data]. Día mundial contra el cáncer 2023: por unos cuidados más justos, 2023 [citado 2023 marzo 15]. Disponible en: https://www.paho.org/es/campanas/dia-mundial-contra-cancer-2023-por-unos-cuidados-mas-justos
2. Organización Mundial de la Salud, Organización Panamericana de la Salud [Internet]. Cáncer, 2024. [citado 2024 abr 25]. Disponible en: https://www.paho.org/es/temas/cancer
3. Ministerio de Salud Pública y Bienestar Social (PY) [Internet]. Asunción: MSPBS; ©2017. Al año se tiene un promedio de 300 nuevos casos de cáncer de mamas, 2022. [citado 2023 jul 10]. Disponible en: https://portal.ips.gov.py/sistemas/ipsportal/noticia.php?cod=747
4. Fernández TA, Reigosa YA. Cáncer de mama hereditario. Comunidad Salud. 2016;14(1):52-60.
5. Organización Mundial de la Salud. Programas Nacionales de Control contra el cáncer. Políticas y pautas para la gestión [Internet]. 2 edición. Genebra: OMS; 2004. [citado 2024 abr 25]. [Disponible en: https://www3.paho.org/hq/dmdocuments/2012/OPS-Programas-Nacionales-Cancer-2004-Esp.pdf
6. Organización Mundial de la Salud, Organización Panamericana de la Salud [Internet]. Cáncer de mama, 2023 [citado 2024 feb 25]. Disponible en: https://www.paho.org/es/temas/cancer-mama
7. Rosado-Jiménez L, Mestre-Terkemani Y, García-Aliaga Á, et al. Variantes genéticas recurrentes y priorización de variantes de significado clínico desconocido asociadas al síndrome de cáncer de mama y ovario hereditario en familias de la Región de Murcia. Adv Lab Med. 2023;4(3):288-97. doi: https://doi.org/10.1515/almed-2023-0032
8. Nanda R. Genetic testing in an ethnically diverse cohort of high-risk women: a comparative analysis of BRCA1 and BRCA2 mutations in American Families of European and African Ancestry. JAMA. 2005;294(15):1925-33. doi: https://doi.org/10.1001/jama.294.15.1925
9. Angeli D, Salvi S, Tedaldi G. Genetic predisposition to breast and ovarian cancers: how many and which genes to test? Int J Mol Sci. 2020;21(3):1128. doi: https://doi.org/10.3390/ijms21031128
10. Cerretini R, Mercado G, Morganstein J, et al. Germline pathogenic variants in BRCA1, BRCA2, PALB2 and RAD51C in breast cancer women from Argentina. Breast Cancer Res Treat. 2019;178(3):629-36.
11. Organización Mundial de la Salud, Organización Panamericana de la Salud. Planificación: Cómo mejorar el acceso a la atención para el cáncer de mama [Internet]. Genebra: OMS; OPAS; 2022. [citado 2024 feb 25]. Disponible en: https://www3.paho.org/hq/dmdocuments/2015/planificacion-mejorar-acceso.pdf
12. Primer3 [Internet]. Versión 4.1.0. Cambridge: Whitehead Institute for Biomedical Research; Ó1996-2019. [citado 2024 feb 20]. Disponible en: https://primer3.ut.ee/
13. Wizard® Genomic DNA Purification Kit Technical Manual [Internet]. São Paulo: Promega Corporation; Ó2025. [citado 2024 feb 20]. Disponible en: https://worldwide.promega.com/resources/protocols/technical-manuals/0/wizard-genomic-dna-purification-kit-protocol/
14. Bioedit [Internet]. Versión 7.7. [sem local]: Informer Technologies, Inc.; ©2025. [citado 2024 feb 20]. Disponible en: https://bioedit.software.informer.com/
15. PureDireX. Genomic DNA Isolation Reagent Kit [Internet]. [Sem Local]: QIAGEN; 2022. [citado 2024 feb 20]. Disponible en: https://www.bio-helix.com/uploads/product_file/file/411/PureDireX_Protocol_PDR05-0100.pdf
16. BLASTN [Internet]. Versión 2.16. Bethesda: NCBI; 2023. [citado 2024 feb 20]. Disponible en: https://blast.ncbi.nlm.nih.gov/Blast.cgi
17. DnaSP v6 [Internet]. Barcelona: Universitat de Barcelona; 2018. [citado 2024 feb 20]. Disponible en: http://www.ub.edu/dnasp/downloadTv6.html
18. Adaniel C, Salinas F, Donaire J, et al. Non-BRCA1/2 variants detected in a high-risk chilean cohort with a history of breast and/or ovarian cancer. J Glob Oncol. 2019;5:1-14.
19. Costa E, Silva Carvalho S, Cury N, et al. Germline variants in DNA repair genes associated with hereditary breast and ovarian cancer syndrome: analysis of a 21 gene panel in the Brazilian population. BMC Med Genomics. 2020;13(1):21. doi: https://doi.org/10.1186/s12920-019-0652-y
20. Zayas O, Campos L, Lugo J, et al. Analysis of the pathogenic variants of BRCA1 and BRCA2 using next-generation sequencing in women with familial breast cancer: a case–control study. BMC Cancer. 2019;19(722):1-8. doi: https://doi.org/10.1186/s12885-019-5950-4
21. Alvarez J. Análisis de mutaciones en BRCA1 Y BRCA2 asociadas al cáncer de mama [Internet]. 2016 [citado 2024 feb 20]. Disponible en: https://digital.csic.es/bitstream/10261/164963/1/BRCAmuta.pdf
22. González Ortega JM, Morales Wong MM, López Cuevas Z, et al. Factores pronósticos del cáncer de mama. Rev Cubana Cir. 2024;50(1):130-38.
23. Depolo J. ¿Es hereditario el cáncer de mama? BreastCancer [Internet]. 2024 [citado 2024 dic 15]. Disponible en: https://www.breastcancer.org/es/riesgo/factores-riesgo/genetica
24. Rubio S, Pacheco R, Gómez A, et al. Secuenciación de nueva generación (NGS) de ADN: presente y futuro en la práctica clínica. 2020;61(2):1. doi: https://doi.org/10.11144/Javeriana.umed61-2.sngs
Recebido em 25/9/2024
Aprovado em 21/2/2025
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
Tabla 1. Regiones y cebadores para la amplificación de las mutaciones asociadas a BRCA2
|
Gen |
|
Exón |
Cebadores |
Mutación |
pb |
TM |
|
BRCA2 |
|
11 |
BRCA2_11F: TGGTATTGAGCCAGTATTGAAGABRCA2_11R: AGACTGACTTATGAAGCTTCCCT |
c.5351_5352insA
c.5681_5682insA |
599
|
58 |
Leyendas: pb = pares de base; TM = temperatura de hibridación.
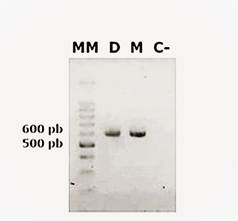
Figura 1. Electroforesis de la región parcial del gen BRCA2; tamaño de amplicón CG1: 599pb. Carril MM: marcador de peso molecular de 1 kb. Carril D: dilución. Carril M: muestra. Carril C: control negativo
Tabla 2. Características clínicas de mujeres con cáncer de mama. Fundación Lazos del Sur
|
Características |
||
|
Edad, años |
||
|
Promedio, desviación estándar |
39,45 |
6,88 |
|
Rango de edad |
31-51 |
|
|
F(*) |
% |
|
|
Tipo de cáncer de mama |
N=11 |
|
|
Bilateral |
0 |
|
|
Invasivo |
11 |
100 |
|
Fases de la menopausia |
|
|
|
Pre menopausia |
7 |
64 |
|
Post menopausia |
4 |
36 |
|
Histología |
||
|
ER+ |
4 |
80 |
|
ER- |
0 |
0 |
|
HER2/neu+ |
4 |
36 |
|
HER2/neu- |
1 |
9 |
|
Triple negativo |
6 |
54 |
|
Familiar con cáncer de mama u ovario |
||
|
Sí |
6 |
54 |
|
No |
5 |
46 |
(*) Frecuencia.
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.