ARTIGO ORIGINAL
Monitoramento Interno da Qualidade e Concordância Interobservador dos Exames Citopatológicos Realizados no Laboratório Municipal de Manaus, Amazonas, Brasil
Internal Quality Monitoring and Interobserver Agreement of Cytopathological Tests Conducted in the Municipal Laboratory of Manaus, Amazonas, Brazil
Monitoreo Interno de Calidad y Concordancia Interobservador de las Pruebas Citopatológicas Realizadas en el Laboratorio Municipal de Manaos, Amazonas, Brasil
https://doi.org/10.32635/2176-9745.RBC.2025v71n2.4992
Carlos Henrique Lamego Guimarães Thomaz Branco[1]; Rita de Cássia Alencar Reffert[2]; Gleyce dos Santos Barbosa Jobim3; Patrícia Danielle Oliveira de Almeida4
1,2,4Universidade Federal do Amazonas (UFAM). Manaus (AM), Brasil. E-mails: carloshgbranco@gmail.com; ritareffert@hotmail.com; patriciaalmeida@ufam.edu.br. Orcid iD: https://orcid.org/0000-0003-1440-5415; Orcid iD: https://orcid.org/0009-0007-1168-9201; Orcid iD: https://orcid.org/0000-0002-2620-8251
3Laboratório Municipal de Especialidades Sebastião Ferreira Marinho. Manaus (AM), Brasil. E-mail: gleyce.barbosa@pmm.am.gov.br. Orcid iD: https://orcid.org/0000-0001-9244-3711
Endereço para correspondência: Patrícia Danielle Oliveira de Almeida. Faculdade de Ciências Farmacêuticas. Av. General Rodrigo Octavio Jordão Ramos, 1200 – Coroado I. Manaus (AM), Brasil. CEP 69067-005. E-mail: patriciaalmeida@ufam.edu.br
RESUMO
Introdução: Um monitoramento interno da qualidade tem como finalidade minimizar falhas e fornecer correções, assegurando a eficácia laboratorial no programa de rastreamento do câncer cervical pelo exame de Papanicolau. Objetivo: Avaliar os indicadores de qualidade do laboratório municipal de Manaus-AM e os índices de concordância interobservador durante o período de 2019 a 2022. Método: Análise descritiva, retrospectiva e quantitativa dos exames de Papanicolau do laboratório municipal de Manaus-AM, de janeiro de 2019 a dezembro de 2022. Foram aplicados seis indicadores de qualidade recomendados pelo Ministério da Saúde, assim como o índice de concordância Kappa para avaliar o desempenho laboratorial e individual dos citologistas, medindo a consistência entre os laudos dos analistas e revisores, utilizando dados dos sistemas nacionais Siscolo, Siscan e registros internos do laboratório. Resultados: O laboratório manteve-se dentro dos parâmetros recomendados para a maioria dos indicadores de qualidade, com exceção do aumento do percentual de células escamosas atípicas (ASC) entre exames alterados, detectado em 2019 (61,27%) e 2020 (60,89%), com diminuição anual progressiva. O índice de concordância Kappa laboratorial foi considerado “boa”, apresentando-se na faixa de 0,73 a 0,77 durante o quadriênio. Entretanto, os indicadores de concordância Kappa individuais mostraram que dois dos 15 analistas apresentaram resultados classificados como “pobre” a “moderada”, e seus indicadores individuais de qualidade divergiram dos valores próximos aos demais citologistas. Conclusão: O estudo demonstrou a importância de integrar os indicadores de qualidade com a concordância interobservador, sugerindo novas metodologias para investigação da qualidade em laboratórios de citopatologia.
Palavras-chave: Controle de Qualidade; Serviços Laboratoriais de Saúde Pública; Teste de Papanicolaou; Indicadores de Qualidade em Assistência à Saúde.
ABSTRACT
Introduction: Internal quality monitoring aims to minimize failures and provide corrections, ensuring laboratory effectiveness using pap smears in the cervical cancer screening program. Objective: To evaluate the quality indicators of the municipal laboratory of Manaus-AM and the interobserver agreement rates from 2019 to 2022. Method: Descriptive, retrospective, and quantitative analysis of pap smears from the municipal laboratory of Manaus-AM conducted from January 2019 to December 2022. Six quality indicators recommended by the Ministry of Health were applied, as well as the Kappa concordance index to assess laboratory and individual cytologist performance, measuring the consistency between analysts’ and reviewers’ reports using data from the national systems Siscolo, Siscan, and internal laboratory records. Results: The laboratory remained within the recommended parameters for most quality indicators, except for an increase in the percentage of atypical squamous cells (ASC) among altered exams, detected in 2019 (61.27%) and 2020 (60.89%), with a progressive annual decrease. The Kappa agreement index for the laboratory was considered “good,” ranging from 0.73 to 0.77 over the four years. However, the individual Kappa agreement indicators showed that 2 of the 15 analysts had results classified as “poor” to “moderate,” their personal quality indicators differing from those of the other cytologists. Conclusion: The study demonstrated the importance of integrating quality indicators with interobserver agreement, suggesting new methodologies for investigating quality in cytopathology laboratories.
Key words: Quality Control; Public Health Laboratory Services; Papanicolaou Test; Quality Indicators, Health Care.
RESUMEN
Introducción: El monitoreo interno de calidad tiene como objetivo minimizar las fallas y proporcionar correcciones, garantizando la eficacia del laboratorio en el programa de tamizaje de Papanicolaou para el cáncer de cuello uterino. Objetivo: Evaluar los indicadores de calidad del laboratorio municipal de Manaos-AM y las tasas de concordancia interobservador durante el período de 2019 a 2022. Método: Análisis descriptivo, retrospectivo y cuantitativo de las pruebas de Papanicolaou en el laboratorio municipal de Manaos entre enero de 2019 y diciembre de 2022. Se aplicaron seis indicadores de calidad recomendados por el Ministerio de Salud, así como el índice de concordancia Kappa para evaluar el desempeño del laboratorio y del citólogo individual, midiendo la consistencia entre los informes de los analistas y los revisores, utilizando datos de los sistemas nacionales Siscolo y Siscan, y los registros internos del laboratorio. Resultados: El laboratorio se mantuvo dentro de los parámetros recomendados para la mayoría de los indicadores de calidad, con excepción del aumento del porcentaje de células escamosas atípicas (ASC) entre los exámenes alterados, detectado en 2019 (61,27%) y 2020 (60,89%), con una disminución anual progresiva. El índice de concordancia Kappa del laboratorio se consideró «bueno», oscilando entre 0,73 y 0,77 durante el cuatrienio. Sin embargo, los indicadores individuales de concordancia Kappa mostraron que 2 de los 15 analistas obtuvieron resultados clasificados como «pobres» o «moderados», y sus indicadores individuales de calidad divergieron de los valores de los demás citólogos. Conclusión: El estudio demostró la importancia de integrar los indicadores de calidad con la concordancia entre observadores, sugiriendo nuevas metodologías para investigar la calidad en los laboratorios de citopatología.
Palabras clave: Control de Calidad; Servicios Laboratoriales de Salud Publica; Prueba de Papanicolaou; Indicadores de Calidad de la Atención de Salud.
O exame de Papanicolau é a principal ferramenta preventiva para a detecção de lesões precursoras do câncer de colo uterino. Por sua simplicidade, especificidade, baixo custo e por ser geralmente indolor durante a coleta, constitui uma triagem citológica esfoliativa eficaz para detectar lesões cervicais uterinas. Esse método de triagem oferece uma boa cobertura assistencial, promovendo um diagnóstico precoce antes que as lesões se tornem invasivas e possam levar à progressão tumoral1,2.
Com procedimentos de obtenção das amostras realizados manualmente, podem ocorrer resultados falsos-positivos e falsos-negativos, se não houver um monitoramento adequado. Os erros podem estar relacionados à coleta, ao preparo e ao armazenamento das lâminas (fase pré-analítica), à interpretação subjetiva para o diagnóstico (fase analítica) ou ao registro e controle de qualidade dos resultados na fase pós-analítica3,4.
Um dos desafios para a efetividade do exame preventivo está relacionado às oscilações de sensibilidade. Essas oscilações são associadas a variáveis na rotina dos profissionais, incluindo a rotatividade intersetorial, a necessidade de treinamentos e atualizações, além de intervenções e falhas técnicas, que podem comprometer o desempenho laboratorial5.
O Ministério da Saúde, pela Portaria GM/MS n.º 3.3886, de 30 de dezembro de 2013, executou as ações de controle de qualidade redefinindo a Qualificação Nacional em Citopatologia, e estabeleceu critérios para os parâmetros de qualidade e avaliação do desempenho dos laboratórios prestadores de serviços por meio da execução do monitoramento interno da qualidade (MIQ) e monitoramento externo da qualidade (MEQ) com a finalidade de garantir a qualidade dos resultados obtidos, identificar as possíveis causas e apontar, estatisticamente, os problemas relacionados ao laboratório7.
Na fase pós-analítica, contemplando o MIQ, é possível realizar o controle de qualidade baseando-se em cálculos efetivos dos resultados emitidos com a utilização de indicadores estatísticos, comparando-os com valores recomendados pelo Ministério da Saúde, de modo a avaliar o desempenho laboratorial e indicar a necessidade de treinamento profissional caso os valores estejam divergentes dos limites recomendados8.
Uma publicação voltada exclusivamente ao cenário do Amazonas foi realizada por Nobre e Lopes Neto9, com indicadores entre 2001 e 2005, destacando melhorias relacionadas ao decréscimo anual de resultados das atipias celulares e insatisfatoriedade emitidos. Além disso, há poucos estudos no Brasil voltados à análise de desempenho dos citologistas, pois a grande maioria se direciona aos resultados divulgados e registrados pelo laboratório.
É imprescindível que haja mais pesquisas e discussões atualizadas a respeito desse tema no Amazonas, para divulgação do cenário atual da Região com as maiores taxas de incidência nacional do câncer de colo do útero, com 31,71 casos a cada 100 mil mulheres10.
Diante do exposto, este trabalho teve como objetivo realizar o MIQ dos exames citopatológicos liberados pelo laboratório municipal de Manaus-AM no quadriênio de 2019 a 2022, aplicando seis indicadores de qualidade estabelecidos pelo Ministério da Saúde para os dados contidos no Sistema de Informação do Câncer do Colo do Útero (Siscolo)11 e no Sistema de Informação do Câncer (Siscan)12, assim como analisar o desempenho individual dos citologistas do laboratório e direcionar medidas corretivas diante dos problemas encontrados.
Considerando que este trabalho se trata de um estudo observacional, descritivo, retrospectivo e quantitativo, a sua idealização, metodologia, apresentação dos resultados e discussão foram conduzidas baseadas nas determinações do STROBE checklist13 (Material suplementar). Foram avaliados os resultados de exames de preventivos realizados pelo Laboratório de Especialidades “Prof. Sebastião Ferreira Marinho”, pertencente à Secretaria Municipal de Saúde (SEMSA) em Manaus-AM, entre os períodos de janeiro de 2019 a dezembro de 2022. A análise baseou-se nas informações do banco de dados do sistema Siscolo11 (para o período de 2019 a 2020), com a última atualização coletada em 25 de agosto de 2022, e do Siscan12 (2021 a 2022), agrupados de forma anual. Foram obtidos 362.461 resultados nas bases de dados, sendo utilizados para análise do MIQ.
Para a análise de desempenho dos citologistas, foram consultados e computados 19.063 dados válidos de registros internos de lâminas com alterações selecionados para revisão entre 2019 e 2021, desconsiderando lâminas que não possuíram desfecho clínico registrado ou ausentes de preenchimento no registro interno do laboratório. A Figura 1 apresenta o fluxograma das etapas para a construção da metodologia deste estudo.
O Ministério da Saúde, por meio do Instituto Nacional de Câncer (INCA), elaborou o Manual de Gestão e Qualidade para Laboratórios de Citopatologia14 (QualiCito) em 2012, com edição mais recente em 2016 e atualizações anuais subsequentes. Seis indicadores estabelecidos nesse manual para o MIQ foram utilizados neste estudo, baseando-se em seus limites e recomendações:
Índice de positividade (IP) – expressa a prevalência das alterações celulares nos exames e caracteriza a sensibilidade do processo de triagem para a detecção de atipias ou lesões precursoras de câncer cervical. A fórmula se apresenta como: (número de exames alterados em determinado local e ano x 100)/total de exames satisfatórios.
Os resultados de IP são classificados em: muito baixo (abaixo de 2%); baixo (entre 2% e 2,9%); esperado (entre 3% e 10%); acima do esperado (superior a 10%, considerando que tais prestadores podem atender serviços de referência secundária em patologia cervical). Com base no QualiCito14, recomenda-se o IP com valor igual ou superior a 3%.
Percentual de exames compatíveis com células escamosas atípicas (ASC) entre os exames satisfatórios – ASC é uma terminologia aplicada quando existem dúvidas diagnósticas para se enquadrarem em lesão intraepitelial característica, englobando dois grupos distintos: as possivelmente não neoplásicas (ASC-US) e as que não se descartam lesão intraepitelial de alto grau (ASC-H). De acordo com o QualiCito14, esses valores em relação aos satisfatórios não podem ultrapassar a marca de 4-5%. A fórmula corresponde ao (número de exames com ASC-US e ASC-H x 100)/total de exames satisfatórios.
Percentual de ASC entre os exames alterados – Essa avaliação será de forma conjunta com o valor de IP, pelo fato de um valor elevado estar associado a um alto percentual de testes liberados como ASC, sugestivo de muitos falso-negativos ou falso-positivos, seguindo a fórmula: (número de exames com ASC-US e ASC-H x 100)/total de exames alterados. Com base no QualiCito14, o percentil recomendado de ASC entre exames alterados deve corresponder entre 37,3% e 57,2%, não ultrapassando 60%.
Razão entre células ASC/lesão intraepitelial escamosa (SIL) – Esse valor contribui para a identificação de dificuldades técnicas para diagnóstico de SIL em baixo (LSIL) e alto grau (HSIL), evitando um excessivo uso da terminologia ASC resultantes em diagnósticos incertos. O QualiCito14 recomenda um valor não superior a 3 utilizando a fórmula: número de exames com ASC-US e ASC-H/número de exames com LSIL e HSIL.
Percentual de exames compatíveis com HSIL – O resultado deve ser maior ou igual a 0,4%14 para um rastreamento bem-sucedido e diminuição nas taxas de incidência e mortalidade pelo câncer do colo uterino a partir dos achados precursores: (número de exames HSIL x 100)/total de exames satisfatórios14.
Percentual de insatisfatoriedade – parâmetro que compreende estimar a quantidade de amostras insatisfatórias por mês e facilitar a identificação de falhas no controle de qualidade interno da unidade prestadora do serviço, seguindo o cálculo: (número de exames insatisfatórios no mês x 100)/total de exames realizados no mês. Com base no QualiCito14, os resultados devem ser menores que 5% em todos os meses.
O desempenho individual dos citologistas foi realizado a partir do índice de produtividade dos profissionais do laboratório, comparando os resultados emitidos pelo primeiro analista (objeto de estudo) com os laudos dos revisores das lâminas (considerados padrão). Entre os 21 citologistas atuantes no laboratório, 15 foram selecionados pelo ponto de corte de produtividade trienal (n>2.800 lâminas) por possuírem maior produtividade em número de lâminas lidas por ano.
Aplicou-se o índice de concordância Kappa15, que mede a concordância entre laudos de ASC e SIL emitidos e indicadores de qualidade individuais, adaptado a partir da metodologia MIQ para laboratórios. Além desse, incluiu-se uma análise de desempenho dos citologistas, baseando-se no mesmo modelo de MIQ do laboratório, porém voltado para os números individuais de produção, nos quais os quantitativos e laudos liberados foram computados como resultados para os cálculos.
A estatística de Kappa para o grau de concordância foi realizada a partir de uma adaptação da planilha disponibilizada pelo INCA15. Na interpretação do coeficiente Kappa do modelo de Landis e Kock, de 1977, considerou-se, para a medida interobservador, os intervalos de concordância, nos quais um valor igual a zero indica ausência de concordância; valores acima de zero até 0,39 indicam concordância "pobre"; valores entre 0,40 e 0,59 sugerem uma concordância "moderada"; valores entre 0,60 a 0,79 sugerem concordância “boa”; valores entre 0,80 e 0,99 correspondem a uma concordância "excelente" (ou substancial); e o valor máximo de 1 sugere uma concordância "perfeita" (ou completa concordância).
Para análise dos dados, foi utilizado o software Tabnet®16 (DATASUS) e o Microsoft Excel® para a quantificação dos resultados e montagem estatística.
O projeto de pesquisa obteve aprovação da SEMSA, ofício de autorização n.º 40/2020, e do Comitê de Ética em Pesquisa da Universidade Federal do Amazonas (UFAM), sob o número de parecer 4.261.386 (CAAE: 35582620.4.0000.5020), conforme a Resolução do Conselho Nacional de Saúde (CNS) n.º 466/201217.
RESULTADOS
A partir dos dados fornecidos pelo Siscolo11 (2019 a 2020) e Siscan12 (2021 a 2022) foi possível quantificar os resultados dos exames realizados durante o quadriênio. A Tabela 1 corresponde aos laudos emitidos pela unidade prestadora do serviço nos sistemas oficiais do Ministério da Saúde.
Segundo o relatório anual do Departamento de Prevenção e Controle do Câncer (DPCC) da Fundação Centro de Controle de Oncologia do Amazonas18, a SEMSA de Manaus somente implantou o Siscan12 como sistema de informação a partir de 2020. Contudo, a maioria das informações de 2019 e 2020 não estaria completa ou em concordância com os números oficiais divulgados, sendo ainda encontradas no sistema anterior (Siscolo11/Sismama), gerando discrepâncias dos sistemas de relatórios anuais. Portanto, foram consultados os dois sistemas para atingir o objetivo do estudo.
Dentro dos valores de ASC, na Tabela 1, são constados resultados individuais de ASC-US: 1.939 em 2019 (1,99%), 2020 com 1.273 (2,01%), 1.357 em 2021 (1,52%) e 1.168 em 2022 (1,04%). Para ASC-H, os valores foram: em 2019 com 1.083 (1,11%), 751 em 2020 (1,19%), 2021 com 1.186 (1,33%) e 979 resultados em 2022 (0,87%). Em 2020, a proporção de ASC emitidos foi maior comparada aos outros anos do estudo, com 3,20% (2.024 exames).
Na Tabela 2, são apresentados os cinco indicadores do MIQ. Os valores recomendados de cada indicador aplicado foram inclusos como base comparativa para avaliação dos resultados estatísticos calculados. Valores acima de 60% para o percentual de ASC entre os exames alterados foram observados em 2019 (61,27%) e 2020 (60,89%).
Os dados de percentual de insatisfatoriedade foram adaptados representando uma média anual, em função de nenhum valor mensal durante o quadriênio analisado ultrapassar o limite de 5%, conforme recomendação pelo QualiCito14. Dados mensais obtiveram maiores valores em 2019, variando de 2% a 2,78% entre os meses de outubro a dezembro; em 2020 de 1,67 a 2,78% nos meses de março a maio; ano de 2021 apresentando valores de 2,04 em julho e 2,16 em agosto; e em 2022, 2,10% a 2,70% nos meses de março a junho.
A Tabela 3 apresenta dados referentes a análise dos 15 citologistas com intuito de comparar a concordância na emissão de laudos entre primeiro analista e revisores, pela aplicação do índice Kappa15 para determinação da concordância, a concordância dos laudos de ASC e SIL emitidos e os indicadores de qualidade individuais dos citologistas.
DISCUSSÃO
A aplicação do MIQ em citopatologia cervical é uma etapa decisiva para garantir o rigor técnico no desempenho laboratorial, a avaliação dos indicadores de qualidade facilita a identificação das falhas na cobertura assistencial, visando corrigi-las por meio de ações estratégicas de revalidação das etapas e na educação continuada dos profissionais envolvidos nas fases pré-analíticas e analíticas19.
Conforme os dados na Tabela 1, o período de 2020 demonstra uma diminuição na quantidade de exames realizados, consequente à pandemia de covid-19, impactando o rastreamento oportunístico estimado de 30 mil mulheres quando comparado aos demais anos. Entretanto, o percentual de exames alterados nesse ano foi o maior (5,26% em relação ao total) entre os anos avaliados, assim como o que apresentou o menor valor relativo ao número de exames insatisfatórios (1,39%).
Em razão da menor procura oportuna do público em 2020, foi identificado um maior número proporcional de alterações em relação ao total de exames, cerca de 5,26%. A partir dos achados, as hipóteses são similares às de Ribeiro et al.20, corroborando a hipótese de que uma maior proporção de mulheres sintomáticas, em seguimento ou com necessidade de repetição de exames por alterações, procurou realizar o exame preventivo em comparação àquelas que buscavam oportunamente o serviço.
Os resultados deste estudo demonstraram que, de forma geral, o laboratório apresentou indicadores compatíveis com as recomendações do Ministério da Saúde. Os IP, percentual de HSIL e insatisfatoriedade mantiveram-se dentro dos valores preconizados durante o período avaliado. Contudo, foram observados valores acima do limite recomendado para ASC entre exames alterados em alguns anos, com uma recuperação progressiva nos anos subsequentes.
Os IP do laboratório, apresentados na Tabela 2, valores dentro do recomendado, entre 3% e 10%, durante todo o quadriênio. Um estudo realizado no Estado da Bahia, durante o período de 2015 a 2019, os IP estavam abaixo de 3% (entre 1,85% e 2,36%), não alcançando o intervalo preconizado pelo Ministério da Saúde21. Em um município do Paraná22, os IP de 2012 e 2013 estavam muito abaixo do preconizado (1,92% e 0,46%), mas a partir de 2014 a 2018 se mantiveram na faixa de 4,77% a 6,44%.
Baixo IP apontaria um excesso de resultados falso-negativos, nos quais amostras verdadeiramente positivas não estariam sendo detectadas na triagem, o que exigiria uma melhor avaliação e intensificação das fases analítica e pré-analítica8.
Quanto ao percentual de HSIL (Tabela 2), todos os valores dos anos analisados estiveram dentro do esperado, acima de 0,4%. Resultados de SIL são o principal objetivo do rastreamento, representando lesões que podem efetivamente progredir para o câncer de colo uterino, sendo as HSIL (ou classificadas como NIC II e III) verdadeiramente precursoras; sua detecção é primordial para a prevenção do câncer cervical. Resultados abaixo do recomendado podem significar falso-negativos, indicando falhas diagnósticas no encaminhamento das pacientes para um tratamento adequado23,24.
No estudo em Anápolis-GO, indicou-se que o percentual de HSIL pela taxa anual foi inferior ao preconizado pelo Ministério da Saúde, com 0,13% entre 2013 e 201425. Tobias et al.26 relataram que, de um total de 20 laboratórios da Região de Minas Gerais, apenas três apresentaram essa taxa dentro do valor recomendado no ano de 2012.
Turkiewicz et al.27 verificaram em Foz do Iguaçu-PR, taxas de IP e percentual de HSIL abaixo do recomendado entre 2014 e 2018. Os autores relatam aumento nas taxas a partir de 2019 até 2021 citando a possibilidade de que isso possa ser proveniente de uma maior proporção de mulheres sintomáticas, em seguimento ou com necessidade de repetição de exames em razão de achados alterados, que continuaram procurando o serviço de saúde mais do que aquelas com resultados negativos.
O principal destaque nos resultados da Tabela 2 foi o valor para o “Percentual de ASC entre exames alterados”, que foi de 61,27% em 2019 e 60,89% em 2020, com base nos dados do Siscolo, indicando uma proporção de resultados ASC-US quantitativamente maior. O Ministério da Saúde preconiza uma faixa aceitável de 37,3% a 57,2%, não ultrapassando 60% quando o IP está dentro do recomendado para o uso dessa terminologia na quantidade total de laudos emitidos em relação ao número total de exames com alteração14.
As ASC são consideradas ambiguidades citológicas pela dificuldade interpretativa do citologista, representando um grupo de achados diagnósticos duvidosos, que não possuem características celulares condizentes com processos reativos de SIL. Essas alterações atípicas podem estar relacionadas à presença de reparo, inflamação ou problemas técnicos no preparo da amostra, tornando os achados insuficientes para um diagnóstico definitivo28,29.
Os laboratórios com valor de “ASC entre exames alterados” superior ao recomendado precisam reavaliar as etapas de coleta, a qualidade da recepção da amostra e o treinamento dos citologistas. Isso se deve ao fato de que as atipias são as principais terminologias (depois dos resultados insatisfatórios) responsáveis pela necessidade de repetição de exames, em razão do aumento de falso-positivos e falso-negativos em achados com alterações24.
Tais fatores refletem na maior possibilidade de perda de seguimento no rastreamento, contribuindo para maiores índices de resultados positivos em graus de lesões mais avançadas. Esses erros de encaminhamento acarretam condutas e tomadas de decisões equivocadas, gerando maiores gastos com repetições desnecessárias de exames e consequências para a saúde das usuárias30,31.
Apesar de os anos de 2019 e 2020 apresentarem valores, anteriormente citados, acima do recomendado, houve uma redução e adequação dos valores em 2021 e 2022, com 58,73% e 51,81%, respectivamente. Em estudos realizados em outras localidades, os laboratórios analisados apresentaram falhas nesse parâmetro. Em Caruaru-PE, identificaram-se em 2019 valores acima do preconizado para “ASC entre exames satisfatórios” (6,5%) e “ASC entre alterados” (68,9%). No ano de 2013, em Goiás, observou-se um alcance de 7% nos valores de “ASC entre os resultados satisfatórios” no Laboratório Clínico da PUC-GO32,33.
Quanto aos valores da razão ASC/SIL, estes se encontravam abaixo do valor máximo recomendado. Essa análise é uma importante ferramenta de controle, visto que o diagnóstico de ASC possui menor significado diagnóstico diferencial do que o de SIL. Laboratórios com valores elevados necessitam de melhorias no desempenho e reavaliação dos critérios de classificação34.
Ao analisar a Tabela 2 sobre o indicador anual de insatisfatoriedade, todos os meses apresentaram valores dentro do limite máximo recomendado (até 5%). Observaram-se maiores percentuais de insatisfatoriedade de outubro a dezembro em 2019 e um aumento crescente entre abril e junho nos anos de 2020 e 2022. Uma maior demanda de exames coletados durante os períodos de campanhas anuais, como “Outubro Rosa” e “Março Lilás”, intensifica o número de amostras a serem coletadas e analisadas até 30 dias após a coleta, podendo, assim, produzir um maior número de resultados insatisfatórios.
Resultado insatisfatório aplica-se a uma leitura de lâmina em que não se determina um laudo por problemas ocorridos nas fases pré-analítica (coleta, preparo, confecção, registro) e analítica (quantidade insuficiente de células para análise, presença de sangue ou outros contaminantes, fixação inadequada ou artefatos por dessecamento), que prejudicam a interpretação pelo analista, sendo necessária a repetição da coleta da amostra35. Segundo Mori et al.36, os erros pré-analíticos correspondem de 20% a 39%, sendo a etapa de coleta considerada uma das principais comprometedoras para obtenção de amostras satisfatórias para leitura.
A análise interobservacional foi aplicada para investigar falhas internas relacionadas ao processo analítico do laboratório. O laboratório apresentou um nível de concordância Kappa classificada como "boa", estando na faixa entre 0,73 e 0,77 com um nível de concordância (Po) médio de 82,68% e uma média de concordância de terminologias em ASC de 69,51% e SIL de 85,89%.
Estudos demonstram uma variabilidade na concordância interobservador Kappa em citologia ginecológica; no entanto, o presente trabalho apresentou resultados satisfatórios. Um estudo realizado na Universidade Federal do Paraná, de 2007 a 2015, obteve uma concordância Kappa dos revisores de 0,46, com a maior faixa de concordância para ASC-H e HSIL correspondendo a 68,6%37.
Pesquisa de Ázara et al.38, em 14 laboratórios de Goiânia entre 2007 e 2008, avaliou 10.053 casos, com um resultado médio de concordância Kappa de 0,81. Siddegowda et al.39 analisaram a variabilidade dos resultados, apresentando um valor final de Kappa de 0,61, no qual 200 lâminas foram preparadas e lidas por um primeiro e um segundo analistas.
Nos resultados da Tabela 3, destacou-se um menor desempenho de dois dos 15 analistas principais do laboratório. Os analistas 6 e 9 foram os que apresentaram os menores valores de concordância Kappa, classificados como de pobre a moderada, e cujos valores individuais dos parâmetros de qualidade divergiam dos valores próximos aos demais citologistas.
A concordância entre ASC e SIL entre analistas e revisores foi uma ferramenta importante para destacar discrepâncias nos resultados emitidos pelo laboratório. Os dados da Tabela 3 indicam que oito dos 15 citologistas apresentaram concordância moderada com os revisores em seus laudos de ASC, com resultados abaixo de 70%. Para SIL, cinco dos citologistas apresentaram níveis abaixo de 80%, incluindo os analistas 5, 6 e 9.
Apesar das limitações do método Kappa para o presente estudo, uma metodologia complementar utilizando cálculos estatísticos de MIQ, conforme disposto na Tabela 3, permitiu elucidar as falhas técnicas de cada citologista com base na média de seus indicadores individuais.
Na análise da Tabela 3, os citologistas 2, 3, 9 e 14 apresentaram um IP acima de 10% e valores ASC/Satisfatórios superiores a 4%, indicando que esses profissionais podem estar produzindo laudos com excesso de achados positivos para anormalidades, ultrapassando o limite da nomenclatura de ASC, e apresentando um valor de ASC/Alterados acima de 50%, próximo ao limite máximo. É evidente que esses analistas apresentam uma concordância de nível "bom" a "ótimo", o que indica a necessidade de uma análise mais aprofundada para compreender melhor sua influência no aumento do IP laboratorial.
Ao se analisar o índice Kappa, é necessário considerar suas limitações e variáveis, uma vez que seu cálculo simples possui natureza dicotômica, não sendo adequado para casos com múltiplos critérios diagnósticos40. Além disso, a ausência de métodos padronizados, como o uso de duplo-cego no processo analítico, pode introduzir viés, especialmente ao permitir que os citologistas revisem lâminas previamente avaliadas. Fatores como a falta de homogeneidade nas atividades laboratoriais, a rotatividade entre setores, o tempo de leitura por lâmina e o viés comportamental (um elemento subjetivo significativo) também podem impactar os resultados.
Este estudo apresenta algumas limitações que devem ser consideradas ao interpretar os resultados. Primeiramente, a redução na quantidade de exames realizados durante o ano de 2020, em decorrência da pandemia de covid-19, pode ter influenciado os achados, gerando uma maior proporção de alterações devido ao perfil diferenciado das pacientes que buscaram o serviço nesse período.
Por fim, os dados utilizados foram extraídos de registros laboratoriais e podem estar sujeitos a erros ou inconsistências na coleta e registro das informações. Apesar disso, as ferramentas e metodologias empregadas no estudo proporcionaram uma visão ampla sobre os indicadores de qualidade e desempenho do laboratório, contribuindo para a identificação de falhas e potencial melhoria dos processos.
Diante dos resultados deste estudo, é imprescindível que o laboratório mantenha o rigor técnico, buscando superar as falhas individuais dos profissionais, realizando treinamentos contínuos e observando aspectos além dos demonstrados neste trabalho. Recomenda-se a implementação de um treinamento de aprimoramento focado na diferenciação entre SIL, a fim de reduzir a emissão de resultados duvidosos (ASC).
Diante dos resultados deste estudo, é imprescindível que o laboratório mantenha o rigor técnico, buscando superar as falhas individuais dos profissionais por meio de treinamentos contínuos e da observação de aspectos além dos abordados neste trabalho.
A análise interobservador revelou boa concordância geral, mas também apontou discrepâncias pontuais entre alguns citologistas, evidenciando a necessidade de ações direcionadas ao treinamento e à padronização para assegurar a qualidade dos resultados emitidos. Nesse sentido, recomenda-se a implementação de um treinamento específico voltado ao aprimoramento dos citologistas, com ênfase na diferenciação entre SIL, visando à redução da emissão de resultados duvidosos, como ASC.
AGRADECIMENTOS
À Escola de Saúde Pública de Manaus, pela anuência concedida, e aos funcionários do Laboratório de Especialidades “Professor Sebastião Ferreira Marinho” que contribuíram direta ou indiretamente para a execução deste trabalho.
CONTRIBUIÇÕES
Carlos Henrique Lamego Guimarães Thomaz Branco no planejamento do estudo; na obtenção, análise e interpretação dos dados; e na redação. Patrícia Danielle Oliveira de Almeida, Rita de Cássia Alencar Reffert e Gleyce dos Santos Barbosa Jobim contribuíram na concepção e no planejamento do estudo; na obtenção, análise, interpretação dos dados; e na revisão crítica. Todos os autores aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Carlos Henrique Lamego Guimarães Thomaz Branco foi bolsista pelo Programa Institucional de Bolsas de Iniciação Científica (PIBIC) da UFAM (PIB-S/0017/2021), financiado pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Apoio financeiro da agência de fomento Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM).
REFERÊNCIAS
1. Santos JC. A importância da prevenção do câncer de colo do útero: uma breve revisão [monografia]. [Araçuaí]: Universidade Federal de Minas Gerais; 2010.
2. Ribeiro Filho MA, Quirino GS, Lima MAG, et al. Estratégias utilizadas para a prevenção do câncer de colo uterino na atenção primária em saúde: revisão da literatura. Pesq Ens Ciênc Exatas Nat. 2021;5(1):e1643. doi: https://doi.org/10.29215/pecen.v5i0.1643
3. Costa MCO, Melo CMS, Lima ES, et al. Fatores que provocam resultados falso-negativos nos exames de citologia oncótica: uma revisão integrativa. RSD. 2021;10(10):e361101019079. doi: https://doi.org/10.33448/rsd-v10i10.19079
4. Gullo CE, Dami ALT, Barbosa AP, et al. Results of a control quality strategy in cervical cytology. Einstein (São Paulo). 2012;10(1):86-91. doi: https://doi.org/10.1590/s1679-45082012000100018
5. Barros ALS, Lima DNO, Azevedo MD, et al., organizadores. Caderno de referência 1: citopatologia ginecológica [Internet]. Rio de Janeiro: Ministério da Saúde; 2012. [acesso 2023 fev 4]. v. 1. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/tecnico_citopatologia_caderno_referencia_1.pdf
6. Ministério da Saúde (BR). Portaria n° 3.388, de 30 de dezembro de 2013. Redefine a Qualificação Nacional em Citopatologia na prevenção do câncer do colo do útero (QualiCito) [Internet]. Diário Oficial da União, Brasília, DF. 31 dez 2013 [acesso 2023 fev 4]; Seção 1:42-5. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/gm/2013/prt3388_30_12_2013.html
7. Araujo Junior MLC, Santana DA, Almeida LB, et al. Quality in cytopathology: an analysis of the internal quality monitoring indicators of the Instituto Nacional de Câncer. J Bras Patol Med Lab. 2015;51(2):102-7. doi: https://www.doi.org/10.5935/1676-2444.20150018
8. Bortolon PC, Silva MAF, Corrêa FM, et al. Avaliação da qualidade dos laboratórios de citopatologia do colo do útero no brasil. Rev Bras Cancerol. 2012;58(3):435-44. doi: https://www.doi.org/10.32635/2176-9745.rbc.2012v58n3.600
9. Nobre JCAA, Lopes Neto D. Avaliação de indicadores de rastreamento do câncer do colo do útero no Amazonas, norte do Brasil, de 2001 a 2005. Rev Bras Cancerol. 2009;55(3): 1609. doi: https://www.doi.org/10.32635/2176-9745.rbc.2009v55n3.1609
10. Instituto Nacional de Câncer José Alencar Gomes da Silva [Internet]. Rio de Janeiro: INCA; 2022. Estatísticas de câncer, 2022 jun 23, atualizado em 2023 jul 18. [acesso 2023 fev 3]. Disponível em: https://www.gov.br/inca/pt-br/assuntos/cancer/numeros/
11. SISCOLO: Sistema de Informação do Câncer do Colo do Útero [Internet] Brasília (DF): DATASUS. [data desconhecida] – [acesso 2024 ago 25]. Disponível em: https://datasus.saude.gov.br/acesso-a-informacao/cancer-de-colo-de-utero-e-de-mama-siscolo-sismama/
12. SISCAN: Sistema de Informação do Câncer [Internet] Brasília (DF): DATASUS. [data desconhecida] – [acesso 2024 ago 25]. Disponível em: https://datasus.saude.gov.br/acesso-a-informacao/sistema-de-informacao-do-cancer-siscan-colo-do-utero-e-mama/
13. von Elm E, Altman DG, Egger M, et al. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. J Clin Epidemiol. 2008;61(4):344-9. doi: https://www.doi.org/10.1016/j.jclinepi.2007.11.008
14. Instituto Nacional de Câncer José Alencar Gomes da Silva. Manual de gestão da qualidade para laboratório de citopatologia [Internet]. 2. ed. rev. ampl. Rio de Janeiro: Inca; 2016. [acesso 2023 fev 2]. 160 p. Disponível em: https://www.inca.gov.br/publicacoes/manuais/manual-de-gestao-da-qualidade-para-laboratorio-de-citopatologia
15. Instituto Nacional de Câncer José Alencar Gomes da Silva. Planilha Kappa. In: Instituto Nacional de Câncer José Alencar Gomes da Silva. Manual de gestão da qualidade para laboratório de citopatologia [Internet]. 2. ed rev ampl. Rio de Janeiro: Inca; 2016. [acesso 2023 fev 2]. 160 p. Disponível em: https://www.inca.gov.br/publicacoes/manuais/manual-de-gestao-da-qualidade-para-laboratorio-de-citopatologia
16. TABNET [Internet]. Brasília (DF): DATASUS. c2008 – [acesso 2024 ago 28]. Disponível em: https://datasus.saude.gov.br/informacoes-de-saude-tabnet/
17. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59
18. Fundação Centro de Controle de Oncologia do Amazonas. Relatório ano de 2020 [Internet]. Amazonas: DPCC/FCECON; 2020. [acesso 2023 fev 2]. 78 p. Disponível em: http://www.fcecon.am.gov.br/wp-content/uploads/2021/06/Relatorio-Anual-DPCC-2020.-FINAL.-28.06.21.-PDF.pdf
19. Silva Santos MJ, Alves Ribeiro A. Estratégias utilizadas para melhorar a qualidade dos exames citopatológicos. Rev Bras Cancerol. 2020;66(1):e-05104. doi: https://www.doi.org/10.32635/2176-9745.rbc.2020v66n1.104
20. Ribeiro CM, Miranda Correa F, Migowski A. Short-term effects of the COVID-19 pandemic on cancer screening, diagnosis and treatment procedures in Brazil: A descriptive study, 2019-2020. Epidemiol Serv Saúde. 2022;31(1):e2021405. doi: https://www.doi.org/10.1590/S1679-49742022000100010
21. Santos BL, Costa ÉSBO, Moreira GD, et al. Análise de citopatologias cérvico-vaginal realizadas na Bahia entre 2015-2019: indicadores técnicos. RSD. 2021;10(12):e404101220609. doi: https://www.doi.org/10.33448/rsd-v10i12.20609
22. Magalhães JC, Morais LSF, Plewka J, et al. Avaliação dos indicadores de qualidade dos exames citopatológicos do colo do útero realizados em um município do Paraná, Brasil. J Bras Patol Med Lab. 2020;56. doi: https://www.doi.org/10.5935/1676-2444.20200041
23. Alrajjal A, Pansare V, Choudhury MSR, et al. Squamous intraepithelial lesions (SIL: LSIL, HSIL, ASCUS, ASC-H, LSIL-H) of uterine cervix and bethesda system. CytoJournal. 2021;18:16. doi: https://www.doi.org/10.25259/CYTOJOURNAL_24_2021
24. Cardoso Filho LI, Tavares SBN, Siqueira MLB, et al. Internal quality control indicators in cervical cytopathology of a university laboratory. Cytopathology. 2018;29(4):355-60. doi: https://www.doi.org/10.1111/cyt.12571
25. Lemos ARM, Silva MS, Segati KD. Lesão de alto grau e carcinoma escamoso: um estudo de prevalências em pacientes atendidas pelo Sistema Único de Saúde (SUS) na cidade de Anápolis, GO, Brasil. Rev Bras Anál Clín. 2017;49(2):1. doi: https://www.doi.org/10.21877/2448-3877.201600494
26. Tobias A, Amaral R, Diniz E, et al. Quality indicators of cervical cytopathology tests in the public service in Minas Gerais, Brazil. Rev Bras Ginecol Obstet. 2016;38(2):65-70. doi: https://www.doi.org/10.1055/s-0035-1571175
27. Turkiewicz M, Plewka J, Santos MA, et al., et al. Os impactos da qualidade nos exames citopatológicos do colo do útero, numa cidade de tríplice fronteira, na pandemia de COVID-19. RSD. 2022;11(6):e52411629428. doi: https://www.doi.org/10.33448/rsd-v11i6.29428
28. Lima CS, Barroso SPC, Boettger LEM, et al. Controle de qualidade da fase pós-analítica do setor de citologia de um laboratório privado de Macapá, Amapá, Brasil. ABMN [Internet]. 2018 [acesso 2023 fev 2];79(1):5. Disponível em: https://portaldeperiodicos.marinha.mil.br/index.php/abmn/issue/view/53
29. Machado EP, Alves MBM, Irie MMT, et al. Controle interno de qualidade em citopatologia: o dilema da subjetividade. Rev Bras Anál Clín [Internet]. 2018;50(3). Disponível em: doi: https://www.doi.org/10.21877/2448-3877.201800662
30. Araújo ES, Barbosa FM, Ázara CZS, et al. Avaliação do seguimento de mulheres com exames citopatológicos alterados de acordo com as condutas preconizadas pelo ministério da saúde do Brasil em Goiânia, Goiás. Rev Bras Cancerol. 2014;60(1):7-13. doi: https://www.doi.org/10.32635/2176-9745.RBC.2014v60n1.486
31. Cavalcante GHO, Reis GJ. Avaliação do seguimento de lesões precursoras de câncer do colo do útero – uma revisão bibliográfica. Pesq Ens Ciênc Exatas Nat. 2021;5:e1741. doi: https://doi.org/10.29215/pecen.v5i0.1741
32. Santos MA, Etlinger-Colonelli D. Análise dos indicadores de qualidade dos exames de citologia cervical do município de Caruaru/PE: uma estratégia para incentivar o monitoramento da qualidade. Recis. 2022;3(3):25-31. doi: https://www.doi.org/10.51909/recis.v3i3.237
33. Paula AC, Souza NG, Prado TC, et al. Indicadores do monitoramento interno da qualidade dos exames citopatológicos do Laboratório Clínico da Pontifícia Universidade Católica de Goiás (PUC-GO). Rev Bras Análises Clínic. 2017;49(2):1. doi: https://www.doi.org/10.21877/2448-3877.201700534
34. Tavares LCC, Coelho KMPA, França PHC, et al. Avaliação da utilidade da razão ASC/SIL como indicador de qualidade em citopatologia. Rev Bras Cancerol. 2015;61(1):31-6. doi: https://www.doi.org/10.32635/2176-9745.rbc.2015v61n1.758
35. Galvão EFB, Silva MJM, Esteves FAM, et al. Frequência de amostras insatisfatórias dos exames preventivos do câncer de colo uterino na rede pública de saúde, em município do agreste Pernambucano. Rev para med. 2015;29(2):51-6.
36. Mori MA, Ribeiro CNM. Falhas no diagnóstico do câncer de colo uterino. Rev Eletr Biociênc Biotecnol Saúde [Internet]. 2015 [acesso 2023 fev 2];2(11):37-50. Disponível em: https://interin.utp.br/index.php/GR1/article/view/1827/1561
37. Pergo LS, Maffini CF, Zanine RM, et al. Concordância interobservador no diagnóstico citológico de atipia escamosa de significado indeterminado favorecendo lesão de alto grau e de lesão intraepitelial escamosa de alto grau nas lesões do colo uterino. Rev Bras Cancerol. 2022;68(1):e-041338. doi: https://www.doi.org/10.32635/2176-9745.rbc.2022v68n1.1338
38. Ázara CZS, Manrique EJC, Souza NLA, et al. External quality control of cervical cytopathology: interlaboratory variability. Acta Cytol. 2013;57(6):585-90. doi: https://www.doi.org/10.1159/000353843
39. Siddegowda RB, DivyaRani M, Natarajan M, et al. Inter-Observer variation in reporting of pap smears. Natl J Lab Med. 2016;5(3):22-5. doi: https://www.doi.org/10.7860/NJLM/2016/20002:2135
40. Silva AF, Velo MMAC, Pereira AC. Importância da reprodutibilidade dos métodos para diagnóstico em odontologia. RFO-UPF. 2016;21(1):115-20. doi: https://www.doi.org/10.5335/rfo.v21i1.4433
Recebido em 16/10/2024
Aprovado em 8/1/2025
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
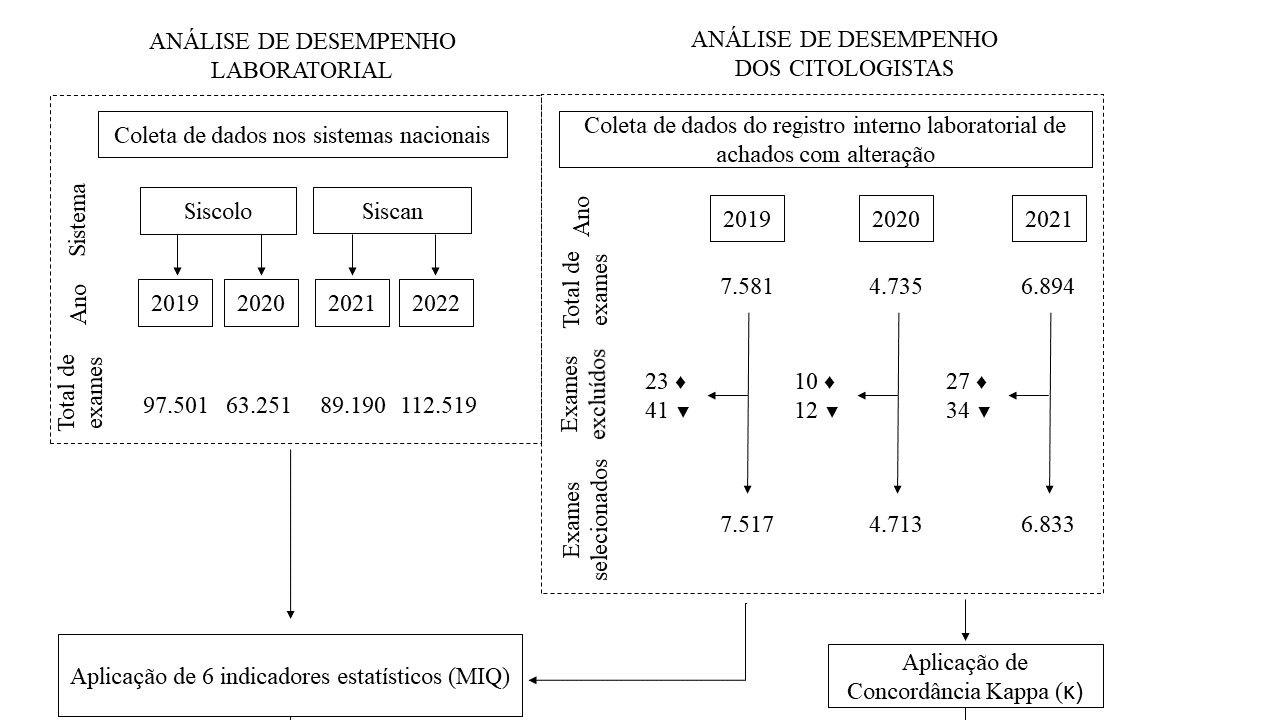
Figura 1. Fluxograma das etapas do estudo
Legendas: Siscolo: Sistema de Informação do Câncer do Colo do Útero; Siscan: Sistema de Informação do Câncer; MIQ: monitoramento interno da qualidade; ♦: lâminas que não possuíram desfecho clínico registrado no controle interno; ▼: ausentes de preenchimento no registro interno laboratorial.
Tabela 1. Exames citopatológicos cervicais realizados pelo laboratório municipal Prof. Sebastião Marinho (Manaus-AM) no triênio 2019 a 2022 a partir dos sistemas de informação
|
Ano |
Base de dados
|
Exames Satisfatórios |
Exames Insatisfatórios |
Exames NM e Achados benignos |
Exames com alteração |
Total de exames com alteração |
Total de exames |
||||||||
|
Escamosas |
|
Glandulares |
Carcinomas |
||||||||||||
|
LSIL |
HSIL |
HSIL Micro |
ASC |
|
AGC-SOE |
AGC-NEO |
|||||||||
|
2019 |
Siscolo |
n |
95.960 |
1.541 |
82.656 |
1.092 |
643 |
53 |
3.022 |
94 |
20 |
8 |
4.932 |
97.501 |
|
|
% |
98,42 |
1,58 |
84,77 |
1,12 |
0,66 |
0,05 |
3,10 |
0,10 |
0,02 |
0,01 |
5,06 |
100,00 |
|||
|
2020 |
Siscolo |
n |
62.372 |
879 |
53.939 |
751 |
452 |
30 |
2.024 |
62 |
11 |
4 |
3.324 |
63.251 |
|
|
% |
98,61 |
1,39 |
85,28 |
1,19 |
0,71 |
0,05 |
3,20 |
0,10 |
0,02 |
0,01 |
5,26 |
100,00 |
|||
|
2021 |
Siscan |
n |
87.585 |
1.573 |
83.942 |
1.011 |
585 |
35 |
2.543 |
126 |
17 |
13 |
4.330 |
89.190 |
|
|
% |
98,20 |
1,76 |
93,50 |
1,13 |
0,65 |
0,04 |
2,85 |
0,14 |
0,02 |
0,01 |
4,85 |
100,00 |
|||
|
2022 |
Siscan |
n |
110.129 |
2.226 |
106.526 |
1.154 |
632 |
46 |
2.147 |
132 |
24 |
14 |
4.144 |
112.519 |
|
|
% |
97,88 |
1,98 |
94,67 |
1,03 |
0,56 |
0,04 |
1,91 |
0,12 |
0,02 |
0,01 |
3,68 |
100,00 |
|||
Fonte: Elaboração dos autores com base nos dados DATASUS: Siscolo11 – 2019, 2020; Siscan12 – 2021, 2022.
Legendas: NM: negativo para malignidade; LSIL: lesão intraepitelial escamosa de baixo grau; HSIL: lesão intraepitelial escamosa de alto grau; HSIL micro: lesão intraepitelial de alto grau não podendo excluir microinvasão; ASC: células escamosas atípicas de significado indeterminado; AGC-SOE: células glandulares atípicas sem outras especificações (possivelmente não neoplásicas); AGC-NEO: células glandulares atípicas de significado indeterminado possivelmente neoplásicas (sem afastar lesão de alto grau); carcinomas: abrangem os achados de carcinoma epidermoide invasor, adenocarcinoma in situ, adenocarcinoma invasor e outras neoplasias.
Tabela 2. Avaliação dos indicadores de qualidade do laboratório prestador do serviço entre 2019 e 2022
|
N.º |
Parâmetros de MIQ |
VR |
Ano de 2019 |
Ano de 2020 |
Ano de 2021 |
Ano de 2022 |
|
Siscolo |
Siscolo |
Siscan |
Siscan |
|||
|
1) |
IP (%) |
3 a 10 |
5,14 |
5,33 |
4,94 |
3,76 |
|
2) |
ASC entre os exames satisfatórios (%) |
< 4 |
3,15 |
3,25 |
2,90 |
1,95 |
|
3) |
ASC entre os exames alterados (%) |
< 60 |
61,27 |
60,89 |
58,73 |
51,81 |
|
4) |
Razão ASC/SIL |
< 3 |
1,69 |
1,64 |
1,56 |
1,17 |
|
5) |
Exames compatíveis com HSIL (%) |
≥ 0,4 |
0,73 |
0,77 |
0,71 |
0,62 |
|
6) |
Média anual de exames insatisfatórios (%) |
< 5 |
1,77 |
1,47 |
1,70 |
1,97 |
Fonte: Elaboração dos autores com base nos dados DATASUS: Siscolo11 - 2019, 2020; Siscan12 - 2021, 2022; VR baseados no Manual de Gestão e Qualidade para Laboratórios de Citopatologia (QualiCito)14.
Legendas: ASC: células escamosas atípicas de significado indeterminado; IP: índice de positividade; VR: valores recomendados do indicador de qualidade; SIL: lesão intraepitelial escamosa; HSIL: lesão intraepitelial escamosa de alto grau.
Tabela 3. Análise do desempenho de citologistas por produtividade, concordância e indicadores de qualidade durante triênio de 2019 a 2021
|
Identificação do analista |
Turno |
Média de Produtividade trienal |
Concordância com revisores |
Média dos indicadores de qualidade no triênio por citologista |
||||||||
|
Concordância Kappa |
Média trienal de resultados (%) |
|||||||||||
|
2019 |
2020 |
2021 |
ASC |
SIL |
IP (%) |
ASC/Satisf |
ASC/ALT |
ASC/SIL |
%HSIL |
|||
|
Analista 1 |
V |
3337 |
0,81 |
0,74 |
0,85 |
66,75* |
84,29 |
3,92 |
1,35% |
34,38% |
0,90 |
0,87% |
|
Analista 2 |
M |
4853 |
0,81 |
0,86 |
0,67 |
78,33 |
92,04 |
10,51** |
5,83%** |
55,51% |
2,40 |
0,94% |
|
Analista 3 |
M/V |
4899 |
0,73 |
0,78 |
0,68 |
70,57 |
82,81 |
14,17** |
7,70%** |
54,16% |
3,09** |
1,22% |
|
Analista 4 |
V |
4685 |
0,75 |
0,64 |
0,77 |
62,96* |
86,23 |
4,37 |
2,18% |
53,00% |
3,77** |
0,21%* |
|
Analista 5 |
V |
4278 |
0,62 |
0,64 |
0,73 |
56,24* |
75,86* |
8,15 |
3,51% |
42,58% |
3,37** |
0,33%* |
|
Analista 6 |
M |
3926 |
0,37* |
0,41* |
0,48* |
35,24* |
73,57* |
4,77 |
3,18% |
66,91%** |
7,73** |
0,22%* |
|
Analista 7 |
M/V |
4479 |
0,9 |
0,91 |
0,90 |
84,22 |
93,66 |
14,36** |
4,75% |
33,13% |
1,42 |
1,56% |
|
Analista 8 |
V |
4615 |
0,78 |
0,81 |
0,80 |
74,36 |
90,76 |
9,46 |
4,23% |
45,08% |
1,90 |
0,91% |
|
Analista 9 |
V |
2811 |
0,5* |
0,62 |
0,51* |
51,23* |
73,28* |
14,98** |
8,22%** |
54,82% |
3,12** |
0,85% |
|
Analista 10 |
M |
2913 |
0,7 |
0,77 |
0,66 |
73,08 |
82,76 |
6,11 |
3,27% |
52,82% |
1,66 |
0,56% |
|
Analista 11 |
M |
4474 |
0,73 |
0,68 |
0,72 |
65,36* |
79,34* |
5,74 |
2,31% |
40,24% |
1,53 |
0,42% |
|
Analista 12 |
V |
3426 |
0,72 |
0,8 |
0,66 |
66,74* |
87,97 |
6,37 |
3,00% |
46,62% |
1,30 |
0,84% |
|
Analista 13 |
V |
2984 |
0,67 |
0,8 |
0,76 |
63,59* |
79,63* |
7,71 |
2,08% |
27,22% |
0,92 |
0,76% |
|
Analista 14 |
M |
4830 |
0,78 |
0,84 |
0,62 |
71,94 |
85,11 |
10,26** |
5,16%** |
50,54% |
2,27 |
0,55% |
|
Analista 15 |
M |
4038 |
0,85 |
0,89 |
0,90 |
82,48 |
91,34 |
6,45 |
3,28% |
50,58% |
1,72 |
0,63% |
|
Média laboratorial |
|
0,74 |
0,77 |
0,73 |
69,51% |
85,89% |
8,15% |
3,94% |
48,14% |
2,31 |
0,71% |
|
|
Valores Recomendados
|
κ > 0,6 Boa 0,4 < κ >0,6 Moderada |
|
|
3 - 10 |
< 4% |
< 60% |
< 3 |
≥ 0,4% |
||||
Fonte: Dados do Registro Interno Laboratorial.
Legendas: ASC: células escamosas atípicas de significado indeterminado; IP: índice de positividade; turno: matutino (M) e vespertino (V); VR: valores recomendados do indicador de qualidade; SIL: lesão intraepitelial escamosa; HSIL: lesão intraepitelial escamosa de alto grau. *valores abaixo da média laboratorial/valores recomendados estabelecidos; ** valores acima da média laboratorial/valores recomendados estabelecidos.
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.