REVISÃO DE LITERATURA
Preditores para Não Adesão e Não Persistência à Terapia Hormonal Adjuvante em Mulheres com Câncer de Mama: Revisão Sistemática da Literatura
Predictors for Non-Adherence and Non-Persistence to Adjuvant Hormone Therapy in Women with Breast Cancer: Literature Systematic Review
Predictores de la No Adherencia y la No Persistencia de la Terapia Hormonal Adyuvante en Mujeres con Cáncer de Mama: Revisión Sistemática de la Literatura
https://doi.org/10.32635/2176-9745.RBC.2025v71n4.5090
Fernanda Venâncio Soares de Sousa1; Anna Paula de Sá Borges2; Maria Ângela Ribeiro3
1Universidade Federal de Uberlândia (UFU), Faculdade de Medicina, Programa de Residência em Área Profissional da Saúde (PRAPS). Uberlândia (MG), Brasil. E-mail: fvenancio2002@gmail.com. Orcid iD: https://orcid.org/0000-0003-1934-1254
2Universidade de São Paulo (USP), Faculdade de Ciências Farmacêuticas de Ribeirão Preto. Ribeirão Preto (SP), Brasil. Universidade Estadual de Goiás (UEG), Instituto de Ciências da Saúde e Biológicas, Curso de Farmácia. Itumbiara (GO), Brasil. E-mail: anna.borges@ueg.br. Orcid iD: https://orcid.org/0000-0002-0668-1957
3Universidade Federal de Minas Gerais (UFMG), Faculdade de Farmácia, Programa de Pós-Graduação em Medicamentos e Assistência Farmacêutica. Belo Horizonte (MG), Brasil. UFU, Hospital de Clínicas, Unidade de Farmácia Clínica e Dispensação Farmacêutica, Ebserh. Uberlândia (MG), Brasil. E-mail: maria.ribeiro.9@ebserh.gov.br. Orcid iD: https://orcid.org/0000-0002-1522-4299
Endereço para correspondência: Anna Paula de Sá Borges. Rua Ronan Manoel Pereira Floriano Peixoto, 792, Apto. 101 – Segismundo Pereira. Uberlândia (MG), Brasil. CEP 38408-274. E-mail: anna.borges@ueg.br
RESUMO
Introdução: A terapia hormonal adjuvante em mulheres com câncer de mama receptor hormonal positivo reduz a recorrência da doença e a mortalidade. No entanto, muitos estudos sugerem que o tratamento para o câncer de mama com terapia endócrina é comprometido pela não adesão e não persistência. Objetivo: Identificar os preditores de não adesão e/ou não persistência que prejudicam os bons resultados do tratamento com terapia endócrina em pacientes com câncer de mama. Método: Revisão sistemática da literatura realizada por meio do MEDLINE/PubMed, Embase e Scopus. Os estudos elegíveis para esta revisão foram selecionados por meio do aplicativo Rayyan QCRI, analisados e classificados segundo a hierarquia dos níveis de evidência Grading of Recommendations Assessment, Development and Evaluations (GRADE) e a confiabilidade entre os examinadores (coeficiente Kappa). O trabalho foi protocolado no International Prospective Register of Systematic Reviews (PROSPERO) e publicado sob n.º CRD42021212788. Resultados: Foram identificados preditores em 21 artigos, com metodologia quantitativa. Esses preditores foram agrupados em sete categorias da seguinte forma: reações adversas, tipo de medicamento, tempo de tratamento, fatores psicológicos, localização geográfica, polifarmácia/comorbidades, aspectos relacionados ao acompanhamento da equipe multiprofissional, considerados responsáveis por não adesão e/ou não persistência à terapia endócrina. Conclusão: Os preditores reações adversas, o uso do tamoxifeno e o longo tempo de tratamento estiveram associados à não adesão e à não persistência à terapia endócrina do câncer de mama.
Palavras-chave: Neoplasias da Mama/terapia; Cooperação e Adesão ao Tratamento; Tamoxifeno; Inibidores de Aromatase.
ABSTRACT
Introduction: Adjuvant hormone therapy reduces disease recurrence and mortality in women with hormone receptor-positive breast cancer. However, many studies suggest that breast cancer treatment with endocrine therapy is compromised by non-adherence and non-persistence. Objective: To identify the predictors of non-adherence and/or non-persistence that impair the good results of treatment with endocrine therapy in breast cancer patients. Method: Systematic Literature Review performed using MEDLINE/PubMed, Embase, and Scopus. Eligible studies for this review were selected using the Rayyan QCRI application, analyzed, and classified according to the Grading of Recommendations Assessment, Development and Evaluations (GRADE) hierarchy of levels of evidence, and inter-rater reliability (Kappa coefficient) was calculated. The study was filed in the International Prospective Register of Systematic Reviews (PROSPERO) and published under number CRD42021212788. Results: Predictors were identified in 21 articles with quantitative methodology. These predictors were grouped into seven categories as follows: adverse reactions, types of medications, duration of treatment, psychological factors, geographic location, polypharmacy/comorbidities and aspects related to monitoring by the multidisciplinary team, considered responsible for non-adherence and/or non-persistence with endocrine therapy. Conclusion: The predictors of adverse reactions, tamoxifen use, and long treatment duration were associated with non-adherence and non-persistence to endocrine therapy for breast cancer.
Key words: Breast Neoplasms/therapy; Treatment Adherence and Compliance; Tamoxifen; Aromatase Inhibitors.
RESUMEN
Introducción: La terapia hormonal adyuvante reduce la recurrencia de la enfermedad y la mortalidad en mujeres con cáncer de mama con receptores hormonales positivos. Sin embargo, muchos estudios sugieren que el tratamiento del cáncer de mama con terapia endocrina se ve comprometido por no adherencia y no persistencia. Objetivo: Identificar los predictores de baja adherencia y/o no persistencia que perjudican los buenos resultados del tratamiento con endocrinoterapia en pacientes con cáncer de mama. Método: Revisión Sistemática de la Literatura realizada en MEDLINE/PubMed, Embase y Scopus. Los estudios elegibles para esta revisión se seleccionaron mediante la aplicación Rayyan QCRI, se analizaron y clasificaron de acuerdo con la jerarquía de niveles de evidencia Grading of Recommendations Assessment, Development and Evaluations (GRADE), y se calculó la confiabilidad entre evaluadores (coeficiente Kappa). La obra fue archivada en el Registro Prospectivo Internacional de Revisiones Sistemáticas (PROSPERO) y publicada con el número CRD42021212788. Resultados: Se identificaron predictores en 21 artículos con metodología cuantitativa. Estos predictores se agruparon en siete categorías de la siguiente manera: reacciones adversas, tipos de medicamentos, duración del tratamiento, factores psicológicos, ubicación geográfica, polifarmacia/comorbilidades y aspectos relacionados con el seguimiento por el equipo multidisciplinario, considerados responsables de la no adherencia y/o no persistencia a la terapia endocrina. Conclusión: Los predictores de reacciones adversas, el uso de tamoxifeno y la duración prolongada del tratamiento se asociaron con la falta de adherencia y la falta de persistencia a la terapia hormonal para el cáncer de mama.
Palabras clave: Neoplasias de la Mama/terapia; Cumplimiento y Adherencia al Tratamiento; Tamoxifeno; Inhibidores de la Aromatasa.
INTRODUÇÃO
O câncer de mama é a neoplasia com maior incidência e mortalidade na população do sexo feminino no mundo1,2. No Brasil, estima-se que, para cada ano do triênio 2023-2025, ocorram 73.610 casos novos, uma taxa de incidência de 41,89 casos por 100 mil mulheres3. Vale mencionar que aproximadamente três-quartos dos cânceres de mama são positivos para receptores hormonais e são tratáveis com terapia endócrina4.
A terapia endócrina do câncer de mama é um tratamento que suprime a produção hormonal ou que interfere na sinalização do receptor de hormônios para prevenir o crescimento do tumor, e pode ser utilizada por até dez anos após o diagnóstico. Os tratamentos hormonais endócrinos adjuvantes mais comuns para mulheres com câncer de mama receptor hormonal positivo compreendem o tamoxifeno e os inibidores da aromatase (IA)5. O tamoxifeno tem ação de bloquear a sinalização por meio do receptor de estrogênio. Por outro lado, os inibidores de aromatase bloqueiam a síntese de estrogênio, sendo os medicamentos de uso comum o anastrozol, exemestano e letrozol de terceira geração6.
A terapia endócrina aumenta a sobrevida global das pacientes, e está associada à redução do risco de recorrência do câncer de mama e da mortalidade5,7. Em adição, por ser administrada por via oral, facilita o tratamento, uma vez que essa via não é invasiva, não requer técnicas estéreis de administração e nem a presença do profissional de saúde. Por outro lado, em virtude de o tratamento ficar condicionado apenas à paciente, há uma grande preocupação com a não adesão e a não persistência ao tratamento8. Vale mencionar que a não adesão ao tratamento ocorre quando um paciente não toma o medicamento conforme prescrito durante o período de tratamento, enquanto a não persistência ocorre quando um paciente interrompe o tratamento continuamente por um período prolongado de tempo9.
De acordo com Teixeira et al.8, existem aspectos relacionados ao paciente e à terapia que podem interferir na não adesão e não persistência ao tratamento oral do câncer de mama. Entre os aspectos relacionados ao paciente, citam-se idade, debilidades cognitivas, grau de escolaridade, relação com o profissional de saúde, complexidade do tratamento, esquecimento, dificuldades de locomoção, fatores emocionais como depressão e ansiedade, falta de informação sobre a doença e o horário de uso do medicamento. Quanto aos aspectos referentes ao medicamento, podem ser citadas as reações adversas, as interações medicamentosas, as interações com alimentos, a superdosagem, a variação na absorção do medicamento e a polifarmácia.
As taxas de não adesão e a não persistência à terapia endócrina adjuvante apresentam variações entre os estudos de 16,0% a 50,5%10-14. Yussof et al.11 mostraram que a adesão à terapia endócrina adjuvante reduz do primeiro ao quinto ano de tratamento, e, no quinto ano, em média, um terço dos pacientes não adere ao tratamento. Pistilli et al.12 e Collin et al.13 associaram a não adesão e a não persistência à terapia endócrina adjuvante a uma maior recorrência e mortalidade da doença. Vale mencionar que esses achados apresentam relevância social, clínica e econômica, uma vez que aumentam a recidiva da doença, a mortalidade das mulheres e onera o sistema de saúde.
Portanto, no intuito de orientar futuras pesquisas, políticas em saúde e serviços clínicos, o objetivo desta revisão é identificar os preditores de não adesão e/ou não persistência que prejudicam os bons resultados do tratamento com terapia endócrina em pacientes com câncer de mama.
MÉTODO
Revisão sistemática previamente protocolada no International Prospective Register of Systematic Reviews (PROSPERO15), publicada sob n.º CRD42021212788 e elaborada de acordo com a estratégia Prefered Reporting Items for Systematic Reviews and MetaAnalysis (PRISMA)16 de 2017 a 2022.
Para a condução desta revisão sistemática, oito etapas foram seguidas: 1 –definição da pergunta de pesquisa, com a população e a intervenção desejada detalhada; 2 – identificação das bases de dados, dos descritores e das palavras-chave; 3 – elaboração das estratégias de busca para cada medicamento correspondente à terapia endócrina (tamoxifeno, anastrozol, letrozol e exemestano); 4 – estabelecimento de critérios de inclusão e exclusão; 5 – busca nas bases de dados; 6 – comparação das buscas dos examinadores e definição da seleção inicial dos estudos; 7 – aplicação dos critérios de inclusão e justificativa das exclusões de todos os estudos excluídos da revisão; 8 – elaboração do texto do artigo sintetizando as informações disponibilizadas pelos artigos incluídos na revisão, e apresentação da conclusão, que informa as evidências relacionadas ao objetivo da pesquisa.
A questão de pesquisa foi definida por meio da estratégia patient-intervention-comparison-outcomes-studies (PICOS) com os seguintes elementos: o acrônimo P foi referente à população (mulheres em uso de terapia hormonal para o câncer de mama); o I foi referente à intervenção (avaliação da adesão e da persistência durante a terapia endócrina); o C relaciona-se à comparação (avaliação da adesão entre diferentes características clínicas e sociais dessas pacientes); O (outcome = resultado): identificação de preditores de não adesão e não persistência. S (study): estudos de ensaio clínico randomizado, ensaio clínico sem randomização, estudo de coorte, estudo coorte retrospectivo, estudo transversal, estudo de coorte prospectivo, estudo observacional e estudo de caso-controle.
Dessa forma, a seguinte questão de pesquisa foi estruturada: Quais são os preditores de não adesão e/ou não persistência à terapia endócrina disponíveis na literatura? Foram definidas as seguintes bases como fonte de dados: MEDLINE/PubMed, Embase e Scopus.
A busca ocorreu com a utilização dos parâmetros descritos nos critérios de elegibilidade, nas bases anteriormente citadas, variando descritores Mesh/DeCs e operadores boleanos com o auxílio de três estratégias de pesquisa conforme descritos a seguir: estratégia de pesquisa 1: “breast neoplasms” AND “Medication Adherence” AND “Endocrine Therapy” OR Tamoxifen. Estratégia de pesquisa 2: “breast neoplasms” AND “Medication Adherence” AND “Endodrine Therapy” OR Anastrozole. Estratégia de pesquisa 3: “breast neoplasms” AND “Medication Adherence” AND “Endodrine Therapy” AND “medication therapy management” OR “Comprenhesive Medication Management” OR tamoxifen OR anastrozole. Todas as estratégias de busca foram aplicadas em todas as bases de dados.
Para a seleção dos artigos, foram incluídos estudos quantitativos no período de 2017 a 2022 que recrutaram mulheres com idade igual ou maior a 18 anos, com prescrição de terapia endócrina para tratamento de câncer de mama, que tratavam sobre adesão ou persistência ao tratamento. Foram excluídos artigos que avaliaram a terapia endócrina como prevenção do câncer de mama, estudos direcionados para triagem ou diagnóstico, ou seja, que não tinha relação com o objetivo da pesquisa, anais de congresso, apenas resumos, revisões, artigos com versão texto completo indisponível e projetos.
Todos os artigos encontrados na busca inicial foram analisados por dois investigadores, de forma independente, treinados para avaliar títulos e resumos, por meio do aplicativo Rayyan Qatar Computing Research Institute (Rayyan QCRI)17 entre 4/8/2022 e 3/9/2022.
O Rayyan QCRI auxilia autores de revisões sistemáticas a realizarem seu trabalho de maneira rápida e fácil, permitindo a exportação dos estudos de uma base de dados determinada para o programa e a exposição de títulos e resumos, com o cegamento do pesquisador auxiliar, o que garante fidedignidade na seleção das informações, acurácia e precisão metodológica17.
Os estudos que apresentaram divergência foram encaminhados a um terceiro pesquisador, responsável por tomar a decisão de inclusão ou exclusão. Em seguida, realizou-se análise crítica dos artigos na íntegra.
A coleta de dados foi realizada em formulário eletrônico elaborado para esse fim, contendo as seguintes variáveis: autores, ano de publicação, país de origem, desenho do estudo, amostra e qualidade da evidência. Os estudos foram analisados e classificados segundo a hierarquia dos níveis de evidência Grading of Recommendations Assessment, Development and Evaluations (GRADE)18: 1 – Evidência alta: ensaios clínicos bem delineados, com amostra representativa. Há forte confiança de que o verdadeiro efeito esteja próximo daquele estimado. 2 – Evidência moderada: estudos observacionais bem delineados, com achados consistentes. Há confiança moderada no efeito estimado. 3 – Evidência baixa: ensaios clínicos com limitações moderadas. A confiança no efeito é limitada18.
A confiabilidade entre os examinadores foi mensurada com a função kappa19. Os cálculos resultaram em um valor de Kappa de 0,8 cujo resultado é considerado excelente.
RESULTADOS
Ao todo, foram encontrados 451 artigos nas bases de dados selecionadas, sendo 216 removidos na fase de identificação da seleção. Na fase de triagem, 214 não atenderam aos critérios de inclusão, resultando em uma amostra com 21 artigos (Figura 1).
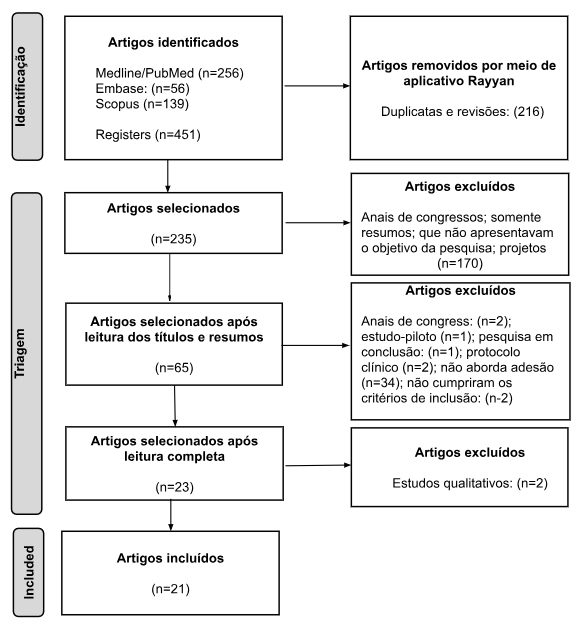
Figura 1. Fluxograma com base em estratégia de base de estudos, para a seleção dos artigos, de acordo com o modelo PRISMA 2020
Fonte: Adaptado de PRISMA 202016.
Dos 21 estudos selecionados, três (14,3%) apresentaram alta qualidade de evidência; oito (38,1%), moderada; e dez (47,6%), baixa. No Quadro 120-40, estão dispostos os artigos selecionados, enfatizando os autores, método utilizado, o número da amostra, o país de origem e o nível de evidência científica.
Quadro 1. Características dos estudos incluídos na revisão sistemática
|
Autores
|
Desenho |
N |
País |
Qualidade da evidência |
|
Ensaio clínico randomizado |
40 |
Espanha |
Alta |
|
|
Berkowitz et al.21 |
Estudo de coorte |
2.353 |
EUA |
Moderada |
|
Sheppard et al.22 |
Estudo prospectivo |
570 |
EUA |
Moderada |
|
Helland et al.23 |
Estudo prospectivo |
220 |
Noruega |
Moderada |
|
Hagen et al.24 |
Estudo prospectivo |
138 |
Noruega |
Moderada |
|
Bhave et al.25 |
Ensaio clínico |
49 |
EUA |
Alta |
|
Smith et al.26 |
Estudo de coorte prospectivo |
321 |
EUA |
Moderada |
|
Wagner et al.27 |
Ensaio clínico randomizado |
686 |
EUA |
Alta |
|
Hwang et al.28 |
Estudo retrospectivo |
338 |
EUA |
Baixa |
|
Cavazza et al.29 |
Estudo retrospectivo |
40.455 |
Itália |
Baixa |
|
Xu et al.30 |
Estudo transversal |
760 |
China |
Baixa |
|
Haskins et al.31 |
Estudo de coorte |
21.894 |
EUA |
Moderada |
|
Salgado et al.32 |
Estudo transversal |
279 |
EUA |
Baixa |
|
Sutton et al.33 |
Estudo de coorte |
592 |
EUA |
Moderada |
|
Lee et al.34 |
Estudo de coorte retrospectivo |
3.580 |
EUA |
Baixa |
|
Ternoven et al.35 |
Estudo de coorte retrospectivo |
2.656 |
Austrália |
Baixa |
|
Heiney et al.36 |
Estudo de coorte retrospectivo |
1.532 |
EUA |
Baixa |
|
Farias et al.37 |
Estudo de coorte retrospectivo |
1.240 |
EUA |
Baixa |
|
Camacho et al.38 |
Estudo observacional |
18.054 |
EUA |
Baixa |
|
Calip et al.39 |
Estudo de coorte retrospectivo |
40.009 |
EUA |
Baixa |
|
Lopes et al.40 |
Estudo de caso-controle |
1.531 |
Austrália |
Moderada |
No Quadro 220-40, é possível observar, entre os estudos analisados, quais foram os métodos de avaliação de adesão e os preditores de não adesão e não persistência à terapia medicamentosa.
Para avaliar as causas de não adesão e não persistência, dez (47,61%)28,29,31,34-40 estudos apresentaram como principal método a quantificação de suprimento diário, taxa de posse e dispensação, e nove (42,85%), ferramentas de autorrelato20-22,26,27,32,33. Outros dois estudos23,25 utilizaram parâmetros laboratoriais e ambulatoriais, sendo a ferramenta de um dos estudos o doseamento sorológico23, e do outro, a avaliação ambulatorial de parâmetro do sono25.
Quadro 2. Características dos estudos quanto aos métodos utilizados para identificar preditores de não adesão e não persistência
|
Autores
|
Métodos de avaliação da adesão |
Preditores de não adesão e não persistência |
|
Conejo et al.20 |
Questionários autorrelatados sobre o estado mental e seu perfil de estado de humor (POMS), avaliação de fadiga (Quickpiper) e qualidade de vida (EORTC QLQ-C30) |
Reação adversa |
|
Berkowitz et al.21 |
A ferramenta Survey Monkey com 33 perguntas objetivas e 13 perguntas com comentário em aberto |
Reação adversa |
|
Sheppard et al.22 |
Avaliação funcional dos sintomas endócrinos da terapia do câncer, questionários de crenças sobre medicina (BMQ) e escala de religiosidade de Lukwago |
Reação adversa |
|
Helland et al.23 |
Amostra de soro, questionários mapeando efeitos colaterais, avaliação funcional da terapia do câncer - sintomas endócrinos (FACT-ES) |
Reação adversa |
|
Hagen et al.24 |
Escala Morisky de adesão à medicação (MMAS-8), inventário subjetivo de reclamações de saúde (SHC) e questionário de qualidade de informação do paciente (QPI) |
Reação adversa |
|
Bhave et al.25 |
Medida realizada pela actigrafia |
Reação adversa |
|
Smith et al.26 |
Resultado relatado pelo paciente (PROMIS), subescala endócrina da avaliação funcional da terapia do câncer – medida de sintoma endócrino (FACT-ES); e a escala medical outcomes study sexual problems (MOS-SP) |
Reação adversa |
|
Wagner et al.27 |
Avaliação funcional da terapia do câncer – sintomas endócrinos (FACT-ES), sintomas relacionados ao tratamento, trial outcome index (TOI) |
Reação adversa |
|
Hwang et al.28 |
Suprimento diário (PDC) em seis meses |
Tipo de medicamento |
|
Cavazza et al.29 |
Proporção de dias cobertos (PCD) em 365 dias |
Tempo de tratamento |
|
Xu et al.30 |
Escala de Morisky de adesão à medicação (MMAS); algum desconforto com esse medicamento? |
Tipo de medicamento |
|
Haskins et al.31 |
“Proporção de dias cobertos” (PDC = dias cobertos por prescrições e terapia endócrina/dias de acompanhamento) |
Tempo de tratamento |
|
Salgado et al.32 |
Subescala do questionário de crenças sobre medicamentos (BMQ), avaliação de escala de preocupações do sobrevivente (ASC), escala de depressão do questionário (PHQ-8) |
Fatores psicológicos |
|
Sutton et al.33 |
Crença sobre medicamentos (BMQ), avaliação funcional do câncer subescala de terapia endócrina (FACT-ES), escala de autoeficácia de comunicação e atitude para câncer (CASE-câncer) e de satisfação do paciente |
Fatores psicológicos |
|
Lee et al.34 |
Cálculo de taxa de posse de medicamento (MPR) |
Tipo de medicamento |
|
Ternoven et al.35 |
Período da dispensação. A não adesão esteve relacionada à ausência de dispensação superior a 180 dias |
Tempo de tratamento |
|
Heiney et al.36 |
Análise das variáveis de raça e localização geográfica por autorrelato. A adesão foi calculada utilizando a taxa de posse de medicamentos (MPR) |
Localização geográfica |
|
Farias et al.37 |
Adesão foi estratifica pela taxa de posse do medicamento (MPR) |
Localização geográfica |
|
Camacho et al.38 |
A adesão à terapia endócrina por raça e região geográfica foi avaliada pelo índice de posse de medicamentos (MPR) |
Localização geográfica |
|
Calip et al.39 |
Os índices de posse de medicamentos (MPR) foram estimados para intervalos subsequentes de 12 meses. Associações entre polifarmácia e adesão na terapia endócrina adjuvante |
Polifarmácia/ comorbidades |
|
Lopes et al.40 |
Períodos da dispensação eram considerados baixa adesão ausência de dispensação superior a 180 dias |
Acompanhamento equipe multiprofissional |
Para a identificação do suprimento diário, taxa de posse de medicamentos e dispensação, as principais fontes de dados utilizadas foram número de prescrições e fornecimento total de medicamentos por período de terapia. Entre os estudos de autorrelato, os principais instrumentos utilizados foram a subscala endócrina da avaliação funcional da terapia do câncer (FACTES), presente em quatro (44,44%)23,26,27,33, o questionário de crenças sobre medicina (BMQ) em três (33,3%)22,32,33 e em dois (22,2%) o Morisky de 8 itens, escala de adesão à medicação (MMAS-8)24,30. Vale destacar que oito (38,1%)20,22-24,26,27,32,33 dos 21 artigos utilizaram mais de uma ferramenta para identificar as causas de não adesão e não persistência.
No que diz respeito aos principais fatores relacionados à não adesão e não persistência à terapia medicamentosa, estes foram agrupados em sete categorias: 1 – reações adversas (n=8), 2 – tipo de medicamento (n=3), 3 – tempo de tratamento (n=3), 4 – fatores psicológicos (n=2), 5 – localização geográfica (n=3), 6 – polifarmácia/comorbidades (n=1) e 7 – aspectos relacionados ao acompanhamento pela equipe multiprofissional (n=1) (Quadro 2).
Dos estudos selecionados para a presente revisão, oito (38,1%) (Quadro 2) abordaram as reações adversas como uma das principais causas de não adesão e não persistência à terapia endócrina. Vale destacar esses estudos trabalharam com diversos métodos de análises das reações adversas e com focos de investigação.
Xu et al.30 identificaram que 30,3% das mulheres em uso da terapia endócrina interromperam o tratamento por conta da presença de reações adversas. De acordo com Hagen et al.24, a estimativa de descontinuação da terapia endócrina em 60 meses foi de 38,0%, e destacaram o sobrepeso ou obesidade como reações adversas significativamente dependentes do tempo de terapia endócrina, e um fator preditivo para sua interrupção.
De acordo com o Berkowitz et al.21, as reações adversas mais prevalentes à terapia endócrina tanto em mulheres com câncer em estágio inicial quanto em metastático (74,6% vs. 77,7%) foram as musculoesqueléticas. Os autores ainda relatam que o uso da terapia endócrina oral esteve associado ao agravamento de sintomas endócrinos, fadiga e distúrbios do sono, o que resultou em descontinuação da terapia.
Sheppard et al.22 identificaram os sintomas gastrointestinais, ginecológicos neuropsicológicos, vasomotores e ósseos como os principais preditores de não adesão à terapia endócrina. Além disso, os fatores psicossociais, como apoio tangível, crenças de necessidade de medicamentos, preocupações com medicamentos e religiosidade também impulsionavam esse comportamento. Ao todo, 35,0% das mulheres relataram pelo menos um comportamento de não adesão, sendo o mais comum o esquecimento de tomar o medicamento (26,4%). As mulheres que apresentavam escores mais elevados de sintomas gerais estavam menos propensas à adesão.
Para Smith et al.26, as reações adversas mais frequentes nos pacientes no período 60 meses foram: distúrbios do sono (54,0%), sintomas endócrinos (53,0%), problemas sexuais (48,0%) e fadiga (46,0%). A probabilidade cumulativa de descontinuação foi de 23,0% em 48 meses. O tratamento com inibidor de aromatase foi associado à maior probabilidade de descontinuação do que o tamoxifeno. Os sintomas endócrinos emergentes do tratamento e os distúrbios do sono estão associados à descontinuação da terapia endócrina.
Conejo et al.20 analisaram as principais reações adversas relacionadas ao uso dos inibidores de aromatase e constataram a presença de dores articulares, na cervical, no ombro, na lombar, nas mãos e punhos, sendo as dores no ombro e na cervical presentes em mais de 80% dos pacientes. Para os autores, a toxicidade musculoesquelética pode ser uma das principais causas para a não adesão e a não persistência em razão da presença de dor.
Bhave et al.25 observaram que a terapia com inibidores de aromatase esteve intimamente relacionada à fadiga causando mudanças nas funções diurnas dos pacientes. Em outro estudo, Wagner et al.27 identificaram que as principais reações adversas ao uso de inibidores de aromatase anastrozol e exemestano foram respectivamente: dores nas articulações (36,1% e 32,5%), ondas de calor (29,9% e 29,1%), diminuição da libido (23,7% e 24,07%), fadiga (15,2% e 24,0%), suor noturno (17,7% e 17,2%). Foi possível verificar que a dor articular é predominante nessa classe de medicamento, e que 36,2% pacientes descontinuaram o tratamento antes de completar cinco anos, e apresentaram como justificativa a presença das reações adversas.
Em adição, o estudo de Helland et al.23 buscou elucidar possíveis associações entre reações adversas, concentrações metabólicas do tamoxifeno e a adesão. As principais reações adversas encontradas foram ondas de calor (87,0%) das mulheres no período de um ano, e 40,0% apresentaram essa reação grave em um período compreendido de três anos, dores nas articulações (30,2%), redução da libido (26,1%) e secura vaginal (18,5%). A taxa de descontinuação do tratamento obtida pelo banco de dados de prescrição norueguês (NorPD) foi de 17,9%, e o monitoramento das concentrações metabólicas do tamoxifeno demonstraram taxa de semelhante. Os autores concluíram que as náuseas, secura vaginal e o estado virgem de quimioterapia foram fatores de risco significativos para a descontinuação do tamoxifeno.
O tempo de tratamento da quimioterapia também foi um fator que esteve associado à adesão e à continuidade à terapia endócrina do câncer de mama. Xu et al.30 apontaram o tempo de tratamento como determinante para a persistência. O estudo demonstrou uma taxa de não persistência de 13,4% e, no quinto ano, 22,6% das mulheres descontinuaram o tratamento. Quanto à adesão, a média dos cinco anos foi de 7,4% das mulheres com baixa adesão ao tratamento, 42% com média e 50,7% elevada.
Ternoven et al.35 demostraram que 45,8% das mulheres descontinuaram a terapia endócrina em cinco anos; o tempo médio do abandono foi em torno de 2,6 anos. A probabilidade de descontinuação em um ano foi de 11,3%; após dois anos, 19,2%; aumentando para 47,9% após cinco anos. As mulheres passíveis de descontinuar eram mais jovens e normalmente estavam em tratamento com o tamoxifeno (46,1 vs. 40,0). Vale mencionar que 45,8% das mulheres retornaram ao tratamento em um período de 182 dias.
Outro fator de não persistência e não adesão à quimioterapia esteve associado aos fatores psicológicos relacionados ao diagnóstico de saúde mental, que poderia ser desde depressão ou algum transtorno diagnosticado, e a crença31-33. Cavazza et al.29 estudaram a possibilidade de as comorbidades influenciarem na adesão. Mulheres diagnosticadas com depressão apresentaram efeito negativo no tocante à adesão ao final de cinco anos (OR: 0,66; IC 95% 0,58-0,74) e dois anos (OR: 0,86; 95% CI 0,78-0,95).
Haskins et al.31 realizaram um estudo de coorte para identificar participantes com doenças mentais preexistentes ao diagnóstico de câncer de mama. Do total de indivíduos selecionados, 24,9% apresentaram alguma doença mental, e um quinto destes nunca iniciaram a terapia endócrina. Tanto o início da terapia endócrina quanto a continuidade da terapia foram menores em indivíduos diagnosticados com alguma doença mental. Os pacientes com alguma doença mental, depressão unipolar, depressão bipolar, demência, delírio e psicótico não esquizofrênico apresentaram menor probabilidade de iniciar o tratamento. A descontinuação foi mais comum em pacientes com “alguma doença mental”, ansiedade, psicótico não esquizofrênico, uso de drogas ilícitas e transtornos por uso de álcool.
Salgado et al.32 investigaram a questão da crença relacionada às características sociodemográficas e clínicas em mulheres em uso de inibidores de aromatase. Dos indivíduos investigados, 30,0% relataram depressão leve e 69,2% apresentaram reações adversas com a classe do medicamento. Mulheres acima de 70 anos apresentaram menos medo de recorrência do câncer, menor preocupação com a saúde e tendência para uma menor necessidade no que diz respeito às crenças. As crenças sobre medicamentos resultaram na perspectiva de “necessidade e preocupação”. As crenças de necessidade maior foram associadas ao aumento no número de medicamentos prescritos. Acerca das crenças de preocupação, estas foram mais elevadas em mulheres com depressão 'leve' e 'moderada a grave', com presença de reação adversa e naquelas que interromperam a terapia com outro medicamento. Em adição, foi detectado que a crença de preocupação estava relacionada com a condição da doença e com a preocupação com a saúde.
Por outro lado, o estudo de Sutton et al.33, que também trata sobre o tema de crença, revelou que as mulheres estavam relativamente satisfeitas com seus cuidados. A idade e a raça não foram preditores de preocupação das mulheres. As crenças de maior preocupação se referiram à renda familiar. As mulheres pertencentes às famílias que possuíam uma renda superior a US$ 100.000 (B: 0,08; IC 95%: 0,06 a 0,10, p< 0,001) e maiores escores de religiosidade (B: 0,05; IC 95%:0,01 a 0,08; p=0,007) foram classificadas no grupo das mulheres com mais preocupação do que o grupo das participantes com renda inferior.
Alguns estudos pesquisaram a localização geográfica como fator de não adesão e não persistência36-38. Heiny et al.36 observaram que mulheres europeias e americanas que viviam em áreas urbanas tiveram uma taxa de posse de medicamentos estatisticamente significativa quando comparada com as mulheres afro-americanas. A proporção de mulheres com adesão à terapia endócrina foi maior naquelas que residiam na zona urbana (75,9%) quando comparadas àquelas da zona rural (24,1%). Outro estudo demonstrou que as mulheres que vivam em região fronteiriça com o México tinham menos de 70,0% de chances de continuar a terapia endócrina37.
Camacho et al.38 avaliaram os aspectos relacionados à cor e à localização geográfica das pacientes. Aquelas autodeclaradas brancas, negras e outros apresentaram um comportamento de adesão de 77%, 74% e 80%, respectivamente. No que diz respeito à localização geográfica, foram observadas diferentes taxas de iniciação e adesão ao tratamento. Pacientes que moram distantes dos centros de distribuição dos medicamentos tendem à baixa adesão à terapia endócrina.
Outra condição que pode influenciar a adesão e a persistência ao tratamento é a polifarmácia. Calip et al.39 realizaram um estudo abordando a polifarmácia para investigar se essa condição implicaria a adesão ao tratamento endócrino em pacientes tratando o câncer de mama. Entre as participantes, 30,0% não faziam uso de outros medicamentos e 36,0% apresentavam comorbidades e utilizavam vários medicamentos.
A equipe multiprofissional está entre os preditores de adesão levantadas entre os artigos selecionados. O estudo de Lopez et al.40 investigou pacientes que passaram por diversas especialidades médicas. Notou-se que as pacientes que descontinuavam a terapia endócrina não estavam fazendo o acompanhamento com clínicos gerais e cirurgiões/oncologistas (48,3% vs. 78,9%, p < 0,001). Por fim, o autor ressalta a importância desses profissionais na adesão e observa que 79,0% das mulheres que descontinuaram com o medicamento não haviam sido consultadas por um médico clínico.
No estudo de Lee et al.34, foi oferecido um sistema de saúde integrado (KPNC), na tentativa de auxiliar os pacientes na adesão à terapia endócrina. Após a implementação do programa, houve um aumento absoluto nas taxas de adesão nos primeiro, segundo e terceiro anos da terapia endócrina de 4,2%, 4,6% e 4,9%, respectivamente.
Nos estudos selecionados, observou-se uma predominância de reações adversas como o principal fator de investigação da não adesão e não persistência à terapia endócrina. As taxas de não persistência ao tratamento nos estudos que analisaram as reações adversas variaram de 17,9% a 38,8%. Os resultados encontrados corroboram os achados de outros estudos41-43. Entre as principais reações adversas relacionadas à não adesão e à não persistência, estão aquelas ligadas ao sistema musculoesquelético20,21,23,27, em especial em mulheres utilizando os inibidores de aromatase.
De acordo com Toivonen et al.42, a dor nas articulações limita as tarefas domésticas, cuidados pessoais e até tarefas simples, como se levantar da cama pela manhã. Esses dados também remetem à fadiga e a dores musculares apresentadas nos resultados da categoria relacionada às reações adversas.
Outras reações adversas mencionadas nos artigos e que apresentam relação com a não adesão e não persistência foram o fogacho, suor noturno, distúrbios do sono, redução da libido e secura vaginal, e estiveram mais presentes em pacientes em uso de tamoxifeno. Essas reações adversas compreendem sintomas da menopausa induzida pela terapia endócrina do câncer de mama.
Pacientes no climatério na fase pré-menopausa podem entrar na menopausa induzida pela terapia endócrina do câncer de mama. O sofrimento associado aos sintomas da menopausa induzida e a incidência de outras reações adversas contribuem para aumentar as crenças negativas sobre a terapia hormonal do câncer de mama e a dificuldade em tolerar o tratamento, levando à não persistência ao tratamento44-47. De acordo com Botelho et al.10, a não persistência ao tratamento ocorre, muitas vezes, pelo fato de esses eventos limitarem a qualidade de vida dessas mulheres.
Embora as reações adversas sejam presentes tanto em pacientes em uso de inibidores de aromatase quanto naqueles em uso de tamoxifeno, vários estudos demonstraram que os pacientes que utilizam os quimioterápicos da classe inibidores de aromatase são mais propensos à adesão22,28-30,39. Ademais, o tempo de tratamento esteve relacionado a um aumento da não persistência à terapia endócrina em ambas as terapias29,30,34,35.
Um estudo de revisão sistemática e metanálise48 avaliou o tempo ideal de extensão da terapia endócrina com inibidor de aromatase, e mostrou uma melhora na não recidiva do câncer de mama ao estender a terapia de cinco para sete a oito anos, especialmente em pacientes com tamanho de tumor ≥ 2 cm, receptor de estrogênio, receptor de progesterona positivos, receptor do fator de crescimento epidérmico humano 2 positivo ou negativo e quimioterapia anterior. Contudo, a análise de eventos adversos revelou um aumento significativo na incidência de artralgia, osteoporose, fraturas ósseas e astenia. Como visto anteriormente, os eventos adversos compreendem uma barreira à adesão à terapia endócrina. De acordo com Xu et al.30, mulheres em uso de inibidores de aromatase tendem a ter uma maior redução na persistência ao tratamento no primeiro e segundo ano. Ternoven et al.35 demonstraram um aumento de não persistência de 11,3% do primeiro ano de tratamento para 47,9% no quinto ano. A identificação de fatores que possam beneficiar a adesão de pacientes com câncer de mama pode reduzir as taxas de recidiva da doença.
Sobre os fatores psicológicos, estes podem ser corresponsáveis pela não adesão à terapia endócrina. Em pacientes com doenças mentais, a adesão à terapia endócrina permanece abaixo do ideal, piorando desnecessariamente a recorrência do câncer e o risco de mortalidade31.
Mausbach et al.49 identificaram a depressão como um preditor do sucesso da terapia endócrina adjuvante. Outro estudo, com método intervencionista para melhorar a adesão à terapia endócrina em mulheres com câncer de mama, mostrou que aquelas que apresentavam menos sintomas de ansiedade e depressivos tiveram melhor adesão à terapia endócrina50. A identificação prévia de doenças mentais pode ajudar a definir pacientes com menor adesão e maior risco de abandono ao tratamento. Além disso, pode nortear a equipe de saúde quanto a implementar intervenções específicas a esse subgrupo de pacientes. Sendo assim, avaliar e apoiar mulheres com de câncer de mama diagnosticadas com doenças mentais prévias impactaria positivamente a adesão ao tratamento31,49,50.
A localização geográfica pode ser um problema para pacientes em tratamento de câncer de mama. Em virtude de o tratamento compreender medicamentos de alto custo, em muitos países, a retirada deles é centralizada em municípios de médio e grande portes. No Brasil, os centros para o tratamento do câncer estão localizados em cidades polos das regiões do país ou capitais. Isso pode inviabilizar o acesso ao medicamento, embora o tratamento seja financiado pelo Sistema Único de Saúde (SUS) ou planos de saúde, garantindo o acesso ao cidadão51,52. Dessa forma, o local de moradia pode representar um problema para a adesão ao tratamento.
Por outro lado, o estudo de Botelho et al.10 mostrou que pacientes que vivem na Grande São Paulo apresentaram menor adesão ao tamoxifeno. Esse achado mostra que há outros fatores relacionados à localização geográfica que podem afetar a adesão à terapia.
Além disso, as comorbidades preexistentes ou adquiridas ao longo do tratamento com terapia endócrina podem afetar o comportamento de adesão da hormonioterapia. De acordo com Brito et al.53, as doenças crônicas exigem mudanças comportamentais dos pacientes que podem afetar o cumprimento do tratamento. Contudo, a doença diagnosticada pode ser um preditor de adesão. No estudo de Calip et al.39, as mulheres com hipertensão arterial e dislipidemia apresentaram maior adesão à terapia endócrina quando comparadas com aquelas com depressão, ansiedade entre outras doenças mentais.
Quanto à equipe de saúde, Heiney et al.36 referem que, quando composta por profissionais médicos, os pacientes apresentam melhores taxas de adesão. Guedes et al. 14 encontraram em seu estudo uma relação direta entre a quantidade de consultas médicas e a persistência ao tratamento, uma vez que estas proveem informações sobre o tratamento, reações adversas e seus manejos, e apoio emocional. No entanto, é imprescindível que a equipe seja multiprofissional com especialidades médicas e não médicas no contexto do tratamento para o câncer de mama36.
Esta revisão mostrou um panorama do que é descrito na literatura sobre os preditores de não adesão e/ou não persistência à terapia endócrina. Embora possua todos os elementos das revisões sistemáticas da literatura como: pergunta de pesquisa, seleção com cegamento por mais de um avaliador, estratégias de busca e critérios de elegibilidade para seleção dos artigos, ainda assim apresenta muitas limitações; uma delas seria os inúmeros artigos encontrados para correlacionar com a proposta do estudo, os diversos outros estudos que não foram selecionados ou que não vieram na busca das bases de dados, e a principal é a impossibilidade de realizar uma metanálise em função da qualidade heterogênea dos estudos encontrados.
CONCLUSÃO
O estudo identificou sete categorias de preditores de não adesão e persistência. As reações adversas foram as variáveis mais investigadas e que estão diretamente associadas à não adesão e não persistência. Outro ponto crucial esteve relacionado ao tipo de medicamento, sendo possível observar que as mulheres em tratamento com tamoxifeno apresentam maiores taxas de não adesão e não persistência quando comparado aos inibidores de aromatase. O tempo de tratamento também foi um preditor negativo de adesão, ou seja, quanto maior o tempo utilizando a terapia endócrina, menor é a adesão e persistência. Quanto às características sociodemográficas, aos fatores psicológicos, à presença de comorbidades e à presença da equipe multiprofissional, mais estudos clínicos randomizados devem ser encorajados para esclarecer a real influencia dessas variáveis na adesão e persistência à terapia endócrina, assim como estudos com manejo desses preditores.
Todas as autoras contribuíram na concepção e no planejamento do estudo; na análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO INTERESSES
Nada a declarar.
DECLARAÇÃO DISPONIBILIDADE DE DADOS
Todos os conteúdos subjacentes ao texto do artigo estão contidos no manuscrito.
FONTES DE FINANCIAMENTO
Universidade Federal de Uberlândia, Programa de Residência em Área Profissional da Saúde (PRAPS), Ministério da Educação (MEC).
REFERÊNCIAS
1.International Agency for Research on Câncer [Internet]. Lyon: IARC; ©1965-2025. Cancer topics: breast cancer. [Acesso 2025 jan 20]. Disponível em: https://www.iarc.who.int/cancer-type/breast-cancer/
2. Pramesh CS, Badwe RA, Bhoo-Pathy N, et al. Priorities for cancer research in low- and middle-income countries: a global perspective. Nat Med. 2022;28:649-57. doi: https://doi.org/10.1038/s41591-022-01738-x
3. Instituto Nacional de Câncer [Internet]. Rio de Janeiro: INCA [2000]. Estimativa 2023: incidência de câncer no Brasil, 2022 maio 31. [Acesso 2025 jan 25]. Disponível em: https://www.gov.br/inca/pt-br/assuntos/cancer/o-que-e-cancer
4. Cardoso F, Spence D, Mertz S, et al. Global analysis of advanced/metastatic breast cancer: decade report (2005-2015). Breast. 2018;39:131-8. doi: https://doi.org/10.1016/j.breast.2018.03.002
5. Haque R, Ahmed SA, Fisher A, et al. Effectiveness of aromatase inhibitors and tamoxifen in reducing subsequent breast cancer. Cancer Med. 2012;1(3):318-27. doi: https://doi.org/10.1002/cam4.37
6. Perez EA. Safety profiles of tamoxifen and the aromatase inhibitors in adjuvant therapy of hormone-responsive early breast cancer. Ann Oncol. 2007;18(Supl 8):viii26-35. doi: https://doi.org/10.1093/annonc/mdm263
7. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet. 2015;386(10001):1341-52. doi: http://dx.doi.org/10.1016/S0140-6736(15)61074-1
8. Teixeira AR, Ruiz BM, Cardoso NR, et al. Adesão ao tratamento com antineoplásicos orais em pacientes com câncer de mama. Rev Bras Ciênc Biomed. 2020;1(3):110-21. doi: https://doi.org/10.46675/rbcbm.v1i2.24
9. Karve S, Cleves MA, Helm M, et al. Boa e baixa adesão: ponto de corte ideal para medidas de adesão usando dados de reivindicações administrativas. Curr Med Res Opin. 2009;25:2303-10. doi: https://doi.org/10.1185/03007990903126833
10. Botelho LO, Sañudo A, Facina G, et al. Adesão à terapia hormonal adjuvante com Tamoxifeno e Anastrozol utilizando ARMS-12 e MMAS-4. Rev Bras Cancerol. 2022;68(2):e-121960. doi: https://doi.org/10.32635/2176-9745.RBC.2022v68n2.1960
11. Yussof I, Mohd Tahir NA, Hatah E, et al. Factors influencing five-year adherence to adjuvant endocrine therapy in breast cancer patients: a systematic review. Breast. 2022;62:22-35. doi: https://doi.org/10.1016/j.breast.2022.01.012
12. Pistilli B, Paci A, Ferreira AR, et al. Serum detection of nonadherence to adjuvant tamoxifen and breast cancer recurrence Risk. J Clin Oncol. 2020;38(24):2762-72. doi: https://doi.org/10.1200/JCO.19.01758
13. Collin LJ, Cronin-Fenton DP, Ahern TP, et al. Early discontinuation of endocrine therapy and recurrence of breast cancer among premenopausal women. Clin Cancer Res. 2021;1;27(5):1421-8. doi: https://doi.org/10.1158/1078-0432.ccr-20-3974
14. Guedes JBR, Guerra MRG, Alvim MM, et al. Factors associated with adherence and persistence to hormonal therapy in women with breast cancer. Rev bras epidemiol. 2017;20(4):636-49. doi: https://doi.org/10.1590/1980-5497201700040007
15. University of York. Centre for Reviews and Dissemination [Internet]. New York: University of York; 2019. PROSPERO - International prospective register of systematic reviews. 2023. [acesso 2025 jun 31]. Disponível em: https://www.crd.york.ac.uk/PROSPERO/view/CRD42021212788
16. Moher D, Liberati A, Tetzlaff J, et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. J Clin Epidemiol. 2009;62(10):1006-12. doi: https://doi.org/10.1016/j.jclinepi.2009.06.005
17. Ouzzani M, Hammady H, Fedorowicz Z, et al. Rayyan-a web and mobile app for systematic reviews. Syst Rev. 2016;5(210):1-10. doi: https://doi.org/10.1186/s13643-016-0384-4
18. Guyatt G, Oxman AD, Akl EA, et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol. 2011;64(4):383-94. doi: https://doi.org/10.1016/j.jclinepi.2010.04.026
19. Miot HA. Análise de concordância em estudos clínicos e experimentais. J Vasc Bras. 2016;15(2):89-92. doi: https://doi.org/10.1590/1677-5449.004216
20. Conejo I, Pajares B, Alba E, et al. Effect of neuromuscular taping on musculoskeletal disorders secondary to the use of aromatase inhibitors in breast cancer survivors: a pragmatic randomised clinical trial. BMC Complement Altern Med. 2018;18:180. doi: https://doi.org/10.1186/s12906-018-2236-3
21. Berkowitz MJ, Thompson CK, Zibecchi LT, et al. How patients experience endocrine therapy for breast cancer: an online survey of side effects, adherence, and medical team support. J Cancer Surviv. 2021;15(1):29-39. doi: https://www.doi.org/10.1007/s11764-020-00908-5
22. Sheppard VB, Sutton AL, Hurtado-de-Mendoza A, et al. Race and patient-reported symptoms in adherence to adjuvant endocrine therapy: a report from the women's hormonal initiation and persistence study. Cancer Epidemiol Biomarkers Prev. 2021;30(4):699-709. doi: https://www.doi.org/10.1158/1055-9965.EPI-20-0604
23. Helland T, Hagen KB, Haugstøyl ME, et al. Drug monitoring of tamoxifen metabolites predicts vaginal dryness and verifies a low discontinuation rate from the norwegian prescription database. Breast Cancer Res Treat. 2019;177(1):185-95. doi: https://doi.org/10.1007/s10549-019-05294-wb
24. Hagen KB, Aas T, Kvaløy JT, et al. Adherence to adjuvant endocrine therapy in postmenopausal breast cancer patients: a 5-year prospective study. Breast. 2019;44:52-8. doi: https://doi.org/10.1016/j.breast.2019.01.003
25. Bhave MA, Speth KA, Kidwell KM, et al. Effect of aromatase inhibitor therapy on sleep and activity patterns in early-stage breast cancer. Clin Breast Cancer. 2018;18(2):168-74. doi: https://doi.org/10.1016/j.clbc.2017.12.012
26. Smith KL, Verma N, Blackford AL, et al. Association of treatment-emergent symptoms identified by patient-reported outcomes with adjuvant endocrine therapy discontinuation. npj Breast Cancer. 2022;8(53):00414-0. doi: https://doi.org/10.1038/s41523-022-00414-0
27. Wagner LI, Zhao F, Goss PE, et al. Patient-reported predictors of early treatment discontinuation: treatment-related symptoms and health-related quality of life among postmenopausal women with primary breast cancer randomized to anastrozole or exemestane on NCIC Clinical Trials Group (CCTG) MA.27 (E1Z03). Breast Cancer Res Treat. 2018;169(3):537-48. doi: https://doi.org/10.1007%2Fs10549-018-4713-2
28. Hwang GS, Paranjpe R, Opsomer C, et al. Oral endocrine therapy agent, race/ethnicity, and time on therapy predict adherence in breast cancer patients in a large academic institution. Clin Breast Cancer. 2020;20(6):520-6. doi: https://doi.org/10.1016/j.clbc.2020.06.004
29. Cavazza M, Banks H, Ercolanoni M, et al. Factors influencing adherence to adjuvant endocrine therapy in breast cancer-treated women: using real-world data to inform a switch from acute to chronic disease management. Breast Cancer Res Treat. 2020;183(1):189-99. doi: https://doi.org/10.1007/s10549-020-05748-6
30. Xu H, Jin F, Zhang XJ, et al. Adherence status to adjuvant endocrine therapy in chinese women with early breast cancer and its influencing factors: a cross-sectional survey. Cancer Med. 2020; 9(11):3703-3713. doi: https://doi.org/10.1002/cam4.3017
31. Haskins CB, McDowell BD, Carnahan RM, et al. Impact of preexisting mental illness on breast cancer endocrine therapy adherence. Breast Cancer Res Treat. 2019;174(1):197-208. doi: https://doi.org/10.1007/s10549-018-5050-1
32. Salgado TM, Davis EJ, Farris KB, et al. Identifying socio-demographic and clinical characteristics associated with medication beliefs about aromatase inhibitors among postmenopausal women with breast cancer. Breast Cancer Res Treat. 2017;163(2):311-9. doi: https://doi.org/10.1002/pds.4751
33. Sutton AL, Salgado TM, He J, et al. Sociodemographic, clinical, psychosocial, and healthcare-related factors associated with beliefs about adjuvant endocrine therapy among breast cancer survivors. Support Care Cancer. 2020;28(9):4147-54. doi: https://doi.org/10.1007/s00520-019-05247-5
34. Lee C, Check DK, Manace Brenman L, et al. Adjuvant endocrine therapy for breast cancer patients: impact of a health system outreach program to improve adherence. Breast Cancer Res Treat. 2020;180(1):219-26. doi: https://doi.org/10.1007/s10549-020-05539-z
35. Ternoven HE, Daniels B, Tang M, et al. Patterns of endocrine therapy in a national cohort of early stage HER2-positive breast cancer patients. Pharmacoepidemiol Drug Saf. 2019;28(6):812-20. doi: https://doi.org/10.1002/pds.4751
36. Heiney SP, Truman S, Babatunde OA, et al. Racial and geographic disparities in endocrine therapy adherence among younger breast cancer survivors. Am J Clin Oncol. 2020;43(7):504-9. doi. https://doi.org/10.1097%2FCOC.0000000000000696
37. Farias AJ, Wu WH, Du XL. Racial and geographic disparities in adherence and discontinuation to adjuvant endocrine therapy in Texas Medicaid-insured patients with breast cancer. Med Oncol. 2018;35(113):e1168-6. doi: https://doi.org/10.1007/s12032-018-1168-6
38. Camacho FT, Tan X, Alcalá HE, et al. Impact of patient race and geographical factors on initiation and adherence to adjuvant endocrine therapy in medicare breast cancer survivors. Medicine (Baltimore). 2017;96(24):e7147. doi: https://doi.org/10.1097/md.0000000000007147
39. Calip GS, Xing S, Jun DH, et al. Polypharmacy and adherence to adjuvant endocrine therapy for breast cancer. J Oncol Pract. 2017;13(5):e451-62. doi: https://doi.org/10.1200/JOP.2016.018317
40. Lopez D, Kemp-Casey A, Saunders C, et al. Clinical consultations and investigations before and after discontinuation of endocrine therapy in women with primary breast cancer. Public Health Res Pract. 2017;27(3):e2731726. doi: https://doi.org/10.17061/phrp2731726
41. Yusufov M, Nathan M, Wiley A, et al. Predictors of increased risk for early treatment non-adherence to oral anti-estrogen therapies in early-stage breast cancer patients. Breast Cancer Research and Treatment. 2021;185:53-62. doi: https://doi.org/10.1007/s10549-020-05920-y
42. Toivonen KI, Williamson TM, Carlson LE, et al. Potentially modifiable factors associated with adherence to adjuvant endocrine therapy among breast cancer survivors: a systematic review. Cancers. 2021;13(107):e13010107. doi: https://doi.org/10.3390/cancers13010107
43. Cunha NF, Querino RA, Wolkers PCB, et al. Fatigue management experiences from women undergoing chemotherapy: self-care strategies. Esc Anna Nery. 2019;23(4):e20190097. https://doi.org/10.1590/2177-9465-EAN-2019-0097
44. Kidwell KM, Harte SE, Hayes DF, et al. Patient-reported symptoms and discontinuation of adjuvant aromatase inhibitor therapy. Cancer. 2014;120(16):2403-11. doi: https://doi.org/10.1002/cncr.28756
45. Paranjpe R, John G, Trivedi M, et al. Identifying adherence barriers to oral endocrine therapy among breast cancer survivors. Breast Cancer Res Treat. 2019;174(2):297-305. doi: https://doi.org/10.1007/s10549-018-05073-z
46. Rosenberg SM, Stanton AL, Petrie KJ, et al. Symptoms and symptom attribution among women on endocrine therapy for breast cancer. Oncologist. 2015;20(6):598-604. doi: https://doi.org/10.1634/theoncologist.2015-0007
47. Nestoriuc Y, von Blanckenburg P, Schuricht F, et al. Is it best to expect the worst? Infuence of patients’ side-efect expectations on endocrine treatment outcome in a 2-year prospective clinical cohort study. Ann Oncol. 2016;27(10):1909-15. doi: https://doi.org/10.1093/annonc/mdw266
48. Ying Z, Linxun L, Kechang Z, et al. Optimal extension time after initial endocrine therapy for postmenopausal hormone receptor-positive early-stage breast cancer: a systematic review and meta-analysis. BMC Womens Health. 2025;25(156):e03610-9. doi: https://doi.org/10.1186/s12905-025-03610-9
49. Mausbach BT, Schwab RB, Irwin SA. Depression as a predictor of adherence to adjuvant endocrine therapy (AET) in women with breast cancer: a systematic review and meta-analysis. Breast Cancer Res Treat. 2015;152(2):239-46. doi: https://doi.org/10.1007/s10549-015-3471-7
50. Walsh EA, Post K, Massad K, et al. Identification of patient subgroups who benefit from a behavioral intervention to improve adjuvant endocrine therapy adherence: a randomized-controlled trial. Breast Cancer Res Treat. 2024;204(3):547-59. doi: https://doi.org/10.1007/s10549-023-07228-z
51. Presidência da República (BR). Lei nº12.880 de 12 de Novembro de 2013. Altera a Lei nº 9.656, de 3 de junho de 1998, que “dispõe sobre os planos e seguros privados de assistência à saúde”, para incluir tratamentos entre as coberturas obrigatórias. Diário Oficial da União, Brasília, DF. 2013 nov 13; Edição 221-A, Seção 1:1.
52. Ministério da Saúde (BR). Lei nº 9.545, de 3 de Junho de 1998. Dispõe sobre os planos e seguros privados de assistência à saúde. Diário Oficial da União [Internet], Brasília, DF. 1998 jun 4 [acesso 2025 jan 25]; Edição 105; Seção 1:1. Available: http://www.planalto.gov.br/ccivil_03/leis/l9656compilado.htm
53. Brito C, Portela MC, Vasconcellos MT. Fatores associados à persistência à terapia hormonal em mulheres com câncer de mama. Rev Saúde Pública. 2014;48(2):284-95. doi: https://doi.org/10.1590/S0034-8910.2014048004799
Recebido em 15/1/2025
Aprovado em 31/7/2025
Editor associado: Fernando Lopes Tavares de Lima. Orcid iD: https://orcid.org/0000-0002-8618-7608
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.