RELATO DE CASO
Hiperprogressão após Aquisição de Mutação de Resistência ao Alectinibe em Paciente com Adenocarcinoma de Pulmão: Relato de Caso
Hyperprogression after Acquisition of Resistance Mutation to Alectinib in a Patient with Lung Adenocarcinoma: Case Report
Hiperprogresión tras la Adquisición de una Mutación de Resistencia a Alectinib en un Paciente con Adenocarcinoma de Pulmón: Informe de Caso
https://doi.org/10.32635/2176-9745.RBC.2025v71n3.5098
Isadora Zampronio dos Santos¹; Bruno Rafael Ramos²
1,2Hospital Santo Antônio. Blumenau (SC), Brasil.
1E-mail: isadora_zampronio@hotmail.com. Orcid iD: https://orcid.org/0009-0003-2057-7472
2E-mail: brunoramosoncologia@gmail.com. Orcid iD: https://orcid.org/0009-0001-3541-2836
Endereço para correspondência: Isadora Zampronio dos Santos. Rua Max Hering, 475 – Victor Konder. Blumenau (SC), Brasil. CEP 89012-510. E-mail: isadora_zampronio@hotmail.com
RESUMO
Introdução: A mutação no gene quinase de linfoma anaplásico (ALK) ocorre em cerca de 3% a 5% dos pacientes com adenocarcinoma de pulmão, sendo mais frequente em pacientes mais jovens, não fumantes ou fumantes leves. Em razão da sua especificidade molecular, o tratamento envolve o uso de terapias-alvo com inibidores de ALK, como alectinibe e lorlatinibe, que demonstram eficácia significativa ao bloquear a atividade anormal da proteína. Relato do caso: Paciente jovem, do sexo masculino, diagnosticado com adenocarcinoma pulmonar metastático para pleura, associado ao rearranjo genético do gene ALK, com nova mutação precoce. O estudo descreve o tratamento com terapias-alvo e as intercorrências clínicas observadas ao longo do curso da doença. Por causa de complicações e limitações por intervenções invasivas, o paciente evoluiu para o óbito após um ano e dois meses de seu diagnóstico. Conclusão: O estudo reforça a importância do diagnóstico precoce com exames específicos e os desafios do tratamento, debatendo sobre terapias novas e seus desafios, a fim de aumentar a taxa de sobrevida em neoplasias avançadas.
Palavras-chave: Adenocarcinoma de Pulmão; Fusão Oncogênica; Proteínas Oncogênicas; Sequenciamento de Nucleotídeos em Larga Escala.
ABSTRACT
Introduction: The mutation in the gene anaplastic lymphoma kinase (ALK) occurs in approximately 3% to 5% of patients with lung adenocarcinoma, being more frequent in younger patients, non-smokers, or light smokers. Due to its molecular specificity, treatment involves the use of targeted therapies with ALK inhibitors, such as alectinib and lorlatinib, which have shown significant efficacy in blocking the abnormal activity of the protein. Case report: Young male patient diagnosed with metastatic lung adenocarcinoma to the pleura, associated with a genetic rearrangement of the ALK gene, featuring a new early mutation. The study describes the treatment with targeted therapies and clinical complications throughout the course of the disease. Due to complications and limitations for invasive interventions, the patient died one year and two months after his diagnosis. Conclusion: The study reinforces the importance of early diagnosis with specific tests and highlights the challenges of treatment, discussing new therapies and their obstacles to improve survival rates in advanced tumors.
Key words: Adenocarcinoma of Lung; Oncogene Fusion; Oncogene Proteins; High-Throughput Nucleotide Sequencing.
RESUMEN
Introducción: La mutación en el gen quinasa de linfoma anaplásico (ALK) ocurre, en aproximadamente, del 3% al 5% de los pacientes con adenocarcinoma de pulmón, siendo más frecuente en pacientes jóvenes, no fumadores o fumadores ocasionales. Debido a su especificidad molecular, el tratamiento implica el uso de terapias dirigidas con inhibidores de ALK, como alectinib y lorlatinib, que han demostrado una eficacia significativa al bloquear la actividad anormal de la proteína. Informe del caso: Paciente joven, de sexo masculino, diagnosticado con adenocarcinoma pulmonar metastásico en la pleura, asociado con la reorganización genética del gen ALK, con una nueva mutación precoz. El estudio describe el tratamiento con terapias dirigidas y las complicaciones clínicas observadas a lo largo del curso de la enfermedad. Debido a complicaciones y limitaciones por intervenciones invasivas, el paciente evolucionó hacia el óbito un año y dos meses después de su diagnóstico. Conclusión: El estudio refuerza la importancia del diagnóstico temprano mediante exámenes específicos y destaca los desafíos del tratamiento, debatiendo sobre nuevas terapias y sus dificultades con el objetivo de aumentar la tasa de supervivencia en neoplasias avanzadas.
Palabras clave: Adenocarcinoma del Pulmón; Fusión de Oncogenes; Proteínas Oncogénicas; Secuenciación de Nucleótidos de Alto Rendimiento.
INTRODUÇÃO
De acordo com as estimativas do Instituto Nacional de Câncer (INCA)1, para cada ano do triênio 2023-2025, o câncer de pulmão é o terceiro tipo mais comum entre os homens no Brasil, com 18.020 novos casos, e o quarto entre as mulheres, com 14.540 novos casos. Em nível global, ocupa a primeira posição em incidência entre os homens e a terceira entre as mulheres.
O adenocarcinoma, pertencente ao grupo do carcinoma pulmonar de células não pequenas (CPCNP), corresponde ao subtipo histológico mais comum, representando mais de 50% de todos os tipos de câncer de pulmão2. Diferentemente do subtipo de pequenas células, o adenocarcinoma é prevalente em não fumantes3. As manifestações clínicas incluem sintomas como tosse persistente, dispneia, fadiga, hemoptise e suscetibilidade a infecções4.
O gene anaplastic lymphoma kinase (ALK), localizado no cromossomo dois, codifica o receptor de tirosino-quinase transmembrana que expressa a proteína ALK. Suas mutações e translocações resultaram na produção de uma proteína ALK oncogênica, que ativa vias de sinalização responsáveis pelo controle celular3. O tratamento baseia-se em terapia-alvo com inibidores de tirosino-kinase anti-ALK e eventualmente com o uso de quimioterapia. Outras opções incluem a combinação com radioterapia5.
Diante do exposto, o objetivo deste relato é abordar a importância de exames específicos e os desafios do tratamento com terapia-alvo, contribuindo para o manejo de neoplasias avançadas. Este relato de caso foi elaborado a partir da observação clínica de um paciente que esteve internado no setor de oncologia da Fundação Hospitalar de Blumenau/Hospital Santo Antônio, no ano de 2024 e que veio a óbito.
O estudo é de natureza observacional descritiva, qualitativa e segue os princípios éticos estabelecidos para relatos de caso, com a devida obtenção do consentimento informado do guardião legal do paciente. Após a aprovação pelo Comitê de Ética em Pesquisa (CEP), o familiar do paciente foi contatado por telefone para a aplicação do Termo de Consentimento Livre e Esclarecido (TCLE) e da Declaração de Ciência e Concordância do Fiel Guardião, sendo então iniciada a análise do prontuário no sistema Tasy da Fundação Hospitalar de Blumenau e coletadas as informações relevantes.
Os dados foram compilados e foi realizada a revisão bibliográfica de artigos encontrados nas plataformas SciELO, PubMed, Scopus, Google Acadêmico e LILACS. Os critérios de inclusão adotados compreenderam a população estudada, a intervenção aplicada em relação ao caso clínico, a disponibilidade do texto completo, a indexação da revista e o período recente de publicação. Como critérios de exclusão, foram consideradas a desatualização do estudo e a inadequação da população analisada.
O presente artigo foi aprovado pelo CEP, sob o número de parecer 7244620 (CAAE: 83720224.0.0000.5359), de acordo com a Resolução n.º 466/20126 do Conselho Nacional de Saúde.
RELATO DE CASO
Paciente masculino, L. M., caucasiano, 42 anos, escala de desempenho do Eastern Cooperative Oncology Group (ECOG 1), sem comorbidades prévias e com história negativa para tabagismo, procura atendimento médico no serviço público em razão de dispneia e tosse progressiva em junho de 2023.
A angiotomografia de tórax de 24/7/23 apresentava nódulo em lobo médio direito de 25 x 28 mm, múltiplos nódulos esparsos, linfonodomegalia mediastinal, derrame pleural moderado à direita e tromboembolismo pulmonar no lobo inferior esquerdo (iniciado tratamento com rivaroxabana para o tromboembolismo). O antígeno carcinoembrionário (CEA) estava elevado, com valor de 6,67 ng/mL (valor de referência < 5,0), e a biópsia pleural confirmou adenocarcinoma pulmonar com estadiamento clínico IV.
O paciente, por meio de plataforma de gratuidade a acesso de exames genéticos, realizou o exame FoundationOne CDx, identificando mutação patogênica ALK – EML 4-ALK fusion (variant 3a/b), além de mutações pontuais em CTNNB1, perda de MTAP, perda em CDKN2A/B e mutação pontual TP53 R306* com frequência de alelos variantes de 15,1%. O teste sugeriu possível resposta aos medicamentos: alectinib, brigatinib, ceritinib, crizotinib, lorlatinib e entrectinib.
No dia 1/9/23, iniciou terapia de primeira linha com alectinibe 600 mg duas vezes ao dia, inicialmente adquirindo a medicação por meios próprios e depois após pleito judicial, visto que tal medicação não é custeada no serviço de saúde público brasileiro, sem apresentar quaisquer efeitos colaterais. Houve redução de 29% do CEA, voltando à faixa da normalidade com resultado de 4,73 em 6/12/23 e, em nova tomografia de 5/1/2024, houve grande resposta parcial, evidenciando pequeno derrame pleural à direita e redução de 89% no maior diâmetro dos nódulos pulmonares, agora com no máximo 3 mm (Figura 1).
Entre fevereiro e março de 2024, por conta da interrupção no fornecimento do medicamento, o paciente permaneceu 30 dias sem tratamento e evoluiu com dispneia importante, necessitando internação hospitalar e oxigenoterapia. Houve elevação de 250% do CEA para 16,6 em 27/3/24 e nova tomografia de tórax de 21/4/24 evidenciou importante aumento do volume tumoral, com velamento de todo o hemitórax direito por massa de aspecto heterogêneo, com realce por meio de contraste e áreas hipodensas/liquefeitas em permeio, além de surgimento de linfonodomegalias axilares à direita (Figura 2).
As adenomegalias foram biopsiadas visando excluir a hipótese de doença linfoproliferativa, visto a rapidez do crescimento tumoral e confirmando adenocarcinoma. Após discussão do caso em reunião multidisciplinar, foi deliberado o início de um ciclo de quimioterapia com esquema triplet (carboplatina + docetaxel + pemetrexede), considerando hiperprogressão e crise visceral, e encaminhado o tecido para novo painel genético amplo. Observou-se melhora clínica parcial, o que possibilitou alta hospitalar.
Em maio, foi internado novamente para o segundo ciclo de quimioterapia, porém apresentou edema generalizado e piora da dispneia, possivelmente como toxicidade do esquema quimioterápico anterior. No dia 28/5/24, evolui com insuficiência ventilatória importante, associada à infecção em aspirado traqueal por Pseudomonas aeruginosa multirresistente, necessitando de intubação orotraqueal e transferência para leito de UTI.
O resultado do novo teste somático evidenciou aquisição de mutação de resistência no gene ALK, agora com mutação pontual G1202R, além da aquisição de seis mutações novas oncogênicas em um curtíssimo período (CCND1, EMSY, FGF19, FGF3, FGF4, KMT2A), conferindo probabilidades de resistência ao alectinibe e sensibilidade somente ao lorlatinibe. O lorlatinibe foi adquirido pelo paciente e um novo tratamento foi iniciado ainda na unidade de terapia intensiva (UTI) em 2/6/24 por via de sonda nasoenteral, seguindo os trabalhos semelhantes e atentando para interação medicamentosa com fluconazol.
Durante a permanência na UTI, necessitou de drenagem de tórax (por conta do pneumotórax após acesso venoso central), traqueostomia, antibióticos de amplo espectro e fungicida por candidemia. O paciente demonstra os primeiros resultados de diminuição de volume de doença após oito dias de tratamento, em tomografia de tórax de 11/6/24, laudada como redução do derrame pleural à esquerda e discreta redução das áreas de consolidação do pulmão direito, além de desmame de ventilação mecânica, após 28 dias, permitindo alta da UTI em 4/7/24.
Após dois dias em enfermaria, houve nova piora ventilatória, sendo coletado painel PCR do aspirado traqueal que evidenciou a manutenção da infecção multirresistente por Pseudomonas aeruginosa, apresentando também o mecanismo de ultrarresistência, o qual demandaria o uso de antibióticos significativamente mais onerosos, que não foram utilizados, além de a presença de vírus parainfluenza, associados à cultura do aspirado traqueal com Serratia ESBL (beta-lactamases de espectro estendido) e urocultura com Escherichia coli ESBL, sendo retornada antibioticoterapia, acoplada novamente em ventilação mecânica e finalizados os 60 dias de tratamento com lorlatinibe.
O paciente apresentou também possível quadro depressivo, efeito colateral descrito em 22,7% dos pacientes em uso de lorlatinibe (segundo a bula7). Após discussão multidisciplinar, optou-se por suspender o tratamento oncológico visando focar em medidas de conforto, com evolução para óbito em 4/8/24, após 11 meses do início do tratamento e aproximadamente três meses de internação hospitalar.
DISCUSSÃO
Inicialmente, é importante destacar que o paciente era oriundo do sistema de saúde pública, o que, embora não exclua a possibilidade de acesso às terapias-alvo, apresenta desafios no manejo de casos complexos, como o relatado, resultando em potenciais atrasos no tratamento e favorecendo a progressão da doença. Assim, o diagnóstico constitui a base fundamental do tratamento oncológico. Inicialmente, somente se diagnosticava os tumores por imuno-histoquímica para ALK, o que tornava o resultado limitado de informações, da mesma forma que o uso do FISH se aplicava somente para um gene, omitindo importantes dados para o tratamento do paciente.
Conforme citado anteriormente, o teste FoundationOne CDx se enquadrada em um exame de sequenciamento de nova geração (NGS), o qual detecta com precisão os principais tipos de alterações genômicas, além de biomarcadores complexos, como instabilidade de microssatélites, carga mutacional e fração tumoral8. No caso do paciente, sua variante 3a/b indicava de partida uma resposta clínica desfavorável9, embora os tumores ALK tenham a tendência a um melhor prognóstico com as novas linhas de tratamento10.
Da mesma maneira que a mutação do TP53 favorece a perda do mecanismo de checagem do DNA, favorecendo o desenvolvimento de novas mutações11, como visto no paciente. Em relação à epidemiologia, 44,5% dos pacientes com adenocarcinoma são do sexo masculino, com uma taxa de sobrevida em média de 20% em cinco anos e sua progressão é marcada por heterogeneidade celular4. Em relação ao tratamento, os inibidores da tirosina quinase (TKI) são considerados tratamentos de primeira linha e atualmente mais de 15 fármacos são aprovados pelo Food and Drug Administration (FDA) para sete drivers oncogênicos em CPNCP12.
O estudo CROWN realizou um acompanhamento de cinco anos comparando os medicamentos lorlatinibe e crizotinibe, demonstrando a superioridade do lorlatinibe em termos de eficácia para pacientes com CPNPC avançado e ALK-positivo. Os resultados evidenciaram benefícios significativos na sobrevida livre de progressão, configurando o acompanhamento mais longo já relatado em terapia molecular para tumores sólidos metastáticos10.
Em contrapartida, um risco dos inibidores de ALK é a resistência ao medicamento, em virtude do fato de as células cancerígenas acumularem novas mutações, o que torna a terapêutica extremamente complexa. As explicações para essa resistência precoce, citadas em alguns trabalhos em até três meses, podem ser atribuídas à alta carga de mutação tumoral e à evolução heterogênea do tumor, tendo também como terapia combinada com inibidores de ALK uma estratégia potente13. É importante destacar que a interrupção do tratamento inicial por um período de 30 dias também deve ser considerada como um fator relevante para a ocorrência de mutação e resistência precoce.
CONCLUSÃO
Embora o desfecho final tenha sido desfavorável, houve um bom controle sintomático com o uso de alectinibe até a primeira pausa no tratamento. Posteriormente, com o suporte de estratégias complementares, foi possível alcançar o desmame da ventilação mecânica, em uso de lorlatinibe. Entretanto, houve influências desfavoráveis no quadro clínico, como presença de infecção não controlada e administração de medicamentos por sonda nasoenteral, que também contribuem para um desfecho desfavorável.
Diante do exposto, o NGS tem proporcionado informações cada vez mais relevantes para a estratificação prognóstica de neoplasias avançadas, além de permitir a predição das taxas de resposta e o tempo de controle da doença.
Dessa forma, no contexto do adenocarcinoma de pulmão, torna-se cada vez mais imprescindível a solicitação do NGS em todos os casos metastáticos, com a leitura dos resultados de forma abrangente e detalhada. Destaca-se, também, a importância de se realizar a reavaliação periódica do perfil mutacional dos pacientes em tratamento com terapias-alvo.
CONTRIBUIÇÕES
Ambos os autores contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica; e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITO DE INTERESSES
Nada a declarar.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Instituto Nacional de Câncer [Internet]. Rio de Janeiro: INCA; 2022. Câncer de pulmão, 2022 [acesso 2024 jul 18]. Disponível em: http://www.gov.br/inca/pt-br/assuntos/cancer/tipos/pulmao
2. Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol. 2011;6(2):244-85. doi: https://doi.org/10.1097/JTO.0b013e318206a221
3. Rani B, Khan A, Hussain M, et al. ALK gene rearrangement in lung adenocarcinoma. Pak Armed Forces Med J. 2023;73(Supl-1):S111-4. doi: https://doi.org/10.51253/pafmj.v73iSUPPL-1.5302
4. Silva MVP, Santos LR, Oliveira JF, et al. Adenocarcinoma pulmonar: aspectos epidemiológicos, fisiopatológicos e terapêuticos. Rev Contemp. 2024;4(5):e4464. doi: https://doi.org/10.56083/RCV4N5-189
5. Garcia F, Martinez L, Ruiz A, et al. Lung adenocarcinoma: clinical characteristics, molecular study, diagnosis and treatment. Eur Respir Soc. 2021;58(sup65):PA2184. doi: https://doi.org/10.1183/13993003.congress-2021.PA2184
6. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
7. Lorbrena® (lorlatinibe) [bula na Internet]. [sem local]: Pfizer Laboratories Div Pfizer Inc; 2018. Bula de remédio [acesso 2025 fev 16]. Disponível em: https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=2b34d62d-e02a-4af3-bc0d-1571dd4ee76d
8. Woodhouse R, Li M, Hughes J, et al. Clinical and analytical validation of FoundationOne Liquid CDx, a novel 324-Gene cfDNA-based comprehensive genomic profiling assay for cancers of solid tumor origin. PloS one. 2020;15(9):e0237802. doi: https://doi.org/10.1080/13696998.2024.2413289
9. Li M, Hou X, Chen J, et al. ALK fusion variant 3a/b, concomitant mutations, and high PD-L1 expression were associated with unfavorable clinical response to second-generation ALK TKIs in patients with advanced ALK-rearranged non-small cell lung cancer (GASTO 1061). Lung Cancer. 2022;165:54-62. doi: https://doi.org/10.1016/j.lungcan.2022.01.006
10. Solomon BJ, Besse B, Bauer TM, et al. Lorlatinib versus crizotinib in patients with advanced ALK-positive non–small cell lung cancer: 5-year outcomes from the phase III CROWN study. J Clin Oncol. 2024;42(29):3400-27. doi: https://doi.org/10.1200/JCO.24.00581
11. Martins AP, Casali AK, Martins AAS. Mutações no gene TP53 e suas implicações em processos de tumorigênese. Braz J Implantol Health Sci. 2023;5(5):6304-21. doi: https://doi.org/10.36557/2674-8169.2023v5n5p6304-6321
12. Chevallier M, Borgeaud M, Addeo A, et al. Oncogenic driver mutations in non-small cell lung cancer: past, present and future. World J Clin Oncol. 2021;12(4):217. doi: https://doi.org/10.5306/wjco.v12.i4.217
13. Makimoto G, Ohashi K, Tomida S, et al. Rapid acquisition of alectinib resistance in ALK-positive lung cancer with high tumor mutation burden. J Thorac Oncol. 2019;14(11):2009-18. doi: https://doi.org/10.1016/j.jtho.2019.07.017
Recebido em 19/2/2025
Aprovado em 19/3/2025
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
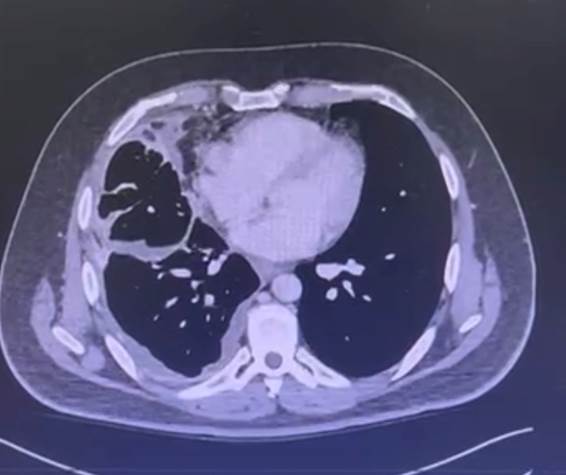
Figura 1. Tomografia de tórax com contraste (5/1/2024) evidenciando pequeno derrame pleural à direita e redução de 89% no maior diâmetro dos nódulos pulmonares, com no máximo 3 mm
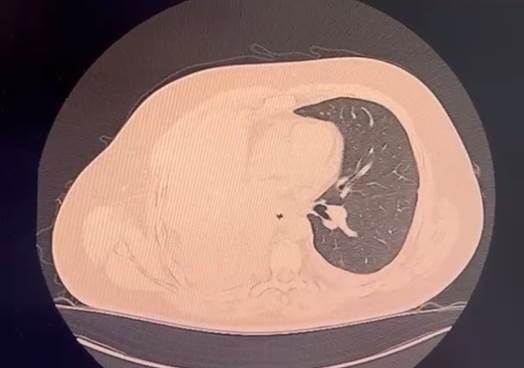
Figura 2. Tomografia de tórax com contraste (21/4/24) evidenciou importante aumento do volume tumoral, com velamento de todo o hemitórax direito por massa de aspecto heterogêneo, com realce ao meio de contraste e áreas hipodensas/liquefeitas em permeio, além de surgimento de linfonodomegalias axilares à direita
![]()
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.