Padrões de Tratamento das Neoplasias Invasivas no Sistema Único de Saúde no Período de 2000 a 2019
Treatment Patterns of Invasive Neoplasms in the Brazilian Unified Health System from 2000 to 2019
Patrones de Tratamiento de las Neoplasias Invasivas en el Sistema Único de Salud del Brasil en el Período de 2000 a 2019
https://doi.org/10.32635/2176-9745.RBC.2025v71n4.5109
Livia Costa de Oliveira1; Karla Santos da Costa Rosa2; Anke Bergmann3; Luiz Claudio Santos Thuler4
1,2Instituto Nacional de Câncer (INCA), Unidade de Cuidados Paliativos. Rio de Janeiro (RJ), Brasil. E-mails: lillycostaoliveira@gmail.com; kcostarosa@gmail.com. Orcid iD: https://orcid.org/0000-0002-5052-1846; Orcid iD: https://orcid.org/0000-0002-0951-8725
3,4INCA, Epidemiologia clínica. Rio de Janeiro (RJ), Brasil. E-mails: abergmann@inca.gov.br; lthuler@gmail.com. Orcid iD: https://orcid.org/0000-0002-1972-8777; Orcid iD: https://orcid.org/0000-0003-2550-6537
Endereço para correspondência: Livia Costa de Oliveira. Rua Visconde de Santa Isabel, 274 – Vila Isabel. Rio de Janeiro (RJ), Brasil. CEP 20560-121. E-mail: livia.oliveira@inca.gov.br
RESUMO
Introdução: Diferentes tratamentos podem ser utilizados para o enfrentamento do câncer. Objetivo: Analisar os padrões de tratamento de pacientes diagnosticados com os seis tipos mais comuns de câncer invasivo no Brasil e atendidos no Sistema Único de Saúde. Método: Análise transversal com dados extraídos do Módulo Integrador dos Registros Hospitalares de Câncer sobre pacientes diagnosticados com os cânceres de mama feminino, próstata, colorretal, pulmão, estômago e colo do útero de 2000 a 2019. Para análise dos dados foi utilizado o teste qui-quadrado e o tamanho do efeito. Resultados: Foram incluídos dados de 1.204.222 pacientes. A cirurgia foi o tratamento mais frequente nos casos diagnosticados precocemente, destacando-se os casos de câncer de próstata (87,5%) e colorretal (56,1%). Para cânceres em estádio avançado, predominou a quimioterapia, principalmente em pulmão (88,2%) e mama (48,3%). A importância do estadiamento clínico no diagnóstico para a tomada de decisão terapêutica foi identificada em todos os tipos de câncer, principalmente em relação à cirurgia e quimioterapia. Variáveis como idade, escolaridade, cor da pele, Região de residência e nível de acreditação do serviço impactaram os padrões de tratamento. Conclusão: Este estudo mostrou que o estádio avançado do câncer no momento do diagnóstico foi o principal definidor do modo de tratamento recebido. Desigualdades sociodemográficas também influenciaram o acesso às diferentes opções terapêuticas.
Palavras-chave: Neoplasias/diagnóstico; Epidemiologia; Sistema Único de Saúde; Protocolos Antineoplásicos.
ABSTRACT
Introduction: Different treatment modalities can be used to manage cancer. Objective: To analyze the treatment patterns of patients diagnosed with the six most common types of invasive cancer in Brazil and treated in the Brazilian Unified Health System. Method: This is a cross-sectional analysis using data extracted from the Integrated Module of Hospital Cancer Registries, including patients diagnosed with female breast, prostate, colorectal, lung, stomach, and cervical cancer from 2000 to 2019. Data were analyzed using the chi-square test and effect size. Results: Data from 1,204,222 patients were included. Surgery was the most frequent treatment in cases diagnosed at an early stage, particularly for prostate (87.5%) and colorectal cancer (56.1%). For advanced-stage cancers, chemotherapy predominated, especially for lung (88.2%) and breast cancer (48.3%). Clinical staging at diagnosis was the primary determinant of therapeutic decision-making, particularly regarding surgery and chemotherapy. Variables such as age, education level, skin color, geographic region, and the accreditation level of oncology services significantly influenced treatment patterns. Conclusion: The advanced stage of cancer at diagnosis was the primary factor determining the type of treatment received. Sociodemographic inequalities also influenced access to different therapeutic options.
Key words: Neoplasms/diagnosis; Epidemiology; Unified Health System; Antineoplastic Protocols.
RESUMEN
Introducción: Existen diferentes modalidades de tratamiento para el manejo del cáncer. Objetivo: Analizar los patrones de tratamiento de pacientes diagnosticados con los seis tipos más comunes de cáncer invasivo en el Brasil y atendidos en el Sistema Único de Salud. Método: Estudio transversal con datos extraídos del Módulo Integrador de los Registros Hospitalarios de Cáncer, incluyendo pacientes diagnosticados con cáncer de mama femenino, próstata, colorrectal, pulmón, estómago y cuello uterino entre 2000 y 2019. El análisis de datos se realizó mediante la prueba de ji al cuadrado y tamaño del efecto. Resultados: Se incluyeron datos de 1 204 222 pacientes. La cirugía fue el tratamiento más frecuente en los casos diagnosticados en etapa temprana, destacándose los cánceres de próstata (87,5%) y colorrectal (56,1%). En los cánceres en estadio avanzado predominó la quimioterapia, especialmente en pulmón (88,2%) y mama (48,3%). La estadificación clínica al momento del diagnóstico fue determinante en la elección terapéutica, especialmente en relación con la cirugía y la quimioterapia. Variables como edad, nivel educativo, color de piel, región de residencia y nivel de acreditación del servicio oncológico impactaron en los patrones de tratamiento. Conclusión: El estadio avanzado del cáncer en el momento del diagnóstico fue el principal factor que determinó el tipo de tratamiento recibido. Las desigualdades sociodemográficas también influyeron en el acceso a las diferentes opciones terapéuticas.
Palabras clave: Neoplasias/diagnóstico; Epidemiología; Sistema Único de Salud; Protocolos Antineoplásicos.
INTRODUÇÃO
A incidência de câncer tem crescido em todo o mundo em decorrência do envelhecimento populacional e da maior exposição a fatores de risco para o seu desenvolvimento1. Destaca-se como a segunda principal causa de morte prematura por doença crônica não transmissível, sendo responsável por nove milhões de mortes por ano no mundo2. É estimada a ocorrência de 28,4 milhões de casos da doença em 2040, ou seja, 47% a mais do que em 20201.
No Brasil, estima-se3 a ocorrência de 704 mil novos casos de câncer em cada um dos três anos de 2023 a 2025. Excluindo-se as neoplasias malignas de pele não melanoma, os mais comuns serão aqueles localizados na mama em mulheres e o de próstata (73 mil e 71 mil casos, respectivamente), seguidos por cólon e reto (45 mil), pulmão (32 mil), estômago (21 mil) e colo de útero (17 mil). Em 2019, houve 120.994 mortes pela doença em indivíduos de 30 a 69 anos no país4.
A escolha do tratamento para tumores sólidos baseia-se, entre outros fatores, no sítio primário, no estádio clínico e na disponibilidade de recursos5. No entanto, em países de baixa e média renda como o Brasil, a dificuldade de acesso aos serviços públicos de saúde pode impactar nos tempos de espera para o diagnóstico e para a primeira consulta e, consequentemente, no início do tratamento, afetando diretamente o prognóstico6.
Um plano de cuidados para pacientes com tumores sólidos pode variar desde o controle local, como cirurgia e radioterapia, até o tratamento sistêmico com quimioterapia, utilizados isoladamente ou em combinação7. Além dessas modalidades tradicionais de tratamento, diversas tecnologias foram desenvolvidas e incorporadas à prática clínica, como terapia direcionada, imunoterapia, terapia hormonal e radiofármacos, incorrendo em aumento de custos para os sistemas de saúde8-12.
Nos sistemas públicos de saúde, como o brasileiro, o aumento da incidência de câncer, somado aos custos crescentes do tratamento, impõe um expressivo desafio econômico13. Diante desse cenário, torna-se fundamental compreender os padrões de tratamento adotados para os principais tipos de câncer no país. Esse conhecimento subsidia a formulação de políticas públicas, orienta o financiamento adequado dos serviços e contribui para a qualificação da atenção oncológica. Nesse sentido, o objetivo deste estudo foi analisar os padrões de tratamento de pacientes diagnosticados com os seis tipos mais comuns de câncer invasivo no Brasil e atendidos no Sistema Único de Saúde (SUS) no período de 2000 a 2019.
MÉTODO
Uma análise transversal foi conduzida usando registros individuais de pacientes diagnosticados com câncer ao longo de duas décadas (2000 a 2019). Os dados foram obtidos, em 10 de junho de 2021, por meio do Módulo Integrador dos Registros Hospitalares de Câncer (RHC), que centraliza os registros hospitalares de câncer do Brasil (https://irhc.inca.gov.br/RHCNet/). Embora existam lacunas consideráveis nos registros de algumas variáveis (notadamente na data de admissão, estádio tumor-nódulo-metástase e estado da doença no final do primeiro tratamento) no RHC, a qualidade dos dados melhorou ao longo dos anos (2000 a 2020)14.
Não foi necessária aprovação do Comitê de Ética em Pesquisa para acessar e usar os dados (secundários e de domínio público), conforme a resolução 510/201615.
Foram incluídos no estudo todos os casos analíticos, referentes a pacientes que foram diagnosticados com um dos seis tipos de câncer mais frequentes no Brasil3, a saber: câncer de mama (feminino) (C50), próstata (C61), colorretal (C18-21), pulmão (C33-34), estômago (C16) e colo do útero (C53)16. Foram excluídos todos os casos com ausência de informações sobre idade ao diagnóstico ou sexo, pacientes menores de 18 anos, aqueles sem registro de tratamento e casos com histórico de tratamento oncológico prévio.
Considerou-se tratamento oncológico qualquer tratamento para controle do tumor ou suas metástases. Não foram incluídos os tratamentos voltados exclusivamente para alívio de sintomas, manejo de comorbidades e complicações tumorais17. Além disso, apenas a primeira modalidade de tratamento realizada após o diagnóstico foi considerada (ou seja, levando em conta a cronologia): cirurgia (sim ou não), quimioterapia (sim ou não) e radioterapia (sim ou não). Quaisquer tratamentos subsequentes recebidos não foram incluídos nesta análise.
Outras variáveis avaliadas foram: idade ao diagnóstico; sexo (quando pertinente); raça/cor da pele18; anos de escolaridade; estado civil; e Região de residência categorizada de acordo com o Índice de Desenvolvimento Humano em 2000 (Norte [0,527] e Nordeste [0,516] ou Sul [0,660], Sudeste [0,676] e Centro-Oeste [0,639])19.
Além disso, os locais de assistência médica foram avaliados quanto ao seu nível de acreditação oncológica no SUS: Centro de Assistência de Alta Complexidade em Oncologia (Cacon), com recursos multidisciplinares para tratar qualquer tipo de câncer, ou Unidade de Assistência de Alta Complexidade em Oncologia (Unacon), com recursos para tratar os cinco tipos mais comuns de câncer no país ou outros (serviços de radioterapia isolados, serviços de radioterapia hospitalar, hospitais especializados em tratamento de câncer, hospitais gerais que oferecem cirurgia de câncer) ou dados faltantes20; e quanto ao estádio clínico do câncer no diagnóstico: inicial – I e II, doença localizada, – ou avançado – III e IV, com envolvimento de linfonodos e/ou metástase – ou dados faltantes21,22. A imputação de dados foi realizada para reduzir a quantidade de dados ausentes da variável estádio clínico no intuito de reduzir o viés de seleção e assegurar maior representatividade dos casos na análise dos padrões de tratamento. A imputação foi realizada seguindo uma metodologia previamente validada no contexto dos Registros Hospitalares de Câncer, conforme descrito por Valerio et al.23
As análises estatísticas foram conduzidas usando Stata 15.024 (StataCorp LLC). Para avaliar a concordância entre os dados imputados e reais no estadiamento clínico, o coeficiente Kappa25 ajustado foi usado. Para isso, os casos para os quais os dados do estádio clínico estavam disponíveis foram selecionados e uma nova variável foi criada com o estádio imputado (Quadro 1). Valores abaixo de 0,40 indicaram baixa concordância; valores entre 0,40 e 0,75 indicaram concordância moderada e valores acima de 0,75 indicaram alta concordância.
Quadro 1. Metodologia utilizada para imputação de dados de estadiamento clínico
|
Passo |
Variáveis consideradas |
Critérios de classificação |
|
1 |
Os dados ausentes foram corrigidos de acordo com a Classificação de Tumores Malignos |
T1 e T2 = estádio inicial |
|
T3 e T4 = estádio avançado |
||
|
2 |
Os dados ausentes restantes após a etapa 1 foram corrigidos de acordo com o motivo principal do não tratamento |
Doença avançada, incapaz de tratar, ou outras doenças associadas = estádio avançado |
|
3 |
Os dados ausentes restantes após a etapa 2 foram corrigidos de acordo com o primeiro tratamento recebido no hospital |
Cirurgia = estádio inicial |
|
Quimioterapia = estádio avançado
|
||
|
4 |
Os dados ausentes restantes após a etapa 3 foram corrigidos de acordo com o estadiamento da doença no final do primeiro tratamentoa |
Óbito = estádio avançado
|
|
5 |
Os dados ausentes restantes após a etapa 4 foram corrigidos de acordo com o motivo principal do não tratamento |
Óbito = estádio avançado
|
Nota: a Para o Estado de São Paulo, a etapa 4 não foi realizada pois não havia registros dessa variável no banco de dados consultado.
Em seguida, foram analisados os números absolutos e frequências relativas do primeiro modo de tratamento após o diagnóstico (cirurgia, quimioterapia ou radioterapia) por tipo de câncer e de acordo com as demais variáveis. Foi utilizado o teste de qui-quadrado para proporções, considerando o valor de p e o tamanho do efeito. Para obtenção do tamanho do efeito, foram utilizados o 𝑊 de Cohen (para variáveis com duas categorias) e o 𝑉 de Cramér (para a variável com três categorias [local de tratamento]) associado ao teste qui-quadrado. Para o 𝑊 de Cohen, o tamanho do efeito de 0,10 a 0,29 foi classificado como fraco, 0,30 a 0,49 como moderado e > 0,50 como forte. Para o 𝑉 de Cramér, o tamanho do efeito de 0,07 a 0,20 foi classificado como fraco, 0,21 a 0,34 como moderado e > 0,35 como forte26.
RESULTADOS
Dados de 1.204.222 pacientes foram incluídos (Figura 1). No entanto, observa-se que a distribuição dos casos não foi homogênea ao longo do período investigado, pois a cobertura do Módulo Integrador do RHC aumentou ao longo dos anos, de 45 hospitais em 2000 para 176 em 2005, 268 em 2012 e 320 em 2019.
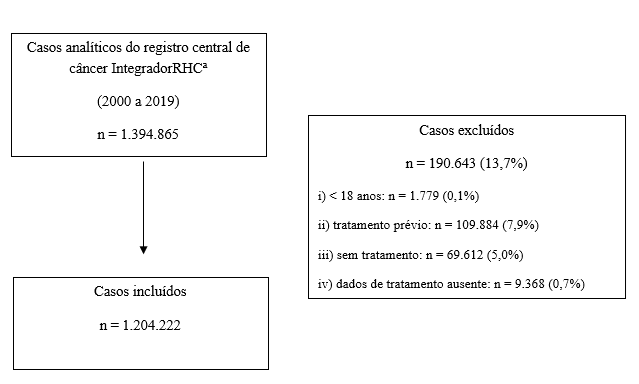
Figura 1. Fluxograma de seleção de casos analíticos do Módulo Integrador dos Registros Hospitalares de Câncer
Nota: a Casos analíticos de pacientes diagnosticados com câncer de mama feminino, próstata, colorretal, pulmão, estômago e colo do útero, com características invasivas, ou seja, excluindo tumores in situ.
Como resultado da imputação dos dados do estadiamento clínico, o número de dados ausentes foi reduzido de 324.992 (27,0%) para 70.631 (5,9%), correspondendo a 21,1% de recuperação (Figura Suplementar 1). Houve concordância moderada (Kappa = 0,64) entre os dados imputados e os reais.
No geral, a cirurgia foi a modalidade de tratamento mais frequentemente adotada como primeira intervenção após o diagnóstico, principalmente para o câncer de mama (62,5%), estômago (62,1%) e colorretal (60,3%) (Tabela 1).
Tabela 1. Valor absoluto e percentual da primeira modalidade de tratamento recebida por pacientes diagnosticados com os seis tipos mais comuns de câncer invasivo no Brasil de 2000 a 2019
|
Tratamento |
Tipos de câncer invasivo |
||||||
|
Mama |
Próstata |
Colorretal |
Pulmão |
Estômago |
Colo do útero |
Total |
|
|
Cirurgia |
|
|
|
|
|
|
|
|
Sim |
230.228 |
130.992 |
108.308 |
23.969 |
55.954 |
62.346 |
549.451 |
|
(62,5%) |
(43,4%) |
(60,3%) |
(22,7%) |
(62,1%) |
(39,1%) |
|
|
|
Não |
137.932 |
170.640 |
71.156 |
81.493 |
34.222 |
96.982 |
592.425
|
|
(37,5%) |
(56,6%) |
(39,7%) |
(77,3%) |
(37,9%) |
(60,9%) |
|
|
|
Quimioterapia |
|
|
|
|
|
|
|
|
Sim |
99.315 |
17.051 |
42.682 |
47.814 |
26.123 |
21.931 |
254.916
|
|
(27,0%) |
(5,6%) |
(23,8%) |
(45,3%) |
(29,0%) |
(13,8%) |
|
|
|
Não |
268.845 |
284.581 |
136.782 |
57.648 |
64.053 |
137.397 |
949.306
|
|
(73,0%) |
(94,4%) |
(76,2%) |
(45,3%) |
(71,0%) |
(86,2%) |
|
|
|
Radioterapia |
|
|
|
|
|
|
|
|
Sim |
23.464 |
23.464 |
25.583 |
29.893 |
5.348 |
72.460 |
150.319
|
|
(6,4%) |
(6,4%) |
(14,3%) |
(28,3%) |
(5,9%) |
(45,5%) |
|
|
|
Não |
344.696 |
344.696 |
153.881 |
75.569 |
84.828 |
86.868 |
1.090.538
|
|
(93,6%) |
(93,6%) |
(85,7%) |
(71,7%) |
(94,1%) |
(54,5%) |
|
|
Nas mulheres com câncer de mama, a realização de cirurgia foi menos frequente entre aquelas que viviam no Norte e Nordeste (54,4%, efeito fraco), tratadas em Unacon (56,9%, efeito fraco) e, especialmente, naquelas diagnosticadas em estádio avançado (36,8%, efeito forte). Por outro lado, a quimioterapia foi menos utilizada em pacientes idosas (30,5%, efeito fraco), enquanto apresentou maior frequência entre aquelas residentes no Norte e Nordeste (35,8%, efeito fraco), tratadas em Unacon (30,9%, efeito fraco) e com doença em estádio avançado (52,9%, efeito forte) (Figura 2 e Tabela Suplementar 1).
Entre os homens com câncer de próstata, a probabilidade de realização de cirurgia foi menor em idosos (39,3%, efeito fraco), em pacientes atendidos em Unacon (32,5%, efeito moderado) e naqueles diagnosticados em estádio avançado da doença (33,0%, efeito fraco). A quimioterapia foi mais frequentemente utilizada nos casos de doença avançada (15,2%, efeito fraco), enquanto a radioterapia foi menos frequente em homens de raça/cor da pele não branca (18,4%, efeito fraco) (Figura 2 e Tabela Suplementar 2).
No câncer colorretal, observou-se menor frequência de cirurgia entre pacientes residentes no Norte e Nordeste (47,3%, efeito fraco), atendidos em Unacon (55,0%, efeito fraco) e naqueles diagnosticados em estádio avançado (49,0%, efeito moderado). A quimioterapia também foi menos frequentemente utilizada entre pacientes tratados em Unacon (30,4%, efeito fraco) e naqueles com doença avançada (37,6%, efeito moderado) (Figura 2 e Tabela Suplementar 3).
Para o câncer de pulmão, pacientes em estádio avançado apresentaram menor probabilidade de serem submetidos à cirurgia (11,6%, efeito forte) e maior probabilidade de receberem quimioterapia (56,3%, efeito forte) e radioterapia (29,1%, efeito fraco). No entanto, tanto a quimioterapia (53,7%, efeito fraco) quanto a radioterapia (20,5%, efeito fraco) foram menos frequentemente indicadas para pacientes atendidos em Unacon (Figura 2 e Tabela Suplementar 4).
Entre os pacientes com câncer gástrico, o tratamento cirúrgico foi menos frequente nos atendidos em Unacon (57,0%, efeito fraco), assim como a quimioterapia (34,1%, efeito fraco). Adicionalmente, aqueles com em estádio avançado apresentaram menor probabilidade de serem submetidos à cirurgia (45,2%, efeito forte) e maior probabilidade de receberem quimioterapia (46,4%, efeito forte) (Figura 2 e Tabela Suplementar 5).
Entre as mulheres com câncer do colo do útero, observou-se menor frequência de cirurgia entre as idosas (25,7%, efeito fraco), com baixa escolaridade (36,5%, efeito fraco) e residentes nas Regiões Norte e Nordeste (32,6%, efeito fraco). Esses mesmos grupos apresentaram maior frequência de radioterapia (57,8%, 48,2% e 51,7%, respectivamente; todos com efeito fraco). Pacientes em estádio avançado tiveram menor probabilidade de serem submetidos à cirurgia (11,3%, efeito forte) e maior probabilidade de receberem quimioterapia (25,9%, efeito moderado) e radioterapia (61,6%, efeito forte). A frequência de quimioterapia também foi maior para pacientes tratados em Unacon (17,5%, efeito fraco) (Figura 2 e Tabela Suplementar 6).
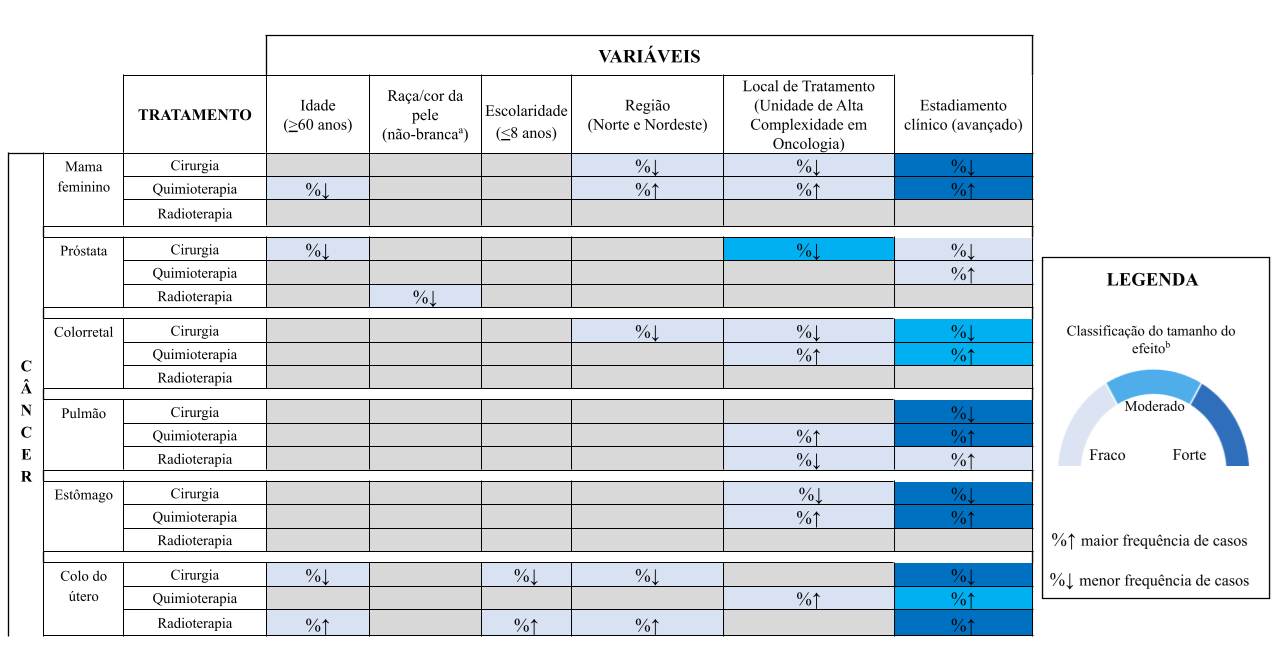
Figura 2. Classificação do tamanho de efeito das características relacionadas à primeira modalidade de tratamento recebida por pacientes diagnosticados com os seis tipos mais comuns de câncer invasivo no Brasil, de acordo com o tamanho do efeito
Nota: a negro, asiático, pardo e indígena. b Para o 𝑊 de Cohen (para variáveis com duas categorias), tamanho de 0,10 a 0,29 foi classificado como fraco, 0,30 a 0,49 como moderado e > 0,50 como forte. Para o 𝑉 de Cramer (para a variável [local de tratamento] com três categorias), tamanho de 0,07 a 0,20 foi classificado como fraco, 0,21 a 0,34 como moderado e > 0,35 como forte25.
DISCUSSÃO
Este estudo demonstrou, de forma inédita no contexto brasileiro, os padrões de tratamento adotados para os seis tipos mais comuns de câncer invasivo, considerando variáveis clínicas e sociodemográficas. De maneira consistente entre todos os tipos de câncer avaliados, os pacientes diagnosticados em estádio avançado receberam mais frequentemente o tratamento quimioterápico e foram menos propensos a serem submetidos à cirurgia. Além disso, características como idade, anos de escolaridade, cor da pele, Região geográfica de residência e o nível de acreditação oncológica do local de tratamento impactaram os padrões de tratamento, apresentando tamanhos de efeito que variaram de fraco a forte, a depender do tipo de câncer e da modalidade terapêutica considerada.
Os resultados deste estudo reforçam a importância da atenção primária à saúde na prevenção e rastreamento de, pelo menos, quatro dos seis tipos mais comuns de câncer na população brasileira. A efetividade dessas estratégias teria o potencial de reduzir tanto a demanda por cuidados oncológicos de alta complexidade quanto a mortalidade, especialmente em Regiões com acesso mais restrito aos serviços especializados27.
Além disso, esses resultados também são indicativos de desigualdade no acesso ao tratamento do câncer no Brasil. A identificação desses elementos pode auxiliar no direcionamento de investimentos estratégicos, na formulação de políticas públicas e na definição de prioridades em termos de programas de saúde no país, uma vez que há necessidade de aumentar a eficiência do sistema de saúde, melhorando as taxas de diagnóstico precoce e a adequação do atendimento. O acesso ao tratamento adequado, além de ser um imperativo ético, é essencial para garantir a sustentabilidade econômica do SUS, promovendo a equidade e a priorização de grupos historicamente vulnerabilizados4,13.
O estadiamento do câncer no momento do diagnóstico deve ser entendido como o principal determinante do tratamento. Como previsto nas diretrizes clínicas, a extensão da doença é um dos principais fatores considerados na elaboração dos planos terapêuticos, sendo a cirurgia a primeira modalidade de escolha em casos de diagnóstico precoce20. O diagnóstico em estadiamento avançado (III ou IV) implica em tratamentos mais agressivos, mais caros e com pior prognóstico28. Em geral, o custo do tratamento de um paciente com câncer em estádio avançado é substancialmente maior do que o do tratamento de um câncer em estádio inicial29. Embora seja bem estabelecido que o potencial de cura é maior quando o câncer é diagnosticado em estádio inicial, no Brasil há um incremento no número de diagnósticos em estádios avançados30, tornando a abordagem curativa menos viável.31
Além disso, indícios consistentes de subtratamento foram verificados em pacientes com 60 anos ou mais, caracterizado por menor frequência de quimioterapia no câncer de mama, menor frequência de cirurgia no câncer de próstata e, no câncer do colo do útero, menor taxa de cirurgia associada a maior uso de radioterapia. Apesar de a idade avançada não ser, isoladamente, uma contraindicação para certos tratamentos, há uma tendência geral de que pacientes com câncer de maior faixa etária não sejam expostos a terapias mais agressivas. Esse fenômeno, frequentemente, decorre da avaliação centrada na idade cronológica, desconsiderando parâmetros clínicos mais robustos, como idade biológica, funcionalidade, cognição, estado nutricional e suporte social. Tal abordagem perpetua o risco de decisões equivocadas, associando envelhecimento de forma automática à fragilidade32.
Superar essas barreiras exige a adoção de critérios mais precisos, baseados em avaliações multidimensionais, para assegurar que as decisões terapêuticas considerem riscos, benefícios, toxicidade e potencial impacto na qualidade de vida33. Vale destacar que, embora pacientes idosos apresentem, em média, cerca de cinco comorbidades no momento do diagnóstico, nem todas são relevantes no aumento da susceptibilidade à toxicidade dos tratamentos34.
Outro importante resultado do estudo foi a disparidade racial no acesso às terapias, particularmente no câncer de próstata, cujos pacientes de cor da pele não branca apresentaram menor probabilidade de receber radioterapia. Embora a literatura científica já tenha documentado que a redução das desigualdades sociais e a ampliação da cobertura dos serviços de saúde são fundamentais para o controle efetivo do câncer, as disparidades raciais e étnicas persistem, refletindo o racismo estrutural que atravessa os sistemas de saúde35. Estudos prévios corroboram esses resultados, demonstrando que homens negros possuem menor probabilidade de receber tratamento adequado, em comparação a homens brancos36.
Também se observou que mulheres com câncer do colo do útero e menor escolaridade apresentaram menor probabilidade de receber cirurgia e radioterapia, indicando um claro gradiente social no acesso ao tratamento. O fortalecimento das políticas educacionais é uma estratégia estruturante, que não apenas melhora os indicadores de saúde, mas também promove maior adesão aos programas de rastreamento e diagnóstico precoce, especialmente para o câncer do colo do útero37,38.
Os resultados apontaram também que os padrões de tratamentos variaram de acordo com a Região geográfica do país, refletindo as históricas desigualdades no desenvolvimento socioeconômico do país. O Brasil, com suas dimensões continentais, enfrenta desafios estruturais que impactam diretamente o acesso a serviços de saúde, particularmente nas Regiões Norte e Nordeste. Nessas Regiões, observou-se menor frequência de cirurgia e maior uso de quimioterapia no câncer de mama, menor realização de cirurgia no câncer colorretal e menor frequência de cirurgia, além do maior uso de radioterapia no câncer do colo do útero. Esses resultados refletem as limitações de infraestrutura, de recursos humanos especializados e de financiamento30.
A distribuição desigual dos serviços oncológicos no país dificulta o acesso a eles. O Norte e o Nordeste são as Regiões com a oferta mais limitada de serviços de saúde, incluindo a oncologia, que se concentram mais no Sul e Sudeste do país. Dos 449 estabelecimentos credenciados para fornecer algum tipo de serviço especializado em câncer no país, 102 (23%) estão localizados no Sul e 220 (49%) no Sudeste39. Nesse cenário, é possível inferir que a ampliação da rede de serviços especializados, combinada com estratégias de redução das desigualdades socioeconômicas, poderia contribuir para a redução do subtratamento e da mortalidade por câncer em populações mais vulneráveis.
Outro fator relevante identificado foi o impacto do nível de acreditação dos serviços oncológicos sobre os padrões de tratamento. Pacientes atendidos em serviços com menor nível de acreditação tiveram menor acesso à cirurgia e maior probabilidade de receber quimioterapia, independentemente do tipo de câncer. Esse resultado reforça que os Cacon, por contarem com equipes multiprofissionais, tecnologias de ponta e infraestrutura adequada, oferecem maiores possibilidades de tratamentos curativos. Esse cenário evidencia a necessidade de um planejamento mais equitativo na distribuição desses centros no território nacional, especialmente diante do aumento projetado da incidência de câncer3 e da crescente demanda por cuidados oncológicos especializados. Além disso, torna-se imprescindível fortalecer a articulação entre as Redes de Atenção à Saúde – federal, estadual e municipal –, assegurando fluxos eficientes de encaminhamento, de modo que os pacientes possam acessar tratamentos compatíveis com o estádio da doença e as melhores práticas clínicas disponíveis39.
Uma limitação deste estudo é a dificuldade em estimar o quão completa é a investigação dos casos e a qualidade dos registros do Módulo integrador do RHC. Especificamente, algumas variáveis que seriam cruciais para otimizar o uso potencial do banco de dados muitas vezes estão ausentes, como o estadiamento clínico da doença24, os resultados da imuno-histoquímica e outros marcadores prognósticos, além da presença de comorbidades. Neste estudo, as lacunas de dados sobre o estadiamento clínico foram imputadas seguindo uma metodologia previamente validada no contexto dos RHC24, alcançando uma taxa de recuperação semelhante à encontrada por Valerio et al.23 e concordância moderada entre os dados imputados e os reais. Esse procedimento teve como objetivo restaurar a completude de uma variável determinante para que os padrões de tratamento dos casos ocorridos nas diferentes Regiões do país pudessem ser avaliados de forma fidedigna, representativa e metodologicamente robusta.
Vale destacar também o uso de um longo período histórico (2000 a 2019), que abrangeu grandes mudanças na organização do atendimento oncológico no país e o aumento do número de hospitais incluídos no RHC nacional. No início do ano 2000, por exemplo, a maioria das cirurgias oncológicas era realizada em hospitais gerais, não em centros oncológicos especializados, e, portanto, os dados sobre estas não eram incluídos no Módulo integrador do RHC. Além disso, as regulamentações para assistência médica privada também mudaram ao longo desse período, incluindo diferentes regras de cobertura do tratamento oncológico e a inclusão de medicamentos quimioterápicos que antes estavam disponíveis apenas no sistema público de saúde.
Ressalta-se que o banco de dados utilizado é uma fonte sistemática de informações sobre casos de câncer diagnosticados e tratados em hospitais de todo o país. Para minimizar a inclusão de registros duplicados, foram considerados apenas os casos analíticos17. Vale destacar também o alto número de casos incluídos que, juntamente com a seleção de casos analíticos e a exclusão de tumores in situ, contribuíram para a obtenção de resultados importantes, analisados sob a perspectiva do tamanho do efeito. Devido ao tamanho da população estudada (1.204.222 pacientes), modelos de regressão múltipla podem produzir resultados estatisticamente significantes, porém com baixa relevância prática. O tamanho do efeito é um indicador padronizado, específico para cada teste estatístico e que, diferentemente do valor de p, não depende do tamanho da amostra26. Por esse motivo, priorizou-se o uso do tamanho do efeito, que oferece uma interpretação mais robusta sobre a magnitude das associações, independentemente do tamanho amostral.
Estudos aprofundados sobre o assunto são necessários, envolvendo análises regionalizadas e multidimensionais e investigações de mudanças longitudinais nos padrões de tratamento, para melhor elucidar outras questões e avançar o conhecimento científico. Entender os padrões de tratamento para os milhares de pacientes com os seis tipos mais comuns de câncer invasivo no Brasil é importante para informar o planejamento e o desenvolvimento de soluções estratégicas para o tratamento apropriado e oportuno do câncer no país. Além disso, essas informações podem ser úteis para debates sobre inclusão social e vulnerabilidade programática em nível individual, social e político.
Considerando o aumento projetado no número de novos casos de câncer no país3, espera-se que esses resultados estimulem instituições acadêmicas e pesquisadores a buscarem mais evidências e que eles incentivem outros atores, como governos, prestadores de serviços de saúde e organizações médicas, a tomarem ações destinadas a melhorar o padrão de tratamento do câncer em todo o país. Ações desse tipo são essenciais para melhorar o prognóstico de pacientes com câncer no Brasil.
CONCLUSÃO
O estadiamento do câncer no momento do diagnóstico é o principal definidor do modo de tratamento recebido. Variáveis demográficas também estão associadas ao acesso limitado a diferentes opções terapêuticas.
CONTRIBUIÇÕES
Livia Costa de Oliveira e Luiz Claudio Santos Thuler delinearam o estudo, analisaram e interpretaram os dados. Todos os autores redigiram, revisaram criticamente o conteúdo do manuscrito e aprovaram a versão final a ser publicada.
DECLARAÇÃO DE CONFLITOS DE INTERESSE
A autora Anke Bergmann declara potencial conflito de interesses pela condição de ser a editora-científica da Revista Brasileira de Cancerologia do INCA. Os demais autores não possuem conflito de interesses.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS
Os dados utilizados no presente estudo estão disponíveis na página do INCA em https://irhc.inca.gov.br/RHCNet/.
FONTES DE FINANCIAMENTO
Este estudo foi financiado pela Fundação Carlos Chagas Filho de Amparo à Pesquisa do Estado do Rio de Janeiro (Faperj) (E_33/2021).
REFERÊNCIAS
1. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-63. doi: https://doi.org/10.3322/caac.21834
2. Cancela MC, Souza DLB, Martins LFL, et al. Can the sustainable development goals for cancer be met in Brazil? A population-based study. Front Oncol. 2023;12:1060608. doi: https://doi.org/10.3389/fonc.2022.1060608
3. Santos MO, Lima FCS, Martins LFL, et al. Estimativa de incidência de câncer no Brasil, 2023-2025. Rev Bras Cancerol. 2023;69(1):e-213700. doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n1.3700
4. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde, Departamento de Análise em Saúde e Vigilância de Doenças Não Transmissíveis. Plano de ações estratégicas para o enfrentamento das doenças crônicas e agravos não transmissíveis no Brasil 2021-2030 [Internet]. Brasília (DF): Ministério da Saúde; 2021. [Acesso 2025 mar 13]. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/plano_enfrentamento_doencas_cronicas_agravos_2021_2030.pdf
5. Ministério da Saúde (BR). Secretaria de Atenção à Saúde. Protocolos clínicos e diretrizes terapêuticas em Oncologia [Internet]. Brasília (DF): Ministério da Saúde; 2014. [Acesso 2025 mar 13]. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/protocolos_clinicos_diretrizes_terapeuticas_oncologia.pdf
6. Shafaee MN, Silva LR, Ramalho S, et al. Breast cancer treatment delay in SafetyNet health systems, Houston versus southeast Brazil. Oncologist. 2022;27(5):344-51. doi: https://doi.org/10.1093/oncolo/oyac050
7. Barroso-Sousa R, Fernandes G. Oncologia: princípios e prática clínica. Santana de Parnaíba: Manole; 2023.
8. Lee YT, Tan YJ, Oon CE. Molecular targeted therapy: treating cancer with specificity. Eur J Pharmacol. 2018;834:188-96. doi: https://doi.org/10.1016/j.ejphar.2018.07.034
9. Yilmaz E, Ismaila N, Bauman JE, et al. immunotherapy and biomarker testing in recurrent and metastatic head and neck cancers: ASCO guideline. J Clin Oncol. 2023;41(5):1132-46. doi: https://doi.org/10.1200/jco.22.02328
10. Burstein HJ, Lacchetti C, Anderson H, et al. Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: ASCO clinical practice guideline focused update. J Clin Oncol. 2019;37(5):423-38. doi: https://doi.org/10.1200/jco.18.01160
11. Herrmann K, Schwaiger M, Lewis JS, et al. Radiotheranostics: a roadmap for future development. Lancet Oncol. 2020;21(3):e146-56. doi: https://doi.org/10.1016/s1470-2045(19)30821-6
12. Morris ZS, Wang AZ, Knox SJ. The radiobiology of radiopharmaceuticals. Semin Radiat Oncol. 2021;31(1):20-7. doi: https://doi.org/10.1016/j.semradonc.2020.07.002
13. Manzano A, Svedman C, Hofmarcher T, et al Comparator report on cancer in Europe 2025: disease burden, costs and access to medicines and molecular diagnostics [Internet]. Lund: The Swedish Institute for Health Economics; 2025. [Acesso 2025 mar 28]. Disponível em: https://efpia.eu/media/nbbbsbhp/ihe-comparator-report-on-cancer-in-europe-2025.pdf
14. Santos Junior ECA, Silva GA, Paiva NS. Qualidade dos dados dos registros hospitalares de câncer: uma análise dos casos cadastrados de câncer no brasil entre 2000 e 2020. Rev Bras Cancerol. 2024;70(1):e-224568. doi: https://doi.org/10.32635/2176-9745.RBC.2024v70n1.4568
15. Conselho Nacional de Saúde (BR). Resolução n° 510, de 7 de abril de 2016. Dispõe sobre as normas aplicáveis a pesquisas em Ciências Humanas e Sociais cujos procedimentos metodológicos envolvam a utilização de dados diretamente obtidos com os participantes ou de informações identificáveis ou que possam acarretar riscos maiores do que os existentes na vida cotidiana, na forma definida nesta Resolução [Internet]. Diário Oficial da União, Brasília, DF. 2016 maio 24 [acesso 2025 abr 7]; Seção 1:44. Disponível em: http://bvsms.saude.gov.br/bvs/saudelegis/cns/2016/res0510_07_04_2016.html
16. World Health Organization. International Statistical Classification of Diseases and Related Health Problems [Internet]. 10. Rev. Geneva: WHO; 2016. [Acesso em 2025 abr 7]. Disponível em: https://icd.who.int/browse10/2016/en#/II
17. Instituto Nacional de Câncer. Registros hospitalares de câncer: rotinas e procedimentos [Internet]. Rio de Janeiro: INCA; 2000. [Acesso 2023 mar 13]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/registros-hospitalares-de-cancer-2000.pdf
18. Petruccelli JL. Autoidentificação, identidade étnico-racial e heteroclassificação [Internet]. In: Petruccelli JL, Saboia AL, organizadores. Características étnico-raciais da população: classificações e identidades. Rio de Janeiro: IBGE; 2013. [Acesso 2023 fev 4]. Disponível em: https://diepafro.ufu.br/sites/diepafro.ufu.br/files/media/document/ibge_caracteristicas_etnico-raciais_da_populacao-classificacoes_e_identidades.pdf
19. Atlas do desenvolvimento humano no Brasil [Internet]. [sem local]: Pnud Brasil, Ipea e FJP; 2022. Consulta em tabela, 2022. [Acesso 2025 fev 4]. Disponível em: http://www.atlasbrasil.org.br/consulta/planilha
20. Ministério da Saúde (BR), Secretaria de Atenção Especializada à Saúde, Departamento de Regulação, Avaliação e Controle, Coordenação-Geral de Gestão Dos Sistemas de Informações em Saúde. Oncologia: manual de bases técnicas [Internet]. 30. ed. Brasília, DF: Ministério da Saúde; 2022. [Acesso 2025 mar 13]. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/manual_oncologia_29a_edicao_-_junho_2022.pdf
21. Brierley JD, Gospodarowicz M, Wittekind CH, editors. TNM Classification of Malignant Tumours. 8. ed. Chichester, West Sussex: Wiley Blackwell; 2017.
22. Amant F, Mirza MR, Koskas M, et al. Cancer of the corpus uteri. Int J Gynecol Obstet. 2018;143(2):37-50. doi: https://doi.org/10.1002/ijgo.12612
23. Valerio TS, Silva MJS, Campos MR, et al. Registros hospitalares de câncer: proposta metodológica para correção do estadiamento de câncer de pulmão. Rev Bras Cancerol. 2023;69(2):e-093753.doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n2.3753
24. StataR [Internet]. Versão 15.0. Lakeway: StataCorp LLC; 1996-2024c. [acesso 2023 nov 20]. Disponível em: https://www.stata.com/
25. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics.1977;33(1):159-75.
26. Cohen J. Statistical Power Analysis for the Behavioral Sciences. Hillsdale: Erlbaum; 1988.
27. Presidência da República (BR). Lei n°14.758, de 19 de dezembro de 2023. Institui a Política Nacional de Prevenção e Controle do Câncer no Sistema Único de Saúde (SUS) e o Programa Nacional de Navegação da Pessoa com Diagnóstico de câncer; e altera a Lei nº 8.080, de 19 de setembro de 1990 (Lei Orgânica da Saúde) [Internet]. Diário Oficial da União, Brasília, DF. 2023 dez 20 [Acesso 2025 mar 13]; Edição 241; Seção 1:1. Disponível em: https://www.in.gov.br/en/web/dou/-/lei-n-14.758-de-19-de-dezembro-de-2023-532172581
28. Lana AP, Perelman J, Andrade EIG, et al. Cost analysis of cancer in Brazil: a population-based study of patients treated by public health system from 2001-2015. Value Health Reg Issues. 2020;23:137-47. doi: https://doi.org/10.1016/j.vhri.2020.05.008
29. Lobo TC. Quanto custa tratar um paciente com câncer no SUS em 2016 [Internet]. São Paulo: Observatório de Oncologia; 2016. [Acesso 2023 jun 13]. Disponível em: https://observatoriodeoncologia.com.br/estudos/cancer-de-sangue/mieloma-multiplo/2016/quanto-custa-tratar-um-paciente-com-cancer-no-sus-em-2016/
30. Oliveira LC, Rosa KSC, Bergmann A, et al. Temporal trends and factors associated with the cancer diagnosed at stage IV in patients included in the integrated hospital-base cancer registry system in Brazil in two decades. Cancer Epidemiol. 2022;80:102242. doi: https://doi.org/10.1016/j.canep.2022.102242
31. Academia Nacional de Cuidados Paliativos (BR). Panorama dos cuidados paliativos no Brasil [Internet]. São Paulo: ANCP; 2018. [Acesso 2025 mar 13]. Disponível em: https://paliativo.org.br/wp-content/uploads/2018/10/Panorama-dos-Cuidados-Paliativos-no-Brasil-2018.pdf
32. DuMontier C, Loh KP, Bain PA, et al. Defining undertreatment and overtreatment in older adults with cancer: a scoping literature review. J Clin Oncol. 2020;38(22):2558-69. doi: https://doi.org/10.1200/jco.19.02809
33. Costa GJ, Mello MJG, Ferreira CG, et al. Undertreatment trend in elderly lung cancer patients in Brazil. J Cancer Res Clin Oncol. 2017;143(8):1469-75. doi: https://doi.org/10.1007/s00432-017-2412-8
34. Freedman RA, Sedrak MS, Tew WP, et al. Does undertreatment with chemotherapy impact the outcomes of older patients with early-stage breast cancer? Clin Breast Cancer. 2025;25(3):e123-30.
35. Thuler LCS, Hartz Z. Big data em pesquisas populacionais sobre câncer: desafios e oportunidades. Rev Bras Cancerol. 2019;65(4):e-03718. doi: https://doi.org/10.32635/2176-9745.RBC.2019v65n4.718
36. Yamoah K, Lee KM, Awasthi S, et al. Racial and ethnic disparities in prostate cancer outcomes in the united states: a population-based cohort study. JAMA Netw Open. 2021;4(11):e2134230.
37. Page CM, Ibrahim S, Park LP, et al. Patient factors affecting successful linkage to treatment in a cervical cancer prevention program in Kenya: a prospective cohort study. PLoS One. 2019;14(9):e0222750. doi: https://doi.org/10.1371/journal.pone.0222750
38. Thuler LC, Aguiar SS, Bergmann A. Determinants of late stage diagnosis of cervical cancer in Brazil. Rev Bras Ginecol Obstet. 2014;36(6):237-43. doi: https://doi.org/10.1590/s0100-720320140005010
39. Machado AS, Machado AS, Guilhem BD. Profile of hospitalizations for neoplasms in the Brazilian Unified Health System: a time-series study. Rev Saúde Pública. 2021;55:83. doi: https://doi.org/10.11606/s1518-8787.2021055003192
Recebido em 31/1/2025
Aprovado em 2/6/2025
Editora-executiva: Letícia Casado. Orcid iD: https://orcid.org/0000-0001-5962-8765
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.