Perfil do Tratamento Quimioterápico de Pacientes com Câncer Colorretal em um Hospital do Rio de Janeiro, Brasil
Profile of Chemotherapeutic Treatment of Patients with Colorectal Cancer in a Hospital in Rio de Janeiro, Brazil
Perfil del Tratamiento Quimioterápico de Pacientes con Cáncer Colorrectal en un Hospital de Río de Janeiro, Brasil
https://doi.org/10.32635/2176-9745.RBC.2025v71n3.5223
Eduardo Rodrigues Pereira1; Mario Jorge Sobreira-da-Silva2
1,2Instituto Nacional de Câncer (INCA), Coordenação de Ensino (Coens). Rio de Janeiro (RJ), Brasil. E-mails: edurodriguesp@oulook.com; mario.silva@inca.gov.br. Orcid iD: https://orcid.org/0009-0009-5148-0626; Orcid iD: https://orcid.org/0000-0002-0477-8595
Endereço para correspondência: Mario Jorge Sobreira da Silva. Rua Marquês de Pombal, 125 – Centro. Rio de Janeiro (RJ), Brasil. CEP 20230-240. E-mail: mjsobreira@yahoo.com.br
RESUMO
Introdução: O câncer colorretal é uma das principais causas de morte por câncer. É possível observar diferenças em relação ao tratamento quimioterápico ao comparar as diretrizes do Ministério da Saúde com as de sociedades científicas. Nesse contexto, estudos com dados de mundo real podem fornecer evidências quanto à necessidade de ajustes dos esquemas em uso. Objetivo: Identificar o perfil do tratamento quimioterápico de pacientes com câncer colorretal em um hospital especializado em oncologia. Método: Estudo de utilização de medicamentos a partir dos dados registrados em prontuário físico ou eletrônico, resultados de exames histopatológicos e prescrições de quimioterapia. As variáveis foram agrupadas em três categorias: sociodemográfica, clínica e tratamento. Estimou-se a sobrevida global em 24 meses pelo método de Kaplan-Meier. Resultados: O esquema de associação de capecitabina e oxaliplatina foi o mais prescrito, com uso em todas as finalidades terapêuticas. Os esquemas neoadjuvantes associados à radioterapia foram exclusivamente para o câncer retal. O esquema de associação de fluoruracila e ácido folínico foi utilizado como adjuvante e os esquemas contendo irinotecano tiveram finalidade paliativa. A sobrevida global em 24 meses foi de 83,8% para o tratamento neoadjuvante, 86,8% para o adjuvante e 44,3% para o paliativo. Conclusão: Os esquemas terapêuticos identificados estão alinhados com o preconizado nas diretrizes do Ministério da Saúde. A maioria dos pacientes foi diagnosticada em estádios avançados, causando impacto significativo na sobrevida. Isso evidencia a necessidade de acesso a terapias mais eficazes, além de ações voltadas para o rastreamento e o acompanhamento das tendências atuais e futuras.
Palavras-chave: Neoplasias Colorretais/tratamento farmacológico; Tratamento Farmacológico; Uso de Medicamentos; Análise de Sobrevida.
ABSTRACT
Introduction: Colorectal cancer is one of the leading causes of cancer-related death. Differences can be observed in relation to chemotherapy treatment when comparing guidelines from the Brazilian Ministry of Health with those of scientific societies. In this context, real-world data studies may provide evidences regarding the necessity of adjustments of the currently used regimens. Objective: To identify the chemotherapy treatment profile of patients with colorectal cancer in an oncology hospital. Method: The study was conducted with data obtained from physical or electronic charts, histopathological test results, and chemotherapy prescriptions. The variables were grouped into three categories: sociodemographic, clinical, and treatment. Overall survival at 24 months was estimated using the Kaplan-Meier method. Results: The combined regimen of capecitabine and oxaliplatin was the most prescribed, being used for all therapeutic purposes. Neoadjuvant regimens associated with radiotherapy were exclusively for rectal cancer. The combination of fluorouracil and folinic acid was used as adjuvant therapy, and regimens containing irinotecan had palliative purpose. The overall survival at 24 months was 83.8% for neoadjuvant treatment, 86.8% for adjuvant treatment, and 44.3% for palliative treatment. Conclusion: The therapeutic regimens identified are aligned with those recommended by the guidelines of the Brazilian Ministry of Health. Most patients were diagnosed at advanced stages, which had a significant impact on survival. This highlights the necessity to access more effective therapies, further to actions focused to screening and monitoring current and future trends.
Key words: Colorectal Neoplasms/drug therapy; Drug Therapy; Drug Use; Survival Analysis.
RESUMEN
Introducción: El cáncer colorrectal es una de las principales causas de muerte por cáncer. Existen diferencias en los tratamientos quimioterapéuticos cuando se comparan las directrices del Ministerio de Salud del Brasil con las de sociedades científicas. Los estudios con datos del mundo real pueden ayudar a identificar la necesidad de ajustes en los esquemas terapéuticos actuales. Objetivo: Identificar el perfil del tratamiento quimioterapéutico de pacientes con cáncer colorrectal en un hospital especializado en oncología. Método: Estudio del uso de medicamentos a partir de datos registrados en la historia clínica física o electrónica, resultados de análisis histopatológicos y prescripciones de quimioterapia. Las variables han sido agrupadas en tres categorías: sociodemográficas, clínicas y de tratamiento. La supervivencia global a 24 meses fue estimada mediante el método de Kaplan-Meier. Resultados: El esquema de asociación de capecitabina y oxaliplatino fue el más prescrito, utilizado para todas las finalidades terapéuticas. Los esquemas neoadyuvantes asociados con radioterapia fueron exclusivos para el cáncer rectal. El esquema de asociación de fluorouracilo y ácido folínico se utilizó como tratamiento adyuvante, mientras que los esquemas que contenían irinotecán han tenido objetivo paliativo. La supervivencia global a 24 meses fue del 83,8% para el tratamiento neoadyuvante, 86,8% para el adyuvante y 44,3% para el paliativo. Conclusión: Los esquemas terapéuticos identificados coinciden con los recomendados en las directrices del Ministerio de Salud del Brasil. La mayoría de los pacientes fue diagnosticada en estadios avanzados, lo que impactó significativamente en la supervivencia. Esto destaca la necesidad de acceder a terapias más efectivas, además de tomar acciones enfocadas en el rastreo y el seguimiento de las tendencias actuales y futuras.
Palabras clave: Neoplasias Colorrectales/tratamiento farmacológico; Quimioterapia; Uso de Medicamentos; Análisis de Supervivencia.
INTRODUÇÃO
O câncer colorretal (CCR) se refere a tumores localizados no intestino grosso, mais especificamente no cólon e no reto. Esse tipo de câncer é o terceiro mais incidente em escala global (9,6% de novos casos em 2022, 1.926.118 casos), sendo o terceiro mais incidente em homens (10,4% dos novos casos em 2022) e em mulheres (8,9% dos novos casos em 2022). Em relação à mortalidade, o câncer colorretal foi a segunda maior causa de morte por câncer em 2022 (9,3%, 903.859 mortes)1.
No Brasil, segundo dados do Instituto Nacional de Câncer (INCA), são estimados 45.630 novos casos por ano, para o triênio 2023-2025, o que representa 9,4% dos novos casos, sendo 21.970 casos em homens (9,2% dos casos) e 23.660 casos em mulheres (9,7% dos casos)2. Segundo dados obtidos pelo Sistema de Informação sobre Mortalidade (SIM), o câncer de cólon e reto foi responsável por 23.953 mortes em 20233.
O tratamento do CCR envolve três abordagens terapêuticas recomendadas: cirurgia, radioterapia e quimioterapia. A cirurgia é o tratamento padrão nesse tipo de câncer. A radioterapia pode ser utilizada com finalidade neoadjuvante ou adjuvante nos casos de câncer de reto, além de ter objetivo paliativo nos tumores metastáticos de cólon e reto. A quimioterapia, por sua vez, é uma abordagem sistêmica que complementa o tratamento cirúrgico, sendo adjuvante ou neoadjuvante. Nos pacientes com doença em estádio metastático ou com doença recidivada inoperável, a quimioterapia pode ser utilizada com abordagem paliativa4.
As Diretrizes Diagnósticas e Terapêuticas (DDT) do Câncer de Cólon e Reto4 recomendam quimioterapia neoadjuvante apenas para o tratamento do câncer de reto nos estádios 2 e 3. O tratamento adjuvante, por sua vez, é direcionado em alguns casos de estádio 2 (lesão T4, ressecção linfonodal insatisfatória ou tumor mal diferenciado) e nos casos de estádio 3. Nesse cenário, podem ser utilizados esquemas terapêuticos baseados em fluoruracila (estádio 2) ou fluoruracila e oxaliplatina (estádio 3) tanto no câncer de cólon quanto no de reto. Além disso, no caso do câncer de reto, há opção de quimiorradioterapia adjuvante. Para pacientes em estádio 4 da doença, o tratamento quimoterápico tem indicação paliativa para ambos os tipos de câncer, e a quimiorradioterapia paliativa pode ser uma alternativa para pacientes com câncer de reto.
Ao comparar as DDT do Ministério da Saúde com diretrizes de sociedades científicas5-8, é possível observar algumas diferenças, principalmente em relação ao tratamento do CCR metastático. Enquanto as diretrizes das sociedades científicas preconizam a realização de testes moleculares para a identificação de biomarcadores no momento do diagnóstico e o uso de terapias-alvo para subgrupos moleculares específicos desde a primeira linha de tratamento paliativo5-8, as DDT não apresentam orientações para realização de testes moleculares e nem indicam o uso das terapias-alvo no primeiro esquema terapêutico4. Essas discrepâncias podem impactar, sobretudo, o acesso a terapias mais atuais por usuários da rede pública de saúde.
Dessa forma, estudos com dados de mundo real voltados para os esquemas terapêuticos em uso são fundamentais, pois podem fornecer evidências quanto à sua efetividade, a partir dos dados locais, que podem ser utilizadas como base para futuras atualizações de protocolos e diretrizes. Nesse cenário, os estudos de utilização de medicamentos permitem analisar padrões de uso e desfechos clínicos em condições reais de prática, com avaliação da adequação, segurança e efetividade dos esquemas terapêuticos, o que pode demonstrar a necessidade de adoção de novas práticas nos serviços de saúde9,10.
Portanto, o objetivo deste estudo é identificar o perfil do tratamento quimioterápico de pacientes com CCR em um hospital especializado em oncologia.
MÉTODO
Estudo de utilização de medicamentos em um hospital especializado em oncologia da cidade do Rio de Janeiro. Trata-se de uma instituição pública de alta complexidade com, aproximadamente, 200 leitos e pode ofertar todas as abordagens terapêuticas para o paciente oncológico (cirurgia, quimioterapia, radioterapia e cuidados paliativos).
Para obtenção dos dados deste estudo, foram selecionados os prontuários de pacientes diagnosticados com CCR, de acordo com a décima Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde (CID-10)11, correspondente aos códigos C18 (câncer de cólon), C19 (câncer da junção retossigmoide) e C20 (câncer de reto), que realizaram quimioterapia intravenosa e oral.
Foram incluídos no estudo pacientes de ambos os sexos, com idade igual ou maior do que 18 anos, cujo primeiro tratamento quimioterápico foi iniciado entre janeiro de 2021 e dezembro de 2022 e finalizado até dezembro de 2023.
Os critérios de exclusão foram pacientes diagnosticados com tumores colorretais não primários ou com tumores primários concomitantes, pacientes que iniciaram o tratamento sem o foco primário definido, participantes de ensaios clínicos financiados pelas indústrias farmacêuticas, além de pacientes que já haviam realizado algum tipo de tratamento oncológico ou que iniciaram tratamento em outro estabelecimento de saúde.
A coleta de dados foi realizada a partir das evoluções clínicas de profissionais de saúde da equipe multiprofissional, registradas em prontuário físico e eletrônico, resultados de exames laboratoriais e prescrições de quimioterapia. Tais informações foram obtidas a partir de sistemas eletrônicos da instituição e dos prontuários físicos dos pacientes.
As variáveis coletadas foram agrupadas em três categorias: caracterização sociodemográfica (sexo, idade, cor/raça e escolaridade); caracterização clínica (presença e quantidade de comorbidades, diagnóstico segundo a CID-1011, data do diagnóstico, diferenciação histológica, presença de mutações genéticas, estadiamento e presença e quantidade de metástases); e caracterização do tratamento (esquema terapêutico, objetivo do tratamento, realização de cirurgia e radioterapia, data de início do tratamento quimioterápico, status do tratamento). Nos casos em que houve perda de seguimento, os casos foram censurados no último dia de registro em prontuário de acompanhamento pela equipe multidisciplinar da instituição.
A análise dos dados foi realizada nos programas Microsof Excel® 365 e R®12 versão 4.4.3. Foram calculadas as frequências absoluta (n) e relativa (%) para variáveis categóricas, além de medidas de tendência central (média com desvio-padrão em variáveis com distribuição normal; mediana com intervalos interquartis nos demais casos) para variáveis numéricas. As variáveis qualitativas (nominais e ordinais) foram categorizadas a partir dos resultados obtidos e, em seguida, foram analisadas com o cálculo das frequências absoluta e relativa. Foi utilizado o teste do qui-quadrado para verificar a diferença estatística entre grupos. A sobrevida em 24 meses foi estimada pelo método de Kaplan-Meier, tendo como nível de significância 5% (p < 0,05) por meio do teste de Mantel-Cox (log rank)13.
Este estudo obedeceu aos princípios éticos estabelecidos pela Declaração de Helsinque e pelas Resoluções números 466/201214 e 510/201615 do Conselho Nacional de Saúde e recebeu aprovação do Comitê de Ética e Pesquisa com seres humanos da instituição sob o número de parecer 6.758.635 (CAAE: 78297524.9.0000.5274).
RESULTADOS
Entre os 2.779 pacientes que realizaram tratamento quimioterápico pelas vias intravenosa e oral nos anos de 2021 e 2022, 582 foram diagnosticados com CCR e, após a aplicação dos critérios de elegibilidade, 328 pacientes foram selecionados, dos quais 158 foram incluídos nas análises (Figura 1).
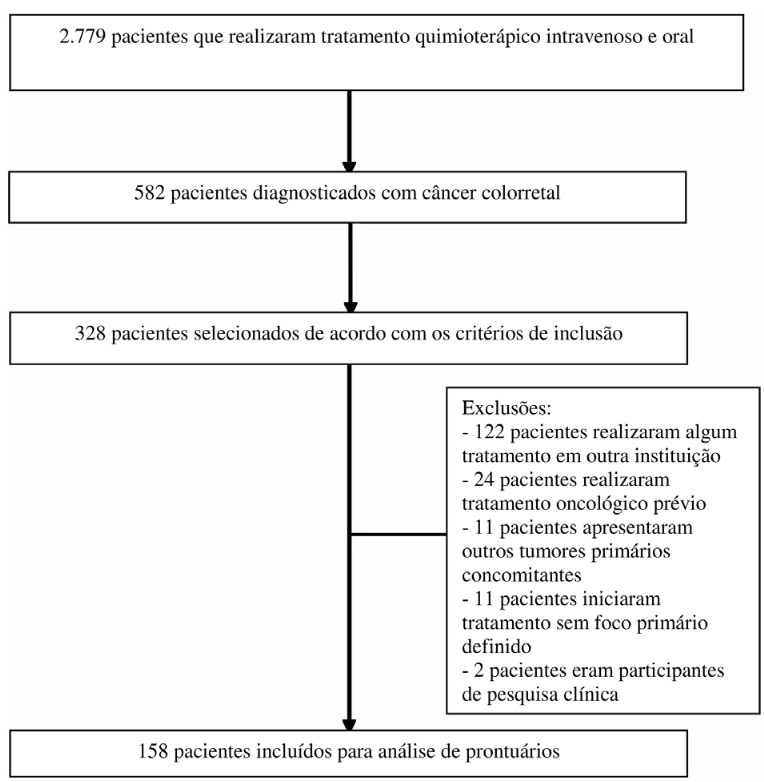
Figura 1. Fluxograma de seleção de pacientes do estudo
A Tabela 1 sintetiza os dados referentes aos perfis sociodemográficos, clínicos e terapêuticos encontrados.
Tabela 1. Perfil sociodemográfico, clínico e terapêutico de pacientes com câncer colorretal tratados com quimioterapia em um hospital especializado em oncologia, entre janeiro de 2021 e dezembro de 2022 (n = 158)
|
Categorização |
n (%) |
|
|
Sexo biológico |
Masculino |
81 (51,3%) |
|
Feminino |
77 (48,7%) |
|
|
Faixa etária |
Até 49 anos |
20 (12,7%) |
|
Entre 50 e 59 anos |
59 (37,3%) |
|
|
Entre 60 e 69 anos |
55 (34,8%) |
|
|
70 anos ou mais |
24 (15,2%) |
|
|
Raça/cor |
Branco |
36 (22,8%) |
|
Não branco |
93 (58,9%) |
|
|
Sem informação |
29 (18,3%) |
|
|
Escolaridade |
Analfabeto |
4 (2,5%) |
|
Ensino fundamental |
57 (36,1%) |
|
|
Ensino médio |
64 (40,5%) |
|
|
Ensino superior |
27 (17,1%) |
|
|
Sem informação |
6 (3,8%) |
|
|
Comorbidades |
Sim |
97 (61,4%) |
|
Não |
61 (38,6%) |
|
|
CID-10 |
C18 - Neoplasia maligna do cólon |
76 (48,1%) |
|
C19 - Neoplasia maligna da junção retossigmoide |
12 (7,6%) |
|
|
C20 - Neoplasia maligna do reto |
70 (44,3%) |
|
|
Diferenciação
|
Bem diferenciado |
5 (3,2%) |
|
Moderadamente diferenciado |
134 (84,8%) |
|
|
Pouco diferenciado |
11 (7,0%) |
|
|
Sem informação |
8 (5,0%) |
|
|
Mutações |
KRAS |
29 (18,3%) |
|
NRAS |
2 (1,3%) |
|
|
KRAS + NRAS |
1 (0,6%) |
|
|
Inconclusivo |
5 (3,2%) |
|
|
Não mutado/Selvagem |
21 (13,3%) |
|
|
Sem informação |
100 (63,3%) |
|
|
Estadiamento |
1 |
1 (0,6%) |
|
2 |
31 (19,6%) |
|
|
3 |
50 (31,7%) |
|
|
4 |
74 (46,8%) |
|
|
Sem informação |
2 (1,3%) |
|
|
Metástases
|
1 Metástase |
44 (27,8%) |
|
2 Metástases |
20 (12,7%) |
|
|
3 ou mais metástases |
10 (6,3%) |
|
|
Tratamentos utilizados |
Quimioterapia |
20 (12,7%) |
|
Cirurgia + Quimioterapia |
83 (52,5%) |
|
|
Radioterapia + Quimioterapia |
11 (7,0%) |
|
|
Cirurgia + Radioterapia + Quimioterapia |
44 (27,8%) |
|
|
Início do tratamento quimioterápico |
Até 1 mês |
9 (5,7%) |
|
De 1 mês até 3 meses |
48 (30,4%) |
|
|
De 3 meses até 6 meses |
61 (38,6%) |
|
|
De 6 meses até 1 ano |
26 (16,5%) |
|
|
Mais de 1 ano |
14 (8,9%) |
|
|
Esquemas terapêuticos utilizados em primeira linha de tratamento |
Capecitabina |
6 (3,8%) |
|
Capecitabina associada à radioterapia |
4 (2,5%) |
|
|
CAPOX |
80 (50,6%) |
|
|
CAPOX associada à radioterapia |
13 (8,2%) |
|
|
FOLFIRI |
2 (1,3%) |
|
|
FOLFOXIRI |
5 (3,2%) |
|
|
FOLFOX |
29 (18,3%) |
|
|
QUASAR |
11 (7,0%) |
|
|
Outros esquemas |
8 (5,0%) |
|
|
Finalidade do tratamento quimioterápico de primeira linha |
Neoadjuvante |
25 (15,8%) |
|
Adjuvante |
60 (38,0%) |
|
|
Paliativo |
72 (45,6%) |
|
|
Curativo |
1 (0,6%) |
|
|
Redução de dose |
Não |
114 (72,2%) |
|
Sim |
44 (27,8%) |
|
|
Status dos tratamentos |
Finalizado |
80 (50,6%) |
|
Interrompido |
43 (27,2%) |
|
|
Alterado |
35 (22,2%) |
Legendas: CAPOX: combinação de oxaliplatina e capecitabina; FOLFOX: combinação de oxaliplatina, fluoruracila e ácido folínico; FOLFOXIRI: combinação de oxaliplatina, fluoruracila e ácido folínico com irinotecano; FOLFIRI: combinação de irinotecano, fluoruracila e ácido folínico; QUASAR: combinação de fluoruracila e ácido folínico.
A maioria dos pacientes era do sexo masculino (51,3% versus 48,7% feminino). A idade mediana no momento do diagnóstico foi de 59,5 anos, variando de 21 até 88 anos, sendo a faixa etária predominante a de 50 a 59 anos (37,3%). Em relação à raça/cor, 58,9% dos pacientes eram autodeclarados não brancos (58,9%) e 40,5% possuíam ensino médio.
Em relação ao perfil clínico desses pacientes, 61,4% apresentavam alguma comorbidade no momento do diagnóstico, sendo a mais comum a hipertensão arterial sistêmica (80 pacientes), seguida por diabetes mellitus (24 pacientes), hipotireoidismo (7 pacientes) e obesidade (5 pacientes). Quanto ao diagnóstico, a neoplasia maligna de cólon representou quase metade dos diagnósticos (48,1%). Classificou-se a maioria dos tumores como moderadamente diferenciado (84,8%). A mutação genética mais observada foi no gene KRAS (18,3% dos pacientes), embora 100 pacientes (63,3% do total) não tivessem informação sobre pesquisa de mutações genéticas. Sobre o estadiamento do câncer, 46,8% dos pacientes foram diagnosticados no estádio 4. Entre estes, a maioria apresentava uma metástase (44 pacientes). As metástases mais encontradas foram hepáticas (53 pacientes), pulmonares (26 pacientes), nodais (12 pacientes) e peritoneais (9 pacientes).
Quanto ao tratamento, 80,3% dos pacientes passaram por algum procedimento cirúrgico, enquanto 12,7% realizaram apenas a quimioterapia. Os esquemas terapêuticos quimioterápicos mais utilizados como primeira linha foram baseados em fluoruracila e oxaliplatina, sendo o esquema capecitabina associada à oxaliplatina (CAPOX) o mais prescrito (50,6%), seguido pelos esquemas oxaliplatina + ácido folínico + fluoruracila em bólus e em infusão contínua (FOLFOX, 18,3%) e fluoruracila + ácido folínico (QUASAR, 7,0%). Esquemas contendo irinotecano foram prescritos em primeira linha para 12 pacientes (7,6% do total). A finalidade do tratamento foi predominantemente paliativa (45,6%), tendo apenas um paciente (0,6%) realizado o tratamento com objetivo curativo.
O intervalo mediano entre o diagnóstico e o início da quimioterapia foi de 124,5 dias, sendo o do tratamento paliativo de 83,5 dias, enquanto os neoadjuvantes e adjuvantes apresentaram um intervalo de 147 e 137,5 dias, respectivamente. Em 44 pacientes (27,8%), foi necessária redução de dose. Os principais motivos para essa redução foram eventos adversos (30 pacientes) e condição clínica do paciente (7 pacientes). O esquema terapêutico prescrito foi finalizado na maior parte dos pacientes (50,6%). No entanto, houve tratamentos interrompidos (27,2%) ou alterados (22,2%), com diferença estatisticamente significativa entre os grupos (χ² = 21,89; p < 0,001). As principais causas de interrupção foram eventos adversos (17 pacientes), condição clínica do paciente (7 pacientes) e encaminhamento para cuidados paliativos exclusivos (6 pacientes). Em relação à alteração do esquema prescrito, as principais causas foram eventos adversos (16 pacientes) e modificação de protocolo (7 pacientes).
Os principais esquemas terapêuticos de primeira linha encontrados neste estudo estão descritos na Tabela 2, de acordo com a finalidade terapêutica proposta. O esquema CAPOX foi utilizado para todas as finalidades, sendo mais empregado nos tratamentos adjuvante (58,3%) e paliativo (54,3%). O esquema FOLFOX também foi empregado em todas as finalidades, sendo mais utilizado como paliativo (24,3% dos casos). Esquemas associados à radioterapia foram utilizados no contexto neoadjuvante, representando 59,3% desse tipo de tratamento. O esquema QUASAR foi utilizado exclusivamente como adjuvante. Foi observado um total de cinco esquemas utilizados com finalidade paliativa contento irinotecano.
Tabela 2. Principais esquemas quimioterápicos de primeira linha prescritos para pacientes com câncer colorretal em um hospital especializado em oncologia, entre janeiro de 2021 e dezembro de 2022, segundo tipo de câncer e a finalidade terapêutica (n = 158)
|
Tipo de câncer |
Finalidade do tratamento |
Esquemas terapêuticos prescritos |
|
Câncer de cólon |
Neoadjuvante |
FOLFOX (2) |
|
Adjuvante |
CAPOX (19), QUASAR (8), FOLFOX (7), capecitabina (5) |
|
|
Paliativo |
CAPOX (18), FOLFOX (11), FOLFIRI modificado (2), FOLFIRI (1), FOLFOXIRI (1), FOLFOXIRI modificado (1), irinotecano (1) |
|
|
Câncer de junção retossigmoide |
Neoadjuvante |
CAPOX (1), FOLFOX (1) |
|
Adjuvante |
CAPOX (3) |
|
|
Paliativo |
FOLFOX (3), CAPOX (2), MFLOX (1), FOLFOXIRI (1) |
|
|
Câncer de reto |
Curativo |
CAPOX (1) |
|
Neoadjuvante |
CAPOX + RT (10), CAPOX (5), capecitabina + RT (4), FOLFOX (1), FOLFOX + RT (1) |
|
|
Adjuvante |
CAPOX (13), QUASAR (3), CAPOX + RT (1), FOLFOX (1) |
|
|
Paliativo |
CAPOX (18), FOLFOX (3), FOLFOXIRI (3), CAPOX + RT (2), Capecitabina oral (1), FOLFIRI (1), FOLFIRI mod. (1), NSABP modificado + 5FU (1) |
Legendas: CAPOX: combinação de oxaliplatina e capecitabina; CAPOX + RT: combinação de oxaliplatina e capecitabina associada à radioterapia; Capecitabina + RT: capecitabina associada à radioterapia; FOLFOX: combinação de oxaliplatina, fluoruracila e ácido folínico; FOLFOX + RT: combinação de oxaliplatina, fluoruracila e ácido folínico associada à radioterapia; FOLFOXIRI: combinação de oxaliplatina, fluoruracila e ácido folínico com irinotecano; FOLFIRI: combinação de irinotecano, fluoruracila e ácido folínico; MFLOX: combinação de oxaliplatina, fluoruracila e ácido folínico, esquema variante do FOLFOX; NSABP modificado + 5FU: esquema modificado dos estudos do National Surgical Adjuvant Breast and Bowel Project (NSABP) em associação com fluoruracila; QUASAR: combinação de fluoruracila e ácido folínico.
Nas linhas subsequentes de tratamento, foi observada uma redução progressiva no número de pacientes: 71 na segunda linha, 31 na terceira linha, 10 na quarta linha, 5 na quinta linha e apenas 1 paciente na sexta linha. A distribuição dos esquemas quimioterápicos nas diferentes linhas de tratamento é apresentada na Figura 2. Apesar de ser o mais empregado como primeira linha, o uso de CAPOX foi reduzido nas linhas subsequentes, passando de 50,6% para 9,9% dos tratamentos de segunda linha. Esquemas associados à radioterapia e o QUASAR foram raramente empregados em outras linhas de tratamento, não sendo utilizados a partir da terceira. Como esses esquemas possuem finalidade predominantemente curativa, seu uso torna-se limitado em casos de doença metastática. Em contrapartida, os esquemas contendo irinotecano passaram a ser mais utilizados, representando 46,4% da segunda linha de tratamento. A imunoterapia, com combinações de panitumumabe e bevacizumabe, também passou a ser empregada a partir da segunda linha.
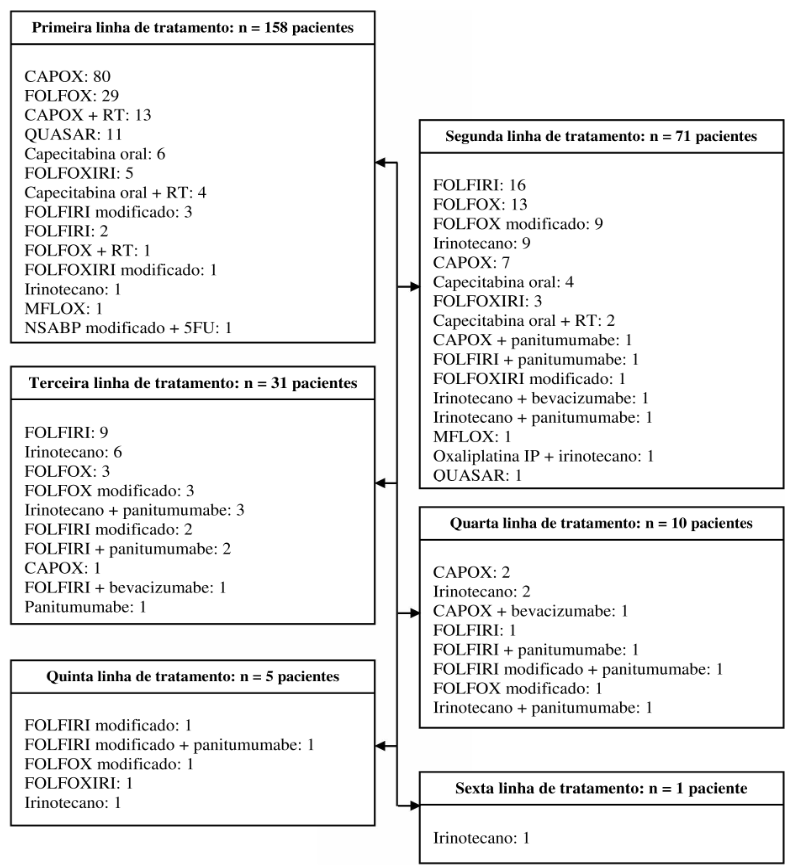
Figura 2. Distribuição dos esquemas de quimioterapia para o câncer colorretal utilizados em um hospital especializado em oncologia, entre janeiro de 2021 e dezembro de 2022, segundo linhas de tratamento
Legendas: CAPOX: combinação de oxaliplatina e capecitabina; CAPOX + RT: combinação de oxaliplatina e capecitabina associada à radioterapia; capecitabina + RT: capecitabina associada à radioterapia; FOLFOX: combinação de oxaliplatina, fluoruracila e ácido folínico; FOLFOX + RT: combinação de oxaliplatina, fluoruracila e ácido folínico associada à radioterapia; FOLFOXIRI: combinação de oxaliplatina, fluoruracila e ácido folínico com irinotecano; FOLFIRI: combinação de irinotecano, fluoruracila e ácido folínico; MFLOX: combinação de oxaliplatina, fluoruracila e ácido folínico, esquema variante do FOLFOX; IP: via intraperitoneal; NSABP modificado + 5FU: esquema modificado dos estudos do National Surgical Adjuvant Breast and Bowel Project (NSABP) em associação com fluoruracila; QUASAR: combinação de fluoruracila e ácido folínico.
O teste de log-rank de Mantel-Cox mostrou que os pacientes que realizaram tratamento paliativo apresentaram um risco 6,14 maior de óbito em comparação aos pacientes que receberam tratamento adjuvante (HR: 6,14; IC 95%: 2,98 – 12,64; p<0,001). Entretanto, ao comparar com o tratamento neoadjuvante com o adjuvante, não foi observada diferença significativa (HR: 1,55; IC 95%: 0,55 – 4,36; p = 0,408). A estimativa de sobrevida global em 24 meses foi de 83,8% (IC 95%: 70,5% – 99,7%) para aqueles que realizaram tratamento neoadjuvante, 86,8% (IC 95%: 78,1% – 96,5%) para quem realizou tratamento adjuvante e 44,3% (IC 95%: 33,7% – 58,3%) para os que fizeram tratamento paliativo. O gráfico de Kaplan-Meier referente aos dados descritos é mostrado na Figura 3.
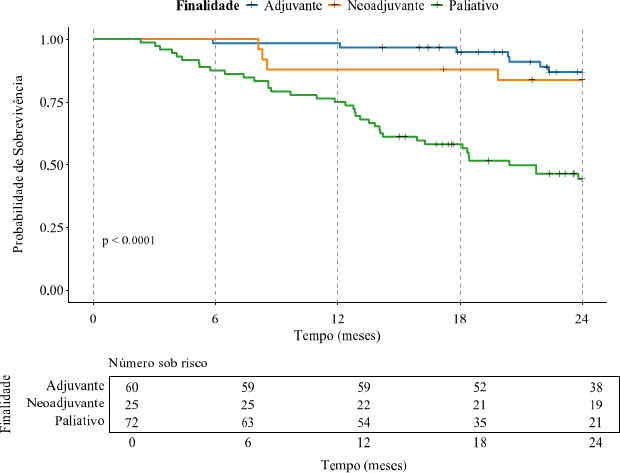
Figura 3. Análise de sobrevida em 24 meses dos pacientes com câncer colorretal tratados em um hospital especializado em oncologia, entre janeiro de 2021 e dezembro de 2022, estratificado de acordo com a finalidade do tratamento quimioterápico
DISCUSSÃO
O esquema CAPOX foi o mais prescrito como tratamento de primeira linha, tendo sido usado para todas as finalidades nos pacientes analisados. Os esquemas associados à radioterapia foram usados como tratamento neoadjuvante, exclusivamente nos casos de câncer retal. O esquema QUASAR foi utilizado como adjuvante, enquanto os esquemas contendo irinotecano tiveram finalidade paliativa. A maior parte dos tratamentos quimioterápicos teve caráter paliativo, o que pode ter influenciado significativamente a sobrevida dos pacientes, uma vez que os pacientes que realizaram tratamento paliativo apresentaram um risco 6,21 maior de óbito em comparação aos pacientes que receberam tratamento adjuvante.
Os pacientes diagnosticados com CCR que realizaram tratamento quimioterápico no local deste estudo apresentaram perfil predominantemente masculino, com idade mediana de 59,5 anos, autodeclarados não brancos e com escolaridade até o ensino médio. O estadiamento predominante no momento do diagnóstico foi estádio 4, com metástases em sítio único, sendo as mais frequentes as metástases hepática e pulmonar. Os resultados do perfil sociodemográfico são semelhantes aos encontrados em um estudo realizado em um hospital no Rio Grande do Sul16, especialmente quanto ao sexo e à idade dos pacientes. Entretanto, houve discrepâncias em relação à cor/raça e escolaridade, com a pesquisa mostrando um perfil majoritário de pacientes autodeclarados brancos com baixo nível de instrução (inferior ao ensino fundamental completo), o que pode ser reflexo das diferenças regionais e de acesso aos serviços de saúde dentro do mesmo país.
Outro estudo17 realizado no mesmo hospital especializado em oncologia na cidade do Rio de Janeiro com pacientes adultos com CCR internados entre 2016 e 2018 mostrou um perfil de pacientes com a maioria autodeclarada branca. Esse dado pode demonstrar uma mudança na característica racial dos pacientes atendidos, com possível impacto do início da regulação para o acesso a instituição. Em relação à raça/cor, Carethers18 discutiu as desigualdades raciais e étnicas observadas na incidência do câncer colorretal na população dos Estados Unidos. A população negra apresentou incidência de 41,9 por 100 mil habitantes para esse tipo de câncer, com uma taxa de incidência entre pacientes negros e brancos de 1,13. Também foi observado que pacientes negros eram menos diagnosticados com doença localizada ou regional (37% e 32%, respectivamente) em comparação aos pacientes brancos (38% e 36%), além de apresentarem maior frequência de diagnóstico em estádio metastático (26% versus 22%). Isso evidencia o impacto das desigualdades sociais nos desfechos de saúde e reforçam a importância de medidas direcionadas para o rastreio e o diagnóstico precoce, especialmente para as populações vulnerabilizadas.
Com relação ao perfil clínico, os resultados foram compatíveis com os de pesquisas anteriores16,17, nas quais a maior parte dos pacientes apresentava tumores moderadamente diferenciados, diagnosticados em estádios avançados (3 e 4), sendo as metástases hepáticas e pulmonares mais frequentes, semelhante aos dados encontrados neste estudo. Esses dados podem ter relação com a sobrevida, uma vez que a sobrevida dos pacientes diagnosticados com câncer colorretal está diretamente relacionada com o estadiamento da doença no momento do diagnóstico. A detecção do tumor em estádios iniciais leva a um aumento de 90% na estimativa de sobrevida em cinco anos. Em razão do seu desenvolvimento lento, em torno de 10 a 15 anos para alteração da lesão benigna para maligna, esse é um tipo de câncer passível de rastreamento e diagnóstico precoce19,20. O fato de a maioria dos tumores ser diagnosticado em estádios mais avançados da doença pode indicar uma falha no rastreamento, dificultando seu diagnóstico precoce. Toledo et al.21 evidenciaram que a ausência de uma política nacional voltada para o rastreamento tem como consequência a grande prevalência de diagnóstico tardio na população, com impacto na mortalidade pela doença. Esse dado pode servir de base para propor medidas voltadas para o rastreamento e o norteamento de políticas públicas voltadas para esse fim.
No que diz respeito ao tratamento quimioterápico, o esquema terapêutico mais utilizado foi o CAPOX. Embora seja um esquema eficaz, ele está associado a toxicidades que exigem monitoramento. Em um estudo realizado na Índia, que tinha objetivo de determinar a eficácia e a segurança desse esquema em ambiente de mundo real, foi observada uma sobrevida global em 24 meses de 80% e 83% no tratamento com caráter adjuvante, e 64% e 67% com caráter paliativo para o câncer de cólon e de reto, respectivamente19. Os dados de sobrevida são semelhantes aos encontrados no presente estudo, embora, no contexto paliativo, as taxas de sobrevida global tenham sido mais baixas.
Segundo a literatura, a ocorrência de eventos adversos tem impactado a continuidade do tratamento dos pacientes com CCR, com necessidade de redução de dose, de interrupção ou alteração dos tratamentos de primeira linha. A síndrome mão-pé, evento adverso dermatológico associado ao uso da capecitabina, e a neuropatia periférica estão entre as principais causas de redução de dose, atraso e descontinuação do tratamento com CAPOX22,23. A instituição onde aconteceu o presente estudo possui um ambulatório de acompanhamento especializado em síndrome mão-pé para pacientes em uso de capecitabina oral, com dispensação de creme hidratante e orientação multiprofissional para manejo desse evento adverso. A adoção dessas medidas parece ter impactado positivamente a continuidade do tratamento na instituição, uma vez que a ocorrência de síndrome mão-pé e neuropatia periférica foi pouco relatada em prontuário, não sendo motivo de suspensão do tratamento.
Cabe destacar que um dos motivos de redução de dose em pacientes idosos (de 70 anos ou mais) recebendo terapia adjuvante com CAPOX para CCR de acordo com a literatura é a toxicidade hematológica nessa população23. Esses dados indicam que a eficácia desse esquema pode ser limitada pelos eventos adversos, afetando a continuidade do tratamento. Entretanto, não foram observados no presente estudo relatos desse tipo de evento, com consequente redução de doses. Porém, o monitoramento e o manejo adequado desse tipo de evento são essenciais para garantir a finalização do tratamento e a sua efetividade.
Os dados também mostram uma diversidade de esquemas terapêuticas utilizados no cenário metastático, o que torna a escolha dos protocolos um desafio na rotina clínica. Um estudo24 realizado nos Estados Unidos, utilizando o banco de dados vinculado Surveillance, Epidemiology, and End Results (SEER) - Medicare, investigou os padrões e preditores de uso para FOLFOX e FOLFIRI como primeira linha de tratamento metastático em pacientes com mais de 65 anos. A maior parte dos pacientes recebeu FOLFOX como primeira linha de terapia. A menor tendência de efeitos adversos do FOLFOX, o menor custo por ano de vida e a eficácia no câncer de cólon em estádio 3 podem influenciar a decisão do médico. Contudo, pacientes com múltiplas comorbidades tiveram uma probabilidade maior de receber FOLFIRI, apesar da falta de benefício de sobrevivência. Isso provavelmente aconteceu em virtude da diferença nos perfis de toxicidade. Os médicos podem ter resistência em prescrever protocolos baseados em oxaliplatina para pacientes com comorbidades como diabetes, que possuem maior risco de desenvolver neuropatia. Enquanto, para pacientes do sexo feminino, foi observada uma preferência em prescrever FOLFOX, pois há uma maior frequência de náuseas e vômitos durante tratamento com FOLFIRI24. Um estudo realizado na mesma instituição deste estudo analisou a ocorrência de reações adversas em pacientes com CCR em uso de FOLFOX e FOLFIRI. Foi observada uma frequência maior do que 90% de toxicidade em ambos os grupos, sendo as gastrointestinais e neurológicas as mais frequentes. Além disso, pacientes que utilizaram o esquema FOLFOX apresentaram maior frequência de manifestações severas ou ameaçadoras à vida25. Portanto, é necessário considerar os fatores individuais no momento da escolha do esquema de tratamento, para otimização e minimização dos riscos associados ao tratamento.
Outra questão a ser considerada no CCR metastático é seu prognóstico desfavorável, com taxa de sobrevivência de cinco anos insatisfatória26. Embora a quimioterapia com fluoruracila, oxaliplatina e irinotecano ainda desempenhe um papel significativo, ainda há muitos desafios, como os eventos adversos, por exemplo27. Nesse contexto, novas abordagens estão sendo investigadas para uma otimização da eficácia terapêutica.
Uma dessas abordagens é a combinação de anticorpos monoclonais com medicamentos quimioterápicos, que tem demonstrado benefícios clínicos aos pacientes, embora a escolha ideal da terapia biológica inicial em pacientes virgens de tratamento seja desconhecida. Um estudo avaliou se a adição de cetuximabe ou bevacizumabe ao regime FOLFOX ou FOLFIRI foi superior como terapia de primeira linha no câncer colorretal KRAS selvagem avançado ou metastático, na qual não houve diferença significativa na sobrevida global no grupo com adição dos medicamentos biológicos e com a quimioterapia inicial28. Isso demonstra que, apesar de alguns dados da literatura mostrarem benefícios, o uso de anticorpos monoclonais associados à quimioterapia como opção terapêutica de primeira linha ainda está em incerto.
Outro ponto abordado é o uso de biomarcadores, que pode ajudar na previsão tanto da probabilidade de benefício clínico quanto do risco de eventos adversos de certos tratamentos, o que permite a personalização do tratamento29,30. Mutações no gene KRAS, por exemplo, são eventos importantes na carcinogênese colorretal e podem ter um impacto negativo na sobrevivência geral e no prognóstico dos pacientes quando mutado31,32. Mesmo com o número crescente de biomarcadores moleculares prognósticos/preditivos, poucos marcadores confiáveis estão disponíveis para identificar pacientes com alto risco de CCR durante a doença em estádio inicial29,33. Atualmente, apenas o status de instabilidade de microssatélites (MSI), a mutação RAS e possivelmente o status da mutação BRAF influenciam a tomada de decisão clínica33. No entanto, esses exames não são realizados na rotina clínica do local deste estudo, uma vez que mais da metade dos pacientes não tinham realizado o teste de pesquisa de mutações genéticas, por exemplo.
Este estudo foi realizado em um hospital especializado em oncologia, que recebe pacientes encaminhados por meio da regulação, o que pode ter impacto no número de pacientes em estádios mais avançados. Por ser um hospital de caráter público, é possível que a forma de financiamento interfira diretamente nas opções terapêuticas disponíveis e na realização de exames laboratoriais. Além disso, o estudo abrange pacientes que iniciaram a quimioterapia em 2021 e 2022, sendo possível que haja impacto da pandemia da covid-19, uma vez que isso pode ter causado atrasos no diagnóstico e no início do tratamento influenciando no prognóstico dos pacientes.
CONCLUSÃO
Os esquemas terapêuticos encontrados neste estudo estão alinhados com o preconizado nas DDT do Ministério da Saúde, não sendo observada utilização de medicamentos não descritos nas diretrizes. O esquema CAPOX foi o mais prescrito, seguido por FOLFOX e QUASAR, em relação ao tratamento de primeira linha. Da segunda linha em diante, houve um aumento significativo no uso dos protocolos baseados em irinotecano e de associações com anticorpos monoclonais (bevacizumabe e panitumumabe). Também foi identificado que a maior parte dos pacientes se encontrava em estádios mais avançados, sendo o tratamento com finalidade paliativa o mais utilizado. Isso tem impacto significativo na sobrevida, com os pacientes em tratamento paliativo apresentando maior risco de óbito em comparação com os pacientes em neoadjuvância e adjuvância. Esse fato evidencia, além da necessidade de acesso a terapias mais efetivas, a importância das ações de rastreamento, uma vez que o CCR é passível de diagnóstico precoce. Além disso, é fundamental acompanhar as tendências atuais e futuras, como a descoberta de novos medicamentos e o uso de biomarcadores na prática clínica, porém, no contexto da saúde pública, é igualmente essencial discutir o acesso a essas novas tecnologias para população usuária da rede pública de saúde.
À Central de Quimioterapia e à Dispensação Ambulatorial do Serviço de Farmácia do Hospital do Câncer I (HC I)/INCA, pela disponibilidade e ajuda na realização deste estudo.
CONTRIBUIÇÕES
Ambos os autores contribuíram substancialmente na concepção e no planejamento do estudo; na obtenção, análise e interpretação dos dados; na redação e revisão crítica; e na aprovação final da versão publicada.
DECLARAÇÃO DE CONFLITOS DE INTERESSE
Nada a declarar.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS
A disponibilização dos dados pode ser solicitada ao autor correspondente, com apresentação de justificativa razoável, dadas as restrições éticas e de privacidade.
FONTES DE FINANCIAMENTO
Não há.
REFERÊNCIAS
1. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229-63. doi: https://doi.org/10.3322/caac.21834
2. Santos MO, Lima FCS, Martins LFL, et al. Estimativa de incidência de câncer no Brasil, 2023-2025. Rev Bras Cancerol. 2023;69(1):e-213700. doi: https://doi.org/10.32635/2176-9745.RBC.2023v69n1.3700
3. SIM: Sistema de Informação sobre Mortalidade [Internet]. Versão 3.2.1.2. Brasília (DF): DATASUS. [data desconhecida] - [acesso 2025 jan 25]. Disponível em: http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sim/cnv/obt10br.def
4. Ministério da Saúde(BR). Portaria n° 958, de 26 de setembro de 2014. Aprova as Diretrizes Diagnósticas e Terapêuticas do Câncer de Cólon e Reto. Diário Oficial da União [Internet], Brasília, DF. 2014 set 29 [acesso 2025 jan 5]; Edição 187; Seção 1:59. Disponível em: https://pesquisa.in.gov.br/imprensa/jsp/visualiza/index.jsp?data=29/09/2014&jornal=1&pagina=59&totalArquivos=192
5. Benson AB, Venook AP, Adam M, et al. Colon cancer, version 3.2024. J Natl Compr Cancer Netw. 2024;22(2D):240029. doi: https://doi.org/10.6004/jnccn.2024.0029
6. Benson AB, Venook AP, Adam M, et al. Rectal cancer, version 3.2024: featured updates to the NCCN Guidelines. J Natl Compr Cancer Netw. 2024;22(6):366-75. doi: https://doi.org/10.6004/jnccn.2024.0041
7. Argilés G, Tabernero J, Labianca R, et al. Localised colon cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020;31(10):1291-305. doi: https://doi.org/10.1016/j.annonc.2020.06.022
8. Cervantes A, Adam R, Roselló S, et al. Metastatic colorectal cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 2023;34(1):10-32. doi: https://doi.org/10.1016/j.annonc.2022.10.003
9. Afanasjeva J, Burk M, Cunningham F, et al. ASHP Guidelines on medication-use evaluation. Am J Heal Pharm. 2021;78(2):168-75. doi: https://doi.org/10.1093/ajhp/zxaa393
10. Wettermark B, Elseviers M, Almarsdóttir AB, et al. Introduction to drug utilization research. In: Elseviers M, Wettermark B, Almarsdóttir AB, et al., organizadores. Drug utilization research. Wiley; 2016. p. 3-12.
11. Organização Mundial da Saúde. CID-10: Classificação Estatística Internacional de Doenças com disquete. Vol. 3, Índice Alfabético. São Paulo: Edusp; 2008.
12. R: The R Project for Statistical Computing [Internet]. Version 4.4.3. [sem local]: The R foundation. [sem data] - [acesso 2017 jul 15]. Disponível em: https://www.R-project.org
13. Kleinbaum DG, Klein M. Kaplan-Meier survival curves and the log-rank test. In: Kleinbaum DG, Klein M, editors. Survival analysis. Statistics for biology and health. New York: Springer; 2012. p. 19-41. doi: https://doi.org/10.1007/978-1-4419-6646-9_2
14. Conselho Nacional de Saúde (BR). Resolução n° 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília, DF. 2013 jun 13; Seção I:59.
15. Conselho Nacional de Saúde (BR). Resolução n° 510, de 7 de abril de 2016. Dispõe sobre as normas aplicáveis a pesquisas em Ciências Humanas e Sociais. Diário Oficial da União, Brasília, DF. 2016 maio 24; Seção I:44.
16. Rohenkohl CA, Pastorello J, Costa NR, et al. Epidemiological profile of patients with colorectal cancer from a hospital in Rio Grande do Sul, Brazil. J Coloproctology. 2021;41(1):001-7. doi: https://doi.org/10.1055/s-0041-1725048
17. Mello MRSP, Moura SF, Muzi CD, et al. Clinical evaluation and pattern of symptoms in colorectal cancer patients. Arq Gastroenterol. 2020;57(2):131-6. doi: https://doi.org/10.1590/S0004-2803.202000000-24
18. Carethers JM. Racial and ethnic disparities in colorectal cancer incidence and mortality. Adv Cancer Res. 2021;151:197-229. doi: https://doi.org/10.1016/bs.acr.2021.02.007
19. Ministério da Saúde (BR). Rastreamento. Cadernos de atenção primária. Brasilia, DF: MS; 2010. v. 29.
20. Instituto Nacional de Câncer. Detecção precoce do câncer. Rio de Janeiro: INCA; 2021.
21. Toledo CM, Almeida LMPR, Averbach M, et al. Analysis of the tracking initiatives of colorectal cancer in Brazil. Arq Gastroenterol. 2023;60(4):450-62. doi: https://doi.org/10.1590/S0004-2803.230402023-93
22. Kalidindi AV, Dubashi B, Jayanthi M, et al. Efficacy and safety of capecitabine and oxaliplatin (CAPOX) treatment in colorectal cancer. Indian J Cancer. 2022;59(1):73-9. doi: https://doi.org/10.4103/ijc.IJC_618_19
23. Tsuchiya A, Ogawa C, Kondo N, et al. Exploratory study on relative dose intensity and reasons for dose reduction of adjuvant CAPOX therapy in elderly patients with colorectal cancer. Glob Heal Med. 2022;4(3):2021.01018. doi: https://doi.org/10.35772/ghm.2021.01018
24. Neugut AI, Lin A, Raab GT, et al. FOLFOX and FOLFIRI use in stage IV colon cancer: analysis of SEER-medicare data. Clin Colorectal Cancer. 2019;18(2):133-40. doi: https://doi.org/10.1016/j.clcc.2019.01.005
25. Melo MM, Cardoso RM, Silva MJS. Reação adversa a medicamento: uma análise comparativa de protocolos utilizados para o tratamento do câncer colorretal. Medicina (Ribeirão Preto). 2017;50(4);245-54. https://doi.org/10.11606/issn.2176-7262.v50i4p245-254
26. Yang W, Zheng H, Lv W, et al. Current status and prospect of immunotherapy for colorectal cancer. Int J Colorectal Dis. 2023;38(1):266. doi: https://doi.org/10.1007/s00384-023-04553-z
27. Adebayo AS, Agbaje K, Adesina SK, et al. Colorectal cancer: disease process, current treatment options, and future perspectives. Pharmaceutics. 2023;15(11):2620. doi: https://doi.org/10.3390/pharmaceutics15112620
28. Venook AP, Niedzwiecki D, Lenz H-J, et al. Effect of first-line chemotherapy combined with cetuximab or bevacizumab on overall survival in patients with KRAS wild-type advanced or metastatic colorectal cancer. JAMA. 2017;317(23):2392. doi: https://doi.org/10.1001/jama.2017.7105
29. Miyamoto Y, Hiyoshi Y, Sawayama H, et el. Precision medicine for adjuvant chemotherapy of resected colorectal cancer. Ann Gastroenterol Surg. 2020;4(6):635-45. doi: https://doi.org/10.1002/ags3.12397
30. Yang L, Yang J, Kleppe A, et al. Personalizing adjuvant therapy for patients with colorectal cancer. Nat Rev Clin Oncol. 2024;21(1):67-79. doi: https://doi.org/10.1038/s41571-023-00834-2
31. Zanatto RM, Santos G, Oliveira JC, et al. Impact of KRAS mutations in clinical features in colorectal cancer. ABCD Arq Bras Cir Dig (São Paulo). 2020;33(3):e1524. doi: https://doi.org/10.1590/0102-672020200003e1524
32. Carvalho LEW, Sarraf JS, Oliveira ACM, et al. What is different in the population of the brazilian Amazon region so that they have a low frequency of KRAS gene mutations. Case Rep Oncol. 2017;10(2):777-82. doi: https://doi.org/10.1159/000479733
33. Tomasello G, Ghidini M, Galassi B, et al. Survival benefit with adjuvant chemotherapy in stage III microsatellite-high/deficient mismatch repair colon cancer: a systematic review and meta-analysis. Sci Rep. 2022;12(1):1055. doi: https://doi.org/10.1038/s41598-022-05065-6
Recebido em 4/5/2025
Aprovado em 24/6/2025
Editora-científica: Anke Bergmann. Orcid iD: https://orcid.org/0000-0002-1972-8777
Este é um artigo publicado em acesso aberto (Open Access) sob a licença Creative Commons Attribution, que permite uso, distribuição e reprodução em qualquer meio, sem restrições, desde que o trabalho original seja corretamente citado.